Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Acessos
Acessos
Links relacionados
-
 Similares em
SciELO
Similares em
SciELO
Compartilhar
Revista de Ciências Agrárias
versão impressa ISSN 0871-018X
Rev. de Ciências Agrárias vol.42 no.3 Lisboa set. 2019
https://doi.org/10.19084/rca.17478
ARTIGO
Concentrações de biorreguladores na germinação e emergência de jiló
Concentrations of bioregulators on germination and emergence of jiló
Leticia Galhardo Jorge1, Thaís Prado Torres2, Bruno Novaes Menezes Martins2,*, Elizabeth Orika Ono1 e João Domingos Rodrigues1
1 Departamento de Botânica, Instituto de Biociências, Universidade Estadual Paulista, Botucatu, São Paulo, Brasil
2 Departamento de Horticultura, Faculdade de Ciências Agronômicas, Universidade Estadual Paulista, Botucatu, São Paulo, Brasil
(*E-mail: brunonovaes17@hotmail.com)
RESUMO
Objetivou-se avaliar o efeito de diferentes concentrações de biorreguladores na germinação e emergência de plântulas de jiló. Foram realizados dois experimentos independentes, sendo o primeiro experimento em câmara tipo BOD, avaliando-se a germinação e o vigor de sementes em função de diferentes concentrações de reguladores vegetais aplicadas via semente, sendo: 0; 100; 200 e 300 mg.L-1 de GA3; 0; 50; 100 e 150 mg L-1 da mistura de GA4+7 + benziladenina e 0; 0,001; 0,05 e 0,1 ppm de brassinolídeo. O segundo experimento foi realizado em casa de vegetação, sendo os tratamentos aplicados os mesmos utilizados no primeiro experimento, determinando-se a emergência de sementes de jiló. O delineamento experimental utilizado nos dois experimentos foi inteiramente casualizado, com 4 repetições de 40 sementes. A aplicação via sementes com concentração próxima de 300 mg.L-1 de GA3 e 150 mg.L-1 de GA4+7 + benziladenina, aumentou a porcentagem de germinação e o índice de velocidade de germinação em jiló. As concentrações de brassinolídeo não influenciou a germinação de sementes. O uso de biorreguladores não contribuiu nas características de emergência de plântulas em casa de vegetação.
Palavra-chave: Solanum arthiopicum gr. Gilo, brassinolídeo, GA3, GA4+7 + benziladenina, reguladores vegetais.
ABSTRACT
The objective of this work was to evaluate the effect of different concentrations of bioregulators on the germination and emergence of jiló seedlings. Two independent experiments were carried out, being the first experiment in chamber type BOD, evaluating the germination and seed vigor as a function of different concentrations of plant regulators applied via seed, being: 0; 100; 200 and 300 mg.L-1 GA3; 0; 50; 100 and 150 mg.L-1 of the mixture of GA4+7 + benzyladenine and 0; 0.001; 0.05 and 0.1 ppm brassinolide. The second experiment was conducted in a greenhouse, and the treatments were the same as those used in the first experiment, determining the emergence of jiló seeds. The experimental design used in the two experiments was completely randomized, with 4 replicates of 40 seeds. The application via seeds with a concentration of approximately 300 mg.L-1 of GA3 and 150 mg.L-1 of GA4+7 + benzyladenine, increased the percentage of germination and the rate of germination speed in jiló. Brassinolide concentrations did not influence seed germination. The use of bioregulators did not contribute to the emergence characteristics of greenhouse seedlings.
Keywords: Solanum arthiopicum gr. Gilo, brassinolide, GA3, GA4+7 + benzyladenine, plant regulators.
INTRODUÇÃO
O jiló (Solanum aethiopicum gr. Gilo) é uma hortaliça tipicamente tropical, pertencente à família das solanáceas. É encontrado de forma abundante no Brasil e na África, porém sua origem ainda é indefinida. A espécie é cultivada, principalmente, na região sudeste do Brasil, sendo o estado do Rio de Janeiro responsável por cerca de 30% da produção nacional. Além disso, São Paulo e Espírito Santo apresentam também uma expressiva produção, variando em média de 20 t/ha a 60 t/ha (Pinheiro et al., 2015).
A planta é considerada de clima quente, pouco tolerante ao frio e excesso de água. A germinação pode ser afetada por vários fatores, destacando a água, a temperatura e o oxigênio que, em conjunto, são fundamentais para que o processo se realize. Deste modo, sementes de boa qualidade fisiológica, física e sanitária são necessárias para a plena formação de mudas (Pinheiro et al., 2015).
Segundo Junqueira et al. (2017), o uso de sementes com alta taxa de germinação e com características que possam auxiliar na redução de efeitos negativos causados por fatores ambientais são importantes, de forma a refletir no desempenho produtivo final da cultura. Assim, a fim de aumentar a germinação, o vigor de sementes e, consequentemente, a melhoria no desempenho inicial de plântulas, o emprego de novas tecnologias no setor de sementes hortícolas, como a utilização de reguladores vegetais no tratamento de sementes têm ganhado destaque (Santos et al., 2013; Junqueira et al., 2017).
A utilização de reguladores vegetais pode ser considerada uma técnica de sucesso para diversas espécies, uma vez que estas substâncias podem interferir no desenvolvimento vegetal, estimulando a divisão, a diferenciação e o alongamento celular, o que proporciona melhor desenvolvimento de plântulas. Além disso, podem também, aumentar a absorção e a utilização de água e nutrientes pelas plantas (Vieira e Castro, 2002).
Os biorreguladores podem ser aplicados tanto no tratamento de sementes, quanto via foliar, melhorando assim, a velocidade de germinação e emergência, enraizamento e incremento no crescimento e desenvolvimento das plantas (Vieira e Castro, 2002; Nicchio et al., 2013; Santos et al., 2013). Biorreguladores à base de giberelinas, auxinas e citocininas têm se destacado nos últimos anos. Porém, existem outros reguladores vegetais como o brassinosteróide, o ácido salicílico, o ácido jasmônico e as poliaminas que, apesar de serem substâncias que podem afetar o crescimento e o desenvolvimento vegetal, ainda são pouco estudados na literatura (Colli, 2004; Freitas, 2010).
Atualmente, existem no mercado diversos reguladores vegetais, tais como, o Promalin®, que é composto por 1,8% das giberelinas GA4 e GA7 e 1,8% da citocinina BA (Benziladenina), além de 96,4% de material inerte, utilizado com o objetivo de promover o aumento na divisão e alongamento celular, além de atuar no tamanho e formato dos frutos (Fioravanço et al., 2010). Outro exemplo é o Pro-gibb®, que é composto por 10% de ácido giberélico (GA3) e 90% de material inerte, conhecido por atuar diretamente na germinação (Rossetto et al., 2000; Passos et al., 2004; Ferreira et al., 2005; Kosera Neto et al., 2015).
Diante do exposto, objetivou-se avaliar se os diferentes reguladores vegetais, em diferentes concentrações, afetam a germinação e a emergência de plântulas de jiló.
MATERIAL E MÉTODOS
Os experimentos foram realizados no Departamento de Botânica do Instituto de Biociências da Universidade Estadual Paulista Júlio de Mesquita Filho (IBB/UNESP), em Botucatu, São Paulo, nos meses de outubro a dezembro de 2018.
Foram conduzidos dois experimentos independentes utilizando-se sementes comerciais de jiló (Solanum aethiopicum gr. Gilo) e diferentes reguladores vegetais: ácido giberélico (GA3) (aplicando-se o produto comercial Pro-gibb®, que contém 10% de ácido giberélico e 90% de material inerte da Valent BioSciences); GA4+7 associado à citocinina BA (aplicando-se o produto comercial Promalin®, que contém 1,8% das giberelinas GA4 + GA7 e 1,8% da citocinina BA (Benziladenina), além de 96,4% de material inerte da Valent BioSciences) e brassinosteróide, utilizando-se brassinolídeo p.a. da Fuji Chemical Industries Ltda.
Os tratamentos consistiram na aplicação via sementes de três biorreguladores testados isoladamente em diferentes concentrações: 0, 100, 200 e 300 mg L-1 de GA3; 0, 50, 100 e 150 mg L-1 da mistura de GA4+7 + BA (Benziladenina); 0, 0,001, 0,05 e 0,1 ppm de Brassinolídeo (BL). O delineamento experimental utilizado nos dois experimentos foi o inteiramente casualizado, com quatro repetições para cada tratamento, sendo a unidade experimental de 40 sementes.
Experimento 1: Germinação, índice de velocidade de germinação e vigor de sementes de jiló em função de diferentes concentrações de biorreguladores
As sementes foram embebidas por 24h nas diferentes concentrações de GA3, mistura de GA4+7 + BA e brassinolídeo (Pinto et al., 2007; Leopoldo Ferreira et al., 2013). Em seguida, as sementes foram semeadas sobre papel germitest®, utilizado como substrato, umedecido com água destilada na proporção de 2,5 vezes à sua massa. As sementes foram espaçadas igualmente no papel em caixas do tipo gerbox, que foram acondicionadas em sacos plásticos individuais, de modo a evitar a desidratação. Posteriormente, as caixas foram colocadas em câmara tipo BOD (Biochemical Oxygen Demand) à temperatura constante de 30 °C, com fotoperíodo de 12 horas (Brasil, 2009).
Para a determinação do vigor de sementes foi considerada a porcentagem de sementes germinadas na primeira e segunda contagem, que ocorreu no 6º e 14º dia após a semeadura, respectivamente, conforme as Regras para Análise de Sementes (Brasil, 2009).
Além disso, foi determinado o índice de velocidade de germinação (IVG), através da contagem diária das sementes germinadas, sendo consideradas como germinadas àquelas com emissão de 2 mm de radícula. O IVG foi determinado pela equação sugerida por Maguire: IVG= N1/D1 + N2/D2 + Nn/Dn, onde: IVG= índice de velocidade de germinação; N1= número de sementes germinadas no primeiro dia; Nn= número acumulado de sementes germinadas; D1= primeiro dia de contagem; Dn= número de dias contados após a semeadura; e porcentagem de germinação (G), utilizando-se a seguinte fórmula: G (%)= N/A, onde N= número de sementes germinadas; A = número total de sementes colocadas para germinar (Maguire, 1962).
Experimento 2: Emergência em bandeja e índice de velocidade de emergência de plântulas de jiló em função de diferentes concentrações de biorreguladores
O experimento foi realizado em casa de vegetação, com tela de sombreamento de 50% e temperatura média de 25 a 30 ºC, no Departamento de Botânica (IBB/UNESP). As sementes de jiló receberam os mesmos tratamentos do primeiro experimento, sendo utilizado o mesmo método de aplicação dos produtos. Porém, a semeadura foi realizada em bandejas de poliestireno com 200 células, contendo o substrato comercial Tropstrato®. A irrigação foi diária, adicionando em média um litro de água por bandeja, de forma a manter o substrato em capacidade de campo.
A avaliação da emergência de plântulas foi determinada por contagens diárias das plântulas emergidas até a estabilização, o que ocorreu aos 22 dias após o semeio, sendo consideradas emergidas plântulas com as folhas cotiledonares totalmente expandidas. Para determinação do índice de velocidade de emergência (IVE) utilizou-se a equação proposta por Maguire: IVE= E1/N1 + E2/N2 + … + En/Nn; onde: E1, E2, En = número de plântulas normais observadas na primeira, segunda e última contagem; N1, N2, Nn= número de dias da semeadura à primeira, segunda e última contagem. Após estabilização foi determinada a porcentagem de emergência pela fórmula: E (%)= N/A, onde N= número de sementes emergidas; A= número total de sementes semeadas (Maguire, 1962).
Análise estatística
Os dados foram submetidos à análise de variância (teste F); e regressão, quando houve diferença significativa (5% de probabilidade) em relação às concentrações de biorreguladores, utilizando o programa estatístico SISVAR 5.5 (Ferreira, 2011).
RESULTADOS e DISCUSSÃO
Experimento 1: Germinação, índice de velocidade de germinação e vigor de sementes de jiló em função de diferentes concentrações de biorreguladores
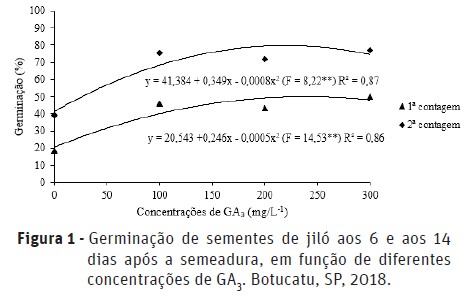
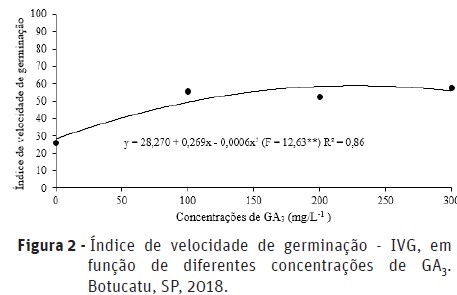
Houve efeito significativo das diferentes concentrações de GA3 aplicadas via sementes sobre a porcentagem de germinação (Figura 1) e sobre o índice de velocidade de germinação (IVG) (Figura 2). De acordo com a análise de regressão, a concentração de 247 e 218 mg.L-1 de GA3 foi a que promoveu maior porcentagem de germinação aos 6 e 14 dias após a semeadura, atingindo 50 e 77% de sementes germinadas, respectivamente (Figura 1). Em relação ao índice de velocidade de germinação (IVG), de acordo com a análise de regressão, quando utilizada a concentração de 225 mg.L-1 de GA3 foi atingido o maior IVG, correspondente à aproximadamente 58%. (Figura 2). Esses resultados podem ser explicados, devido ao fato do ácido giberélico estimular a síntese de α-amilase e outras enzimas, responsáveis por hidrolisar as reservas das sementes, liberando energia, que é utilizada pelas regiões de crescimento do embrião, estimulando o alongamento celular, promovendo o rompimento do tegumento da semente pela raiz e acelerando a germinação com maior uniformidade (Stenzel et al., 2003).
De maneira semelhante, Kosera Neto et al. (2015), ao estudarem métodos para a superação de dormência em sementes de tomateiro arbóreo, observaram que a germinação foi favorecida pela aplicação de solução de 100 e 300 mg.L-1 de ácido giberélico via sementes. Além disso, Picolotto et al. (2007), ao estudarem a ação de giberelinas e citocininas em sementes de pessegueiro, observaram maior porcentagem de germinação no tratamento via sementes com 300 mg.L-1 de GA3, porém não diferiu significativamente dos tratamentos com 100 e 200 mg.L-1. Ynoue et al. (1999) observaram maior porcentagem de germinação em sementes de kiwi tratadas com 150 mg.L-1 de GA3, obtendo-se média de 43% de sementes germinadas.
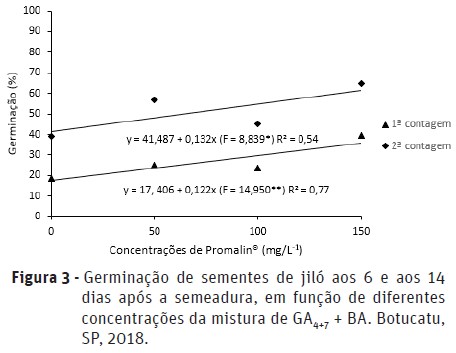
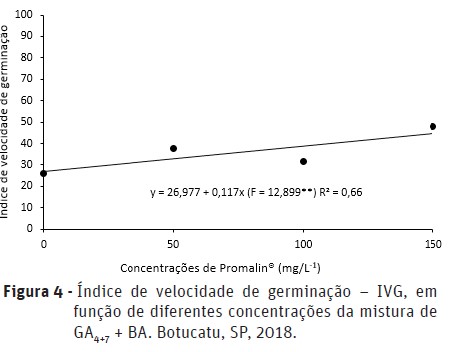
Notou-se efeito significativo das diferentes concentrações da mistura de GA4+7 + BA aplicada via sementes sobre a porcentagem de germinação (Figura 3) e sobre o índice de velocidade de germinação (IVG) (Figura 4). A maior porcentagem de germinação de sementes foi de 39 e 65% quando se utilizou 150 mg.L-1 da mistura de GA4+7 + BA, aos 6 e 14 dias após a semeadura, respectivamente. Em relação ao índice de velocidade de germinação (IVG), a concentração de 150 mg.L-1 de GA4+7 + BA promoveu também o maior IVG, correspondente à 48% (Figura 4).
Assim como as giberelinas, as citocininas possuem importante papel na germinação, pois estão relacionadas em eventos pós-germinativos, promovendo o crescimento da radícula do embrião através da divisão celular (Horcat e Letham, 1990). Além disso, a citocinina é considerada substância essencial para complementar a ação do ácido giberélico em induzir a germinação ou os processos enzimáticos, quando esses são bloqueados por inibidores, como o ácido abscísico e/ou cumarina (Taiz e Zeiger, 2009).
Em pêssego, Picolotto et al. (2007) observaram maior porcentagem de germinação em sementes tratadas com 200 mg.L-1 da mistura de GA4+7 + BA, alcançando 85% de sementes germinadas. Em relação ao IVG, o melhor desempenho foi obtido nas concentrações de 200 e 300 mg.L-1, correspondendo à 0,081 e 0,078, respectivamente. Ono et al. (1993) observaram que a concentração de 50 mg.L-1 da mistura de GA4+7 + BA proporcionou 89% de sementes de limão ‘Volkameriano’ germinadas. Além disso, Ferrari et al. (2008), ao estudarem o efeito de reguladores vegetais na germinação de sementes de maracujá-doce, observaram que as concentrações de 200 e 250 mg.L-1 da mistura de GA4+7 + BA proporcionaram maiores valores para o incremento do processo germinativo de sementes.
Não houve efeito significativo das diferentes concentrações de brassinolídeo aplicadas via sementes, sobre a porcentagem de germinação e sobre o índice de velocidade de germinação (IVG), com médias de 14e 9%, respectivamente. Esse resultado pode ser explicado, uma vez que, os efeitos dos brassinosteróides não podem ser considerados de forma isolada, já que estes compostos interagem com outros reguladores vegetais endógenos e com sinais ambientais, particularmente com a qualidade de luz (Vasquez e Rodriguez, 2000).
No entanto, Larré et al. (2011), ao estudarem a qualidade fisiológica de sementes de arroz tratadas com 24-epibrassinolídeo, observaram que a aplicação dessa substância aumentou significativamente o percentual de germinação. Além disso, Borcioni e Negrelle (2012), ao aplicarem diferentes concentrações do análogo de brassinosteróide BIOBRAS 16® em embriões zigóticos de bocaiuva in vitro, observaram que a aplicação não proporcionou acréscimo no percentual de germinação, porém estimulou o desenvolvimento de plantas normais. Larré et al. (2009), ao analisarem o potencial fisiológico de dois lotes de sementes de arroz tratadas com 24-epibrassinolídeo, observaram que concentrações de até 0,1 μM afetam positivamente o vigor das sementes de arroz cv. IRGA 422CL.
Experimento 2: Emergência em bandeja e índice de velocidade de emergência de plântulas de jiló em função de diferentes concentrações de biorreguladores
Não houve diferença significativa para a característica de porcentagem de emergência das plântulas em função das diferentes concentrações de GA3, da mistura de GA4+7 + BA e brassinolídeo, obtendo-se médias de 95,78, 96,25 e 93,90%, respectivamente. Também foi observado ausência de significância para o índice de velocidade de emergência (IVE), com médias de 38,90, 38,12 e 32,06, respectivamente.
Entretanto, observou-se que sementes tratadas com 100 mg.L-1 de GA3 obtiveram maior porcentagem de plântulas emergidas e IVE, correspondente à 99,38% e 41,33, respectivamente.
De maneira semelhante Vieira e Gusmão (2006) observaram que não houve diferenças significativas na emergência de plântulas de Talisia esculenta entre os tratamentos com GA3. Campos et al. (2015), ao estudarem o efeito do ácido giberélico na emergência e crescimento de plântulas de biribá, observaram que o tratamento de sementes com 1000 mg.L-1 de GA3 foi positivo, proporcionando aumento na porcentagem e velocidade de emergência. Além disso, Leonel e Pedroso (2005) observaram que a concentração de 300 mg.L-1 de GA3 aumentaram a porcentagem de emergência de maracujazeiro-doce, chegando a 97,50%.
Em relação ao produto comercial Promalin®, apesar de não haver diferença significativa, verificou-se que sementes tratadas com 150 mg.L-1 da mistura de GA4+7 + BA apresentaram maior porcentagem de plântulas emergidas e maior IVE, correspondente à 100 e 40,9%, respectivamente. Resultados satisfatórios foram obtidos por Zucareli et al. (2009) em Passiflora cincinnata e por Oliveira et al. (2017) em Passiflora alata cv. BRS Mel do Cerrado, confirmando assim, sua eficiência.
Segundo Taiz e Zeiger (2009), a germinação de sementes pode exigir giberelinas em algumas de suas etapas, como a ativação de crescimento vegetativo do embrião, o enfraquecimento da camada do endosperma que envolve o embrião e restringe seu crescimento, além da mobilização de reservas energéticas do endosperma. Além das giberelinas, as citocininas e auxinas também participam de alguns processos fisiológicos, como a germinação de sementes, a quebra de dormência das gemas e a senescência foliar (Taiz e Zeiger, 2009).
Em relação ao brassinolídeo, mesmo não havendo diferença significativa pelos fatores em estudo, observou-se que sementes tratadas com 0,01 ppm apresentaram maior porcentagem de plântulas emergidas e maior IVE, correspondente à 96,3% e 32, respectivamente. Resultado semelhante foi relatado por Larré et al. (2009) ao se analisar o potencial fisiológico de sementes de arroz.
Apesar de ser uma nova classe de hormônios vegetais, ainda pouco estudadas, sabe-se que os brassinosteróides são capazes de produzir efeitos morfológicos e fisiológicos no desenvolvimento vegetal, podendo estimular ou inibir o crescimento radicular (Bao et al., 2004; Mazorra e Núñez, 2008), promover a divisão e o alongamento celular (Grove et al., 1979), além de aumentar o rendimento e produção de biomassa, acelerar o processo de maturação das plantas (Mazorra e Núñez, 2008) e proporcionar aumento no percentual de germinação de sementes (Rao et al., 2002).
Em Lepidium sativum L. a aplicação do 24-epibrassinolídeo incrementou a germinação, provavelmente por reduzir o efeito inibitório do ácido abscísico (Rao et al., 2002). No entanto, em sementes de café (Coffea arabica L.) a aplicação do regulador vegetal não influenciou no processo germinativo (Zullo e Adam, 2002). Contudo, ainda não está bem estabelecido de que forma os brassinosteróides atuam na germinação de sementes.
CONCLUSÃO
Pode-se concluir que a aplicação via sementes de GA3 e da mistura de GA4+7 + BA, na concentração de próxima de 300 e 150 mg.L-1, respectivamente, aumentou a porcentagem de germinação e o índice de velocidade de germinação (IVG) em jiló. No entanto, as concentrações de brassinolídeo não influenciou as germinação de sementes, e o uso de biorreguladores não contribuiu nas características de emergência de plântulas em casa de vegetação.
REFERÊNCIAS BIBLIOGRÁFICAS
Bao, F.; Shen, J.; Brady, S.R.; Muday, G.K.; Asami, T. & Yang, Z. (2004) - Brassinosteroids interact with auxin to promote lateral root development in Arabidopsis. Plant Physiology, vol. 134, n. 4, p. 1624-1631. https://doi.org/10.1104/pp.103.036897 [ Links ]
Borcioni, E. & Bonato Negrelle, R.R. (2012) - Aplicação de análogo de brassinosteroide (Biobras 16®) sobre a germinação e crescimento in vitro de embriões zigóticos e aclimatização de plântulas de bocaiuva. Ciência Rural, vol. 42, n. 2, p. 270-275. http://dx.doi.org/10.1590/S0103-84782012000200014 [ Links ]
Brasil (2009) - Regras para análise de sementes. Ministério da Agricultura. Brasília: SNDA/DNDV/CLAV, 395 p.
Campos, L.F.C.; de Abreu, C.M.; Guimarães, R.N. & Seleguini, A. (2015) - Escarificação e ácido giberélico na emergência e crescimento de plântulas de biribá. Ciência Rural, vol. 45, n. 10, p. 1748-1754. http://dx.doi.org/10.1590/0103-8478cr20140249 [ Links ]
Colli, S. (2004) - Outros reguladores: brassinosteróides, poliaminas, ácidos jasmônico e salicílico. In: Kerbauy, G.B. (Ed.) - Fisiologia vegetal. São Paulo: Guanabara Koogan, p. 333-340. [ Links ]
Ferrari, T.B.; Ferreira, G.; Mischan, M.M. & de Pinho, S. Z. (2008) - Germinação de sementes de maracujá-doce (Passiflora alata Curtis): Fases e efeito de reguladores vegetais. Biotemas, vol. 21, n. 3, p. 65-74. https://doi.org/10.5007/2175-7925.2008v21n3p65 [ Links ]
Ferreira, D.F. (2011) - Sisvar: a computer statistical analysis system. Ciência e Agrotecnologia, vol. 35, n. 6, p. 1039-1042. http://dx.doi.org/10.1590/S1413-70542011000600001 [ Links ]
Ferreira, G.; Oliveira, A.D.; Rodrigues, J.D.; Dias, G.B.; Detoni, A.M.; Tesser, S.M. & Antunes, A.M. (2005) - Efeito de arilo na germinação de sementes de Passiflora alata Curtis em diferentes substratos e submetidas a tratamentos com giberelina. Revista Brasileira de Fruticultura, vol. 27, n. 2, p. 277-280. https://doi.org/10.1590/S0100-29452005000200022 [ Links ]
Fioravanço, J.C.; de Almeida, G.K. & da Silva, V.C. (2010) - Efeito da Promalina (GA4+ 7+ 6BA) na produção e desenvolvimento dos frutos da macieira cv. Royal Gala. Revista de Ciências Agroveterinárias, vol. 9, n. 2, p. 143-149. [ Links ]
Freitas, S.J. (2010) - Brassinosteroides e adubação no desenvolvimento, crescimento e nutrição de mudas de abacaxi. (Tese (Doutorado Produção vegetal) - Universidade Estadual do Norte Fluminense, Campos dos Goytacazes). [ Links ]
Grove, M.D.; Spencer, F.; Rohwedder, W.K.; Mandava, N.; Worley, J.F.; Warthen Jr, J.D. & Cook Jr, J.C. (1979) - Brassinolide, a plant growth-promoting steroid isolated from Brassica napus pollen. Nature, vol. 281, p. 216-217. [ Links ]
Hocart, C.H. & Letham, D S. (1990) - Biosynthesis of cytokinin in germinating seeds of Zea mays. Journal of Experimental Botany, vol. 41, n. 12, p. 1525-1528. https://doi.org/10.1093/jxb/41.12.1525 [ Links ]
Junqueira, I.A.; Nicchio, B.; de Deus, M.B. & Lana, R.M.Q. (2017) - Biorreguladores no tratamento de sementes de girassol. Pesquisa Agropecuária Pernambucana, vol. 22, p. 1-5. [ Links ]
Kosera Neto, C.; Fabiane, K.C.; Radaelli, J.C.; Wagner Júnior, A. & Correa Moura, G. (2015) - Métodos para superação de dormência em sementes de tomateiro arbóreo (Solanum betaceum). Pesquisa Agropecuária Tropical, vol. 45, n. 4, p. 420-425. http://dx.doi.org/10.1590/1983-40632015v4537332 [ Links ]
Larré, C.F.; De Moraes, D.M. & Lopes, N.F. (2009) - Potencial fisiológico de dois lotes de sementes de arroz tratadas com 24-epibrassinolídeo. Revista Brasileira de Sementes, vol. 31, n. 4, p. 27-35. http://dx.doi.org/10.1590/S0101-31222009000400003 [ Links ]
Larré, C.F.; Moraes, D.D. & Lopes, N.F. (2011) - Qualidade fisiológica de sementes de arroz tratadas com solução salina e 24-epibrassinolídeo. Revista Brasileira de Sementes, vol. 33, n. 1, p. 86-94. http://dx.doi.org/10.1590/S0101-31222011000100010 [ Links ]
Leonel, S. & Pedroso, C.J. (2005) - Produção de mudas de maracujazeiro-doce com o uso de biorregulador. Revista Brasileira de Fruticultura, vol. 27, n. 1, p. 107-109. http://dx.doi.org/10.1590/S0100-29452005000100029 [ Links ]
Leopoldo Ferreira, R.; Forti, V.A.; Neumann Silva, V. & da Costa Melo, S. (2013) - Temperatura inicial de germinação no desempenho de plântulas e mudas de tomate. Ciência Rural, vol. 43, n. 7, p. 1189-1195. http://dx.doi.org/10.1590/S0103-84782013000700008 [ Links ]
Maguire, J.D. (1962) - Speed of Germination - Aid In Selection And Evaluation for Seedling Emergence And Vigor. Crop Science, vol. 2, n. 2, p. 176-177. [ Links ]
Mazorra, L.M. & Núñez, M. (2008) - Estado actual sobre el conocimiento de la biosíntesis y los mecanismos moleculares de acción de los brasinoesteroides en las plantas. Cultivos tropicales, vol. 29, n. 1, p. 91-105. [ Links ]
Nicchio, B.; Boer, C.A.; Siqueira, T.P. & Carolina, A. (2013) - Ácido húmico e bioativador no tratamento de sementes de milho. Journal of Agronomic Sciences, vol. 2, n. 2, p. 61-73. [ Links ]
Oliveira, J.S.; Viana, C.G.; Faleiro, F.G.; Viana, M.L. & Junqueira, N.T.V. (2017) - Emergência de plântulas de maracujazeiro cultivar BRS Mel do Cerrado e seus genitores com regulador vegetal. Magistra, vol. 28, n. 3-4, p. 463-467. [ Links ]
Ono, E.O.; Leonel, S. & Rodrigues, J.D. (1993) - Efeitos de fitorreguladores e nitrato de potássio na germinação de sementes do limão 'Volkameriano'. Scientia Agricola, vol. 50, n. 3, p. 338-342. http://dx.doi.org/10.1590/S0103-90161993000300003 [ Links ]
Passos, I.D.S.; Matos, G.D.C.; Meletti, L.M.M.; Scott, M.D.S.; Bernacci, L.C. & Vieira, M.A.R. (2004) - Utilização do ácido giberélico para a quebra de dormência de sementes de Passiflora nitida Kunth germinadas in vitro. Revista Brasileira de Fruticultura, vol. 26, n. 2, p. 380-381. http://dx.doi.org/10.1590/S0100-29452004000200051 [ Links ]
Picolotto, L.; Bianchi, V.J. & Fachinello, J.C. (2007) - Ação de giberelinas e citocininas na germinação de sementes de pessegueiro. Scientia Agraria, vol. 8, n. 3, p. 225-232. http://dx.doi.org/10.5380/rsa.v8i3.9526 [ Links ]
Pinheiro, J.B.; Pereira, R.B.; de Freitas, R.A. & Melo, R.D.C. (2015) - A cultura do jiló. Brasília, DF: Embrapa. [ Links ]
Pinto, L.V.; Da Silva, E.A.; Davide, A.C.; De Jesus, V.A.M.; Toorop, P.E. & Hilhorst, H. W. (2007) - Mechanism and control of Solanum lycocarpum seed germination. Annals of Botany, vol. 100, n. 6, p. 1175-1187. http://dx.doi.org/10.1093/aob/mcm211 [ Links ]
Rao, S.S.R.; Vardhini, B.V.; Sujatha, E. & Anuradha, S. (2002) - Brassinosteroids – a new class of phytohormones. Current Science, vol. 82, n. 10, p.1239-1245.
Rosseto, C.A.V.; Coneglian, R.C.C.; Nakagawa, J.; Shimizu, M.K. & Marin, V.A. (2000) - Germinação de sementes de maracujá-doce (Passiflora alata Dryand) em função de tratamento pré-germinativo. Revista Brasileira de Sementes, vol. 22, n. 1, p. 247-252. [ Links ]
Santos, C.A.C.; Peixoto, C.P.; Vieira, E.L.; Carvalho, E.V. & Peixoto, V.A.B. (2013) - Stimulate® na germinação de sementes, emergência e vigor de plântulas de girassol. Bioscience Journal, vol. 29, n. 2, p. 605-616. [ Links ]
Stenzel, N.M.C.; Murata, I.M. & Neves, C.S.V.J. (2003) - Superação da dormência em sementes de atemóia e fruta-do-conde. Revista Brasileira de Fruticultura, vol. 25, n. 2, p. 305-308. http://dx.doi.org/10.1590/S0100-29452003000200031 [ Links ]
Taiz, L. & Zeiger, E. (2009) - Fisiologia vegetal. 4a ed. Porto Alegre: Artmed, 848 p. [ Links ]
Vasquez, M.C.N. & Rodriguez, R.C.M. (2000) - Brassinosteróides: nuevos reguladores del crescimento vegetal com amplias perspectivas para la agricultura. Campinas (Documento IAC, n. 68). [ Links ]
Vieira, E.L. & Castro, P.R.C. (2002) - Ação de Stimulate no desenvolvimento inicial de plantas de algodoeiro (Gossypium hirsutum L.). Piracicaba: USP, Departamento de Ciências Biológicas, 3p. [ Links ]
Vieira, F.D.A. & Gusmão, E. (2006) - Uso de giberelinas na emergência de plântulas de Talisia esculenta (A. St.-Hil.) Radlk. Revista Ciência Eletrônica de Engenharia Florestal, vol. 4, n. 8, p. 1-10. [ Links ]
Ynoue, C.K.; Ono, E.O. & Marchi, L.D.O.S. (1999) - The effect of gibberellic acid on kiwi (Actinidia chinensis Pl.) seed germination. Scientia Agricola, vol. 56, n. 1, p. 9-12. http://dx.doi.org/10.1590/S0103-90161999000100002 [ Links ]
Zucareli, V.; Ferreira, G.; Amaro, A.C.E. & Fazio, J.L.D. (2009) - GA4+7 + N-(Fenilmetil)-aminopurina na germinação de sementes e emergência de plântulas de Passiflora cincinnata Mast. Revista Brasileira de Fruticultura, vol. 31, n. 1, p. 216-223. http://dx.doi.org/10.1590/S0100-29452009000100030 [ Links ]
Zullo, M.A.T. & Adam, G. (2002) - Brassinosteroid phytohormones: structure, bioactivity and applications. Brazilian Journal of Plant Physiology, vol. 14, n. 3, p. 143-181. http://dx.doi.org/10.1590/S1677-04202002000300001 [ Links ]
Recebido/received: 2019.03.17
Aceite/accepted: 2019.06.17