INTRODUCCIÓN
En las últimas décadas, las malas hierbas han desarrollado mecanismos de resistencia a los herbicidas convencionales, hasta el punto que la incorporación de productos respetuosos con el medio ambiente, como herbicidas naturales basados en metabolitos especializados, se ha convertido en uno de los principales intereses de los investigadores. Entre las distintas clases de metabolitos especializados, los poliacetilenos son compuestos alelopáticos que han demostrado eficacia frente al crecimiento y germinación de distintas especies, como fue recientemente relatado por Nishidono & Tanaka (2022). Muchos poliacetilenos son compuestos volátiles, que pueden encontrarse como constituyentes de los aceites esenciales (AE) de las plantas. Por ejemplo, las raíces de Carlina acaulis L. (Asteraceae) contienen alrededor de 1% de AE, que está prácticamente constituido por el óxido aromático poliacetileno de carlina, alcanzando 90% o más de la composición total del AE, como fue recientemente relatado por Pavela et al. (2021). Los AE de plantas también son conocidos por ser prometedores bioherbicidas debido a su capacidad para inhibir la germinación de semillas y el crecimiento de plántulas, causando estrés oxidativo y alterando la maquinaria fotosintética, tal y como ya ha sido relatado por Verdeguer Sancho et al. (2020). De hecho, muchos AE y extractos de diferentes especies vegetales ya se han probado contra malezas problemáticas en todo el mundo, como Bidens pilosa L., con resultados prometedores en cuanto al posible desarrollo de nuevos herbicidas naturales (Pergo et al., 2008). Bidens pilosa (Asteraceae) es una especie herbácea considerada una maleza problemática en muchos ecosistemas debido a su resistencia a herbicidas convencionales, fuerte adaptabilidad y alta invasividad. Dado el desconocimiento sobre la fitotoxicidad de este producto natural, en este trabajo hemos evaluado por primera vez la fitotoxicidad del AE de C. acaulis en plantas adultas de B. pilosa. Además, se evaluaron los efectos del AE en la maquinaria fotosintética y el perfil ionómico y metabolómico.
MATERIALES Y MÉTODOS
Ensayos de fitotoxicidad con el AE
Se seleccionaron plantas adultas de Bidens pilosa previamente crecidas en macetas en condiciones de invernadero con un fotoperiodo de luz natural. Se seleccionaron aquellas que habían alcanzado cuatro hojas verdaderas y se pulverizaron una sola vez con 10 mL de emulsión de AE a distintas concentraciones: 4, 8, 12 y 20 µL/mL. Tras 48 horas de tratamiento con el AE, se cosechó material vegetal para evaluar los siguientes parámetros: área foliar total, contenido relativo de agua y peso seco/peso fresco.
Medidas de fluorescencia de la clorofila a
Se monitorizaron las variaciones en la maquinaria fotosintética de la planta tras 0, 6, 24 y 48 horas de exposición con el AE utilizando el medidor de fotosíntesis portátil Photosynq MultispeQ v2.0. En concreto, se midió la eficiencia fotoquímica del fotosistema II (Φ II), la disipación de energía regulada en forma de calor (Φ NPQ), la disipación de energía no regulada (Φ NO) y la eficiencia cuántica máxima del fotosistema II (F v /F m ).
Análisis del perfil ionómico
Además, se comparó el perfil ionómico de plantas no tratadas plantas tratadas con 4, 8, 12 y 20 µL/mL del AE de C. acaulis tras 48 h de exposición. El análisis ionómico se llevó a cabo mediante Espectrometría de Masas con Plasma de Acoplamiento Inductivo (ICP-MS), obteniéndose información de las concentraciones de Na, Mg, Al, K, Ca, Cr, Mn, Fe, Zn, Se, Cd, y P.
Análisis del perfil metabolómico
Por último, se realizó un análisis metabolómico no dirigido mediante Cromatografía de Gases acoplada a Espectrometría de Masas (GC/MS). Tras la extracción y derivatización de las muestras, utilizando el ribitol como estándar interno (0,2 mg/mL), se inyectaron en un cromatógrafo de gases Agilent (GC 7890 A) acoplado a un espectrómetro de masas de cuadrupolo único (MS 5975 C INERT XL MSD) y un auto-muestreador CTC ANALYTICS PAL. Para la cromatografía de la muestra se utilizó una columna MEGA-5MS (30 m × 0,25 mm × 0,25 µm + 10 m de precolumna) (MEGA s.r.l., Milán, Italia) y como gas portador helio ultrapuro (6,0) con un caudal de 1 mL/min.
Análisis estadístico
Los datos de los experimentos fueron analizados utilizando el test Kruskal-Wallis (p ≤ 0.05). Por otro lado, el análisis de datos de metabolómica se realizó primeramente con el software MS-DIAL y posteriormente en Metaboanalyst 6.0. Se realizó un análisis de componentes principales (PCA) el análisis ortogonal de mínimos discriminantes parciales (OPLS-DA). Se llevó a cabo un t-test (p ≤ 0,05) para analizar las diferencias estadísticas entre los metabolitos de las plantas control y las plantas tratadas con AE.
RESULTADOS
Tras el tratamiento con la emulsión del AE, las plantas de B. pilosa mostraron efectos tempranos como necrosis en las hojas (u hojas completamente secas en el caso de las concentraciones más altas ensayadas) (Figura 1), reducción significativa del área foliar total y reducción del peso fresco y peso seco.

Figura 1 Efectos fenotípicos ocasionados por el AE de C. acaulis en plantas adultas de B. pilosa tras 24 horas. De izquierda a derecha, tratamiento control (0 µL/mL), 12 µL/mL y 20 µL/mL.
Además, las plantas de B. pilosa mostraron un aumento progresivo del ratio peso seco/peso seco a medida que aumentaba concentración de AE, unido con la disminución significativa del contenido relativo en agua. Los resultados del análisis ionómico revelaron que el AE redujo significativamente las concentraciones de Mn y Ca, entre otros. Sin embargo, los niveles de K y P aumentaron significativamente en comparación con las plantas control (Tabla 1).
Tabla 1 Contenido de iones de plantas adultas de B. pilosa tras 48 horas de exposición al AE de C. acaulis. De izquierda a derecha, tratamiento control (0 µL/mL), 4, 8, y 20 µL/mL
| Elemento (µg/µgDW) | Tratamiento (µg/mL) | ||||
| 0 | 4 | 8 | 12 | 20 | |
| K | 28099.33 ± 914.57 | 31842.43 ± 325.78* | 31532.62 ± 743.03* | 31709.27 ± 437* | 30647.31 ± 1004.6* |
| P | 7419.94 ± 158.28 | 7881.90 ± 760.18 | 8551.05 ± 577.72* | 8176.64 ± 627.02 | 9592.04 ± 423.05* |
| Ca | 20698.96 ± 1270.13 | 20169 ± 618.64 | 20029.34 ± 818.87 | 18908.18 ± 584.33 | 17098.22 ± 395.33* |
| Mn | 252.97 ± 15.57 | 229.74 ± 5.27* | 190.06 ± 14.62* | 198.99 ± 8.61* | 202.96 ± 5.73* |
Tras la monitorización de los parámetros fotosintéticos de la planta a las 0, 6, 24 y 48 horas, se observó que la eficiencia del fotosistema II (Φ II) fue progresivamente disminuyendo a medida que aumentaba la concentración de AE (Figura 2A). Simultáneamente, la eficiencia máxima del fotosistema II en oscuridad (F v /F m ) experimentó la misma tendencia (Figura 2D). La emisión de energía no regulada en exceso en forma de fluorescencia (Φ NO) disminuyó significativamente en comparación con las plantas control (Figura 2B), mientras que la energía disipada en forma de calor (Φ NPQ) aumentó significativamente tras la pulverización del AE de C. acaulis (Figura 2C).
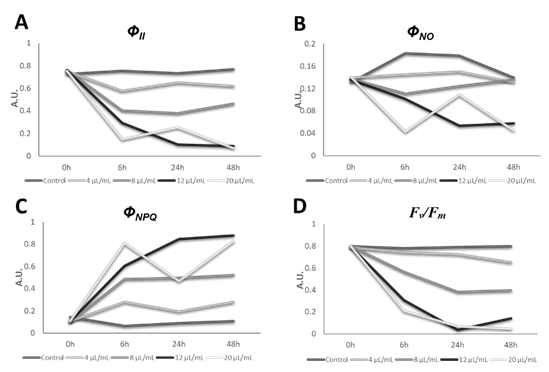
Figura 2 Valores medios de la eficiencia del fotosistema II (Φ II) (A), la energía no regulada en exceso en forma de fluorescencia (Φ NO) (B), la energía disipada en forma de calor (Φ NPQ) (C), y la eficiencia máxima del fotosistema II en oscuridad (F v /F m ) (D) de plantas de B. pilosa expuestas a distintas concentraciones de AE (0, 4, 8, 12, and 20 µL/mL) durante 0, 6, 24 y 48 h. Los valores medios estaban expresados en unidades arbitrarias (A.U.).
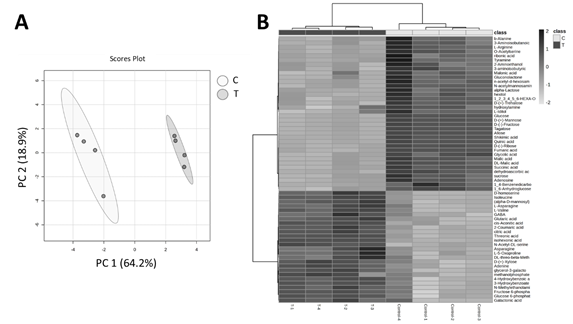
El perfil metabolómico analizó un total de 444 metabolitos, de los cuales 97 fueron correctamente identificados. El análisis de componentes principales construido sobre la primera y la segunda componente, explicó una varianza total del 83,1% y reveló una clara separación entre grupos de muestras (Figura 3A). El t-test demostró que 62 metabolitos fueron alterados significativamente después de la exposición al AE. Los metabolitos alterados fueron principalmente aminoácidos (alanina, GABA, isoleucina), azúcares (fructosa, glucosa y manosa) y ácidos orgánicos (ácido cítrico, ácido fumárico, ácido glutárico), entre otros (Figura 3B). En general, los aminoácidos incrementaron su contenido tras el tratamiento con el AE de C. acaulis mientras que los azúcares disminuyeron en comparación con el tratamiento control. Por último, se evaluaron también las rutas metabólicas afectadas, obteniéndose un total de 41 rutas alteradas tras la exposición al AE. Entre ellas, las más impactadas fueron la ruta de la alanina, aspartato y glutamato, la ruta metabólica de la glicina, serina y treonina y la ruta metabólica del almidón y la sacarosa.
DISCUSIÓN
En este trabajo se ha evaluado el efecto fitotóxico del AE de C. acaulis contra la mala hierba Bidens pilosa. Como ya fue relatado por Benelli et al. (2022), la actividad biológica del AE de C. acaulis está principalmente ligada a la presencia de óxido de carlina como principal constituyente, que también fue demostrado en este trabajo mediante una hidrodestilación del AE. Los ensayos demostraron que el AE causó deshidratación de las hojas y necrosis foliar, también confirmado por el aumento del ratio peso seco/peso fresco. Resultados similares ya habían sido relatados por Diaz-Tielas et al. (2014) tras el tratamiento con trans-chalcona, sugiriendo alteraciones en el estado hídrico de la planta. Las plantas de B. pilosa experimentaron una disminución significativa de la eficiencia del fotosistema II (Φ II) y de la eficiencia máxima del fotosistema II en oscuridad (F v /F m ), sugiriendo un posible daño físico en el complejo antena del fotosistema II y causando una disminución de la eficiencia fotosintética, tal y como ya había sido relatado por Sánchez-Moreiras et al. (2020) y Álvarez-Rodríguez et al. (2023). El posible daño en el fotosistema II fue también demostrado con el análisis ionómico. Las plantas de B. pilosa experimentaron una reducción significativa del contenido en Mn, considerado como un componente principal del complejo evolutivo de oxígeno del fotosistema II. El cluster Mn4Ca es el encargado de proteger frente a situaciones de estrés oxidativo y de impulsar la cadena de transporte de electrones (Schmidt et al., 2016). Por lo tanto, una disminución en el contenido de Mn derivaría en una reducción del número de electrones que atraviesan el fotosistema, induciendo una disminución de la eficiencia fotosintética. En consecuencia, la deficiencia de Mn está directamente correlacionada con el parámetro F v /F m , que se reduce debido al estrés, como hemos observado en las plantas de B. pilosa tras la exposición al AE de C. acaulis. Como ya fue relatado por Schmidt et al. (2016), las hojas de Hordeum vulgare L. mostraron manchas marrones necróticas como consecuencia de la deficiencia de Mn, síntoma también observado en las hojas de B. pilosa tras el tratamiento con AE de C. acaulis. Además, el análisis ionómico mostró disminución del contenido de Ca, también parte del cluster Mn4Ca, y cuyo déficit afecta negativamente a la eficiencia fotosintética. El análisis metabolómico reveló que el AE de C. acaulis aumentó generalmente el contenido de aminoácidos con capacidad osmoprotectora (GABA, isoleucina, valina). Resultados similares fueron documentados por López-González et al. (2023) tras el tratamiento con citral y farnesene, sugiriendo que las plantas se estaban defendiendo del estrés con un incremento en la producción de estos aminoácidos con capacidad osmoprotectora. La acumulación de aminoácidos de cadena ramificada, como la isoleucina y la valina, ya se ha relacionado con respuestas a situaciones de estrés osmótico, principalmente debido a condiciones de estrés por sequía, como ha sido relatado por Huang and Jander (2017). Nuestros resultados sugieren que la exposición al AE de C. acaulis provoca una alteración del estado hídrico de la planta, induciendo alteraciones osmóticas y, como consecuencia, la acumulación de aminoácidos de cadena ramificada. Por último, las plantas de B. pilosa experimentaron una disminución generalizada del contenido de azúcares. Como ha sido relatado por Khan et al. (2020), frente a condiciones severas de estrés, las plantas pueden experimentar una disminución del contenido de azúcares. De hecho, ha sido relatado recientemente (López-González et al. 2023) que una reducción en el contenido de sacarosa puede estar relacionado con una disminución de la eficiencia fotosintética, ya que es el producto principal de la fotosíntesis. Esta situación estaría en relacionada con nuestros resultados, ya que el AE de C. acaulis alteró varios parámetros de fluorescencia de clorofila a, sugiriendo daños en la maquinaria fotosintética de las plantas de B. pilosa, reduciendo la eficiencia fotosintética.
CONCLUSIONES
El AE de C. acaulis, compuesto principalmente por óxido de carlina, ha demostrado tener un fuerte potencial fitotóxico contra plantas de Bidens pilosa. Los efectos provocados por este AE sugieren una posible alteración en el estado hídrico de la planta y daño físico en la maquinaria fotosintética. La reducción de los niveles de azúcares, Mn y Ca confirmó aún más esos daños potenciales, sugiriendo una alteración en la correcta funcionalidad del cluster Mn4Ca del PSII. Los resultados de este trabajo sugieren que el AE de C. acaulis podría considerarse un producto fitotóxico prometedor para la gestión de malas hierbas.