INTRODUCCIÓN
El manejo de las malezas es uno de los principales problemas de la agricultura, ya que provocan importantes pérdidas económicas para los agricultores (Dayan et al., 2009). Si bien el uso de herbicidas químicos es la solución más rápida y económica, son altamente contaminantes, y el número limitado de dianas moleculares de estos herbicidas favorece la aparición de malas hierbas resistentes (López-González et al., 2020). Dada esta situación, se están buscando sustancias de origen natural con capacidad herbicida, ya que estas poseen una mayor diversidad estructural y pueden presentar modos de acción novedosos (Duke et al., 2000).
El ácido pelargónico (AP) es un ácido graso saturado de 9 carbonos cuyo uso como herbicida está actualmente autorizado en muchos países, siendo un bioherbicida de contacto no selectivo, de estadíos tempranos y de aplicación foliar (Muñoz et al., 2022). Sin embargo, a pesar de su amplia aceptación, su modo de acción todavía no se conoce con detalle. Hasta hace unos años, se pensaba que el AP actua sobre los lípidos de membrana, desestabilizando la membrana plasmática y modificando su estructura, pero según Lebecque et al. (2019), en un estudio utilizando simulaciones de dinámica molecular, el efecto fitotóxico del PA asociado a su incrustación en la bicapa lipídica no podría justificarse, ya que no tiene una cadena alquílica lo suficientemente larga como para causar la desestabilización lipídica de la membrana.
Por ello, este trabajo tiene como objetivo estudiar el modo de acción del bioherbicida AP sobre la fisiología vegetal de plántulas de la especie modelo Arabidopsis thaliana.
MATERIALES Y MÉTODOS
Curva dosis-respuesta
Se esterilizaron semillas de A. thaliana en EtOH al 50% durante 3 min y NaOCl al 0,5% durante otros 3 min y se dejaron en agar al 0,1% durante 72 h en nevera. Posteriormente, se sembraron 24 semillas en medio agar vegetal con una mezcla de macro y micronutrientes y sacarosa al 1% en placas Petri, con 5 réplicas por tratamiento. El AP se disolvió en diferentes concentraciones en el medio (0, 10, 20, 40, 80 y 160 µM). Las placas se colocaron verticalmente en una cámara de crecimiento a 22 ºC, 55% humedad y 8 h de luz durante 14 días. Al final del tratamiento, se midió la longitud radicular y se calcularon los valores de IC50 e IC80 (concentraciones que causan el 50 y 80% de inhibición del crecimiento radicular, respectivamente) y se observaron de visu los efectos del AP. Los datos de crecimiento radicular se analizaron estadísticamente con el programa SPSS mediante ANOVA con DMS, mientras que para el cálculo de las IC50 e IC80 se empleó el modelo de regresión con un mayor coeficiente de correlación.
Análisis ultraestructural en raíces
Los ápices radiculares de plántulas control y tratadas con la IC50 de AP durante 7 días se cosecharon y se introdujeron en tampón cacodilato 0,1 M con glutaraldehído al 5% durante 4 h a 4 ºC. Posteriormente, se lavaron con tampón cacodilato fresco y se sumergieron en una solución de acetona al 10% con acetato de uranilo al 2% durante 1 h y se pasaron a tampón cacodilato 0,1 M con OsO4 durante 3 h. Las muestras se deshidrataron en soluciones de acetona de concentración creciente y se añadió resina Spurr a 4 ºC para finalmente dejarlas polimerizar durante 2-3 días a 60 ºC. Se realizaron cortes ultrafinos (50-70 nm) y se observaron en el microscopio electrónico de transmisión.
Bioensayo con PCIB
Dada la morfología observada en la curva dosis-respuesta, se realizó un ensayo con la molécula antiauxínica PCIB (ácido p-clorofenoxisobutírico) para observar un posible desequilibrio auxínico. Se sembraron plántulas y se tratatron con las IC0, IC50 e IC80 de AP, 15 µM de PCIB y las combinaciones de AP y PCIB.Tras 14 días de tratamiento se tomaron fotos con la lupa y se comparó su morfología.
Ensayo con líneas transgénicas
Para entender más el posible efecto del AP sobre las auxinas, se realizó un ensayo con las líneas transgénicas GFP de A. thaliana pDR5::GFP (marca en verde la presencia de auxinas) y pPIN1::PIN1-GFP (marca en verde la proteína transportadora de auxinas PIN1). Se sembraron plántulas de ambas líneas y se trataron con la IC50 de AP. Tras 7 y 14 días, las raíces se observaron al microscopio confocal y se tomaron imágenes.
Detección de microtúbulos
Las raíces de plántulas control y tratadas con la IC50 de AP se cosecharon tras 7 y 14 días de tratamiento. Para la detección de los microtúbulos, se utilizó un marcaje mediante inmunofluorescencia según el método de Holzinger et al. (2010), y se comparó la distribución y morfología de los microtúbulos en el control y el tratamiento.
Docking molecular
Se estudió la interacción del AP con la proteína PIN1 y se comparó con la interacción de esta proteína con la auxina natural IAA y con el inhibidor del transporte auxínico NPA. Los estudios de acoplamiento molecular se realizaron con el paquete de software de gráficos moleculares ICM-Pro Molsoft versión 3.9-2d. Los ligandos IAA, NPA y PA se convirtieron a sus estructuras 3D y se buscaron sus geometrías conformacionales de menor energía. Se realizaron simulaciones ciegas de acoplamiento flexible ICM entre PIN1At y los ligandos IAA, NPA y PA utilizando la estructura completa de la proteína.
RESULTADOS Y DISCUSIÓN
La curva dosis-respuesta confirmó el efecto fitotóxico del AP, obteniéndose unos valores de IC50 e IC80 de 30,4 y 61,6 µM respectivamente. Visualmente, se observó que a medida que aumentaba la concentración, disminuía la longitud de la raíz, apareciendo raíces adventicias y raíces primarias que se retorcían ligeramente, mientras que no se observaron efectos relevantes en la parte aérea. A nivel ultraestructural, las raíces tratadas con el AP mostraron células con paredes irregulares dispuestas en zigzag y algunas de ellas inacabadas, mientras que las paredes eran rectas y continuas en las plántulas control (Figura 1).
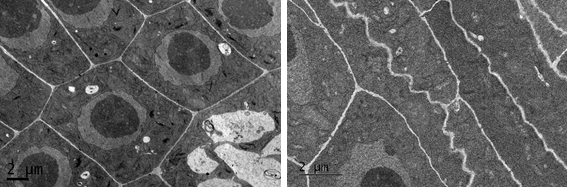
Figura 1 Imágenes del microscopio electrónico de transmisión de raíces control (izquierda) y tratadas con AP (derecha) tras 7d de tratamiento.
Estas alteraciones en la pared junto a la torsión observada en las raíces sugieren un problema a nivel de los microtúbulos, el cual fue confirmado mediante inmunofluorescencia. A ambos tiempos, los microtúbulos se observaban bien alineados en las plántulas control, mientras que en el tratamiento con AP aparecían desorganizados y en ocasiones perdían la continuidad que se observaba en el control (Figura 2).
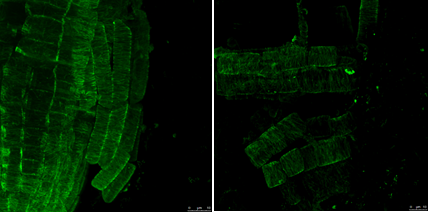
Figura 2 Imágenes de microtúbulos tomadas en el microscopio confocal en plántulas control (izquierda) y tratadas con AP (derecha) tras 7d de tratamiento.
La presencia de raíces adventicias y torsión sugiere que el compuesto podría estar afectando al balance de auxinas. Esto se confirmó mediante un ensayo con el antiauxínico PCIB. Las plántulas que crecieron con la combinación de PCIB y AP mostraron un menor número de raíces adventicias y no presentaron torsión, por lo que el PCIB estaría revirtiendo los efectos del AP (Figura 3).
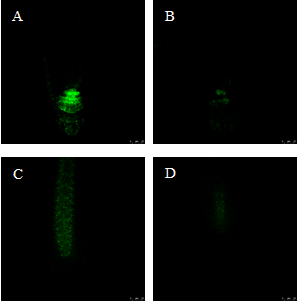
Figura 3 Imágenes de estereo microscopio de plántulas control (A), IC50 AP (B), IC80 AP (C), PCIB (D), IC50 AP + PCIB (E) y IC80 + PCIB (F) tras 14d de tratamiento.
Los ensayos con las líneas transgénicas pDR5::GFP y pPIN1::PIN1-GFP, demostraron cómo el AP altera el balance de auxinas, ya que en las plántulas pDR5::GFP se observó una menor señal que indica una menor cantidad de auxinas en el ápice en comparación con el control, viéndose alterado, además, el transporte de auxinas, tal y como se puede observar en las plántulas de la línea pPIN1::PIN1-GFP, que mostraron una menor señal en comparación con el control, lo que indica una menor cantidad de proteínas transportadoras PIN1 (Figura 4).
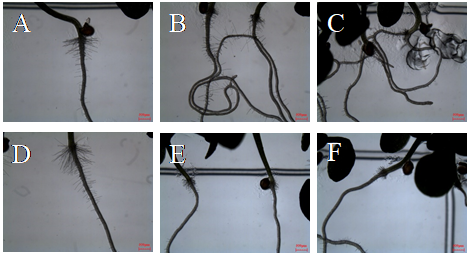
Figura 4 Imágenes de microscopio confocal de plántulas de las líneas transgénicas pDR5::GFP y pPIN1::PIN1-GFP control y tratadas con AP tras 7 d de tratamiento.
Los ensayos de docking molecular permitieron conocer el comportamiento del AP en el interior celular, encontrándose que tanto el IAA y el NPA, como el AP se unen a la proteína PIN1 en el mismo sitio, siendo el NPA el que presenta mayor afinidad, seguido del AP y por último el IAA. Esto sugiere que tanto AP como IAA compiten por el sitio de unión en PIN1, haciendo que la planta perciba el AP como una auxina y mimetizando así su efecto. Este exceso de auxina es lo que provocaría cambios en la organización de los microtúbulos (True & Shaw, 2016), y cambios en la morfología de la raíz, favoreciendo el desarrollo de raíces adventicias (López-González et al., 2020).
CONCLUSIONES
Podemos concluir que el AP es un compuesto natural que podría actuar como imitador del IAA. Esta aplicación exógena de “auxina” sería la responsable de las alteraciones observadas causadas por un cambio en el transporte de auxinas, lo que induce la inhibición radicular y finalmente la detención total del crecimiento radicular.














