Introdução: Cancro de mama e expressão HER2
O cancro da mama é o diagnóstico oncológico com maior incidência em todo o mundo, sendo uma das principais causas de morte relacionadas com o cancro. Em 2020, mais de 2,2 milhões de pessoas foram diagnosticadas com cancro da mama, tendo sido reportadas cerca de 685.000 mortes no mundo1. Na Europa, cerca de 531.000 pessoas foram diagnosticadas com cancro da mama, registando-se 141.000 mortes2.
O recetor tipo 2 do fator de crescimento epidérmico humano (HER2, do inglês Human Epidermal growth factor Receptor-type 2) é um recetor de tirosina cinase que regula o crescimento, a proliferação e a sobrevivência celulares. É expresso na superfície de muitos tipos de células tumorais, incluindo as do cancro da mama, gástrico, do pulmão e colorretal. É um reconhecido biomarcador no cancro da mama, sendo que a sua sobre-expressão ou amplificação ocorre em cerca de 15-20% dos casos de cancro da mama invasivos, estando associada a um prognóstico negativo3-7. Deste modo, constitui um alvo terapêutico para o qual se têm desenvolvido vários fármacos dirigidos nas últimas décadas6,8.
A expressão HER2 é determinada por um teste de imunohistoquímica (IHC, do inglês immunohistochemistry) que estima a quantidade/expressão de proteína HER2 presente na membrana celular das células cancerígenas e/ou através de um teste de hibridização in situ (ISH, do inglês in situ hybridization) que permite determinar o número de cópias/amplificação do gene HER2. Na prática clínica, um score 3+ por IHC é considerado positivo, permitindo a classificação do cancro da mama como HER2 positivo e o respetivo acesso a tratamentos com fármacos dirigidos ao HER2. Quando o resultado é ambíguo (score 2+), é recomendado avaliar a amplificação do gene HER2 através de ISH de modo a clarificar a classificação HER29,10.
Atualmente, sabe-se que aproximadamente 50% de todos os cancros da mama previamente classificados como HER2-negativos são HER2-low (definidos por um score HER2 de IHC 1+ ou IHC 2+/ISH negativo), ocorrendo tanto nos cancros da mama recetores hormonais positivos (HR+) como nos HR negativos (HR-)11 (Figura 1).
Historicamente, os doentes com cancro da mama metastático HR+ e HER2-low que progridem após terapêutica endócrina e inibidores das cinases dependentes de ciclinas 4/6 (iCDK4/6), apresentam opções de tratamento limitadas com impacto na sobrevivência global12. Por outro lado, as opções de tratamento são ainda mais limitadas nos doentes com cancro da mama triplo-negativo (negativo para recetores de estrogénio, progesterona e HER2)13,14.
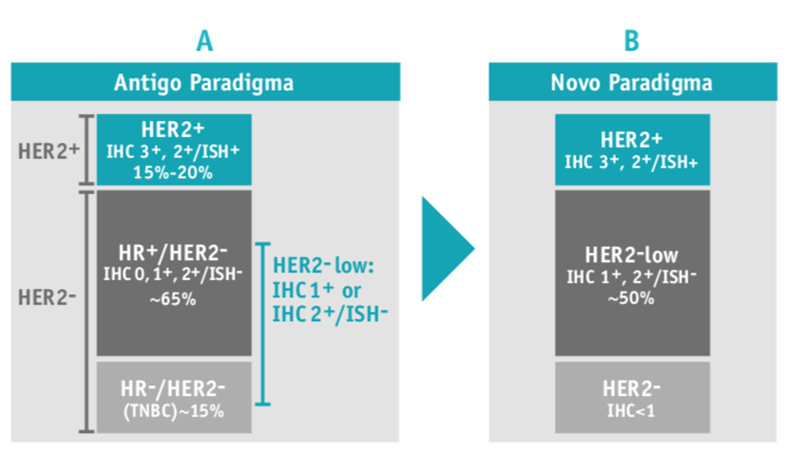
Figura 1 Mudança de paradigma na classificação do cancro da mama metastático (adaptado de 15,16). A - A classificação do cancro da mama metastático era feita entre HER2 positivo (20%) e HER2 negativo (80%)15,16. B - De acordo com os métodos de classificação atuais, cerca de 50% dos cancros de mama são HER2-low15,17. HER2 - receptor tipo 2 do fator de crescimento epidérmico humano (do inglês human epidermal growth factor receptor-type 2); IHC - imunohistoquímica (IHC, do inglês immunohistochemistry); ISH - hibridização in situ (do inglês in situ hybridization); HR - recetores hormonais (do inglês hormone receptors); TNBC -cancro da mama triplo-negativo, do inglês triple-negative breast cancer.
Este documento é o resultado da discussão e validação de um grupo de peritos na área do cancro da mama e tem como finalidade recomendar procedimentos e boas práticas para a gestão dos eventos adversos associados ao tratamento com trastuzumab deruxtecano na pessoa com cancro da mama.
Molécula: Farmacologia e mecanismo de ação
O trastuzumab deruxtecano (T-DXd) é um conjugado anticorpo-fármaco (ADC, do inglês antibody-drug conjugate) direcionado ao HER2. É constituído por um anticorpo monoclonal humanizado anti-HER2, do tipo IgG1, com a mesma sequência de aminoácidos que o trastuzumab, ligado covalentemente ao deruxtecano, um derivado do exatecano com ação inibitória da topoisomerase I. Cada anticorpo está conjugado através de uma ponte peptídica, com aproximadamente oito moléculas de deruxtecano18-20.
O T-DXd atua ligando-se aos recetores HER2 presentes na superfície membranar das células tumorais, sendo internalizado. Após a internalização, as enzimas lisossomais presentes nas células tumorais clivam a ponte peptídica, libertando as moléculas de deruxtecano. Essas moléculas inibem a topoisomerase I, interferindo com a replicação do ácido desoxirribonucleico (ADN), com consequente apoptose celular18-21. O deruxtecano libertado pode ainda atravessar a membrana celular, exercendo atividade nas células tumorais adjacentes (bystander effect) (Figura 2)20,22. Após a sua clivagem, há uma metabolização dos componentes individuais: o trastuzumab é catabolizado à semelhança de anticorpos endógenos23 e o deruxtecano é oxidado pela enzima CYP3A4 e eliminado sobretudo por via fecal24. O tempo médio de semivida do T-DXd é de 5,8 dias25,26, não estando descritas interações medicamentosas clinicamente significativas18,27.
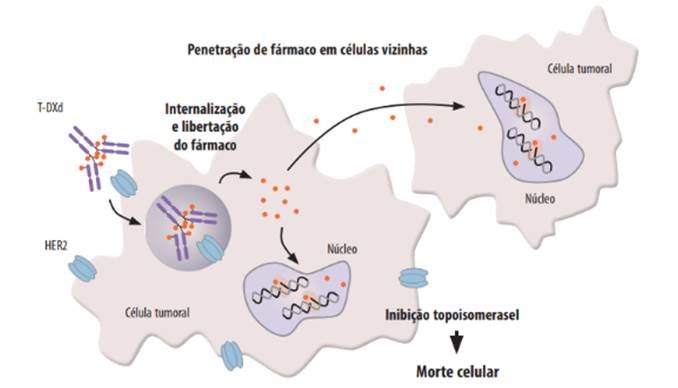
Figura 2 Mecanismo de ação do trastuzumab deruxtecano. HER2 - Receptor tipo 2 do fator de crescimento epidérmico humano (do inglês human epidermal growth factor receptor-type 2; T-DXd - trastuzumab deruxtecano. Adaptado de28.
Indicações do trastuzumab deruxtecano
A Tabela 1 resume as indicações terapêuticas aprovadas para o T-DXd, de acordo com o Resumo das Características do Medicamento Enhertu®18.
Revisão dos dados de eficácia
Os principais dados de eficácia do T-DXd no tratamento da pessoa com cancro da mama encontram-se descritos na Tabela 2. O ensaio clínico DESTINY-Breast01 foi fundamental para a aprovação inicial do medicamento, estabelecendo-o como a opção preferencial, quando disponível, em terceira linha terapêutica e subsequentes no cancro da mama HER2 positivo irressecável ou metastático. A validação da utilização de T-DXd em segunda linha provém dos resultados do ensaio DESTINY-Breast03. Por outro lado, os benefícios clínicos da utilização de T-DXd no cancro da mama HER2-low foram demonstrados no ensaio DESTINY-Breast04.
Tabela 2. Principais dados de eficácia clínica do trastuzumab deruxtecano.

sobrevivência global, a sobrevivência livre de progressão, assim como a duração de resposta são apresentados sob a forma de mediana. Abreviaturas: IC, intervalo de confiança; HR, taxa de risco (do inglês hazard ratio); HER2, receptor tipo 2 do fator de crescimento epidérmico humano (do inglês human epidermal growth factor Receptor-type 2); T-DXd, trastuzumab deruxtecano; HR+, recetores hormonais positivos; HR-, recetores hormonais negativos; T-DM1, trastuzumab emtansina; NA, não atingida. 1 Capecitabina + trastuzumab, capecitabina + lapatinib 2 Capecitabina, eribulina, gemcitabina, paclitaxel, ou nab-paclitaxel
Perfil de segurança
Durante todo o programa clínico DESTINY, o T-DXd demonstrou um perfil de segurança, no geral, manuseável e bem tolerável, com eventos adversos mais comuns de baixo grau (Tabela 3).
Tabela 3. Resumo dos principais eventos adversos do trastuzumab deruxtecano.
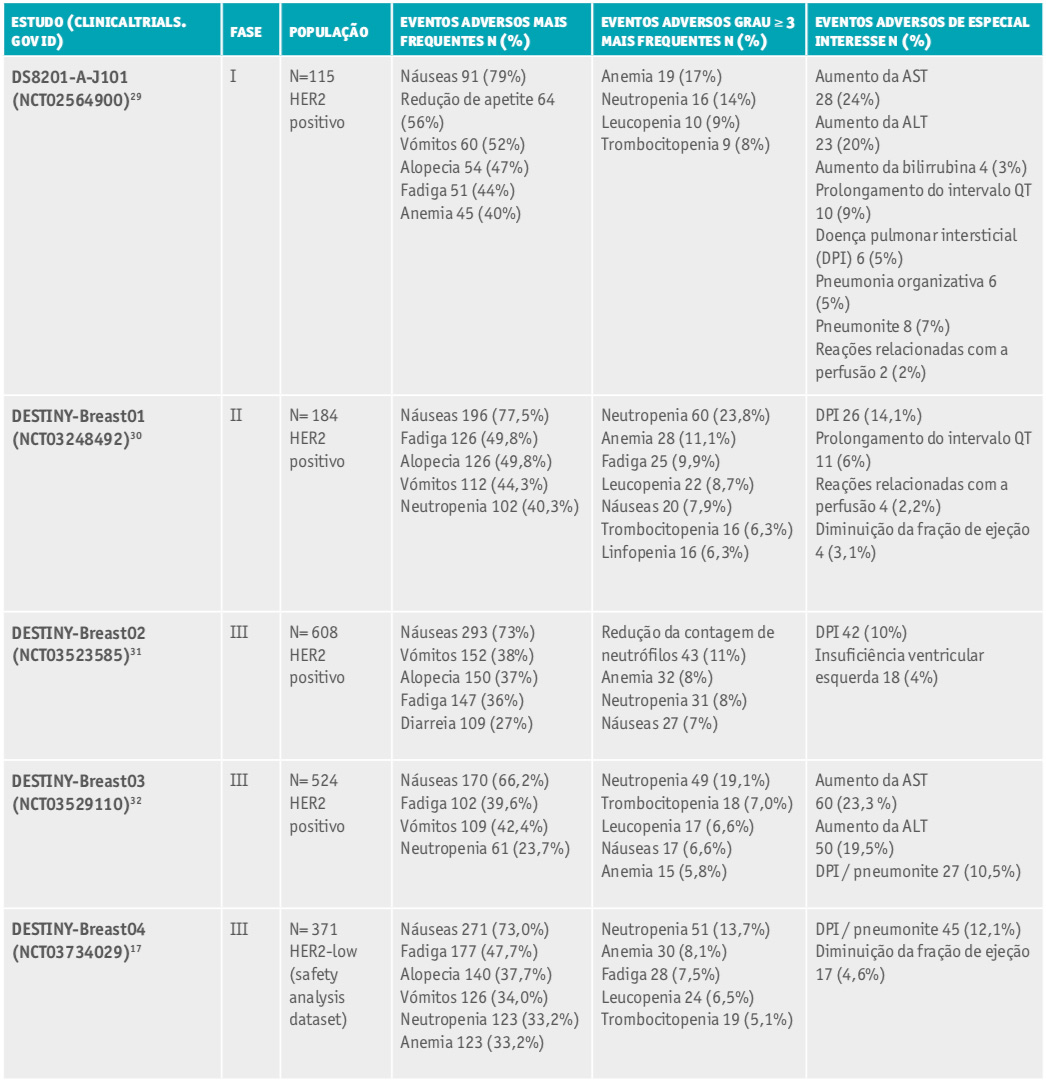
Abreviaturas: DPI - doença pulmonar intersticial; HER2 - receptor tipo 2 do fator de crescimento epidérmico humano (do inglês Hu- man Epidermal growth factor Receptor-type 2); AST - aspartato aminotransferase; ALT - alanina aminotransferase
Relativamente a eventos adversos de especial interesse, o mais preocupante é a doença pulmonar intersticial (DPI). Numa meta-análise de nove ensaios clínicos de fase I/II com T-DXd, com uma avaliação retrospetiva da ocorrência de DPI/pneumonite em 1150 doentes, a incidência reportada foi de 15,4%, com uma duração mediana de 5,4 meses. A DPI/pneumonite foi classificada como grau 1 ou grau 2 em 77,4% dos casos, grau 3 ou grau 4 em 1,3% e grau 5 em 2,2%33.
Numa outra meta-análise incluindo um total 1970 doentes de 15 ensaios clínicos em cancro da mama, a DPI foi observada em 11,7% dos doentes (222; IC 95%: 9,1% - 15,0%). A maioria dos casos de DPI foram de grau 1 ou 2 (80,2%; 174/217 doentes). Observou-se DPI de Grau 3 ou 4 em 29 doentes (13,4%) e de grau 5 em 14 doentes (6,4%)34.
Dada a gravidade deste evento adverso, têm sido publicadas recomendações sobre a monitorização, o diagnóstico e a abordagem da DPI/pneumonite nos doentes sob T-DXd, que incluem a deteção precoce de sinais e sintomas (ex.: tosse, dispneia, agravamento de sintomas respiratórios), vigilância clínica e imagiológica e abordagem multidisciplinar35.
Gestão dos procedimentos na utilização do trastuzumab deruxtecano
Posologia e modo de administração
A dose recomendada de T-DXd no tratamento da pessoa com cancro da mama é de 5,4 mg/kg administrada por perfusão intravenosa uma vez a cada 3 semanas (ciclo de 21 dias) (Figura 3), até à progressão da doença ou toxicidade inaceitável18.
O T-DXd deve ser reconstituído imediatamente antes da administração, diluído em solução de glucose a 5% e administrado usando um sistema opaco para proteção da luz e um filtro de polietersulfona (PES) ou de polissulfona (PS) em linha, de 0,20 ou 0,22 mícrones18. Se não for imediatamente utilizado, deve ser conservado à temperatura ambiente até 4 horas, incluindo preparação e perfusão, ou no frigorífico entre 2 °C e 8 °C até 24 horas, protegido da luz. Não deve ser congelado18.
A dose inicial deve ser administrada na forma de uma perfusão intravenosa de 90 minutos. Se a perfusão anterior foi bem tolerada, as doses subsequentes de T-DXd podem ser administradas na forma de perfusões de 30 minutos (Figura 4)18. Não existe tempo de vigilância recomendado, em qualquer administração18.
A velocidade da perfusão de T-DXd deve ser diminuída ou interrompida se o doente desenvolver sintomas relacionados com a perfusão. Recomenda-se a descontinuação permanente do T-DXd no caso de reações graves à perfusão18.
Atraso ou omissão de uma dose
No caso de atraso ou omissão de uma dose planeada, o T-DXd deve ser administrado logo que possível, sem aguardar até ao ciclo planeado seguinte. O esquema de administração deve ser ajustado de forma a manter um intervalo de 3 semanas entre as doses. A perfusão deverá ser administrada na dose e velocidade que o doente tolerou na perfusão mais recente18.
Pré-medicação
O T-DXd apresenta potencial emetogénico, incluindo a possibilidade de provocar náuseas e/ou vómitos tardios. Antes de cada dose de T-DXd, os doentes devem ser pré-medicados com um esquema de associação de dois ou três medicamentos (p. ex., dexametasona e um antagonista do recetor da serotonina (5-HT3) e/ou um antagonista do recetor da neurocinina-1 (NK1), conforme indicado) para a prevenção de náuseas e vómitos induzidos pela quimioterapia18.
Modificações da dose
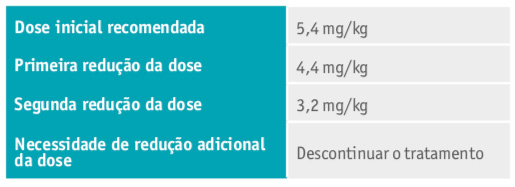
O tratamento das reações adversas pode exigir a interrupção temporária, redução da dose ou descontinuação do tratamento com T-DXd de acordo com as normas de orientação apresentadas na Tabela 4. A dose de T-DXd não deve ser novamente aumentada após ter sido efetuada uma redução da dose18.
Tabela 4. Esquema para redução da dose de trastuzumab deruxtecano no tratamento do cancro da mama18.
Recomendações para a gestão eficaz de eventos adversos
Avaliação e monitorização do doente
É importante esclarecer os doentes que identificar e comunicar imediatamente qualquer sintoma (incluindo aqueles não mencionados abaixo) pode ajudar a prevenir o agravamento de alguns eventos adversos e reduzir a necessidade de modificações de dose, possibilitando assim a continuidade do tratamento.

Figura 4 Sinais e sintomas de potenciais reações adversas muito frequentes com trastuzumab deruxtecano (podem afetar mais de 1 em 10 doentes)18.
Outras reações adversas comuns18:
- Alterações na pele (por exemplo: prurido, hiperpigmentação);
- Neutropenia febril (febre, juntamente com uma diminuição no número de neutrófilos);
- Alterações da visão (por exemplo: visão turva);
- Distensão abdominal;
- Xerostomia;
- Gastrite;
- Alterações analíticas no sangue (por exemplo: aumento da fosfatase alcalina, bilirrubinemia ou creatinemia);
- Reações infusionais relacionadas com a perfusão do medicamento.
Para além de fazer um levantamento dos sinais e sintomas reportados pelos doentes, é importante perceber se:
- Os sinais e sintomas já se encontravam presentes antes do tratamento;
- Os sinais e sintomas já se encontravam presentes antes do tratamento, mas agravaram-se após início do tratamento com T-DXd;
- Os sinais e sintomas surgiram após início do tratamento com T-DXd.
Tabela 5. Resumo da gestão dos eventos adversos relacionados ao trastuzumab deruxtecano18.
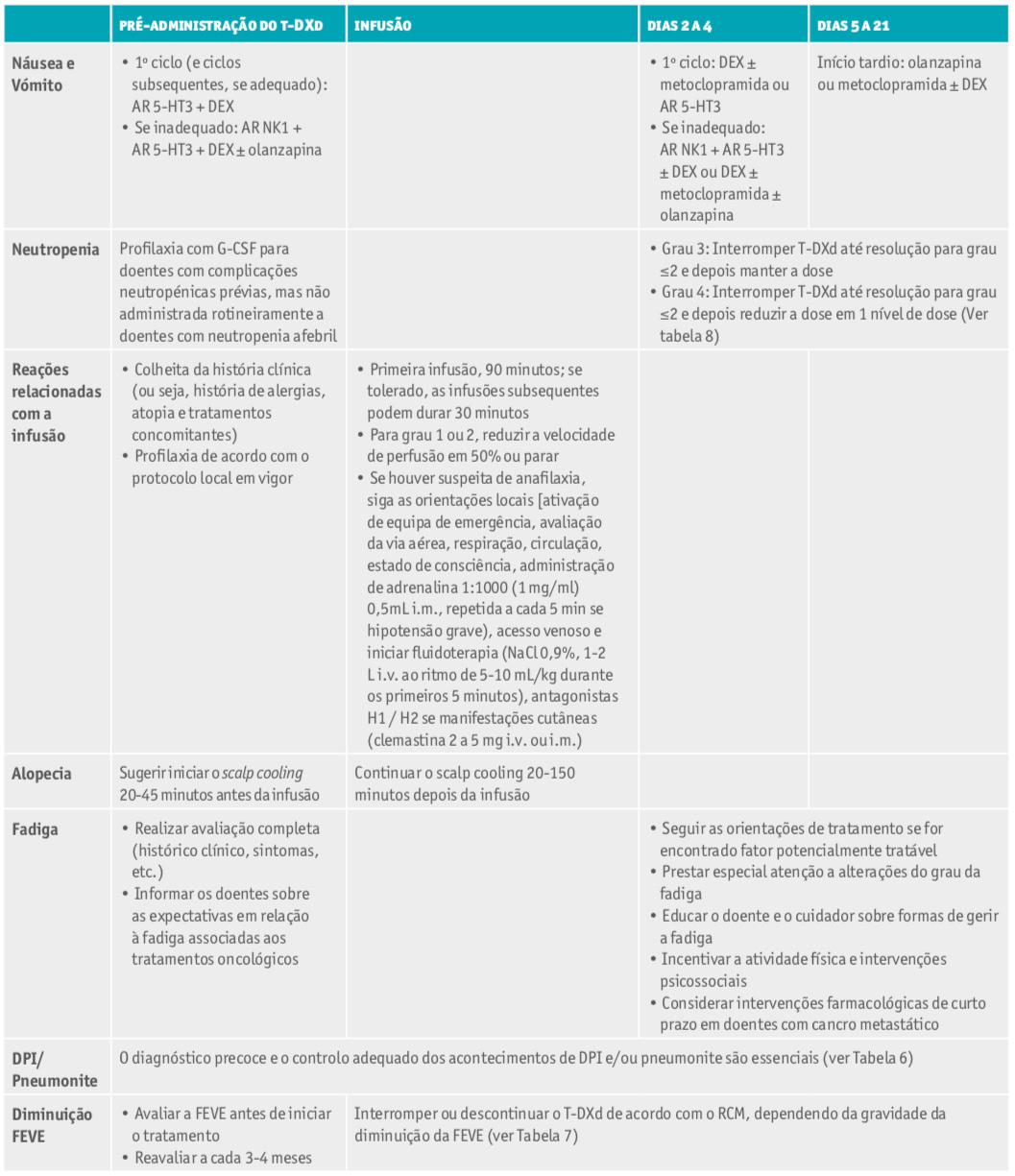
Considerar outras medidas não farmacológicas segundo o protocolo da instituição. Abreviaturas: 5-HT3 - 5-hidroxitriptamina tipo 3; AR - antagonista do receptor; DPI - doença pulmonar intersticial; DEX - dexametasona; FEVE - fração de ejeção do ventrículo esquerdo; G-CSF - fator estimulador de colónias de granulócitos (do inglês, granulocyte colony stimulating factor); i.m. - intramuscular; i.v. - intravenoso; NK1 - neurocinina-1; RCM - resumo das características do medicamento; T-DXd - trastuzumab deruxtecano
Identificação e minimização de eventos adversos graves
Doença pulmonar intersticial (DPI)/Pneumonite
Foram notificados casos de DPI e/ou pneumonite com T-DXd, que em 1,0% dos doentes foram fatais18. O diagnóstico precoce e o controlo adequado dos acontecimentos de DPI/pneumonite são essenciais para minimizar desfechos graves (Tabela 6, Tabela 7). Os doentes devem ser atentamente monitorizados e aconselhados a notificar imediatamente sinais e sintomas de DPI/pneumonite. Doentes com antecedentes de DPI/pneumonite podem ter um maior risco de desenvolverem uma DPI/pneumonite. Foi observada uma incidência mais elevada de DPI/pneumonite Graus 1 e 2 em doentes com compromisso renal moderado. Doentes com compromisso renal moderado ou grave devem ser monitorizados cuidadosamente18.
Tabela 6. Medidas de identificação e minimização de DPI/pneumonite18.

Medidas adicionais de minimização de risco de DPI/pneumonite podem ser consultadas em: https://extranet.infarmed.pt/web/fl/matedu/SEGURANCA/2023/5/78761/93ffb4e50a214676a00ded7dd35df9bc_ENHERTU_Guia_Profissionais_Saude_DPI_Pneu-monite_versao_3_17-04-2023.pdf
Tabela 7. Modificações do tratamento com trastuzumab deruxtecano face a DPI/Pneumonite18.

Abreviaturas: T-DXd, trastuzumab deruxtecano; DPI, doença pulmonar intersticial
Neutropenia
Foram notificados casos de neutropenia, incluindo neutropenia febril com evolução fatal, em ensaios clínicos de T-DXd. Devem ser monitorizados os hemogramas completos antes do início do tratamento com T-DXd, antes de cada dose, e conforme clinicamente indicado. Dependendo do grau de gravidade da neutropenia, poderá ser modificado ou descontinuado o tratamento com T-DXd (Tabela 8)18.
Tabela 8. Modificações do tratamento com trastuzumab deruxtecano face a neutropenia18.

Abreviaturas: T-DXd, trastuzumab deruxtecano
Diminuição da fração de ejeção ventricular esquerda (FEVE)
Observou-se diminuição da FEVE com as terapêuticas anti-HER2. Aconselha-se a realização de testes padrão da função cardíaca para avaliar a FEVE antes do início do tratamento com T-DXd e em intervalos regulares durante o tratamento, conforme clinicamente indicado. A gestão da diminuição da FEVE pode ser feita através de modificações de dose (Tabela 9)18.
Tabela 9. Modificações do tratamento com trastuzumab deruxtecano face à diminuição da FEVE18.

Avaliar a necessidade de referenciação para Cardiologia, de acordo com os protocolos institucionais aplicáveis. Abreviaturas: FEVE - fração de ejeção ventricular esquerda; T-DXd - trastuzumab deruxtecano
Guia de orientação para visitas dos doentes
Na primeira visita:
- Informar e esclarecer o doente sobre o protocolo terapêutico proposto antes de iniciar o tratamento com T-DXd.
- Informar o doente de que pode ter eventos adversos graves e potencialmente fatais resultantes de problemas pulmonares.
- Validar se o doente tem antecedentes de DPI/pneumonite.
- Verificar se existem sinais e sintomas de doença pulmonar.
- Informar o doente de que o diagnostico precoce e o controlo adequado dos acontecimentos de DPI/pneumonite são essenciais para minimizar eventos adversos graves.
- Alertar o doente da necessidade de contactar imediatamente se tiver sinais ou sintomas ainda que ligeiros de DPI/pneumonite, dado que alguns acontecimentos podem agravar rapidamente se não forem tratados. O doente deve procurar assistência médica imediata e deve mostrar o Cartão do Doente ao(s) médico(s) de outra(s) unidade(s) de saúde se o oncologista responsável não estiver disponível.
- Sensibilizar o doente para não tratar os seus próprios sintomas.
- Preencher o Cartão do Doente (Apêndice II), entregá-lo ao doente, e lembrá-lo de que deve ter o cartão sempre consigo.
- Avaliar se existem outros sinais e sintomas de eventos adversos causados pelo T-DXd (Apêndice I. Checklist de sinais e sintomas de eventos adversos).
Em todas as visitas seguintes:
- Verificar se existem sinais e sintomas de doença pulmonar (Apêndice I).
- Informar o doente de que o diagnóstico precoce e o controlo adequado de doença pulmonar são essenciais para minimizar complicações com risco de vida.
- Lembrar o doente da importância de comparecer às consultas marcadas.
- Relembrar a possibilidade de contacto telefónico com as equipas de enfermagem.
- Verificar se o doente transporta consigo o Cartão do Doente.
- Verificar se existem outros sinais e sintomas de eventos adversos causados pelo T-DXd (Apêndice I. Checklist de sinais e sintomas de eventos adversos)
Conclusão
O T-DXd é um fármaco promissor no tratamento da pessoa com cancro da mama. Para além da sua eficácia no tratamento do cancro HER2 positivo, é também uma alternativa para tumores HER2-low. Este documento inclui um resumo dos dados de eficácia e segurança do T-DXd e recomendações para as equipas de enfermagem, de forma a uniformizar os protocolos de utilização e gestão do T-DXd no tratamento da pessoa com cancro da mama em Portugal. É essencial a identificação precoce e monitorização dos sinais e sintomas de eventos adversos graves, para uma atuação imediata, evitando assim a descontinuação e/ou suspensão do tratamento com T-DXd e/ou complicações mais graves e irreversíveis. Recomenda-se que os profissionais definam uma metodologia de trabalhos capaz de utilizar as recomendações major aqui descritas nas visitas dos doentes.