INTRODUÇÃO
Os erros inatos da imunidade (EII), também referidos como imunodeficiências primárias (IDP), manifestam-se por suscetibilidade aumentada a doenças infeciosas e estão frequentemente associados a autoimunidade, doenças autoinflamatórias, alergias e malignidade, relacionadas com elevada morbimortalidade1.
As IDP podem dividir-se em distúrbios da imunidade adaptativa (défices de anticorpos, celulares ou combinados) e da imunidade inata (defeitos da fagocitose ou do complemento) 2. Estas patologias são, na sua maioria, hereditárias e monogénicas, com padrão de transmissão mendeliano simples, embora se verifique alguma variabilidade fenotípica que resulta da interação entre a genética, fatores ambientais e caraterísticas do próprio indivíduo 3.
A imunodeficiência comum variável (IDCV) é uma doença rara, ocorrendo em aproximadamente 2 a 4 por 100 000 indivíduos na população em geral 4. É a IDP sintomática mais comum na idade adulta 5 e corresponde a uma proporção considerável dos doentes seguidos em centros terciários especializados em imunologia clínica.
A causa da IDCV não está totalmente definida e o seu quadro é caracterizado por uma grande variabilidade de manifestações clínicas. O diagnóstico assenta numa diminuição marcada dos níveis de imunoglobulina G (IgG) (pelo menos dois desvios-padrão abaixo da média para a idade) e de imunoglobulina M (IgM) ou imunoglobulina A (IgA) na presença dos seguintes critérios: a) início da imunodeficiência após os 2 anos de idade; b) ausência de iso‑hemaglutininas e fraca resposta vacinal; c) exclusão de outras causas possíveis de hipogamaglobulinemia 6.
A produção de anticorpos está sempre comprometida na IDCV; isto é frequentemente consequência da disfunção de células B, mas pode também resultar primariamente da disfunção de células T com consequente compromisso da produção de anticorpos 6.
Um novo coronavírus designado severe acute respiratory syndrome coronavirus 2 (SARS-CoV-2) deu início à pandemia coronavirus disease 2019 (COVID-19) em dezembro de 2019 7. A apresentação clínica desta doença pode variar de assintomática a insuficiência respiratória grave e falência multiorgânica com necessidade de admissão em unidade de cuidados intensivos e ventilação mecânica 8.
Existe algum grau de incerteza sobre o impacto da infeção SARS-CoV-2 em indivíduos com IDP, nomeadamente se esta população tem risco acrescido para desenvolver COVID-19 grave 9. Aparentemente, doenças pulmonares crónicas subjacentes representam um fator de risco para COVID-19 grave nos doentes com IDCV10. Além da maior vulnerabilidade dos doentes com IDP ao SARS-CoV-2, a associação a uma maior prevalência de doença pulmonar crónica pode modificar a resposta à vacinação, aumentando o risco de infeção a longo prazo 11.
O estudo da resposta à vacinação pneumocócica nas IDP tem um papel diagnóstico e permite um melhor prognóstico, podendo ser usado em doentes com função residual de células B para providenciar imunidade humoral para agentes infeciosos específicos 12. A resposta à imunização depende do tipo de antigénio, do mecanismo da vacina e do defeito imunológico específico do doente 13.
As vacinas podem ser agrupadas em vivas atenuadas, inativadas (conjugadas, polissacarídeas), mRNA e vetores virais. Doentes imunodeprimidos não apresentam contraindicação para administração de vacinas inativadas, enquanto vacinas vivas atenuadas não são recomendadas nas deficiências major de anticorpos 12. À luz do conhecimento atual, as vacinas de mRNA contra a COVID-19 podem ser consideradas seguras nesta população 14,15.
A imprevisibilidade do desfecho clínico da COVID-19 em indivíduos imunocomprometidos veio sublinhar a importância da vacinação contra o SARS-CoV-2, que tem sido corroborada por investigações que demostraram a produção de anticorpos anti-spike específicos e células T na maioria dos doentes com IDP que foram vacinados 16. De facto, esta população deve ter acesso prioritário à vacinação, dado que, se infetada, pode desenvolver infeção crónica, o que perpetua a propagação viral e facilita a emergência de novas variantes 11,17.
O objetivo deste estudo foi analisar a resposta imunológica à vacinação contra a COVID-19 em doentes com IDP, particularmente na subpopulação com IDCV.
MATERIAL E MÉTODOS
Os autores realizaram um estudo prospetivo que incluiu uma população de doentes com IDP [IDCV, deficiência seletiva de anticorpos e agamaglobulinemia ligada ao cromossoma X (ALX)] seguidos numa Unidade de Imunoalergologia de um hospital periférico em 2021-2022 e que foram vacinados contra a COVID-19.
Procedeu-se à consulta dos processos clínicos dos doentes elegíveis para estudo, com colheita de dados demográficos, clínicos e laboratoriais, nomeadamente: idade, sexo, comorbilidades, tratamento de substituição com gamaglobulina e história de infeção por SARS-CoV-2.
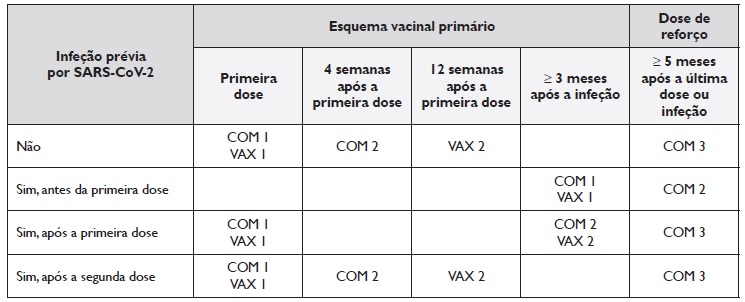
O esquema vacinal primário foi realizado de acordo com o recomendado em 2021 para a vacina administrada 18:
• Comirnaty® (Pfizer-BioNTech): primeira dose seguida por uma segunda dose após 4 semanas;
• Vaxzevria® (AstraZeneca): primeira dose seguida por uma segunda dose após 12 semanas.
De acordo com as recomendações atuais (18), os doentes receberam uma dose de reforço com a vacina Comirnaty® (Pfizer-BioNTech) 5 a 6 meses após a segunda dose.
O esquema vacinal para os doentes infetados pelo SARS-CoV-2 antes ou durante este estudo foi ajustado da seguinte forma:
• Doentes infetados pelo menos 3 meses antes do início do estudo receberam apenas 1 dose da vacina Comirnaty® (Pfizer-BioNTech), seguida pela dose de reforço 5 a 6 meses depois;
• Doentes infetados após a primeira dose receberam a segunda dose pelo menos 3 meses após a infeção;
• Doentes infetados após receberem 2 doses das vacinas Comirnaty® (Pfizer-BioNTech) ou Vaxzevria® (AstraZeneca) receberam a dose de reforço pelo menos 5 meses após a infeção.
Quanto à subpopulação de doentes com IDCV, foram consultados os resultados laboratoriais à data do diagnóstico para determinar a contagem basal de células CD19, IgA, IgM e IgG total.
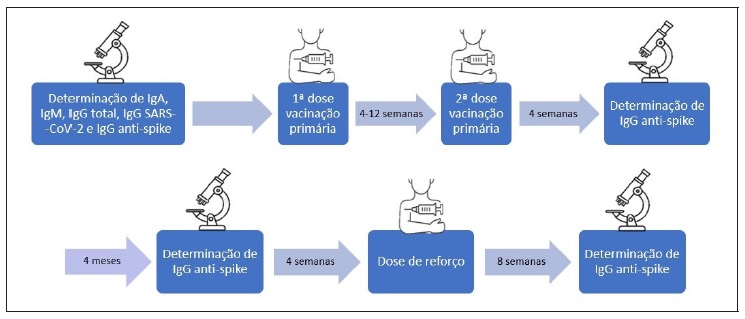
Todos os doentes incluídos no estudo foram submetidos a avaliações laboratoriais para determinar os valores de IgG total, IgG SARS-CoV-2 e IgG anti-spike antes de iniciarem a vacinação contra a COVID-19, para determinar a presença ou não de anticorpos contra o SARS-CoV-2 antes da vacinação e a gravidade da imunodepressão.
Novas determinações de IgG anti-spike foram realizadas 4 semanas após os doentes completarem o esquema vacinal primário. Para a subpopulação com IDCV, foi realizada determinação adicional 4 semanas antes e 8 semanas após a dose de reforço. Este estudo adicional não incluiu os doentes com deficiência seletiva de anticorpos ou ALX, considerando o facto de as amostras serem pouco representativas e dado que o objetivo desta análise era avaliar especificamente a resposta dos doentes com IDCV, a IDP mais frequente na prática clínica diária. Os doentes foram monitorizados para registar qualquer reação alérgica ou adversa durante ou após as inoculações. O esquema vacinal e o desenho do estudo estão representados na Tabela 1 e Figura 1, respetivamente. A comparação entre variáveis contínuas foi realizada através de análise de regressão linear simples. As diferenças foram consideradas significativas quando p <0,05. O GraphPad Prism Software versão 9.4.1 foi utilizado para a análise estatística.
Tabela 1 Esquema vacinal
COM - Comirnaty® (Pfizer-BioNTech); VAX - Vaxzevria® (AstraZeneca); SPI - Spikevax® (Moderna)
RESULTADOS
Foram incluídos 22 doentes com diagnóstico confirmado de IDP, no entanto 2 não compareceram à colheita de sangue para serologia pós-vacinal, pelo que foram excluídos. A nossa amostra final de 20 doentes era maioritariamente do sexo feminino (n=11, 55%) com média de idades de 36,8±13,1 anos (mínimo 16, máximo 62).
As IDP da população estudada foram: IDCV (n=12, 60%), deficiência seletiva de anticorpos (n=6, 30%) e ALX (n=2, 10%). A maioria dos doentes (n=12, 60%) realizava terapêutica de substituição com gamaglobulina subcutânea Gammanorm® (10 doentes com IDCV e 2 com ALX); a administração era efetuada no domicílio, com periodicidade semanal em todos os casos, sendo a dose administrada 4,95 ou 6,6 g. Dois doentes com IDCV não faziam tratamento por apresentarem níveis de IgG > 500 mg/dL associados a ausência de clínica de infeções de repetição.
Relativamente às comorbilidades, os doentes apresentavam: rinite (n=9, 45%); rinossinusite (n=8, 40%); asma (n=7, 35%); hiperplasia linfoide intestinal (n=5, 25%); hiperesplenismo (n=4, 20%); doenças autoimunes (n=2, 10%); e neoplasia (n=1, 5%).
Verificou-se que 1 doente teve infeção por SARS- -CoV-2 antes do início da vacinação, enquanto 2 doentes foram infetados após receberem a dose de reforço.
A mediana do valor de IgG total antes da vacinação foi de 419 mg/dL (IIQ, 238;896). A determinação de IgG SARS-CoV-2 antes do início da vacinação foi negativa (<0,9) em todos os doentes, incluindo o doente que reportou infeção prévia (diagnosticada 14 meses antes).
A maioria dos doentes (n=18, 90%) recebeu duas doses da vacina Comirnaty® (Pfizer-BioNTech) com intervalo de 4 semanas; 1 doente do sexo masculino fez duas doses da vacina Vaxzervria® (AstraZeneca) com intervalo de 12 semanas; e 1 doente previamente infetado fez uma dose da vacina Comirnaty® (Pfizer-BioNTech).
A determinação de anticorpos anti-spike foi positiva (IgG anti-spike ≥50 AU/mL) em 75% dos doentes (n=15), com valor mediano de 796 AU/mL (IIQ, 107;3772). Os resultados negativos (IgG anti-spike <50 AU/mL) ocorreram em 4 doentes com IDCV e 1 doente com ALX (IgG anti-spike 0 AU/mL). O outro doente com ALX apresentou seroconversão (IgG anti-spike 190,4 AU/mL), destacando-se um valor de IgG basal superior comparativamente ao doente com ALX com serologia negativa (1160 versus 690 mg/dL). Não houve ocorrência de reações alérgicas ou outras reações adversas significativas durante ou após a inoculação.
SUBPOPULAÇÃO COM IDCV
Na subpopulação com IDCV (n=12), as medianas dos valores basais de IgG total, IgA e IgM foram de 269 mg/dL (IIQ, 59;398), 25 mg/dL (IIQ, 24;26) e 19 mg/dL (IIQ, 17;26), respetivamente. Neste subgrupo, o valor mediano de IgG anti-spike 4 semanas após conclusão do esquema vacinal primário foi de 757 AU/mL (IIQ, 19;1062) e apresentou uma grande variabilidade (0-4298 AU/mL). Se separarmos os doentes sob terapêutica de substituição com gamaglobulina (n=10) dos que não a receberam (n=2), constatamos que os valores medianos de IgG anti-spike pós-vacinação primária são inferiores no primeiro subgrupo [516 AU/mL (IIQ, 9;960)] comparativamente ao segundo [2153 AU/mL (IIQ, 1457;2850)].
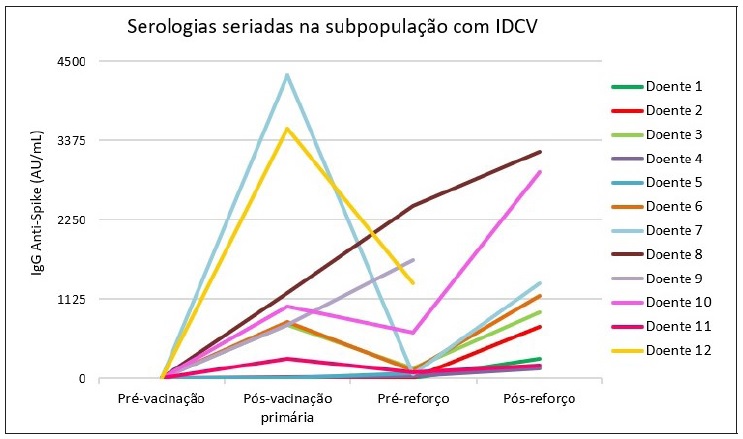
Nos doentes com IDCV foi realizado estudo adicional com serologias antes e após administração da dose de reforço. A Figura 2 ilustra os doseamentos seriados de IgG anti-spike ao longo do estudo.
A determinação de IgG anti-spike 4 semanas antes da dose de reforço (4 meses após conclusão do esquema vacinal primário) foi positiva em 75% dos casos (n=9/12). Dos 4 doentes com IDCV com serologia negativa após esquema vacinal primário, 3 permaneceram negativos e 1 apresentou resultado positivo muito baixo (IgG anti-spike 78 AU/mL) na ausência de infeção por SARS-CoV-2 conhecida. Estes 4 doentes apresentaram um aumento progressivo dos níveis de IgG anti‑spike ao longo do tempo. O valor mediano de IgG anti-spike antes da dose de reforço foi de 106 AU/mL (IIQ, 50;825).
Dez doentes fizeram a dose de reforço com a vacina Comirnaty® (Pfizer-BioNTech) e 2 recusaram esta dose adicional. Aproximadamente 8 semanas após administração do reforço foi realizado novo doseamento de IgG anti-spike; houve 1 doente que não compareceu à colheita.
Todos os doentes apresentaram serologia positiva após a dose de reforço (n=9), incluindo os 3 que tinham tido resultados negativos (IgG anti-spike 149, 286 e 737 AU/mL). O valor mediano de IgG anti-spike pós-reforço foi de 942 AU/mL (IIQ, 286;1343), variando entre 149 e 3219 AU/mL.
Adicionalmente, quatro doentes realizaram serologia de controlo 8 a 12 meses após administração da dose de reforço. Verificou-se que esta continuou positiva em todos e que o valor de IgG anti-spike aumentou ao longo do tempo [mediana 6449 AU/mL (IIQ, 2886-9241)], na ausência de infeção por SARS-CoV-2 conhecida. Importa referir que 2 doentes com IDCV foram infetados pelo SARS-CoV-2 após a dose de reforço: um doente com IgG anti-spike de 3219 AU/mL (infeção após a última serologia) e outro com IgG anti-spike de 286 AU/mL (infeção 4 semanas antes da serologia pós-reforço).
Relativamente à contagem de células CD19 na altura do diagnóstico, a mediana foi de 180 células/μL (IIQ, 60;372). A Tabela 2 resume a contagem de células CD19 na altura do diagnóstico, o valor de IgG total antes da primeira inoculação da vacinação e as determinações seriadas de IgG anti-spike na subpopulação com IDCV. Foi possível constatar que, à exceção do doente 3, todos os outros com contagem CD19 inferior a 150 células/μL (doentes 1, 6, 7 e 9) apresentaram serologia negativa após esquema vacinal primário; no entanto, estas serologias positivaram após administração da dose de reforço.
Tabela 2 Resultados laboratoriais dos doentes com IDCV
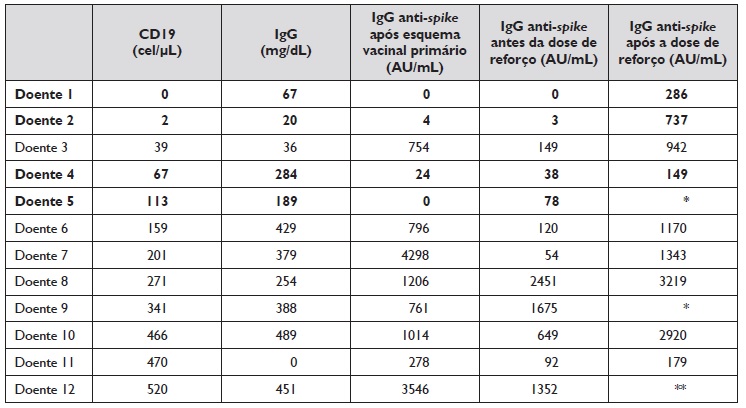
IgG - Imunoglobulina G; * - Não fez dose de reforço; ** - Não fez serologia após dose de reforço
A análise estatística demonstrou que, nos doentes com IDCV, os valores de IgG anti-spike após esquema vacinal primário apresentaram correlação positiva com a contagem de células CD19 na altura do diagnóstico (95% IC=0,117-0,898; p=0,023), sendo que níveis mais baixos de células CD19 correlacionam-se com resultados serológicos negativos.
DISCUSSÃO
A presente amostra final de 20 doentes com IDP era maioritariamente do sexo feminino e apresentava média de idades de 36,8±13,1 anos. O diagnóstico mais frequente foi a IDCV, o que é consistente com a literatura, sendo a IDCV a IDP sintomática mais frequente na idade adulta 5.
A maioria dos doentes encontrava-se a realizar terapêutica de substituição com gamaglobulina subcutânea, o que poderá ter impacto na resposta à vacinação contra a COVID-19. Os dadores de plasma podem ter títulos relevantes de anticorpos contra SARS-CoV-2, o que pode contribuir para o aumento dos níveis de anticorpos nos doentes tratados com gamaglobulina sem que estes tenham sido infetados ou vacinados 5,19. No entanto, à data das serologias pós-esquema vacinal primário (junho de 2021) e atendendo à demora no processamento e preparação da gamaglobulina (cerca de 12 meses), torna-se improvável que os dadores tenham sido infetados ou vacinados. Os presentes resultados corroboram esta hipótese, tendo em conta que os títulos de anticorpos foram superiores nos doentes que não recebiam terapêutica de substituição com gamaglobulina [mediana de 2153 AU/mL (IIQ, 1457;2850) versus 516 AU/mL (IIQ, 9;960)].
Atualmente, as vacinas contra a COVID-19 são a intervenção mais indicada para conter a pandemia 7 e estudos prévios sugerem que as vacinas de mRNA desencadeiam uma resposta imune adaptativa robusta 20 que não atinge o seu valor máximo até 14 dias após conclusão do esquema vacinal 21. A experiência com outras vacinas sugere que doentes com IDP podem ter uma resposta imune menos robusta; contudo, a possibilidade de algum grau de proteção é vantajosa comparativamente à ausência total de proteção 15. Um estudo revelou que doentes com IDCV geram uma baixa resposta específica anti-spike 22, que poderá ser justificada pela marcada redução nos centros germinativos de células B e plasmoblastos 23. Pensa-se que a produção de anticorpos neutralizadores exija pelo menos a preservação da população de linfócitos B 4.
No presente estudo, a determinação de IgG anti-spike após conclusão do esquema vacinal primário foi positiva em 75% dos doentes, com valor mediano de 796 AU/mL (IIQ, 107;3772). Estes resultados são consistentes com a literatura. Numa coorte de 26 doentes imunocomprometidos (22 sob terapêutica de substituição com imunoglobulina), 69% desenvolveram resposta imune humoral específica 24. Num estudo que incluiu 81 doentes com IDP, 58,7% apresentaram anticorpos anti-spike detetáveis após 1 dose de vacina mRNA, valor que aumentou para 85,1% após completarem o esquema vacinal primário 25. Bergman et al observaram seroconversão em 72,2% dos doentes com IDP vacinados, comparativamente a 100% dos controlos saudáveis, realçando a importância de doses de reforço adicionais em indivíduos imunocomprometidos26. Vários outros trabalhos reportaram um aumento significativo de anticorpos contra SARS-CoV-2 em doentes imunocomprometidos após conclusão do esquema vacinal primário 27.
Numa coorte de indivíduos saudáveis, Goel et al constataram que as vacinas mRNA induziram a produção robusta de anticorpos anti-spike que permaneceram acima dos níveis basais pré-vacinação na maioria dos indivíduos aos 6 meses pós-vacinação, ainda que os níveis de anticorpos tenham diminuído ao longo do tempo. Curiosamente, as células B de memória específicas continuaram a aumentar entre os 3 e 6 meses pós-vacinação, demonstrando que a resposta imune é duradoura, apesar da redução gradual dos anticorpos 28. Estes achados são consistentes com outro trabalho que verificou que dois meses após a segunda dose da vacina mRNA houve diminuição dos níveis de anticorpos específicos, contudo as células B de memória específicas continuaram a aumentar, predizendo uma proteção sustentada contra doença grave em indivíduos vacinados 29.
Analisando a resposta humoral dos dois doentes com ALX, verificamos que apenas um apresentou serologia pós-vacinal positiva. Ambos eram jovens adultos (23 e 29 anos) com história prévia semelhante de infeções de repetição, e ambos recebiam terapêutica de substituição com gamaglobulina, destacando-se analiticamente um valor de IgG basal superior no caso do doente que apresentou seroconversão (1160 versus 690 mg/dL).
Na subpopulação com IDCV estudada, a determinação de IgG anti-spike após esquema vacinal primário foi positiva em 67% dos doentes [mediana 757 AU/mL (IIQ, 19; 1062)], valor que aumentou para 75% antes da dose de reforço [mediana 106 AU/mL (IIQ, 50;825)] e para 100% após administração do reforço [mediana 942 AU/mL (IIQ, 286;1343)]. O valor de IgG anti-spike continuou a aumentar [mediana 6449 AU/mL (IIQ, 2886-9241)] nos doentes que repetiram serologia 8 a 12 meses após a dose reforço, na ausência de infeção por SARS-CoV-2 conhecida.
A literatura sugere que doentes com IDCV devem ser incluídos nos programas de vacinação contra a COVID-19, tendo em conta a possibilidade de as vacinas de mRNA induzirem a produção de anticorpos neutralizadores 4. Na população estudada, não se documentou ocorrência de doença grave ou necessidade de internamento por COVID-19.
Vários trabalhos têm vindo a reforçar a necessidade de doses de reforço adicionais 30,31. Na população com IDCV, a produção de IgG anti-spike parece ser mais frequentemente induzida pela infeção SARS-CoV-2 do que pela vacinação 22,31. Não obstante, a produção de anticorpos é potenciada pela vacinação em indivíduos convalescentes, sublinhando a necessidade de continuar a estimular a resposta imune através de doses de reforço adicionais em doentes com IDCV 22,32.
Por outro lado, alguns estudos têm demonstrado que as vacinas de mRNA são capazes de estimular a resposta celular em doentes com IDP 33, sugerindo benefício adicional da vacinação mesmo em indivíduos com hipogamaglobulinemia grave ou agamaglobulinemia, independentemente do aumento dos títulos de anticorpos. Estudos adicionais são necessários para compreender a forma como células T e anticorpos orquestram a imunidade de longa duração induzida pela infeção ou vacinação contra a COVID-19 34.
Foi reportado que uma contagem basal de células CD19 inferior a 100 células/μL está associada a níveis mais baixos de IgG anti-spike 25. Esta associação é consistente com os resultados presentes dado que, à exceção de um, todos os doentes com IDCV com contagem CD19 inferior a 150 células/μL apresentaram serologia negativa após esquema vacinal primário, e os valores de IgG anti-spike apresentaram correlação positiva com a contagem de células CD19 na altura do diagnóstico (95% IC=0,117- 0,898; p=0,023).
Neste estudo apenas 1 doente reportou infeção por SARS-CoV-2 previamente ao início da vacinação, no entanto a serologia pré-vacinal foi negativa, pelo que a infeção não deve ter tido repercussão na avaliação da resposta à vacinação. Relativamente aos doentes infetados após a dose de reforço, num deles a infeção só ocorreu após o doseamento de anticorpos, não tendo influência no resultado obtido; no outro doente, a infeção ocorreu 4 semanas antes da serologia pós-vacinal, o que pode ter contribuído significativamente para o aumento do nível de anticorpos.
Quanto à ocorrência de reações alérgicas ou outras reações adversas durante ou após a inoculação, nenhum doente reportou reações significativas. A literatura tem demonstrado de forma consistente que a vacinação contra a COVID-19 é segura, incluindo em doentes com IDP, dado que os mesmos não têm reportado efeitos adversos significativos 4,24-26.
Este estudo apresenta como limitações a dimensão da amostra e o facto de várias IDP não estarem representadas, impedindo a extrapolação destes resultados para doentes com outras IDP. Por outro lado, os doentes podem ter tido infeção por SARS-CoV-2 assintomática, o que poderia enviesar os níveis de anticorpos medidos posteriormente. Paralelamente, não se pode excluir que haja uma contribuição da terapêutica de substituição com gamaglobulina para os níveis de anticorpos doseados mais recentemente. Por fim, importa referir que o cut-off dos níveis protetores de IgG anti-spike não se encontra claramente definido.
CONCLUSÕES
Apesar das limitações, este estudo poderá contribuir para aumentar o conhecimento sobre a resposta humoral à vacinação em indivíduos com IDP. As vacinas apresentaram elevado grau de seroconversão e segurança nos doentes imunocomprometidos, sugerindo que esta população tem potencial benefício com a imunização e deve ter acesso prioritário à mesma. Adicionalmente, na subpopulação com IDCV verificou-se que formas mais graves com contagens reduzidas de células CD19 apresentaram títulos mais baixos de anticorpos após vacinação, quando comparados com
doentes com níveis normais de células CD19. Não obstante, a dose de reforço potenciou a resposta imune em todos os doentes, predizendo a necessidade de inoculações adicionais para conferir proteção sustentada contra a COVID-19.
A monitorização clínica e laboratorial da resposta vacinal nos doentes imunocomprometidos permitirá, no futuro, adequar os valores de referência para esta população. São necessários estudos multicêntricos para permitir aferir os níveis de anticorpos que conferem proteção contra a doença e o intervalo de tempo ideal entre as inoculações adicionais para a maximização da resposta imune nas IDP.