Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Acessos
Acessos
Links relacionados
-
 Similares em
SciELO
Similares em
SciELO
Compartilhar
Nascer e Crescer
versão impressa ISSN 0872-0754
Nascer e Crescer v.20 n.2 Porto jun. 2011
Pancitopenia num lactente
Marta Contreiras1, Filipa Vieira1, Conceição Santos1, José Guimarães1
1 Serviço de Pediatria, H São Francisco Xavier, CH Lisboa Ocidental
RESUMO
Introdução: No lactente a causa mais frequente de deficiência de cobalamina é a carência alimentar da mãe, e geralmente em crianças em aleitamento materno exclusivo. As manifestações clínicas nos primeiros meses de vida, incluem, irritabilidade, má progressão estaturoponderal, apatia e anorexia, bem como manifestações neurológicas como hipotonia e regressão no desenvolvimento psicomotor.
Caso clínico: Apresenta-se um caso de anemia megaloblástica por défice de cobalamina num lactente com sete meses de idade em aleitamento materno exclusivo. Um mês antes do internamento apresentava apatia e regressão no desenvolvimento psicomotor, a que mais tarde se associou palidez cutânea. A avaliação laboratorial evidenciou pancitopenia com anemia grave.
Conclusão: A idade de início precoce e a longa duração dos sintomas neurológicos podem contribuir para a persistência de sintomas a longo prazo, sendo por isso fundamentais o diagnóstico e tratamento precoces.
Palavras-chave: aleitamento materno, anemia megalobástica, cobalamina, pancitopenia, lactente.
Pancytopenia in an infant
ABSTRACT
Introduction: The most common cause of cobalamin deficiency in infants is dietary deficiency in the mother, usually in those children who are exclusively breastfed.
In the first months of life, the clinical manifestations of cobalamin deficiency include irritability, failure to thrive, apathy, anorexia, and neurological manifestations such as hypotonia or developmental regression.
Case report: We report a case of megaloblastic anaemia due to cobalamin deficiency in a seven-month-old girl who was exclusively breastfed. One month before being admitted she started apathy and developmental regression, later associated with pallor. Laboratory findings showed pancytopenia with severe anaemia.
Conclusions: The early age of onset and long duration of neurological symptoms may contribute to the development of long-term symptoms, so early diagnosis and treatment are of extreme importance.
Keywords: megaloblastic anaemia, breastfeeding, cobalamin, pancytopenia, infant.
INTRODUÇÃO
Os seres humanos são incapazes de sintetizar Cobalamina (Cbl), também denominada vitamina B12, sendo a sua única fonte os produtos animais.(1-3) Contrariamente aos adultos, as crianças têm pequenas reservas desta vitamina, podendo desenvolver sinais e sintomas devidos à sua deficiência em meses.(1,4)
Ainda assim, o défice de Cbl é uma situação rara na infância.(1,3,5) Das causas conhecidas em idade pediátrica, a mais frequente é a carência alimentar da mãe por deficiência de armazenamento ou ingestão e geralmente em crianças em aleitamento materno exclusivo.(2,3,6,7) As mulheres que seguem regimes alimentares vegetarianos e macrobióticos estão particularmente em risco.(6,8) Das outras causas destacam-se a carência alimentar da criança, a falta de factor intrínseco activo (anemia perniciosa congénita), a presença de anti-corpos anti-Cbl e anti-factor intrínseco (anemia perniciosa), a má absorção selectiva de Cbl (síndrome de Imerslund Grasbek), vários síndromes de má absorção, doenças com envolvimento ileal (local de absorção da Cbl) e presença de mecanismo de competição pela Cbl (parasitismo por Diphyllobothrium latum).(2,4,8)
Nos primeiros meses de vida, as manifestações clínicas da deficiência de Cbl, incluem irritabilidade, má progressão estaturoponderal, apatia, anorexia e recusa de alimentos sólidos. As manifestações neurológicas mais comuns são o atraso ou regressão no desenvolvimento psicomotor. As crianças mais velhas (ou quando o diagnóstico é mais tardio) podem apresentar anemia megaloblástica, pancitopenia e sintomas ou sinais neurológicos como hipotonia, hiperreflexia, tremor ou convulsões.(2,6,9) Saliente-se que a sintomatologia neurológica pode preceder os achados hematológicos.(6,9)
Os doseamentos de homocisteína e de ácido metilmalónico no plasma e na urina, têm sido utilizados para diagnosticar precocemente e monitorizar a deficiência de Cbl,(4) já que os valores hematológicos e o doseamento de Cbl podem ser normais ou apenas discretamente diminuídos.(2)
Desde Junho de 2006 que o Programa Nacional de Diagnóstico Precoce permite o rastreio alargado de doenças metabólicas a todos os recém-nascidos. Este rastreio inclui o doseamento de propionilcarnitina, que se encontra aumentada no défice de cobalamina.(12)A deficiência de Cbl diminui a actividade de duas enzimas, a metionina sintase e a L-metilmalonilCoA mutase, o que resulta na acumulação de homocisteína, ácido metilmalónico e propionilcarnitina.(9)
Apresenta-se um caso de anemia megaloblástica por défice de Cbl num lactente em aleitamento materno exclusivo, em que a mãe negou ter seguido um regime alimentar vegetariano.
CASO CLÍNICO
Lactente do sexo feminino, sete meses, filha de pais jovens não consanguíneos, saudáveis, pertencentes a classe socioeconómica desfavorecida. Gravidez não vigiada; serologias à data do parto adequadas. Parto distócico por ventosa às 40 semanas. Peso ao nascer 3290g; sem intercorrências no período neonatal. Aleitamento materno exclusivo, com bom desenvolvimento estaturoponderal (P75). Rastreio de doenças metabólicas realizado ao sétimo dia de vida.
Foi admitida no Serviço de Urgência por apatia associada a palidez cutânea e vómitos com a tentativa de diversificação alimentar. Um mês antes do internamento apresentava cansaço fácil e regressão no desenvolvimento psicomotor, deixando de se sentar com apoio e perdendo interesse pelos brinquedos.
À admissão, apresentava-se prostrada, com mucosas pálidas e hiperpigmentação cutânea difusa; hipotonia axial e dos membros. Sem outras alterações no exame objectivo nomeadamente neurológico.
Na avaliação laboratorial (Tabela 1) verificou-se pancitopenia com anemia grave, eritrócitos 1.100.000/µl; hemoglobina 3,8 g/dl; plaquetas 105.000/µl, reticulócitos 0,6%; hematócrito 10,5%; volume globular médio 95,5 fl (>P95); RDW 29,8%; leucócitos 3.200/µl, neutrófilos 20% (640/µl). O esfregaço de sangue periférico evidenciava anisopoiquilocitose acentuada e neutrófilos macrocíticos hipersegmentados. A desidrogenase láctica (LDH) estava aumentada (9.147 U/l). Perante a anemia grave sintomática fez transfusão de concentrado de eritrócitos.
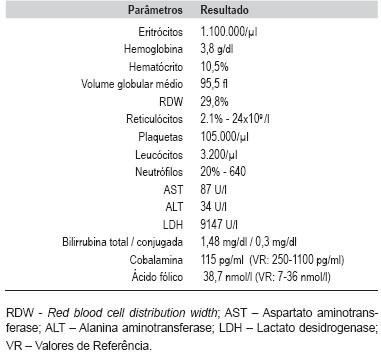
TABELA 1 - Resultados da avaliação analítica
Os achados do mielograma foram sugestivos de anemia megaloblástica: medula óssea hipercelular (três séries), reactiva, com aspectos megaloblastóides e sinais de eritropoiese ineficaz. O doseamento sérico de Cbl 115 pg/ml (250-1100 pg/ml) confirmou a carência de Cbl.
Com base nestes achados foi diagnosticada deficiência de Cbl por deficiência nutricional numa criança em aleitamento materno exclusivo.
Foi medicada com Cbl, durante três meses, inicialmente intramuscular (50 µg/dia) e depois por via oral. Ao sétimo dia de terapêutica verificou-se resposta reticulocitária, com melhoria franca dos valores hematológicos. Observou-se melhoria da hipotonia, recuperação das aquisições psicomotoras e progressiva normalização da pigmentação cutânea. Iniciou diversificação alimentar com sucesso, com introdução progressiva de papas, sopas, fruta e produtos de origem animal nomeadamente carne, peixe e ovos. Gatinhou aos nove meses, adquiriu marcha autónoma aos 14 e aos 28 meses subia e descia escadas. Actualmente, com quatro anos de idade, tem um regime alimentar equilibrado adequado à sua idade, com um desenvolvimento estaturo-ponderal no P75: corre em bicos dos pés e tem um discurso completamente inteligível.
A investigação realizada à mãe evidenciou anemia ferropénica e défice de Cbl. O seu regime alimentar caracterizava-se por um aporte inadequado de produtos de origem animal. Foi encaminhada para consulta de Medicina Interna, a que faltou repetidamente.
DISCUSSÃO
A cobalamina é sintetizada exclusivamente por microrganismos, encontrando-se em grandes quantidades nos produtos lácteos, fígado, carne, ovos, crustáceos e peixe, estando ausente na fruta, legumes e cereais, o que explica a sua carência frequente nos vegetarianos estritos.(3,7,8,10,11) A necessidade diária de Cbl na criança é de 3 µg/dia.(7)
Contrariamente ao que acontece no adulto, os lactentes com carência de Cbl podem ser sintomáticos em poucos meses, devido à sua pequena reserva hepática.(1,3,4,8) Nos primeiros meses de vida a sintomatologia é inespecífica. Das manifestações neurológicas destaca-se o atraso ou regressão no desenvolvimento, apatia e hipotonia, presentes neste caso. Pode-se encontrar ainda irritabilidade, ataxia, tremor e convulsões.
A deficiência de Cbl induz alterações como a desmielinização, degeneração axonal e morte neuronal.(2,5,11) Contrariamente ao adulto, que apresenta atingimento do sistema nervoso periférico, na criança em desenvolvimento, parece haver um envolvimento predominante do sistema nervoso central com atraso ou regressão nas aquisições psicomotoras.(11) Do ponto de vista hematológico pode haver anemia, trombocitopenia e leucopenia.(5) Dos sintomas gastrointestinais destaca-se anorexia, diarreia e glossite.(10) A hiperpigmentação cutânea, como no caso descrito, é uma forma de apresentação rara.(5) O mecanismo exacto da hiperpigmentação é desconhecido mas, provavelmente, está relacionado com os níveis de tirosinase, enzima envolvida na melanogénese, que se encontra aumentada, resultando em hipermelanose.(5)
No caso clínico apresentado, o diagnóstico foi sugerido pela associação de sintomas neurológicos (apatia, hipotonia e perda de aquisições psicomotoras) e anemia macrocítica grave arregenerativa (com reticulócitos baixos). A elevação de LDH é sugestiva de destruição intramedular.(15) A presença de neutrófilos com núcleos hipersegmentados(10) e os aspectos megaloblastóides encontrados no mielograma apoiaram essa suspeita, confirmada pelo doseamento de Cbl na criança e na mãe.
O doseamento de ácido metilmalónico e propionilcarnitina foi feito, no nosso caso, no cartão de Guthrie, a posteriori, e foi normal. Este facto pode ser explicado por carência vitamínica discreta na mãe, o que permitiu alguma reserva fetal durante a gestação.
A deficiência de cobalamina deve ser sempre considerada no diagnóstico diferencial das situações clínicas na infância com sintomas neurológicos como a regressão psicomotora, perturbações adquiridas do movimento, tremor, convulsões e apatia, principalmente se associadas a anemia megaloblástica e má progressão estaturoponderal, mesmo nos casos em que a mãe não apresente anemia e siga um regime alimentar aparentemente adequado.(1,2)
É difícil afirmar que uma carência numa etapa tão crucial do desenvolvimento não tenha consequências no desenvolvimento destas crianças, mas em geral a resposta clínica e laboratorial à terapêutica instituída é rápida e aparentemente favorável. O prognóstico neurológico a longo prazo parece depender da idade de início e da duração dos sintomas neurológicos.(2,3,5,8,11,13,14) O diagnóstico e tratamento precoce do défice de Cbl pode evitar a lesão cerebral permanente e depende da correcta avaliação da história nutricional da mãe e da criança.(2,5,6)
Nas mulheres vegetarianas ou com consumo escasso de carne e de outros produtos de origem animal, parece sensato o suplemento com Cbl.(3,15)
BIBLIOGRAFIA
1. Turner RJC, Scott-Jupp R, Kohler JA. Infantile megaloblastosis secondary to acquired vitamimin B12 deficiency. Letter to the editor. Pediatr Hematol Oncol 1999; 16:79-81. [ Links ]
2. Korenke CG, Hunneman HD, Eber S, Hanefeld F. Severe encephalopathy with epilepsy in an infant caused by subclinical maternal pernicious anaemia: Case report and review of the literature. Eur J Pediatr 2004; 163:196-201. [ Links ]
3. Yenicesu I. Pancytopenia due vitamin B12 deficiency in a brest-fed infant. Pediatr Hematol Oncol 2008; 25:365-7. [ Links ]
4. Díaz Conradi A, Ruggeri Rodríguez N, Massaguer Cabrera J, Vilaseca Busca MA, Artuch Iberri R, Englert Grannell E. Anemia megaloblástica por deficit nutricional. Cartas al Editor. An Pediatr (Barc) 2007; 66:96-7. [ Links ]
5. Simsek OP, Gönç N, GȨmrȨk F, Çetin M. A child with vitamin B12 deficiency presenting with pancitopenia and hyperpigmentation. J Pediatr Hematol Oncol 2004; 26:834-6. [ Links ]
6. Whitehead VM. Acquired and inherited disorders of cobalamin and folate in children. Br J Haematol 2006; 134:125-36. [ Links ]
7. Rosenblatt DS, Whitehead M. Cobalamin and Folate Deficiency: Acquired and Hereditary Disorders in children. Semin Hematol 1999; 36:19-34. [ Links ]
8. Gutiérrez-Aguilar G, Abenia-Usón P, Garcia-Cazorla A, Vila-seca MA, Campistol J. Encefalopatia con aciduria metilmalónica y homocistinuria secundária a un deficit de aporte exógeno de vitamina B12. Rev Neurol 2005; 40:605-8. [ Links ]
9. Campbell CD, Ganesh J, Ficicioglu C. Two newborns with nutritional vitamin B12 deficiency: Challenges in newborn screening for vitamin B12 deficiency. The Haematologica 2005; 90:119-21. [ Links ]
10. Marble M, Copeland S, Khanfar N, Rosenblatt DS. Neonatal vitamin B12 deficiency secondary to maternal subclinical pernicious anemia: identification by expanded newborn screening. J Pediatr 2008; 152:731-3. [ Links ]
11. Lumley L, Boulesteix J, Borreda D, Tuel MC, Gilbert B. Anémie mégaloblastique chez lenfant. Arch Pediatri 1994; 1:281-8. [ Links ]
12. Graham SM, Arvela OM, Wise GA. Long-term neurologic consequences of nutricional vitamin B12 deficiency in infants. J Pediatric 1992; 121:710-4. [ Links ]
13. Kanra G, Cetin M, Unal S, Haliloglu G, Akça T, Akalan N, et al. Answer to hypotonia: A simple hemogram. J Child Neurol 2005; 20:930-1. [ Links ]
14. Monfort-Gouraud M, Bongiorno A, Le Gall MA, Badoual J. Anémie mégaloblastique sévère chez un enfant allaité par une mère végétarienne. Ann Pediatr 1993; 40:28-31. [ Links ]
15. Mathey C, Di Marco JN, Poujol A, Cournelle MA, Brevaut V, Livet MO, et al. Stagnation pondérale et régression psychomotrice révélant une carence vitamine B12 chez 3 nourrissons. Arch Pediatr 2007; 14:467-71. [ Links ]
Marta Contreiras
E-mail: mcontreiras@gmail.com














