Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Acessos
Acessos
Links relacionados
-
 Similares em
SciELO
Similares em
SciELO
Compartilhar
Portugaliae Electrochimica Acta
versão impressa ISSN 0872-1904
Port. Electrochim. Acta v.28 n.5 Coimbra 2010
Estudo do Benzotriazol como Aditivo para a Fosfatização de Aço Carbono
V. Annies,1 I. Costa,2 M. Terada,3 P.R.P. Rodrigues,1 E.P. Banczek1,*
1 Universidade Estadual do Centro-Oeste, Departamento de Química/Unicentro-Guarapuava-PR, Brazil
2 Instituto de Pesquisas Energéticas e Nucleares, IPEN/CNEN-SP, Centro de Ciência e Tecnologia de Materiais, Av. Lineu Prestes, 2242, CEP 05508-000, São Paulo-SP, Brazil
3 Escola Politécnica da Universidade de São Paulo, Departamento de Engenharia Metalúrgica e de Materiais, Av. Prof. Mello de Morais, 2463, CEP 05508-030, São Paulo-SP, Brazil
DOI: 10.4152/pea.201005279
Resumo
Neste trabalho foi estudada a viabilidade de substituição do nitrito de sódio NaNO2 por benzotriazol (BTAH), no banho de fosfato de zinco (PZn+NaNO2) utilizado para a fosfatização do aço carbono (SAE 1010). A caracterização da superfície das amostras fosfatizadas foi realizada através de ensaios de Microscopia Eletrônica de Varredura (MEV), Microscopia Ótica (MO) e Difração de Raios – X. A composição elementar foi avaliada através de Espectroscopia de Energia Dispersiva (EDS). O comportamento de corrosão das amostras foi determinado por meio de medidas de Potencial de Circuito Aberto, Espectroscopia de Impedância Eletroquímica (EIE) e ensaios de Polarização Potenciodinâmica Anódica. Para os ensaios de corrosão foi utilizada como eletrólito uma solução de cloreto de sódio 0.5 molL-1. Os resultados experimentais mostraram que a camada de fosfato em presença de benzotriazol (PZn+BTAH) e ausência de nitrito de sódio apresentou melhores propriedades, pois houve um aumento de aproximadamente 6 vezes na massa do revestimento depositado e foi obtida maior resistência à corrosão para este revestimento. Os resultados obtidos demonstraram que o nitrito de sódio NaNO2 pode ser substituído por benzotriazol (BTAH) em banhos de fosfato de zinco.
Palavras chave: fosfatização, aço carbono, fosfato de zinco, nitrito de sódio, benzotriazol.
Study of Benzotriazole as Addictive for Carbon Steel Phosphating
Abstract
The aim of this study is to evaluate the potential of benzotriazole (BTAH) for replacement of sodium nitrite (NaNO2) in the zinc phosphate bath (PZn+NaNO2) used for carbon steel (SAE 1010). Surface characterization of phosphated and unphosphated samples was carried out by Scanning Electron Microscopy, Energy Dispersive Spectroscopy, Optical Microscopy and X-ray diffraction. The corrosion resistance of the samples was evaluated by electrochemical techniques such as Open Circuit Potential, Electrochemical Impedance Spectroscopy and Anodic Potentiodynamic Polarization Curves, in a 0.5 mol L−1 NaCl electrolyte at room temperature. The experimental results showed that not only benzotriazol (PZn+BTAH) presented better corrosion properties than sodium nitrite, but also the amount of the deposited phosphate increased approximately six times comparatively to the bath with sodium nitrite. The results demonstrated that benzotriazole (BTAH) is a potential candidate for replacement of sodium nitrite (NaNO2) in zinc phosphate baths.
Keywords: phosphating, carbon steel, zinc phosphate, sodium nitrite, benzotriazole.
Introdução
Entre os processos de tratamento de superfícies mais utilizados está a fosfatização [1-10]. A fosfatização é um tratamento de corrosão que permite o revestimento da superfície com uma camada de sais insolúveis de fosfato, na maioria das vezes fosfato de zinco [11,12], com a finalidade de proteção contra a corrosão, preparação para a pintura, separação elétrica e decoração [11,12]. Os revestimentos de fosfato podem ser aplicados em vários materiais metálicos, sendo os mais utilizados o aço carbono [1-5], aço galvanizado [4,10,13], ferro [6], magnésio [8,14,15], alumínio [9,16] e zinco [17].
Os banhos de fosfatização podem ser à base de zinco [1,17-20], manganês [4, 21-23], fosfato tricatiônico [24], fosfato orgânico [6, 25, 26] ou, ainda uma combinação destes, sendo que o tipo de banho utilizado é dependente da aplicação que será dada ao material fosfatizado.
Inicialmente, as camadas de fosfato eram obtidas em condições muito onerosas com relação ao consumo de energia, mas o estudo detalhado das reações envolvidas no processo de fosfatização permitiu a diminuição do tempo de imersão, e a obtenção de revestimentos em temperaturas menores, próximas da ambiente. A adequação do processo aconteceu devido à alteração das condições de operação, sendo que a principal modificação dos banhos de fosfatização foi a variação da composição e alguns aditivos que são empregados para acelerar o processo e obter as melhores propriedades dos revestimentos.
Entre os parâmetros do processo que podem ser modificados são importantes o emprego de corrente elétrica [2, 5, 7, 17,18] e a adição de aceleradores químicos. Os aceleradores químicos podem ser substâncias oxidantes ou sais de metais mais nobres que o metal a ser fosfatizado. Os aceleradores químicos apresentam primordial importância, principalmente devido ao custo e consumo de energia, pois são menos onerosos [11].
Entre os aceleradores químicos podem ser citados o nitrito de sódio [1,7,14,27-29], os nitratos [3,7,8,14,15,27, 28,30,31] e os cloratos [30,32]. Outros aditivos podem ser usados para obtenção de propriedades específicas. Entre os aditivos utilizados podem ser citados os íons de cálcio [7,32-35], íons de manganês [19,21,23,30,35-37] ácido tartárico [8,15], íons fluoreto [8, 14-16, 27, 29] íons de níquel[1,16,19,28,30,32,38], íons de cobre [39] e íons de molibdênio [15,37], benzotriazol [1,10,40] e tolitriazol [24].
A utilização de aditivos causa um problema devido à geração e descarte de resíduos que são inerentes ao processo de fosfatização. Entre os aditivos citados, o nitrito de sódio é um dos que proporcionam maiores problemas, visto que este elemento é agressivo ao meio ambiente. Existe uma quantidade mínima aceita para ingestão de íons nitrito pelo organismo humano que é de aproximadamente 50 mg/kg; acima disto pode ser prejudicial, já que na presença de aminas secundárias e terciárias acontecem reações que originam compostos nitrosos, que têm elevado potencial carcinogênico, teratogênico e mutagênico. O perigo aumenta quando o nitrito entra em contato com aminas, principalmente aquelas encontradas em proteínas. O resultado da mistura é um composto conhecido como nitrosaminas, substância reconhecidamente cancerígena [41].
Com relação ao meio ambiente, no ar, o nitrito forma misturas tóxicas e oxidantes através da liberação de poeira. Na água é prejudicial à vida aquática e, no solo, em soluções aquosas atinge o lençol freático. O limite de descarte desta substância para rios é de 1 mg de nitrito/litro de água natural [41]. A utilização do nitrito em banhos de fosfatização causa problemas devido à geração e descarte de resíduos que são produzidos, sendo estes inerentes ao processo de fosfatização.
Devido aos problemas ambientais gerados pelo nitrito de sódio, a possibilidade de sua substituição ou aprimoramento dos processos de fosfatização deve ser estudada. Substitutos em potencial são compostos orgânicos triazólicos, entre eles tem-se o benzotriazol [10]. Estes compostos são inibidores de corrosão de cobre e suas ligas. Quando utilizados em concentrações menores que 10-2 mol/L apresentam maior compatibilidade ambiental comparativamente ao nitrito de sódio [40].
Neste contexto, este trabalho tem como objetivo estudar a viabilidade de substituição do nitrito de sódio por benzotriazol como aditivo em banhos de fosfatização.
Materiais e métodos
Preparação do material metálico
O material utilizado como substrato para a fosfatização foi o aço carbono (SAE 1010) no formato retangular. A tabela 1 apresenta a composição química do aço carbono usado como substrato para fosfatização.
Tabela 1. Composição química do aço carbono utilizado neste estudo (SAE 1010).
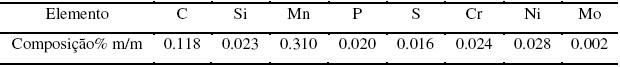
Todas as superfícies das amostras foram lixadas com lixas SiC de granulometria #600, antes do procedimento de fosfatização.
Preparo do banho desengraxante e do ativador
Foi utilizado como banho desengraxante um produto alcalino comercial (ES-70). Para a preparação da solução deste banho foram dissolvidos 50 g em 1 L de água. As peças foram imersas por 5 minutos neste banho à temperatura de (70 ± 5) ºC.
Para a preparação da solução de ativador (refinamento da superfície) foram utilizados 3 g de Na4TiO(PO4)27H2O (pH = 7.5 - 9.0) em 1 L de água. As peças foram imersas por 90 segundos na solução à temperatura de (25±2) ºC.
Fosfatização
Preparo dos banhos de fosfato de zinco
Um banho concentrado de fosfato de zinco contendo nitrito de sódio (PZn+NaNO2) foi utilizado como solução de referência e uma solução concentrada de fosfato de zinco e benzotriazol (PZn+BTAH) foi empregada como solução teste. A composição do banho de fosfato de zinco com níquel é apresentada na Tabela 2.
Tabela 2. Composição dos banhos de fosfatos.
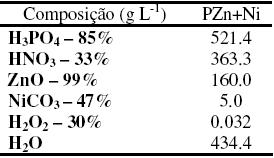
A partir das soluções concentradas de fosfato, os banhos de fosfatização foram preparados por meio de diluição da solução concentrada e adição de hidróxido de sódio NaOH de 50 % m/m. Os banhos de fosfato diluídos foram titulados com NaOH 0.1 mol L−1, e a acidez total e livre foram determinadas.
As condições para aplicação do banho de fosfato de PZn+NaNO2 foram determinadas anteriormente[41]. Para o banho teste de PZn+BTAH, as condições de aplicação, foram avaliadas e os parâmetros testados são apresentados na Tabela 3.
Tabela 3 . Condições para aplicação das soluções diluídas de fosfatização.
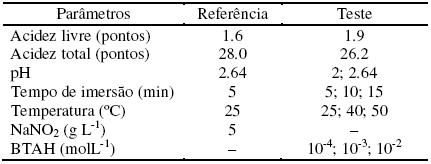
Ensaios gravimétricos
Ensaios gravimétricos foram realizados para estimativa da massa de fosfato depositada. A fosfatização foi realizada por exposição de amostras retangulares com dimensões de 2 cm x 3 cm e 1 mm de espessura às seguintes etapas:
1) Banho desengraxante alcalino a 70 ºC, t = 5 min.
2) Enxágüe a temperatura ambiente, t = 1 min.
3) Secagem com ar forçado e determinação da massa = m1
4) Imersão em banho refinador a 25 ºC, t = 90 seg.
5) Fosfatização a 25, 40 ou 50 ºC, tempo de 5, 10 e 15 min, e o pH 2 ou 2.6.
6) Enxágüe a temperatura ambiente, t = 1 min.
7) Secagem com ar forçado e determinação da massa = m2
Para a determinação da massa da camada de fosfato depositada na superfície do aço carbono foi utilizado a seguinte equação:
![]()
onde:
m1 = massa da peça antes da fosfatização.
m2 = massa da peça após a fosfatização.
A = área da peça em m2.
Caracterização físico-química dos revestimentos de fosfato
Determinação da morfologia e composição das camadas de fosfato
A morfologia dos revestimentos de fosfato obtidos foi analisada por Microscopia Eletrônica de Varredura (MEV) em microscópio Philips modelo XL30®. A composição química semi-quantitativa das camadas de fosfato foi avaliada empregando-se Espectroscopia de Energia Dispersiva (EDS) acoplada ao microscópio eletrônico de varredura.
A superfície das amostras foi analisada por microscopia óptica com um microscópio metalográfico Olympus (modelo BX441RF ).
Caracterização das camadas de fosfato por difração de raios – X
As fases presentes nas camadas de fosfato foram investigadas por difração de raios-X empregando-se um difratômetro da Rigaku DEMAX 2000® e radiação CuKa (1.5418 Å) na faixa de 2q de 5 a 70o e com varredura de 0.02o.
Comportamento de corrosão
A resistência à corrosão foi avaliada por meio de medidas do Potencial de Circuito Aberto, Espectroscopia de Impedância Eletroquímica (EIE) e Curvas de Polarização Potenciodinâmica Anódica.
As medidas de EIE foram realizadas potenciostaticamente no potencial de corrosão Ecorr, com uma perturbação de ± 10 mV em uma faixa de freqüência de 10 KHz a 0.01 Hz, e taxa de aquisição de 10 pontos por década. Os testes de polarização potenciodinâmica anódica foram realizados a partir do potencial de corrosão até uma sobretensão de +250 mV usando uma velocidade de varredura de 1 mVs-1. Um analisador de resposta de freqüências (Gamry model EIS 300) acoplado a um potenciostato PCI4/300 foi utilizado para avaliação do comportamento eletroquímico.
Uma célula de três eletrodos foi utilizada com um fio de platina e um eletrodo de prata-cloreto de prata Ag/AgCl como contra eletrodo e eletrodo de referência, respectivamente . O eletrodo de trabalho foi uma placa retangular de aço carbono (SAE 1010) com dimensões de 20x30 mm e espessura de 1 mm (área geométrica de 1.5 cm2). A placa inteira foi imersa no banho de fosfatização.
Uma solução de cloreto de sódio 0.5 molL-1 foi usada como eletrólito para os ensaios de corrosão. A temperatura de trabalho foi de (20 ± 2) °C.
Resultados e discussões
Determinação das condições de obtenção da camada de fosfato de PZn+BTAH
As condições experimentais para a obtenção do revestimento de fosfato de zinco (PZn + NaNO2), utilizado como camada de referência neste trabalho, foram pré-estabelecidas em trabalho anterior [1, 40].
Para o revestimento de fosfato de zinco em presença de benzotriazol PZn+BTAH algumas variáveis do processo foram avaliadas e os ensaios foram realizados segundo os dados apresentados na tabela 4. As variáveis testadas foram concentração de BTAH, temperatura, pH e tempo de imersão.
Tabela 4. Variáveis testadas para a otimização das condições para a fosfatização do aço carbono (SAE 1010) com o banho de (PZn+BTAH).

Otimização das condições da fosfatização
Concentração de BTAH
A primeira variável avaliada para a fosfatização do metal base com banho de PZn+BTAH foi a concentração de benzotriazol. Foi determinado o grau de recobrimento superficial por meio da análise da morfologia superficial utilizando a técnica de microscopia eletrônica de varredura e os resultados são apresentados nas micrografias da Fig. 1.

Figura 1. Micrografias obtidas por MEV da superfície do (A) aço carbono (SAE 1010) fosfatizado com (B) PZn (acelerador = NaNO2), (C) PZn+BTAH ([BTAH] = 10-4 molL-1) (D) PZn+BTAH ([BTAH] = 10-3 molL-1) (E) PZn+BTAH ([BTAH] = 10-2 molL-1). pH = 2.64, Temperatura = 25 oC, Tempo de imersão = 5 min.
As micrografias da Fig.1 mostram que os revestimentos de fosfato alteram a morfologia da superfície do aço carbono devido à formação de cristais de fosfato que possuem o formato de lâminas hexagonais em forma de agulhas. Entretanto, o número de agulhas e, como conseqüência o recobrimento superficial, é diferente em cada camada de fosfato, pois é possível observar que a camada tradicional de PZn+NaNO2 (figura 1 (B)) recobre totalmente a superfície metálica, sendo que tal comportamento não foi observado para as camadas em presença de benzotriazol.
Os resultados demonstraram que não existe uma relação bem definida entre a variação na concentração de BTAH e o recobrimento superficial promovido pela camada de fosfato. Foi possível observar que nas concentrações de 10-2 e 10-4 molL-1 de BTAH (Fig. 1 (C) e 1 (E)) a superfície do metal base parece estar mais recoberta que na concentração de 10-3 molL-1 deste composto (Fig. 1 (D)). A explicação para este comportamento pode estar relacionada com a forma distinta em que atua o BTAH em comparação ao nitrito de sódio. O nitrito de sódio atua na reação de redução de hidrogênio despolarizando a mesma, ao contrário do BTAH, que pode atuar através da formação de micropilhas por adsorção ou pelo condicionamento do pH interfacial.
Em baixas concentrações (10-4 molL-1) o BTAH pode estar atuando somente através da formação de micropilhas que podem agir na reação que dá início ao processo de fosfatização que é o ataque ao metal base pelos íons hidrônio (H3O+) presentes no banho ácido de fosfato. À medida que a concentração de BTAH aumenta diminui a formação de micropilhas e ocorre a formação de um filme de inibidor que protege a superfície metálica contra o ataque dos íons hidrônio e, por isso, foi obtido um baixo grau de recobrimento superficial para a concentração de 10-3 molL-1 (Fig. 1 D). Para concentrações da ordem de 10-2 molL-1 de benzotriazol ocorre um efeito de condicionamento superficial devido à alteração do pH da interfase metal/banho de fosfato que pode agir de forma mais acentuada, pois o benzotriazol é uma base fraca e pode se protonar fazendo com que o pH da interfase se eleve para valores em torno de 4.0 e 6.0 que são os valores de pH nos quais se atinge o produto de solubilidade dos fosfatos de ferro e zinco e estes precipitam.
Através dos resultados obtidos com a variação da concentração do BTAH no banho de fosfato de zinco pôde ser selecionada a concentração de BTAH de 10-2 molL-1 para a fosfatização do aço carbono (SAE 1010), pois nesta condição o recobrimento superficial foi maior. Entretanto, como pode ser visto na micrografia da Fig. 2, há a evidência de que a camada de fosfato em presença de BTAH (10-2 molL-1) não recobre totalmente a superfície metálica e, por isso, as condições de obtenção da camada não estavam otimizadas e outras variáveis deveriam ser testadas.

Figura 2. Micrografias obtidas por MEV da superfície do aço carbono (SAE 1010) fosfatizado com PZn+BTAH com uma concentração de BTAH de 10-2 molL-1. pH = 2.64, Temperatura = 25 oC, Tempo de imersão = 5 min.
Em conjunto com a análise morfológica, a composição semi-quantitativa foi determinada por espectroscopia de energia dispersiva (EDS) e os espectros obtidos são apresentados na Fig. 3.
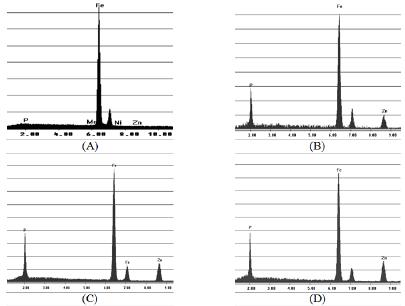
Figura 3. Espectros obtidos por EDS, da superfície de aço carbono (SAE 1010) sem revestimento (A); fosfatizado em: (B) PZn+BTAH ([BTAH] = 10-4 molL-1); (C) PZn+BTAH ([BTAH] = 10-3 molL-1); (D) PZn+BTAH ([BTAH] = 10-2 molL-1). pH = 2.64, Temperatura = 25 oC, Tempo de imersão = 5 min.
Os espectros de EDS confirmam a presença das camadas de fosfato sobre a superfície do aço carbono, pois os picos referentes aos elementos ferro, fósforo e zinco foram detectados. O elemento ferro, apesar de não fazer parte da composição do banho de fosfato, está presente no metal base e este, ao ser atacado pelo banho de fosfato, arrasta um pouco de ferro para o banho e em seqüência para o revestimento. Os outros elementos fazem parte da constituição dos banhos e camadas de fosfato.
Efeito da temperatura
A concentração de benzotriazol pôde ser selecionada pela avaliação do melhor recobrimento superficial, o que ocorreu para a concentração de BTAH de 10-2 molL-1. Algumas regiões da superfície metálica permaneceram descobertas, por isso, outras variáveis do processo foram avaliadas com relação às suas influências no grau de cobertura superficial. A temperatura do processo de fosfatização foi variada e o grau de cobertura superficial foi avaliado e os resultados obtidos são apresentados nas micrografias óticas da Fig. 4.

Figura 4. Micrografias obtidas por microscopia óptica da superfície do aço carbono (SAE 1010) fosfatizado com zinco nas diferentes temperaturas, com um aumento de 400 X. (A) PZn+BTAH (40 ºC) (B) PZn+BTAH (50 ºC). pH = 2.64 e Tempo de imersão = 5 min.
As micrografias da Fig. 4 mostram que houve um aumento no recobrimento superficial com o aumento da temperatura do banho de fosfato. Para a temperatura de 40 ºC (Fig. 4 (A)) a superfície metálica apresentou um recobrimento irregular com algumas regiões descobertas (regiões mais claras na micrografia) indicando que aumento da temperatura, de 25 oC para 40 oC, não promoveu significativo aumento do recobrimento superficial. Os resultados apresentados na micrografia da (Fig. 4 (B)) mostram que houve um aumento no recobrimento superficial com o aumento na temperatura para 50 ºC.
Os resultados podem ser explicados devido ao fato de que em temperaturas mais elevadas a dissociação do ácido fosfórico é maior e, como conseqüência, a acidez livre aumenta, promovendo um ataque mais intenso à superfície metálica e acelerando a reação que dá inicio ao processo de fosfatização. A acidez livre para o banho de PZn+NaNO2 foi de 1.6 pontos e para o banho de PZn+BTAH foi de 1.9, determinadas por titulação com hidróxido de sódio 0.1 molL-1 e azul de bromofenol como indicador.
Os resultados obtidos com a variação na temperatura do banho de fosfatização permitiram selecionar mais uma condição para a fosfatização do aço carbono (SAE 1010) com PZn+BTAH, que é a temperatura de 50 oC.
Efeito da temperatura e do pH
Após avaliar a influência da variação da temperatura no grau de cobertura superficial com um banho de fosfatização em pH = 2.64, um estudo foi realizado para verificar o efeito da variável concentração de íons hidrogênio sobre o recobrimento superficial e, para isto, um banho de fosfatização de PZn+BTAH em pH = 2.00 foi utilizado.
Os resultados obtidos com a fosfatização em banho com pH 2.00 são apresentados por micrografias óticas mostradas na Fig. 5. Os resultados obtidos mostram que houve um aumento no grau de cobertura superficial com a diminuição do pH e aumento da temperatura, sendo o melhor resultado obtido para pH = 2.00 e 50 ºC (Fig. 5 (B)), comparativamente ao recobrimento obtido para pH = 2.00 e 40 ºC (Fig. 5 (A)).

Figura 5 . Micrografias obtidas por microscopia óptica da superfície do aço carbono (SAE 1010) fosfatizado em pH 2,0 em diferentes temperaturas. (A) PZn+BTAH (40 ºC) aumento de 200x; (B) PZn+BTAH (50 ºC) aumento de 200x. Tempo de imersão 5 min.
Efeito do tempo de imersão
Os resultados obtidos com a variação do tempo de imersão no banho de PZn+BTAH à temperatura de 50 oC e pH = 2.00, foram avaliados pelo recobrimento do substrato que foi investigado por microscopia ótica. Os resultados obtidos são apresentados nas micrografias da Fig. 6. Os resultados obtidos demonstram que houve um aumento no grau de cobertura superficial devido ao aumento no tempo de imersão no banho de fosfato. É possível observar que com 5 minutos de imersão (Fig. 6 (A)) a superfície metálica apresenta algumas regiões descobertas, o que indica que o processo de fosfatização não havia estabilizado em 5 minutos de imersão. Os melhores recobrimentos foram obtidos para 10 min (Fig. 6 (B)) e 15 min (Fig. 6 (C)), respectivamente. Os resultados indicam que o aumento do tempo de contato da peça metálica com o banho de fosfato promove uma maior cobertura superficial permitindo que haja uma finalização no processo de fosfatização.

Figura 6. Micrografias obtidas por microscopia óptica da superfície do aço carbono (SAE 1010) fosfatizado em diferentes tempos de imersão. (A) PZn+BTAH (5 min) aumento de 100x; (B) PZn+BTAH (10 min) aumento de 100x; (C) PZn+BTAH (15 min) aumento de 100x. pH = 2.00 e Temperatura 50 oC.
A partir dos resultados obtidos com a variação do tempo de imersão no banho de fosfato pôde-se selecionar a melhor condição de fosfatização que foi de 10 minutos de imersão, pH = 2.00, temperatura de 50 ºC e concentração de BTAH de 10-2 molL-1.
Caracterização dos revestimentos de fosfato
Microscopia Eletrônica de Varredura
A Fig.7 mostra as micrografias obtidas por MEV da superfície do aço carbono (SAE 1010) sem revestimento e revestido com as camadas de fosfato de zinco estudadas. Os resultados mostram que a deposição do fosfato altera as características da superfície, Fig. 7 (A). A formação da camada de fosfato a partir de banhos de (PZn+NaNO2), (Fig. 7 (B)), ocorre pela precipitação de cristais em forma de lâminas hexagonais. A substituição do NaNO2 por benzotriazol promoveu o condicionamento da superfície, permitindo a obtenção de revestimentos de fosfato com cristas de forma diferente daquela apresentada pelos cristais obtidos do banho de PZn+NaNO2. O revestimento de PZn+BTAH apresentou cristais em forma de grãos, (Fig. 7 (C)), os quais, aparentemente, recobriram de forma mais eficiente o substrato metálico que os cristais de PZn+NaNO2, embora lâminas também pudessem ser observadas no revestimento de PZn+BTAH.

Figura 7. Micrografias obtidas por MEV da superfície do aço carbono (SAE 1010) (A) sem revestimento (B) fosfatizado com PZn+NaNO2 (pH = 2.64, Temperatura = 25 oC, Tempo de imersão = 5 min) (C) fosfatizado com PZn+BTAH (pH = 2.00, Temperatura = 50 oC, Tempo de imersão = 10 min).
Aparentemente, o revestimento de PZn+BTAH recobriu de maneira mais eficiente a superfície metálica, sugerindo que, possivelmente, esta camada apresente maior proteção contra a corrosão do substrato metálico.
Os revestimentos de fosfato de zinco, em geral, apresentam cristais em forma de lâminas hexagonais [2,10,13,17,28,33], como foi observado com o revestimento de PZn+NaNO2 obtido neste trabalho, sendo que a forma dos cristais é atribuída à fase opeita, Zn3(PO4)2.4H2O[2,17].
A forma de grãos observada para os cristais do revestimento de PZn+BTAH também foi relatada na literatura [15] para camadas obtidas em banhos com aditivos de molibdato, sendo esta forma atribuída ao aumento da concentração de zinco na camada depositada, à medida que a concentração de molibdato aumentava no banho [15]. A morfologia do revestimento de PZn+BTAH observada foi também semelhante à dos revestimentos de fosfato tricatiônico (Fe, Zn e Ni) estudados na literatura[4].
A composição elementar das camadas de fosfato foi avaliada por espectroscopia de energia dispersiva (EDS) e os espectros com os principais elementos presentes nos revestimentos são mostrados na Fig. 8. Os espectros de EDS mostram dos principais elementos presentes nas camadas de fosfato, como o fósforo e o zinco. Foi observado também o pico referente ao ferro, sendo este proveniente do ataque ao substrato pelo banho de fosfatização e, conseqüentemente, sua incorporação na camada depositada. Para a amostra não revestida, somente o pico referente ao elemento ferro foi detectado, pois este elemento é principal constituinte do aço carbono (SAE 1010).
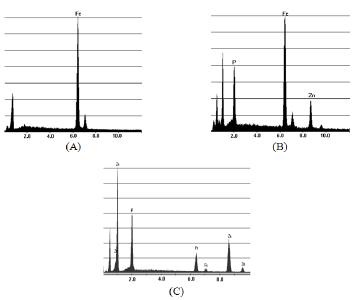
Figura 8. Espectros de EDS da superfície do aço carbono (SAE 1010) (A) sem revestimento (B) fosfatizado com PZn+NaNO2 (C) fosfatizado com PZn+BTAH.
A partir dos espectros de EDS pôde-se determinar os elementos presentes nas camadas de fosfato (semi-quantitativamente) e os resultados são apresentados na Tabela 5.
Tabela 5. Composição química elementar da superfície do aço carbono (SAE 1010) fosfatizado.
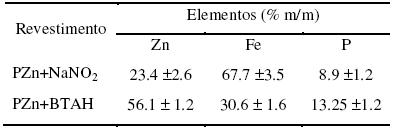
É possível observar que houve um grande aumento na quantidade dos elementos Zn e P na camada de PZn+BTAH quando comparada com as quantidades destes elementos na camada de PZn+NaNO2. Tal resultado deve-se às condições de obtenção de cada uma das camadas. A obtenção do revestimento em banho com BTAH ocorreu a temperatura mais elevada, em menor pH, e com maior tempo de imersão. Nestas condições a deposição da camada de fosfato é favorecida e, por isso, uma maior quantidade dos elementos Zn e P foi detectada. Em contraste, pode ser observado pelos resultados da Tabela 5, que a quantidade de ferro na camada de PZn+BTAH é menor que na camada de PZn+NaNO2, apesar da maior agressividade da primeira solução. Este resultado pode ser devido à maior espessura do primeiro revestimento, pois o ferro detectado no espectro de EDS é uma contribuição do ferro que constitui a camada e do substrato metálico.
Caracterização das fases presentes nos revestimentos de fosfato
Os revestimentos de fosfato foram caracterizados por difração de raios-X determinando-se as fases presentes nas camadas. Os difratogramas obtidos são apresentados na Fig. 9.
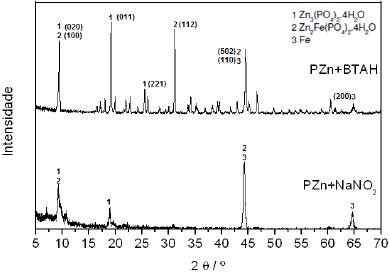
Figura 9. Difratogramas, obtidos por difração de raios-X, do aço carbono (SAE1010) revestido com as camadas de fosfato de zinco estudadas e picos indexados empregando-se o programa de análise de dados de difração de Raios-X. Para a fase de Zn3(PO4)2.4H2O (opeita), foram utilizados as fichas e para a fase de Zn2Fe(PO4)2.4H2O (fosfofilita) foi empregada a ficha (JCPDS 29-1427).
Os difratogramas são característicos de revestimentos de fosfato de zinco com as seguintes fases principais: Zn3(PO4)2·4H2O (opeita) e Zn2Fe(PO4)2·4H2O (fosfofilita). A partir dos resultados obtidos dos difratogramas, pôde-se propor o seguinte mecanismo para a fosfatização:
![]()
![]()
A reação descrita pela equação 2 corresponde à oxidação do ferro pela solução ácida de fosfatização; e as outras reações (3 e 4) são responsáveis pela formação dos cristais de fosfato e sua deposição sobre a superfície metálica.
O difratograma para PZn+BTAH indica a presença de dois picos que não aparecem no difratograma para PZn+NaNO2. Os referidos picos podem ser observados em 25o e 32o relacionados às fases Zn3(PO4)2.4H2O e Zn2Fe(PO4)24H2O, respectivamente. A presença destes picos está relacionada com as condições de temperatura e pH para obtenção da camada de fosfato em presença de BTAH. Em temperaturas maiores ocorre maior ataque à superfície metálica com produção de um revestimento de fosfato com maior quantidade da fase fosfofilita e opeita. Estes resultados estão de acordo com os resultados de EDS, pois maiores quantidades de Zn foram observadas para o revestimento obtido em presença de BTAH, entretanto, a menor quantidade de ferro pode ser explicada pela obtenção de um revestimento mais espesso, como foi evidenciado pelas medidas gravimétricas que serão apresentadas na seção 3.4.
Ensaios gravimétricos
Os ensaios gravimétricos foram realizados conforme descrito na secção Fosfatização, sendo a massa da camada calculada pela equação 1. Os resultados são apresentados na Tabela 6.
Tabela 6. Massa média e tempo de estabilização das camadas de fosfato.
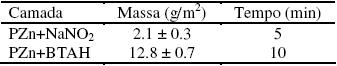
É possível observar que a massa da camada de PZn+BTAH é cerca de seis vezes maior que a de PZn+NaNO2. Tal comportamento está relacionado com as condições de obtenção da camada de PZn+BTAH bem mais agressivas que aquelas utilizadas para a deposição de PZn+NaNO2. A maior massa obtida para PZn+BTAH representa uma maior espessura e, possivelmente, menor porosidade pela superposição de maior número de cristais, o que resulta em maior proteção contra a corrosão do aço carbono. A relação entre a massa de fosfato e a espessura pode ser realizada por meio da densidade da camada segundo:
![]()
onde e é a espessura, m a massa da camada, d a densidade do fosfato e A a área.
Nesta equação d e A são fixos e, como conseqüência, uma maior massa representa também maior espessura. Supõe-se também que uma camada mais espessa e com cristais com forma arredondada, conforme foi observado para a camada de PZn+BTAH, resulta em menor porosidade em comparação à camada de PZn+NaNO2, pois cristais com formato arredondado recobrem de forma mais eficiente a superfície metálica do que cristais com forma de lâminas hexagonais e de agulhas.
Caracterização eletroquímica
Potencial de circuito aberto
Curvas de variação do potencial de circuito aberto em função do tempo de imersão do aço carbono (SAE 1010) em solução de NaCl 0.5 molL-1 são apresentadas na Fig. 10. Estas curvas mostram a tendência do potencial do substrato em se deslocar para valores mais negativos com o tempo de imersão.
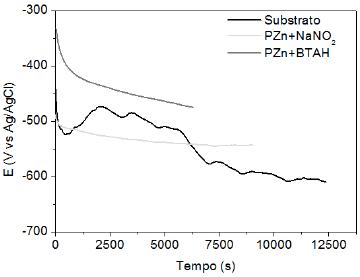
Figura 10. Curvas de variação do potencial do circuito aberto em função do tempo de imersão do aço carbono (SAE1010) em solução de NaCl 0.5 molL-1, sem e com os revestimentos estudados.
O potencial da amostra de aço com camada de PZn+NaNO2 também mostra uma tendência de deslocamento para valores mais negativos, o que ocorreu desde o início da imersão das amostras na solução de cloreto. Entretanto, após duas horas de imersão o potencial se mostrou mais positivo que aquele do substrato sem revestimento, indicando uma superfície mais nobre em presença de PZn+NaNO2. Comportamento distinto foi apresentado pelas amostras com camada de PZn+BTAH, observando-se para todo o período de imersão que os potenciais medidos foram mais positivos, sugerindo um comportamento mais nobre da superfície com camada de PZn+BTAH quando comparada com a camada de PZn+NaNO2.
Espectroscopia de impedância eletroquímica
Ensaios de espectroscopia de impedância eletroquímica foram realizados após quatro horas de imersão em solução de NaCl 0.5 molL-1 e os resultados obtidos são apresentados na Fig. 11 na forma de diagramas de Nyquist e de ângulo de fase de Bode.
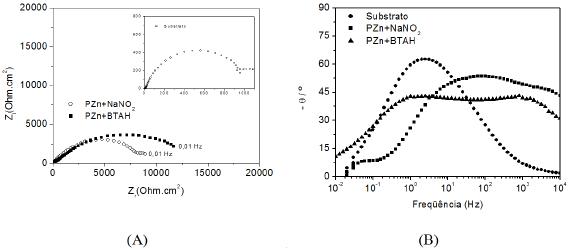
Figura 11. Diagramas de Nyquist (A) e de ângulo de fases de Bode (B) obtidos em NaCl 0.5 molL-1 para amostras de aço carbono (SAE 1010) sem revestimento e fosfatizadas nos banhos propostos para estudo.
A Fig. 11 (A) mostra apenas um arco capacitivo achatado para a amostra de aço não revestido. Para as amostras com camadas de PZn+NaNO2 e PZn+BTAH, observou-se, respectivamente, dois arcos e um arco capacitivo achatados.
Os valores de impedância estimados dos diagramas de Nyquist da Fig. 11 (A), indicaram que os revestimentos de fosfato promoveram uma proteção significativa ao substrato metálico. As camadas de PZn+BTAH estiveram associadas a maiores impedâncias que a de PZn+NaNO2, indicando que o NaNO2 pode ser substituído por benzotriazol, com vantagens nas propriedades de proteção contra a corrosão do aço carbono (SAE 1010). Uma das razões para estes resultados está relacionada com a morfologia dos cristais de fosfato de cada camada. O revestimento de PZn+NaNO2 é composto por cristais em forma hexagonal que não recobrem totalmente a superfície e, coincidentemente, esta camada apresentou menor proteção frente à corrosão do substrato entre as testadas. Em contrapartida, os revestimentos PZn+BTAH apresentaram cristais com formas arredondadas, que aparentemente recobrem melhor a superfície metálica. Estas camadas apresentavam-se com maior espessura que a camada de PZn+NaNO2 e também se mostraram como mais protetoras frente à corrosão.
Os diagramas de ângulo de fase de Bode, apresentados na Fig. 11 (B) mostram que para o aço sem revestimento houve apenas uma constante de tempo, observada em freqüências próximas de 1 Hz, associada a processos de transferência de carga. Todavia, diferentemente do substrato sem revestimento, o aço com camadas de fosfato apresentou pelo menos duas constantes de tempo. A primeira constante de tempo, em altas freqüências (AF), foi relacionada à presença da camada de fosfato porosa, cujos poros foram preenchidos com eletrólito. A constante de tempo observada em freqüências próximas de 10 Hz, ou seja, em médias freqüências (MF), está associada à resposta de transferência de carga. A terceira constante de tempo, em baixas freqüências BF, próximas de 0.1 Hz, presente apenas nos diagramas das amostras com camadas de PZn+NaNO2 e PZn+BTAH, está associada a processos de corrosão.
Para o aço com camada PZn+BTAH, houve uma maior separação das duas constantes de tempo, e a segunda constante foi deslocada para freqüências mais baixas em comparação com a camada de PZn+NaNO2, o que indicou o retardamento de processos de transferência de carga, associado a um revestimento com melhores propriedades protetoras contra a corrosão.
Os resultados de EIE apoiaram os resultados apresentados pelo MEV apresentados anteriormente, indicando que as camadas obtidas em presença de BTAH mostraram melhores propriedades de proteção contra a corrosão do aço carbono (SAE 1010) do que as obtidas em solução com NaNO2.
Polarização potenciodinâmica anódica
As curvas de polarização anódicas obtidas em meio de NaCl 0.5 molL-1 são apresentadas na Fig. 12.
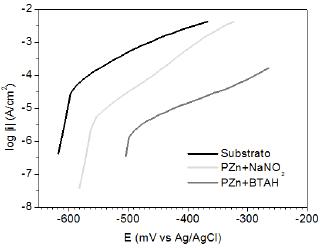
Figura 12. Curvas de polarização potenciodinâmica anódica, obtidas em meio de NaCl 0.5 molL-1 para amostras de aço carbono (SAE 1010), sem e com revestimento de fosfato.
Em toda a faixa de sobrepotencial anódico estudado, as densidades de corrente para as amostras fosfatizadas foram menores que para o aço sem revestimento. A camada associada com menores valores de densidade de corrente foi a de PZn+BTAH, seguida de PZn+NaNO2, o que confirma os resultados de espectroscopia de impedância já apresentados que sugeriam que a camada de PZn+BTAH promove maior proteção contra a corrosão do aço carbono (SAE 1010).
Os resultados das curvas de polarização também concordaram com os indicados pela observação da superfície por MEV, os quais sugeriam que as camadas de PZn+BTAH promovem maior cobertura, e a diminuição das densidades de corrente deve ocorrer por efeito de barreira, sendo tal comportamento relatado na literatura [21].
Conclusões
O efeito de substituição do nitrito de sódio, presente em banhos de fosfato de zinco, por benzotriazol foi investigado e os resultados obtidos permitiram as seguintes conclusões:
- as análises gravimétricas mostraram aumento da massa de fosfato depositada quando se utilizou a solução de PZn+BTAH em comparação com a solução de PZn+NaNO2;
- as principais fases presentes nas camadas de fosfato obtidas com os banhos de fosfatização testados foram caracterizadas por difração de raios-X e identificadas como Zn3(PO4)2.4H2O (opeita) e Zn2Fe(PO4)2.4H2O (fosfofilita);
- a camada formada na solução de PZn+NaNO2 é composta por cristais em forma de agulhas, enquanto as camadas formadas em soluções de PZn+BTAH consistiram de cristais em forma de grãos. Esta última forma resultou em melhor cobertura do substrato que a proporcionada pelos cristais em forma de agulhas da camada de PZn+NaNO2;
- maior resistência à corrosão e maior eficiência de proteção foi associada à camada de PZn+BTAH, em comparação com a camada de PZn+NaNO2;
- o nitrito de sódio pode ser substituído por benzotriazol com vantagens ambientais e de proteção contra a corrosão do aço carbono (SAE 1010).
Agradecimentos
Os autores agradecem à FAPESP (Fundação de Amparo à Pesquisa do Estado de São Paulo) pelos auxílios 2007/51363-5 e 08/54836-4.
Referências
1. E.P. Banczek, P.R.P. Rodrigues, I. Costa, Surf. Coat. Technol. 201 (2006) 3701-3708. [10.1016/j.surfcoat.2006.09.003]
2. S. Jegannathan, T.S.N.S. Narayanan, K. Ravichandran, S. Rajeswari, Surf. Coat. Technol. 200 (2006) 6014-6021. [10.1016/j.surfcoat.2005.09.017]
3. C.M. Wang, H.C. Liau, W.T. Tsai, Surf. Coat. Technol. 201 (2006) 2994-3001. [10.1016/j.surfcoat.2006.06.010]
4. T.K. Rout, H.K. Pradhan, T. Venugopalan, Surf. Coat. Technol. 201 (2006) 3496-3501. [10.1016/j.surfcoat.2006.07.260]
5. S. Jegannathan, T.S.N.S. Narayanan, K. Ravichandran, S. Rajeswari, Surf. Coat. Technol. 200 (2006) 4117-4126. [10.1016/j.surfcoat.2005.04.022]
6. S. Rebeyrat, J.L. G-Poussard, J.F. Silvain, B. Panicaud, J.F. Dinhut, Appl. Surf. Sci. 199 (2002) 11-21. [10.1016/S0169-4332(02)00152-6]
7. P.T. Olesen, T. Steenberg, E. Christensen, N.J. Bjerrum, Journal of Materials Science 33 (1998) 3059-3063. [10.1023/A:1004379319348]
8. L.Y. Niu, Z.H. Jiang, G.Y. Li, C.D. Gu, J.S. Lian, Surf. Coat. Technol. 200 (2004) 3021–3026. [10.1016/j.surfcoat.2004.10.119]
9. M.C. Whitten, C.-T. Lin, Prog. Org. Coat. 38 (2000) 151-162. [10.1016/S0300-9440(00)00101-6]
10. G. Bustamante, F.J.F. Miranda, I.C.P. Margarit, O.R. Mattos, Prog. Org. Coat. 46 (2003) 84-90. [10.1016/S0300-9440(02)00214-X]
11. V. Gentil, Corrosão, 3ª ed., Rio de Janeiro, R.J.: LTC , p. 319-384, 1987.
12. G. Lorin, Phosphating of Metals, Middlesex, Finishing Publications, Ltd., Great Britain, p. 4- 7 (1974).
13. H.A. Ponte, A.M. Maul, E.A. Alvarenga, Mater. Res. 5 (2002) 439-446. [10.1590/S1516-14392002000400008]
14. L. Kouisni, M. Azzi, M. Zertoubi, F. Dalard, S. Maximovitch, Surf. Coat. Technol. 185 (2004) 58-67. [10.1016/j.surfcoat.2003.10.061]
15. J.S. Lian, G.Y. Li, L.Y. Niu, C.D. Gu, Z.H. Jiang, Q. Jiang, Surf. Coat. Technol. 200 (2006) 5956-5962. [10.1016/j.surfcoat.2005.09.007]
16. A.S. Akhtar, D. Susac, P.K. Glaze, C. Wong, K.A.R. Mitchell, Surf. Coat. Technol. 187 (2004) 208–215. [10.1016/j.surfcoat.2004.02.044]
17. S. Jegannathan, T.S.N.S. Narayanan, K.R.s. Rajeswari, Electrochim. Acta 51 (2005) 247–256. [10.1016/j.electacta.2005.04.020] [ Links ]
18. T.S.N.S. Narayanan, S. Jegannathan, K. Ravichandran, Prog. Org. Coat. 55 (2006) 355-362. [10.1016/j.porgcoat.2006.01.009]
19. M. Shoeib, M. Farouk, F. Hanna, Metal Finishing 95 (1997) 62-68. [10.1016/S0026-0576(97)85862-X]
20. M. Wolpers, J. Angeli, Appl. Surf. Sc. 179 (2001) 281-291. [10.1016/S0169-4332(01)00296-3]
21. D. Weng, P. Jokiel, A. Uebleis, H. Boehni, Surf. Coat. Technol. 88 (1996) 147-156. [10.1016/S0257-8972(96)02860-5]
22. Y. Totik, Surf. Coat. Technol. 200 (2004) 2711–2717. [10.1016/j.surfcoat.2004.10.004]
23. J. Flis, J. Mankowski, T. Zakroczymski, T. Bell, Corrosion Sci. 43 (2001) 1711-1725. [10.1016/S0010-938X(00)00179-7]
24. E.P. Banczek, M.F. Oliveira, M.T. Cunha, P.R.P. Rodrigues, Port. Electrochim. Acta 23 (2005) 379-391. [10.4152/pea.200503379] [ Links ]
25. B. Ptacek, F. dalard, J.J. Rameau, Surf. Coat. Technol. 82 (1996) 277-283. [10.1016/0257-8972(95)02724-6]
26. L. Gang, S. Wangen, C. Yanrong, Z. Shili, Metal Finishing 95 (1997) 54-57. [10.1016/S0026-0576(97)85860-6]
27. L. Kouisni, M. Azzi, F. Dalard, S. Maximovitch, Surf. Coat. Technol. 192 (2005) 239-246. [10.1016/j.surfcoat.2004.05.028]
28. D. Zimmermann, A.G. Munoz, J.W. Schultze, Electrochim. Acta 48 (2003) 3267-3277. [10.1016/S0013-4686(03)00385-2]
29. D. He, F. Chen, A. Zhou, L. Nie, S. Yao, Thin Solid Films 382 (2001) 263-270. [10.1016/S0040-6090(00)01075-0]
30. G.Y. Li, J.S. Lian, L.Y. Niu, Z.H. Jiang, Q. Jiang, Surf. Coat. Technol. 201 (2006) 1814–1820. [10.1016/j.surfcoat.2006.03.006]
31. L.C. Deepa, C.S. Sathiyanarayanan, C. Marikkannu, D. Mukherjee, Anti Corros. Methods Mater. 50 (2003) 286-290. [10.1108/00035590310482523]
32. G. Górecki, Metal Finishing 93 (1995) 36-39. [10.1016/0026-0576(95)93627-E]
33. P.K. Sinha, R. Feser, Surf. Coat. Technol. 161 (2002) 158–168. [10.1016/S0257-8972(02)00521-2]
34. G. Bikulcius, V. Burokas, A. Martusiene, E. Matulionis, Surf. Coat. Technol. 172 (2003) 139-143. [10.1016/S0257-8972(03)00388-8]
35. S. Palraj, M. Selvaraj, P. Jayakrishnan, Prog. Org. Coat. 54 (2005) 5-9. [10.1016/j.porgcoat.2004.03.012]
36. P. Hivart, B. Hauw, J.P. Bricout, J. Oudin, Tribol. Int. 30 (1997) 561-570. [10.1016/S0301-679X(97)00019-4]
37. G. Niu, L. Niu, J. Lian Surf. Coat. Technol. 76 (2004) 215-221. 10.1016/S0257-8972(03)00736-9.
38. D. Zimmermann, A.G. Munoz, J.W. Schultze, Surf. Coat. Technol. 197 (2005) 260-269. [10.1016/j.surfcoat.2004.07.129]
39. W. Wimmer, J. Gottschlich, B. Motorenwerke, Metal Finishing 96 (1998) 16-19. [10.1016/S0026-0576(98)80079-2]
40. E.P. Banczek, Desenvolvimento e Caracterização de Camadas de Fosfato de Zinco/Níquel e Zinco/Nióbio. São Paulo 2008. 192 f. Tese de doutorado apresentada ao IPEN/USP.
41. Disponível em: http://www.metalchek.com.br/artigos_tecnicos/nitrito.pdf. Acesso em: 10/08/2009.
Received 16 January 2010; accepted 11 November 2010
*Corresponding author
E-mail address: edopradobanczek@yahoo.com.br














