Introdução
A doença hepática esteatótica associada a disfunção metabólica, metabolic dysfunction-associated steatotic liver dissesse (MASLD), anteriormente denominada de fígado gordo não alcoólico, é a forma mais frequente de lesão hepática crónica, podendo variar de um aumento da quantidade de gordura hepática, até formas de esteato-hepatite associada a disfunção metabólica, metabolic dysfunction-associated steatohepatitis (MASH), com fibrose, cirrose, carcinoma hepatocelular e morte.1,2A obesidade, insulinorresistência e, particularmente, a diabetes mellitus tipo 2 (DM2), estão particularmente associadas a MASLD.3
Métodos
Para a presente revisão narrativa, foi utilizado o motor de busca científica PubMed. Foram utilizados os seguintes termos MeSH (Medical Subject Headings): "Non-alcoholic Fatty Liver Disease", "Diabetes Mellitus, Type 2", "Obesity", "Hypoglycemic Agents", cruzados com termos adicionais de pesquisa não-MeSH, como agonistas do recetor GLP-1, inibidores do recetor SGLT-2, "glitazona". Não houve restrições quanto ao período de publicação dos artigos, embora os mais recentes fossem preferidos. Para assegurar a adequação dos artigos, estes foram submetidos a uma revisão pelo título e resumo e posteriormente a uma revisão pelo texto completo. As bibliografias dos artigos relevantes também foram consultadas para encontrar artigos adicionais. Apenas artigos es-critos em inglês ou português foram incluídos. Foi adotada a nova nomenclatura proposta de acordo com o consenso de Delphi em 2023.4,5
EPIDEMIOLOGIA
A MASLD está a tornar-se uma doença cada vez mais reconhecida a nível mundial, afetando cerca de 25% da população.6 Não é surpresa que a prevalência de MASLD seja muito semelhante à da obesidade, uma vez que esta representa o principal fator de risco. Adicionalmente, cerca de 70% dos diabéticos apresentam MASLD. Deste grupo, e dependendo das séries, cerca de 10% a 37% dos indivíduos demonstram já algum grau de lesão hepatocitária, com MASH e fibrose variável.7,8
O diagnóstico de MASLD duplica a mortalidade por todas as causas e a relacionada com a doença hepática, nos doentes com DM2.9A prevalência de fibrose avançada, neste grupo de doentes, está estimada em cerca de 5%, sendo este o maior preditor de mortalidade.8
FISIOPATOLOGIA
A apresentação de MASLD pode variar desde esteatose hepática não complicada até MASH, que pode estar associada a cirrose ou até mesmo a carcinoma hepatocelular (Fig. 1).1 A fisiopatologia permanece desconhecida. Todavia, a acumulação de gordura nos hepatócitos parece ser a condição sine qua non para a sua ocorrência.10 São numerosos os fatores que afetam a clearance hepática de gorduras e contribuem para o desenvolvimento e progressão de MASLD, incluindo a resistência à insulina, a gordura visceral, o sedentarismo e a DM2.8
Em indivíduos saudáveis, a hidrólise dos triglicéridos pela lípase hormono-sensível e a subsequente libertação de ácidos gordos livres (AGL) do tecido adiposo para a circulação é diretamente inibida pela insulina. Contudo, em indivíduos obesos, a lípase hormono-sensível é resistente à ação da insulina, que, em conjunto ao inerente aumento da massa adipocitária, aumenta significativamente os AGL em circulação, especialmente na veia hepática.8 Desta forma, a captação de AGL pelos hepatócitos aumenta.10
Curiosamente, o fígado apenas desenvolve uma resistência parcial à insulina, ao contrário do que ocorre no músculo esquelético e tecido adiposo.8 De facto, a lipogénese hepática mantém a sua sensibilidade à insulina mesmo na presença de estados de resistência à insulina avançados, levando à acumulação de triglicéridos nos hepatócitos.8 Além disso, a insulina diminui também a síntese hepática de apolipoproteína B100 e a produção de lipoproteínas de muito baixa densidade (VLDL).8
Como resultado, a insulina aumenta o conteúdo hepático de triglicéridos, tanto estimulando a sua produção, como diminuindo a sua exportação através da secreção de VLDL. Os triglicéridos hepáticos levam à geração de espécies reativas de oxigénio que vão promover a produção de moléculas pró-inflamatórias, como o fator de necrose tumoral alfa (TNF-α), contribuindo para a atividade necroinflamatória e balonização dos hepatócitos, resultando em esteato-hepatite e fibrose.8,10
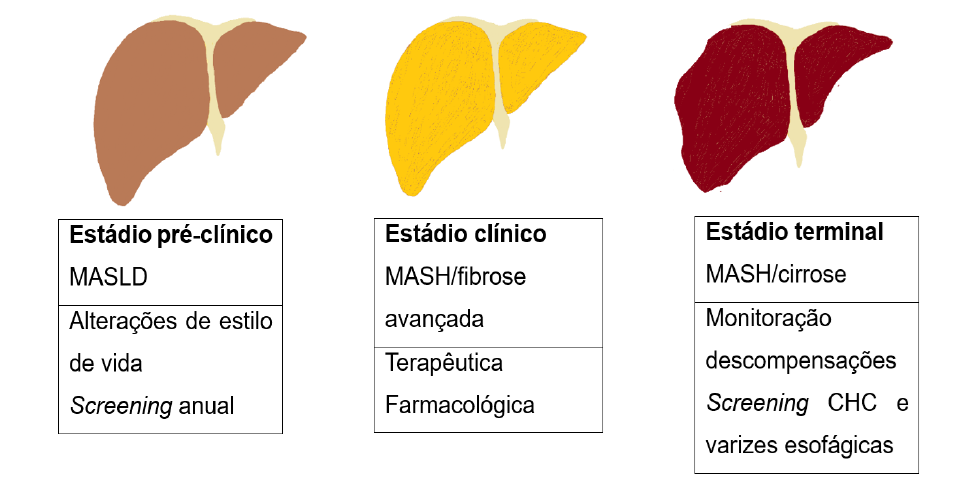
Figura 1: Diferentes estádios da MASLD e respetivas atuações. Adaptado com autorização de Pandyarajan et al.21 CHC - carcinoma hepatocelular.
CLÍNICA
Relativamente à clínica associada a MASLD, a maioria dos doentes é assintomática. Poderá haver referência a fadiga ou desconforto abdominal no quadrante superior direito do abdómen. Ao exame objetivo, achados possíveis são hepatomegalia ou sinais de insulinorresistência. Na presença de cirrose, vão existir estigmas clássicos de doença hepática crónica.11
RASTREIO E DIAGNÓSTICO
O primeiro passo no diagnóstico é excluir outras patologias hepáticas que se apresentam de forma semelhante, nomeadamente, e de forma mais comum, a doença hepática alcoólica.
As ferramentas de diagnóstico de primeira linha devem idealmente consistir em scores não invasivos. O doseamento isolado das transamínases é insuficiente e perderá uma proporção considerável de casos, uma vez que pelo menos um quarto dos doentes com MASLD e um quinto daqueles com MASH terão valores normais.12
Análises prévias de custo-efetividade do rastreio de MASLD produziram resultados negativos. Corey et al13 compararam o rastreio de diabéticos com mais de 50 anos com ultrassonografia seguida de biópsia hepática e subsequente tratamento farmacológico com pioglitazona, com ausência de rastreio. Os resultados desanimadores foram impulsionados principalmente pelos efeitos colaterais da pioglitazona e a invasividade da biópsia. O diagnóstico precoce de carcinoma hepatocelular e a realização de transplante hepático não foram considerados.
Mais recentemente, investigadores da NASHNET14 usaram um algoritmo ligeiramente diferente, que consistia no doseamento das transamínases e ultrassonografia, seguida de elastografia transitória controlada por vibração (VCTE) ou Fibroscan®, verificando que, desta forma, o rastreio de MASLD entre os doentes com DM2 era mais rentável.
FIBROSIS-4 SCORE
Os investigadores da NASHNET14 advogam também o uso do score de Fibrose-4 (FIB-4), na medida em que o modelo preservaria a sua relação custo-eficácia se este score fosse utilizado. De facto, o FIB-4 é um score simples e barato, que agrega valores bioquímicos (plaquetas, ALT, AST) e idade, resultando num valor numérico.15
Apesar de ter sido desenvolvido para doentes com infeção crónica por hepatite C, foi extensivamente validado e recomendado em guidelines de MASH e DM2.1,16,17O valor deste e de outros scores similares reside na capacidade de excluir fibrose avançada (com elevado valor preditivo negativo) e não no rastreio de doença precoce.8
Devido ao seu cálculo simples, o FIB-4 pode ter grande potencial de utilização na prática clínica. Um doente com um score FIB-4 inferior a 1,3 tem um baixo risco de fibro-se avançada, enquanto um score FIB-4 superior a 2,67 está associado a um alto risco. Os doentes de risco intermédio (score FIB-4 ≥ 1,3 e < 2,67) e alto devem ser avaliados por VCTE.8 Seguindo esta avaliação sequencial, é expectável que o número de biópsias hepáticas desnecessárias seja re-duzido.18,19No entanto, a biópsia hepática permanece o gold standard para diagnóstico e estadiamento, mas raramente é realizada devido à sua invasividade.8
NONALCOHOLIC FATTY LIVER DISEASE FIBROSIS SCORE
O nonalcoholic fatty liver disease fibrosis score (NFS) é um score alternativo, desenvolvido para o diagnóstico de fibrose hepática avançada em doentes com fígado gordo não alcoólico. Foi validado pela primeira vez em 200720 e utiliza a idade, o índice de massa corporal, o estado de diabetes, as enzimas hepáticas, a albumina e as plaquetas para determinar a probabilidade de fibrose hepática avançada. O diagnóstico pode ser excluído (com um valor preditivo negativo de 93%) utilizando o cut-off de score baixo (< -1,455) ou considerado de forma confiável (com um valor preditivo positivo de 90%) utilizando o cut-off de score alto (> 0,676). Ao aplicar este modelo, é possível evitar a realização de biópsia hepática na grande maioria dos doentes.20
RASTREIO SEQUENCIAL POR ETAPAS
Jafarov et al19 validaram um algoritmo para comparar os scores FIB-4 e NFS em associação com a VCTE. Foram incluídos 139 doentes com MASLD confirmado por biópsia. O uso de FIB-4 (< 1,45 para baixo risco de fibrose avançada e > 3,25 para alto risco de fibrose avançada) mais a medição da rigidez hepática (< 8,8 kPa para baixo risco de fibrose avançada e > 10,9 kPa para alto risco de fibrose avançada) revelou a melhor performance diagnóstica, com um valor preditivo positivo de 74% com uma sensibilidade de 89%, e um valor preditivo negativo de 93% com uma especificidade de 82%. Numa comparação direta, o FIB-4 pareceu ter melhor desempenho em relação ao NFS, sendo igualmente mais atraente, por contar com menos parâmetros de avaliação.
Um algoritmo simplificado para cuidados primários também foi sugerido.21 Doentes de alto risco (idade > 50 anos com DM2 ou síndrome metabólica) são rastreados pelo doseamento das transamínases e ultrassonografia abdominal. Subsequentemente, os scores de FIB-4 e NFS são utilizados para identificar aqueles com alta probabilidade de fibrose avançada, que devem ser encaminhados para uma consulta da especialidade (Fig. 2).
Outra modalidade de screening inclui o score Fibroscan®-AST (FAST), que consiste na realização de VCTE e no cálculo da relação alanina transamínase/aspartato transamínases (ALT/AST). Este modelo identifica igualmente aqueles com alto risco de progressão para fibrose.22
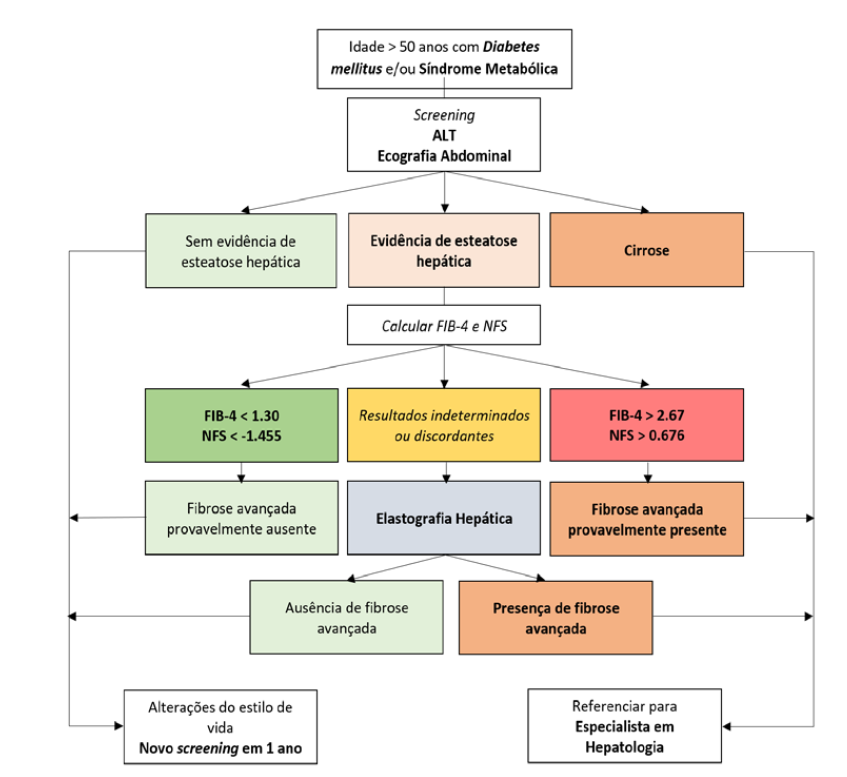
Figura 2: Proposta de rastreio sequencial de MASLD. Adaptado com autorização de Pandyarajan et al.21
TRATAMENTO
A modificação do estilo de vida, como restrição calórica e exercício físico, são atualmente a pedra angular do tratamento da MASLD, tal como acontece na DM2.23
A dieta mediterrânica caracteriza-se pelo consumo de alimentos de origem vegetal e peixe, com reduzido consumo de carne e produtos lácteos. Esta dieta representa o gold standard na medicina preventiva, provavelmente devido à combinação harmónica de muitos alimentos com propriedades antioxidantes e anti-inflamatórias. A European Association for the Study of the Liver (EASLD) recentemente incentivou a dieta mediterrânica como uma forma de tratamento da MASLD.23
Contudo, para muitos indivíduos, a alteração de hábitos de vida pode ser algo difícil de alcançar e manter, levando à discussão da potencialidade e necessidade do recurso à farmacoterapia.
Embora atualmente não haja terapêutica farmacológica aprovada especificamente para a MASLD/MASH, quer pela Federal Drug Administration (FDA) quer pela European Medicines Agency (EMA), vários agentes antidiabéticos já aprovados mostraram resultados promissores em ensaios clínicos no tratamento da MASLD. De acordo com as diretrizes dos Estados Unidos da América, Europa e Japão, a pioglitazona e a vitamina E são agora recomendados para o tratamento da MASH comprovada por biópsia, com e sem DM2, respetivamente.1,16,23Ambos os agentes reduziram a esteatose, a inflamação e os níveis de enzimas hepáticas comparativamente ao placebo. No entanto, não houve melhoria nos scores de fibrose, o que levanta a necessidade da aprovação de agentes mais eficazes e modificares da evolução natural da MASLD.
Inibidores do recetor SGLT-2
Os inibidores do cotransportador de sódio-glicose 2 (iSGLT-2) causam uma redução da massa adipocitária pela promoção da excreção renal de glicose, representando um potencial terapêutico na MASLD/MASH.24
Num estudo prospetivo, Akuta et al25 incluíram nove doentes com MASLD comprovada por biópsia e DM2, que foram tratados com canagliflozina 100 mg 1 vez por dia, durante 24 semanas, com posterior reavaliação da histologia no final do período de tratamento. Todos os indivíduos apresentaram melhoria histológica ao final de 24 semanas de tratamento. Face ao estado pré-tratamento, verificou-se uma melhoria nos scores de esteatose, inflamação lobular, ballooning hepatocitário e no estadio de fibrose de 78%, 33%, 22% e 33%, respetivamente.
Um meta-análise,26 que incluiu oito ensaios randomizados, avaliou a eficácia dos iSGLT-2 nos doentes com DM2 e MASLD. O endpoint primário avaliou as mudanças ao nível das enzimas hepáticas ALT, AST e gama-glutamil transpeptidase (GGT), e o endpoint secundário incluiu a avaliação do nível da resistência à insulina. Ao nível do endpoint primário, os resultados foram positivos para dois fármacos da classe - dapagliflozina e canagliflozina. Adicionalmente, a canagliflozina parece causar uma maior redução da GGT, enquanto a dapagliflozina trouxe mais benefícios ao nível do controlo glicémico e resistência à insulina.
Estudos adicionais serão necessários para avaliar o potencial real desta classe farmacológica nos outcomes associados à MASLD.
Agonistas do recetor GLP-1
Os agonistas dos recetores do peptídeo-1 semelhante ao glucagon (aGLP-1) promovem perda de peso, enfatizando o seu potencial papel no tratamento da MASLD/MASH. Os aGLP-1 têm também uma miríade de outros efeitos metabólicos benéficos, muitos relevantes para a fisiopatologia da MASLD.27
O exenatide e o lixisenatide são exemplos de aGLP-1 de ação relativamente curta, enquanto as formulações de ação mais prolongada incluem o liraglutide e as formulações semanais de exenatide, dulaglutide, semaglutide e albiglutide. A sua estrutura química modificada, em comparação com o GLP-1 nativo, torna-os mais resistentes à degradação enzimática pela dipeptidil peptidase-4 (DPP-4), permitindo uma duração prolongada da ação.28
A melhoria da resistência hepática à insulina com o tratamento com os aGLP-1 tem sido demonstrada não só em indivíduos com DM2, mas também naqueles com MASH ou com obesidade mórbida.28
EXENATIDE
Os efeitos do exenatide na MASLD foram avaliados em vários estudos em humanos. Foi demonstrada uma melhoria do índice de massa corporal, perímetro abdominal, hemoglobina glicada, glucose plasmática em jejum, ALT, AST e GGT, quando comparado com a metformina, em 170 doentes com DM2 e MASLD (diagnosticados por ultrassonografia), após 12 semanas de tratamento.29
Dutour et al30mostraram que o exenatide (10 μg, duas vezes por dia) durante 26 semanas levou a uma redução significativa na hemoglobina A1c (HbA1c), peso, tecido adiposo epicárdico e conteúdo de triglicéridos hepáticos em 44 doentes obesos com DM2.
Liraglutide
O liraglutide tem demonstrado melhorar tanto as características bioquímicas como histológicas da MASLD/MASH em vários estudos em humanos.27Um estudo de coorte retrospetivo mostrou que o liraglutide (0,3-0,6 mg/dia), após 6 meses, reduziu significativamente o peso, ALT, AST, glucose plasmática em jejum e HbA1c em 26 doentes com DM2 e MASLD, avaliados por ultrassonografia.31 Da mesma forma, 6 a 12 meses de terapia com liraglutide (1,2 mg/dia) levaram a melhorias significativas nos níveis de glucose no sangue e lípidos (exceto o colesterol de lipoproteínas de alta densidade; HDL-C), bem como diminuição da AST, ALT e GGT em 424 doentes com DM2 complicada por MASLD.32
No estudo Lira-NAFLD,33 o liraglutide (1,2 mg/dia) diminuiu significativamente o peso corporal, HbA1c e conteúdo de gordura hepática (medido por espetroscopia magnética de protões) em 68 doentes com DM2 inadequadamente controlados, após 6 meses.
No estudo LEAN (liraglutide safety and efficacy in patients with nonalcoholic steatohepatitis),34 um estudo randomizado, duplamente cego e controlado por placebo, de fase 2, o liraglutide (1,8 mg/dia) mostrou que resolveu a MASH comprovada por biópsia em 9 de 23 doentes, enquanto isso foi observado em apenas 2 de 22 doentes do grupo placebo (p = 0,019), após 48 semanas.
Para avaliar o efeito direto do fármaco na MASLD, independentemente da perda de peso, Matikainen et al35 desenharam um estudo com um grupo de controlo com perda de peso induzida por dieta e outro com perda de peso induzida por liraglutide. A diminuição da gordura intra-hepática foi superior no grupo do liraglutide, contudo não foi estatisticamente significativa.
Dulaglutide
O dulaglutide é administrado uma vez por semana, proporcionando redução de HbA1c semelhante ao liraglutide, uma redução de peso semelhante ao exenatide, e um perfil de efeitos adversos semelhante.23
De acordo com um estudo de série de casos japonês, o dulaglutide (0,75 mg uma vez por semana) melhorou significativamente os níveis séricos de AST, ALT e a rigidez hepática (medida por elastografia transitória), após 12 semanas de terapia em doentes com DM2 com MASH comprovada por biópsia. Também se observou uma melhoria significativa no índice de gordura corporal, sem alterações na massa muscular esquelética ou na água corporal total, seguido por redução no peso corporal e dos níveis de HbA1c nestes doentes.36
Além disso, num total de 1499 doentes com DM2 provenientes de quatro ensaios clínicos randomizados - Assessment of Weekly Administration of LY2189265 (dulaglutide) in Diabetes (AWARD-1, AWARD-5, AWARD-8 e AWARD-9), - o dulaglutide (1,5 mg uma vez por semana) reduziu significativamente os níveis plasmáticos de AST, ALT, GGT e a gordura hepática, em comparação com placebo, após 6 meses de tratamento.37
Semaglutide
Para investigar o efeito do semaglutide na MASH, está em andamento um ensaio clínico randomizado, duplamente cego e controlado por placebo, em fase 2, que compara a eficácia e a segurança de três doses diferentes de semaglutide subcutâneo uma vez ao dia, versus placebo, em 288 participantes com MASH (estadio 1-3 de fibrose) (estudo SEMA-NASH, NCT02970942).38
O semaglutide tem três vantagens relativamente aos outros aGLP-1s. Primeiro, o estudo SUSTAIN-6 mostrou que o semaglutide tem o benefício potencial de prevenir eventos cardiovasculares. Em subanálises do estudo SUSTAIN-6, o semaglutide reduziu significativamente os níveis de ALT, de forma dose-dependente, em indivíduos com DM2.39 Em segundo lugar, o semaglutide é superior ao dulaglutide no controlo da glucose e perda de peso em doentes com DM2 (estudo SUSTAIN-7). SUSTAIN-7 é um estudo de eficácia e segurança de fase 3b, de 40 semanas, de 0,5 mg de semaglutide versus 0,75 mg de dulaglutide e 1 mg de semaglutide versus 1,5 mg de dulaglutide, ambos uma vez por semana, como um complemento à metformina, em 1201 pessoas com DM2.40 Existe uma forma oral de semaglutide, mas ainda não há dados sobre os seus efeitos na MASLD/MASH.41
Tirzepatida
Tirzepatida é um fármaco agonista dos recetores GLP-1 bem como GIP (peptídeo inibitório gástrico), aprovado para a DM2, em monoterapia ou em associação. Também demonstrou melhoria do perfil tensional e da dislipidemia.42 A eficácia e segurança foram avaliadas no ensaio clínico randomizado e duplamente cego SURPASS-1, em que doentes com DM2 com mau controlo por dieta e exercício físico eram submetidos a administrações subcutâneas semanais (doses 5 mg, 10 mg, 15 mg), concluindo eficácia robusta do controlo glicémico e perda ponderal em comparação com o placebo.43 Numa análise post hoc44 com 316 doentes, concluiu-se que doses mais altas de tirzepatida reduziram as transamínases bem como levaram ao aumento da adiponectina em doentes com DM2. Contudo, a percentagem de doentes com MASH era desconhecida e não houve avaliação hepática dirigida. Em suma, ensaios clínicos randomizados de grandes dimensões adicionais devem ser realizados para determinar se os aGLP-1s representam a terapêutica de primeira linha em doentes com MASLD/MASH, com ou sem DM2. Além disso, é necessário demonstrar se a melhoria da MASLD/MASH está associada a uma diminuição significativa de eventos vasculares.
Glitazonas
As glitazonas são uma classe de fármacos que atuam como agonistas dos recetores ativados por proliferadores de peroxissoma (PPAR), um recetor nuclear associado à inflamação, sensibilização à insulina e metabolismo lipídico.8,28
Parte do benefício clínico do uso de pioglitazona na MASH tem sido associado ao seu agonismo parcial nos PPAR-α, potenciando a oxidação dos ácidos gordos nos hepatócitos e alterações nas lipoproteínas que levam a uma redução nas concentrações plasmáticas de triglicerídeos e um aumento nas concentrações de lipoproteínas de alta densidade.45
Isto contrasta com a ação de um agonista puro de PPAR-γ, como a rosiglitazona, que tem um efeito limitado na inflamação/necrose na MASH, não apresenta nenhum efeito nos níveis plasmáticos de triglicerídeos e aumenta os níveis de colesterol LDL.28,45
Ao restaurar a biologia adipocitária normal, a pioglitazona provoca uma mudança radical do tecido adiposo resistente à insulina para um estado de obesidade metabolicamente "saudável" (ou seja, levando a uma sensibilidade à insulina quase normal ou pelo menos significativamente melhorada). De facto, o ganho de peso durante o tratamento com pioglitazona muitas vezes indica uma melhoria na ação da insulina nos tecidos sensíveis à insulina (gordura, fígado, músculos), que está associada a aumento na adiponectina plasmática, redução de AGL plasmáticos, melhoria da inflamação subclínica e redução na gordura visceral.28,45
Vários estudos tentaram estabelecer o papel desta classe farmacológica no tratamento da MASLD/MASH. Um ensaio clínico46 randomizado, duplamente cego, reportou efeitos positivos do saroglitazar (uma glitazona) na melhoria do teor de gordura hepática quantificada por ressonância magnética, resistência à insulina, níveis de ALT e perfil lipídico, em doentes com MASLD. Cusi et al47 concluíram que o tratamento prolongado com pioglitazona em doentes com pré-diabetes ou DM2 levou a melhorias na histologia hepática (esteatose, inflamação e balloning), sem agravamento da fibrose.
Contudo, a utilização destes fármacos na MASLD/MASH permanece controversa. Uma abordagem que está a ganhar ímpeto entre os hepatologistas é a prescrição de pioglitazona em baixa dose (15 mg/dia) e a titulação ao longo do tempo, conforme necessário, nos doentes com MASH. No entanto, a eficácia desta dose, nestes doentes, ainda está por ser estabelecida.28,45
Adicionalmente, a segurança a longo prazo ainda necessita de ser avaliada, estabelecendo também a prevalência de efeito adversos potenciais como a retenção hidrossalina, precipitação de insuficiência cardíaca, fraturas ósseas e cancro de bexiga.8,28,48
EVOLUÇÃO E PROGNÓSTICO
O prognóstico da esteatose não complicada é geralmente bom, principalmente se houver controlo de fatores de risco tais como obesidade e DM2, podendo até assistir à reversibilidade da esteatose. A análise por Younossi et al6 revelou uma incidência de carcinoma hepatocelular em doentes com esteatose não complicada de 0,44/1000 pessoas-ano e de 5,29/1000 pessoa-ano em doentes com MASH.
Conclusão
Esta revisão teve como principal objetivo demonstrar a associação entre MASLD e DM2. A associação fisiopatológica bidirecional entre estas duas entidades é amplamente estudada e conhecida. A existência de fármacos no tratamento da DM2 que possuem capacidades modificadoras de prognóstico na doença cardiovascular e regressão da acumulação de gordura no fígado vai permitir a melhoria de cuidados nestes doentes.















