Introdução
A endometriose é uma doença inflamatória crónica, estrogénio-dependente1, caracterizada histologicamente pela presença de glândulas e estroma do endométrio em localização extrauterina. Estes focos ectópicos de endométrio sofrem proliferação e degradação cíclica semelhantes ao endométrio eutópico, conforme as flutuações hormonais2. Este processo resulta sobretudo em inflamação local e dor, que pode comprometer a anatomia e fisiologia dos órgãos envolvidos, devido à formação de tecido cicatricial e aderências1,3. Esta definição não abrange toda a natureza complexa da endometriose, nas suas possíveis e variadas localizações, expressões sintomáticas, patobiológicas e multissistémicas4.
Embora tenha sido identificada pela primeira vez há mais de 160 anos5, existem ainda lacunas substanciais na sua etiopatogenia. O seu desenvolvimento é atribuído à interação de processos endócrinos, imunológicos, pró-inflamatórios e pró-angiogénicos1,6. É geralmente diagnosticada entre os 30 a 40 anos de idade3, contudo, existe ainda um grande atraso entre o início dos sintomas e a assunção do diagnóstico que tem, em média, 8 a 12 anos7. No caso particular das adolescentes o diagnóstico da endometriose é particularmente difícil e pode ser mal interpretado, mesmo por ginecologistas experientes. A dismenorreia e a dor não menstrual são frequentemente ignoradas nesta faixa etária e embora a endometriose afete a qualidade de vida, existe frequentemente um atraso no diagnóstico, com muitos casos a serem identificados após vários anos.
As dificuldades e erros no diagnóstico da endometriose, bem como o facto de ser assintomática em alguns casos, justificam que não se conheça a sua prevalência com rigor8. Estima-se que afete cerca de 10% das mulheres em idade reprodutiva9 e cerca de 50% dos casos de infertilidade10.
A adenomiose é uma variante da doença, que se caracteriza pela infiltração de células endometriais no miométrio e que frequentemente coexiste com a endometriose11. Atendendo às suas especificidades, não será objeto de abordagem nesta revisão.
A dor e perda de qualidade de vida, bem como a infertilidade, são as características clínicas mais marcantes da doença12. Trata-se de uma doença crónica e recorrente da mulher em idade reprodutiva, por vezes debilitante, com um impacto acentuado em todos os domínios da sua saúde física e mental, afetando a atividade escolar e laboral, a sexualidade e intimidade, a vida familiar e social, e o seu equilíbrio emocional13-15. A melhoria deste quadro passa por abordagens mais rigorosas e eficazes, sendo da maior importância a valorização precoce dos sintomas pelas mulheres e pelos profissionais de saúde16.
Diagnóstico
O diagnóstico precoce da endometriose é crucial para a minimização do impacto da doença na afetação da qualidade de vida da mulher e na fertilidade17.
O diagnóstico histológico implica frequentemente a cirurgia, que é controversa para este objetivo. Houve uma mudança significativa no paradigma do diagnóstico da doença, que assenta em 3 pilares: história clínica da doente com atenção aos sinais e sintomas cíclicos e não cíclicos, exame ginecológico e exames de imagem17.
A dor resistente ao tratamento com analgésicos (ou na toma de anticoncetivos) é o sintoma mais relevante e pode assumir diversas matizes e associações:dismenorreia, dispareunia profunda, disúria, disquesia, dor pélvica crónica, hemorragia rectal dolorosa ou hematúria, dor no ombro, pneumotórax catamenial, tosse cíclica/hemoptise/dor torácica, inchaço e dor cíclica em cicatriz abdominal, fadiga e infertilidade18,19.
O exame ginecológico deve ser exaustivo e dirigido à procura de alterações associadas à endometriose, nomeadamente a visualização de lesões azuladas ou a palpação (minuciosa e profunda) de nódulos nos fundos de saco vaginais, particularmente nos ligamentos útero-sagrados, endurecimento e dor à mobilização dos órgãos pélvicos18. Muitos estudos têm sido publicados sobre a procura de testes laboratoriais e melhoria na acuidade diagnóstica dos meios imagiológicos. A ecografia pélvica (suprapúbica e endovaginal) é o exame mais utilizado. A sua sensibilidade e especificidade no diagnóstico de endometriomas é de 93% e 95%, respetivamente. A sua acuidade diagnóstica é limitada na identificação de lesões peritoneais superficiais, mas melhor nas lesões infiltrativas profundas20-23. A ressonância magnética (RM) não aumenta a acuidade diagnóstica das lesões superficiais, mas é uma mais-valia na caraterização das lesões infiltrativas, podendo estimar a profundidade da invasão, especialmente nas lesões retosigmoideias (91% de sensibilidade e 96% de especificidade) 24-26. A tomografia computorizada (TC) provou ser uma técnica de imagem útil para a endometriose torácica e a RM pode fornecer dados adicionais no envolvimento dos tecidos moles27. A laparoscopia é o ‘gold standard’ mas o diagnóstico deve ser presumido em doentes com sintomatologia que não responde ao tratamento médico, mesmo quando a imagiologia é negativa18.
Vários biomarcadores séricos têm sido estudados como possíveis ferramentas de diagnóstico. O doseamento da glicoproteína MUC-16 (marcador sérico do crescimento epitelial), de interleucinas (IL-6 e IL-8), de citocinas (CCL5 e CCL2), fator de crescimento vascular (VEGF) e do antigénio 19-9 dos hidratos de carbono (CA19-9), foram testados isoladamente ou em combinação, mas não apresentaram sensibilidade e especificidade suficientes para um diagnóstico fiável17. Os microRNAs (miRNAs) são fragmentos de RNAs não codificantes, constituindo-se como marcadores epigenéticos promissores como biomarcadores, porque estão presentes em diversos fluidos humanos e têm perfis de expressão com associação significativa à endometriose28. No estudo ENDO-miRNA foram envolvidas 200 mulheres com dor pélvica sugestiva de endometriose, a quem foi aplicado o teste miRNeasy para deteção do miRNA na saliva. As doentes foram submetidas a cirurgia, 153 confirmaram a doença e 47 não, pelo que foram incluídas no grupo controlo. O teste revelou 96,7% de sensibilidade, 100% de especificidade e 98,3% de área abaixo da curva. Estão em curso mais estudos para sua validação na prática clínica29.
História natural da endometriose
As lesões de endometriose podem ser classificadas em três tipos: endometriose peritoneal superficial (EPS), endometrioma do ovário (EO) e endometriose infiltrativa profunda (EIP) 30. As lesões de EPS podem apresentar-se com três diferentes aspetos, que correspondem às etapas evolutivas da doença: lesões vermelhas que representam a primeira etapa - são lesões altamente vascularizadas e ativas; lesões pretas - representam a etapa seguinte (endometriose avançada); lesões brancas - endometriose quiescente ou latente30. As lesões infiltrativas profundas são definidas como lesões com mais de 5 mm de profundidade de invasão do peritoneu ou infiltração da camada muscular das vísceras ocas. As lesões devem ser classificadas conforme as recomendações consagradas (ver classificações e estadiamento clínico da endometriose) 17,31.
Não há evidência que suporte a progressão ordenada da extensão e gravidade das lesões. Em estudos de cirurgias repetidas as lesões progrediram em 29% dos casos, estabilizaram igualmente em 29% e regrediram em 42% dos casos4. A gravidade dos sintomas não tem correlação com o quadro da doença, nem com a evolução4. Os tratamentos hormonais, cirurgias, gestações, estimulações e punções ováricas para tratamento de infertilidade, afetam o seu desenvolvimento32-34. As lesões cursam com hemorragia cíclica e consequente reação inflamatória35. O refluxo de conteúdo menstrual provoca igualmente inflamação, o que contribui para a dor e infertilidade36,37. Durante cada ciclo menstrual, em função das flutuações hormonais, principalmente dos estrogénios e progesterona, os focos de endometriose transformam-se, reativam as lesões, a reparação tecidular, inflamação, angiogénese e neurogénese locais38. Estabelece-se uma cascata de eventos que envolve alterações epiteliais e mesenquimatosas, alterações na diferenciação fibroblasto-miofibroblasto, produção de colagénio pelas células do endométrio ectópico, metaplasia progressiva das fibras musculares lisas e fibrose39. A progressão histológica para fibrose dos focos de endometriose não é sinónimo de evolução da doença de formas superficiais para formas profundas ou progressão para estádios mais avançados40,41. A evidência sugere que a endometriose não é uma doença proliferativa (ao contrário do cancro), mas sim uma doença que progride ao longo do tempo para fibrose38.
Patogénese da endometriose
A teoria sobre a fisiopatologia da endometriose mais aceite é a da menstruação retrógrada de Sampson17. É suportada por dados que mostram que a maioria das doentes com endometriose têm fluxo menstrual retrógrado e que essa condição, causada por defeitos obstrutivos do canal cervical ou por menstruações abundantes, aumenta substancialmente a prevalência da doença42. Outro elemento igualmente relevante que suporta esta teoria é a distribuição anatómica assimétrica das lesões, por influência da gravidade e dos gradientes de pressão intra-abdominal. Na pélvis, as lesões são mais frequentes do lado esquerdo e no compartimento posterior, ao passo que no tórax e pleura predominam à direita, provavelmente como resultado do movimento intra-abdominal ascendente à direita do fluxo do líquido peritoneal e sua difusão transdiafragmática38.
A metaplasia celómica é outra teoria aceite sobre a génese da endometriose. Fundamenta-se na tese de que a endometriose pode resultar de uma alteração metaplásica no mesotélio do peritoneu, pleura e ovários43,44. Essa transformação é aceite como justificação dos casos raros de endometriose fora da pélvis: gânglios linfáticos abdominais, pulmões, cérebro, membros, cavidade nasal e em casos de agenesia Mülleriana44-46.
A investigação sobre o envolvimento de células estaminais no desenvolvimento da endometriose identificou mais elementos que reforçam essa teoria47. A reprogramação de células estaminais mesenquimatosas multipotentes, derivadas da medula óssea podem permitir a sua diferenciação em células epiteliais e estromais do endométrio em locais ectópicos48,49. Verifica-se que mulheres com endometriose apresentam maior número de células basais/like durante a menstruação, em comparação com mulheres sem a doença e essas células podem diferenciar-se em estruturas endometrióticas50,51. Foram identificados fatores que favorecem o enxerto de células estaminais derivadas da medula óssea na endometriose. A SDF-1 é uma quimiocina envolvida na migração de células estaminais hematopoiéticas e mesenquimatosas. A expressão de SDF-1 é aumentada pelos estrogénios em implantes endometrióticos, que subsequentemente atraem preferencialmente células estaminais para esses implantes52-54. O bloqueio do recetor do SDF-1 (CXC-R4 ou CXC-R7) resulta na inibição do crescimento das lesões em modelos animais, sugerindo que é uma via a explorar no tratamento55. Outro elemento relevante é que células estaminais circulantes foram identificadas num modelo murino, sugerindo que a disseminação hematogénica e linfática pode ocorrer, e contribuir para a génese de lesões distantes da cavidade peritoneal56,57.
O desenvolvimento dos implantes endometrióticos depende da ação do estradiol plasmático de origem gonadal, mas igualmente da produção autócrina nas lesões de endometriose, mediada por enzimas esteroidogénicas, em particular as aromatases58. Outro mecanismo local são as concentrações relativas das isoformas de recetores de estrogénios (RE alfa e RE beta) e isoformas dos recetores da progesterona (RP-A e RP-B). Os tecidos endometriais ectópicos sobreexpressam o RE-beta, com supressão relativa do RE-alfa, o que leva à redução da concentração de RP, que é mediada pelo RE-alfa59-61. Como consequência, o RE-beta promove a sobrevivência celular e perpetua a inflamação. A progesterona normalmente inibe a proliferação endometrial induzida pelos estrogénios, provoca a decidualização do endométrio e atua como agente anti-inflamatório. A resistência à progesterona nos focos de endometriose é uma das limitações à sua ação terapêutica. A proporção da isoforma B (RP-B) com a isoforma A (RP-A) é baixa na endometriose. O RP-A é um repressor dominante do RP-B, que por sua vez é um forte ativador da resposta à progesterona, o que sugere que a resistência à progesterona é parcialmente mediada pela redução do RP-B58. A resistência à progesterona também é afetada por perturbações na metilação do RP-B e do RE- beta60,61. Estes aspetos são da maior importância na resposta ao tratamento com estroprogestativos e progestativos, cuja avaliação seria interessante na prática clínica61.
A resposta imunitária é uma condicionante que emerge com uma importância crescente e que entronca em todas as teorias. As disfunções imunitárias podem justificar que em algumas mulheres as células endometriais se implantem e progridam fora da cavidade uterina e que tal não ocorra noutras mulheres. Há estudos que mostram que em doentes com endometriose há alterações em praticamente todas as células da resposta imunitária, nomeadamente os macrófagos, linfócitos B e T, células natural killer (NK) e citocinas62. Os recetores das NK foram igualmente estudados na fisiopatologia da doença. O aumento na expressão de recetores inibidores, especificamente CD158a+, KIR2DL1, CD94/NKG2A, PD-1, NKB1 e EB6, e a inibição de alguns ligandos, incluindo PD-L1, HLA-E, HLA-G e HLA-I, parecem ser características da fisiopatologia da endometriose63. Também a capacidade dos leucócitos em reconhecer os implantes endometriais pode ser dificultada pela síntese de proteínas, como seja a versão solúvel da molécula de adesão intercelular ICAM-164. É ainda possível que a sobreexpressão de proteínas anti-apoptose e a subexpressão de fatores pró-apoptose comprometam a homeostase peritoneal e acelerem o curso da doença65. À medida que os implantes endometriais ectópicos proliferam, sabe-se que as células imunitárias são atraídas ao local e ocorre uma intensa resposta inflamatória, acompanhada por um aumento de citocinas pró-inflamatórias e angiogénese, bem como a ativação de um mecanismo para a mobilização de fibroblastos e proliferação de tecido conjuntivo, contribuindo para o ciclo de inflamação/fibrose característico da endometriose66. Sabendo-se que todos os tratamentos médicos atualmente disponíveis são baseados em compostos hormonais que impedem a gravidez, as mulheres são confrontadas com a opção de controlar a dor ou tentar engravidar, pelo que a eventual modulação do sistema imunológico por fármacos não hormonais poderá abrir uma importante janela terapêutica no tratamento da doença.
A inflamação é um acontecimento central na patogenia da endometriose4,47. Os estrogénios e as prostaglandinas estimulam-se de forma direta e bidirecional59. As concentrações de citocinas (IL-1β, IL-6, IL-8, fator de necrose tumoral alfa, CCL2, CCL5 e VEGF) estão aumentadas em doentes com endometriose67-69. As plaquetas são outro elemento a considerar no processo inflamatório. São as primeiras células a acorrer a uma lesão sangrante, dando início à hemóstase e ao processo de reparação tecidular, promovendo a inflamação, proliferação e remodelação tecidular39. Estimulam a síntese de moléculas bioativas, incluindo várias citocinas/quimiocinas e fatores de crescimento, incluindo PDGF e TGF-β170. As lesões endometrióticas e as plaquetas estabelecem ligações cruzadas que favorecem o crescimento da lesão, facilitam a sua progressão e a fibrogénese71-72. O líquido peritoneal é um elemento recentemente introduzido na tentativa de compreensão da patogénese da endometriose39,73. Pode considerar-se como componente do sistema imunitário inato. As mulheres com endometriose têm uma concentração mais elevada de linfócitos e de macrófagos ativados no fluido peritoneal, quando comparadas com mulheres sem a doença74,75. Os macrófagos ativados promovem a secreção de fatores de crescimento, incluindo o fator de crescimento dos hepatócitos (HGF) e outras citocinas76-78. Estes mediadores pró-inflamatórios, podem estar envolvidos na expressão e desenvolvimento da doença, quer isoladamente, quer em combinação com os estrogénios73.
A componente genética tem merecido um interesse crescente. Os estudos têm-se centrado nas principais regiões cromossómicas de suscetibilidade em casos de endometriose familiar79. As descendentes de doentes com endometriose têm um risco seis vezes superior de desenvolver a doença. No estudo de gémeas, a hereditariedade é de cerca de 50%4. Os estudos de associação do genoma relataram doze regiões de suscetibilidade, embora estas regiões representem apenas um pouco mais de 4% da hereditariedade80. Outro forte argumento em favor da influência genética reside no facto da origem dos implantes endometrióticos e da endometriose infiltrativa profunda ser consistentemente apontada como monoclonal. Este achado sugere uma alteração inicial cromossómica ou epigenética34. Apesar destes fortes indícios de hereditariedade, os estudos de associação de genes não foram bem-sucedidos na identificação de relação consistente com a endometriose79.
Outra referência recente é a possível relação entre o microbioma e a endometriose. Há sinais de que o microbioma está implicado na imunomodulação e no desenvolvimento de várias doenças inflamatórias81. Um número crescente de estudos em seres humanos e em animais tem revelado alterações no microbioma do intestino, do líquido peritoneal e da vagina em mulheres com endometriose em comparação com controlos saudáveis. Não se conhece se há interação entre esses achados ou se é um elemento acidental82.
Podemos concluir que, a etiologia e desenvolvimento da endometriose é complexa e multifatorial. Envolve a interação de processos endócrinos, inflamatórios, angiogénicos e imunológicos não completamente esclarecidos na sua importância relativa e interação4.
Tratamento
O tratamento da endometriose deve ser concebido numa estratégia de longo prazo e ter como objetivos centrais o controlo sintomático, a melhoria da qualidade de vida da doente e o controlo da doença, sem esquecer o projeto de fertilidade, que deve fazer parte da equação, mesmo quando não é emergente17,38.
A estratégia de tratamento deve ser partilhada com a doente, no contexto da sua situação clínica - idade, expressão sintomática, extensão e localização das lesões, fertilidade, repercussão sistémica da doença, tratamentos anteriores e custos, com ponderação dos objetivos de curto e longo prazo38.
De uma forma geral, o controlo sintomático é o alvo fundamental do tratamento, pelo que é consensual que se recomende a prescrição de um tratamento médico em primeira linha, sem a necessidade de confirmação histológica prévia, com exceção das doentes em que haja suspeita de malignidade de tumor do ovário e casos de compromisso de função de outros órgãos, tais como infiltração do intestino ou ureter com sinais de repercussão na função renal18,38.
Tratamento médico
O tratamento ideal deveria ser capaz de curar, controlar a sintomatologia, resolver a infertilidade e ter um perfil de segurança aceitável4,38. Tal idealização não é atingida. Aproximadamente 50% das mulheres com endometriose têm sintomas recorrentes durante o período de 5 anos, independentemente do tipo de tratamento4. Deve ser seguida uma abordagem personalizada e de longo prazo18.
Anti-inflamatórios não esteroides
O uso de anti-inflamatórios não esteroides (AINEs) e/ou outros analgésicos para o controlo da dor, administrados de forma isolada ou associados a outros fármacos pode ser inicialmente recomendada (ex. neuromoduladores com ação central) 18. A evidência que suporta a sua utilização é escassa, limitada a um pequeno ensaio clínico randomizado83. Têm uma ação anti-inflamatória que pode ser útil quando usados após cirurgia e associados a tratamentos hormonais, podendo eventualmente prevenir complicações da dor crónica, por sensibilização periférica e central18,84.
Tratamento hormonal
O tratamento hormonal fundamenta-se na preposição de que a endometriose é uma doença estrogénio-dependente, visando assim a supressão sistémica e local dos estrogénios, inibição da proliferação tecidular, da inflamação, ou de ambos4.
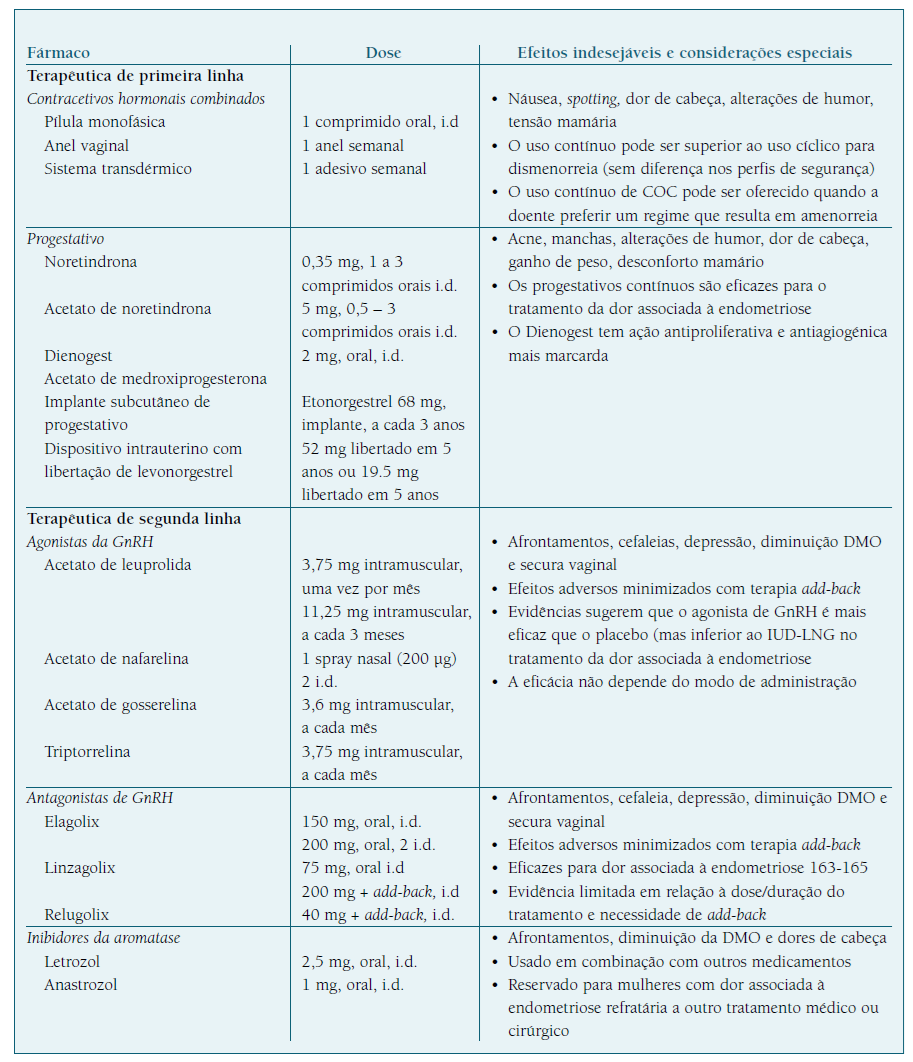
Estão incluídos neste grupo: progestativos, estroprogestativos, agonistas e antagonistas da hormona libertadora das gonadotrofinas (GnRH), danazol e inibidores da aromatase (os dois últimos são raramente recomendados) 18. Há autores que incluem neste grupo as técnicas de procriação medicamente assistida, que não abordaremos38.
Os tratamentos hormonais são eficazes no controlo dos sintomas, tendo demostrado uma eficácia em 60% a 80% dos casos (Quadro I) 18. A sobreexpressão da aromatase nas lesões de endometriose e consequente síntese de estradiol levaram ao uso off-label de inibidores de aromatase para mulheres com sintomas resistentes ao tratamento hormonal. No entanto, o uso a longo prazo é restrito devido à perda de massa óssea e efeitos adversos intensos85. Em casos raros, nas doentes refratárias ao tratamento com contracetivos orais combinados (COC) e progestativos, pode considerar-se o uso de danazol e inibidores de aromatase, com as limitações referidas86. Temos em alternativa os agonistas da GnRH e mais recentemente os antagonistas, melhor aceites e com maior segurança, sobretudo quando associam terapêutica add-back87.
Estroprogestativos e progestativos
Os COCs e os progestativo isolados, são amplamente utilizados como primeira linha de tratamento da dismenorreia e da dor pélvica crónica, com ou sem endometriose presumida88. Devido ao seu baixo custo, facilidade de administração e tolerância, estes medicamentos têm sido usados com sucesso em mulheres com endometriose. Três revisões sistemáticas da literatura reportam a eficácia dos contracetivos orais na redução significativa da dor associada à endometriose e melhoria na qualidade de vida89-91. O tratamento contínuo demonstrou ter melhor controlo da dor do que a administração cíclica convencional92,93. Os fatores limitantes da sua eficácia de longo prazo, são a falta de compliance, risco de tromboembolismo (TVE) e altas taxas de recorrência após a descontinuação. As combinações com 20 µg de etinilestradiol em comparação com 30 µg apresentam menor risco teórico de TEV e são atualmente mais recomendadas88, mas não há evidência que o demonstre88,90,94.
A utilização de um progestativo isolado mostrou ser eficaz, sendo uma opção para mulheres com contraindicação aos estrogénios. Estão disponíveis em diferentes apresentações: comprimidos, implante subcutâneo, dispositivos intrauterinos e injetáveis85. O dienogest é dos progestativos mais usados em mulheres com endometriose e o único aprovado em Portugal para o tratamento da endometriose. Oferece uma alternativa eficaz e bem tolerada. Um estudo realizado em Portugal confirma os achados verificados noutras investigações: aos 6 meses de tratamento 78,7% das doentes referiram melhoria significativa no controlo da dor; 85,1% sentiram mais energia; 72,3% aumentaram a sensação de bem-estar; 63,6% sentiram-se mais confortáveis nas relações sociais e 53,2% melhoraram a autoimagem94. Pode ser usado isoladamente ou como adjuvante da cirurgia95. A utilização de dienogest tem também impacto positivo sobre o endometrioma, reduzindo as suas dimensões, podendo mesmo evitar a cirurgia em alguns casos96.
Agonistas da GnRH
Outra opção de tratamento médico, de 2.ª linha, são os agonistas da GnRH88. Esta classe de medicamentos suprime substancialmente os níveis sistémicos de estrogénios, conduzindo a efeitos indesejáveis associados ao hipoestrogenismo, semelhantes aos da menopausa, incluindo perda de massa óssea. A associação de estroprogestativos ou tibolona, em baixas doses, controla esses efeitos adversos e melhora a adesão da doente ao tratamento88.
Antagonistas da GnRH
Os antagonistas da GnRH integram as recomendações de segunda linha para o tratamento da sintomatologia associada à endometriose88. O desenvolvimento de antagonistas da GnRH, orais, com semividas curtas, doses variadas e um perfil de segurança adequado representa uma alternativa farmacológica de relevo97. O elagolix foi o primeiro antagonista oral da GnRH desenvolvido, sendo objeto de um ensaio randomizado que comparava a administração de 150 mg 1 i.d, com 200 mg 2 i.d. e placebo98. A redução da dismenorreia e da dor pélvica não menstrual foram significativas logo após um mês de administração do fármaco e foram mantidas após 6 meses (46,4% de redução na dose mais baixa e 75,8% na dose mais alta). Mais de 70% das mulheres em cada grupo de estudo relataram pelo menos um evento adverso, com uma incidência significativamente maior entre as que receberam a dose mais alta de elagolix. Os eventos adversos relatados com mais frequência foram afrontamentos, cefaleias e náuseas98.
Existem ainda mais dois antagonistas de GnRH orais: o linzagolix e o relugolix97. O linzagolix foi avaliado em 2 ensaios randomizados com a administração diária de 75 mg, num grupo, 200 mg + terapêutica add-back (1 mg de estradiol e 0,5 de acetato de noretisterona) noutro grupo, ambos comparados com placebo. Às 24 semanas o grupo com a dose mais baixa revelou uma melhoria da dismenorreia de 49,5% e da dor pélvica não cíclica de 52,2%; as doentes que fizeram a dose mais elevada de 200 mg combinada com add-back, mostraram melhoria da dismenorreia em 80% dos casos e em 57,1% da dor não cíclica. A baixa da densidade mineral óssea (DMO) foi em média inferior a 1%, para as 2 doses e os efeitos adversos foram observados em pouco mais de 5% das doentes que fizeram o tratamento: dores de cabeça (10,5%, 8,1% e 8,0%), afrontamentos (6,8%, 7,5% e 2,5%) e fadiga (6,8%, 3,8% e 2,5%) nas que fizeram 200 mg de linzagolix + add-back, 75 mg de linzagolix ou placebo, respetivamente99.
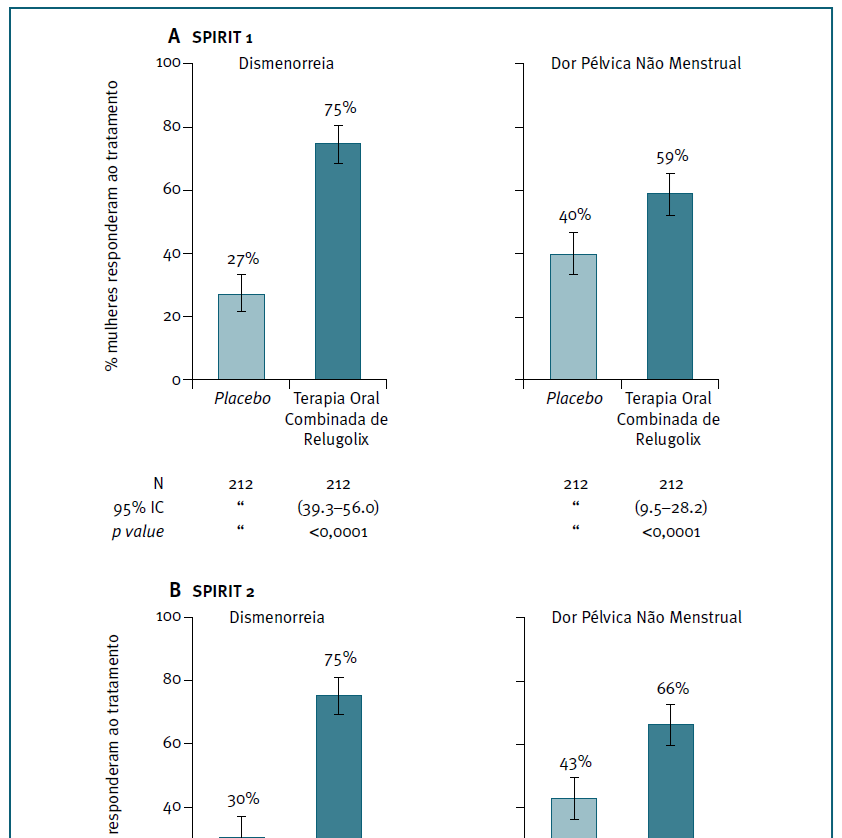
O relugolix é outro antagonista oral da GnRH, que bloqueia de forma reversível e é dose-dependente dos recetores da GnRH100. Num estudo de fase 2, na dose de 40 mg demonstrou eficácia semelhante a um agonista da GnRH (Leuprolide) no controlo da sintomatologia das doentes com endometriose, mas mantendo os efeitos adversos decorrentes do hipoestrogenismo induzido101. A terapêutica combinada foi desenvolvida numa formulação com 40 mg de relugolix associado à terapêutica add-back (1 mg de estradiol e 0,5 mg de acetato de noretisterona) de modo a otimizar a eficácia e segurança, com melhor compliance. Nos ensaios clínicos em mulheres com sintomatologia associada aos miomas uterinos, observou-se supressão da produção de gonadotrofinas, da esteroidogénese ovárica e da ovulação, e se associada à terapêutica add-back os níveis de estrogénios circulantes eram semelhantes aos do início da fase folicular102. Esta combinação terapêutica foi avaliada no tratamento de doentes com endometriose em 2 ensaios clínicos randomizados e duplamente cegos (SPIRIT 1 e 2), realizados em países de todos os continentes. Na avaliação às 24 semanas, 75% das doentes referiram redução significativa da dismenorreia nos 2 estudos; 59% sentiram redução significativa da dor pélvica não associada à menstruação no SPIRIT 1 e 66% no SPIRIT 2 (Figura 1); a dispareunia teve redução significativa em 40% das doentes e o uso de analgésicos baixou consideravelmente: 69% das doentes do estudo 1 e 76% das doentes do estudo 2 usavam analgésicos no início do estudo, mas às 24 semanas com relugolix + add-back apenas 44 % e 46% respetivamente, precisavam de o fazer. A incidência de efeitos adversos foi semelhante ao placebo e a perda de massa óssea foi, em média, inferior a 1% e não progrediu ao longo do tratamento102. O estudo “SPIRIT open-label extension” avaliou a segurança do tratamento a 2 anos com relugolix associado à terapêutica add-back, em mulheres com dor moderada a grave associada à endometriose. Verificou-se que, até ao período avaliado, esta terapêutica melhorou a dor menstrual e não-menstrual, dispareunia e função em mulheres com endometriose, constatando-se que após um declínio inicial <1%, a densidade mineral óssea média permaneceu estável com o tratamento continuado103.
Medicamentos emergentes
Outros fármacos são emergentes no tratamento da endometriose. São exemplo os moduladores seletivos dos recetores de estrogénios ou da progesterona, os anti-angiogénicos, antioxidantes, imunomoduladores e os agentes epigenéticos, para os quais temos de aguardar por ensaios clínicos robustos38.
Tratamento cirúrgico
O paradigma da cirurgia como opção terapêutica de 1.ª linha já não faz sentido, na medida em que a comprovação histológica da doença não é necessária para justificar o início do tratamento médico. Para além do caráter invasivo, não se podem desvalorizar os inconvenientes de um tratamento cirúrgico precoce, para uma doença crónica que vai requerer uma estratégia terapêutica de longo prazo38.
A cirurgia pode ser conservadora ou definitiva conforme a situação especifica da doente, idade, projeto reprodutivo, objetivos de curto prazo e de prazo mais alargado. É imperativa quando há suspeita de malignidade nas massas anexiais e quando há compromisso na função de outros órgãos (reto, bexiga, rim), devendo ser realizada em centros de referência e com uma equipa multidisciplinar, que inclua além do ginecologista com experiência em cirurgia de endometriose, outras especialidades como a cirurgia geral colo-retal e urologia38. O objetivo da cirurgia é a destruição ou remoção o mais completa possível do endométrio ectópico e aderências. As diretrizes da ESHRE e NICE recomendam igualmente que se considere a cirurgia como opção de tratamento para reduzir a dor intensa associada à endometriose, refratária ao tratamento médico, ou quando o tratamento médico está contraindicado ou não seja aceite pela doente88,104. Contudo, as evidências que suportam o tratamento cirúrgico para o alívio da dor são escassas e objeto de debate85,105. Uma revisão sistemática de avaliação do efeito da cirurgia laparoscópica no índice geral de dor e na qualidade de vida das doentes operadas por endometriose é inconclusiva, devido à baixa qualidade dos estudos106. Outra possível indicação da cirurgia é no contexto de uma estratégia de tratamento para a infertilidade107, no entanto a cirurgia dos endometriomas do ovário requer particular atenção devido ao risco de danos potenciais na reserva ovárica e fertilidade futura, com destaque para os casos de quistos bilaterais107. O dogma de que, nestes casos, a quistectomia laparoscópica deve ser a opção terapêutica sistemática de primeira linha é discutível38,108. A quistectomia tende a oferecer melhores resultados que a drenagem, mesmo quando associada à electrocoagulação ou vaporização por LASER do leito do quisto, sobretudo quando são maiores que 3 cm de diâmetro18.
A laparoscopia pode ser uma opção de tratamento para a infertilidade associada à endometriose no estádio I/II uma vez que melhora a taxa de gravidez espontânea. No que respeita às lesões de endometriose profunda, a cirurgia laparoscópica pode igualmente representar uma opção de tratamento, em pacientes sintomáticas que desejem engravidar18. A cirurgia continua a ter um lugar insubstituível em algumas situações clínicas, mas deve ser realizada em centros diferenciados38.
No caso de ser equacionada cirurgia e se existir risco de impacto desta sobre os ovários, a doente deve ser aconselhada sobre a preservação da fertilidade e a discussão deve incluir opções de criopreservação de embriões ou de oócitos. Relativamente a esta última, os dados apoiam a criopreservação de 10-15 oócitos em mulheres abaixo dos 35 anos e mais de 20 para as que têm acima de 35 anos, para uma hipótese realista de conseguir um ou mais nados vivos. De referir, contudo, que apesar da evidência favorável à criopreservação de oócitos, na doente jovem com indicação cirúrgica por endometriose em estádios avançados, é prematuro recomendar o seu uso generalizado em todas as doentes com endometriose, tendo em conta que não existem estudos conclusivos sobre a eficácia da criopreservação de oócitos especificamente em pacientes com endometriose, falta conhecimento a longo prazo sobre a qualidade dos oócitos vitrificados, e falta estabelecer uma relação custo-eficácia da criopreservação109.
Uma das questões em aberto prende-se com a utilização da terapêutica hormonal antes e/ou após o tratamento cirúrgico. As evidências revelam que a prescrição de tratamento hormonal antes da cirurgia não melhora os resultados e que a sua prescrição pós-operatória pode ser benéfica para as mulheres que não desejem engravidar94.
Tratamento holístico
O impacto da doença a nível pessoal é, por vezes, altamente comprometedor da qualidade de vida da mulher e família. A dor crónica associada à endometriose é o resultado de sinais periféricos dos órgãos pélvicos e extrapélvicos integrado num processo dinâmico com uma interação complexa entre redes neuronais amplificadoras da sensibilidade central110. A dor também é afetada por influências emocionais, hormonais e outras de natureza física e ambiental111,112. As mulheres com dor pélvica crónica devem receber cuidados multidisciplinares, por especialistas em dor, fisioterapeutas, psicólogos, nutricionistas, além do ginecologista4. No entanto, é importante alertar as mulheres que as evidências disponíveis não apoiam o uso de “medicinas alternativas” ou suplementos para o tratamento da endometriose, ainda que algumas técnicas, como é o caso da acupunctura possam ser úteis no alívio da dor104. Segundo alguns autores as intervenções nutricionais podem ser úteis no controlo da dor associada113. É referido que o consumo de gorduras polinsaturadas, de ácido palmítico e de carne vermelha está associado a um risco acrescido de endometriose e de agravamento da sintomatologia da doença, enquanto os alimentos de origem vegetal, em particular as fibras, os antioxidantes e a vitamina D podem ter efeitos úteis no tratamento e no alívio da dor. Refira-se que os estudos não têm o rigor necessário para se extrair recomendações fundamentadas114.
Conclusão
A endometriose é uma doença muito heterogénea. A dor pélvica é o sintoma mais alarmante e problemático. A abordagem inicial baseia-se no diagnóstico precoce através do diagnóstico clínico, com a utilização criteriosa da imagiologia, sem a necessidade de comprovação histológica das lesões. A identificação de marcadores moleculares fiáveis para o diagnóstico será seguramente um avanço considerável. A patogénese é complexa e multifatorial, mas os estrogénios desempenham um papel central na evolução da doença, interagindo com um vasto leque de agentes que modulam a reação hormonal, inflamatória, imunológica e nociceptiva. A abordagem terapêutica deve ser holística, numa perspetiva global da doente. O tratamento tem como objetivo central o controlo da proliferação do endométrio ectópico, consequentemente do sangramento e da cascata de consequências, de que a dor, a infertilidade e o envolvimento e compromisso de função de órgãos não ginecológicos são as expressões mais dramáticas. O tratamento médico deve ser de eleição, salvo quando a cirurgia é imperativa, por suspeição de malignidade, sintomatologia incontrolável, invasão e compromisso de outros órgãos, ou no contexto de tratamento de infertilidade em situações especificas. Os progestativos e os estroprogestativos são de 1.ª linha. Contamos atualmente com novos agentes terapêuticos, nomeadamente os antagonistas da GnRH que oferecem uma alternativa eficaz, segura e de longo prazo, o que constitui mais uma opção para as doentes, no contexto do tratamento prolongado de uma doença que é crónica. O planeamento terapêutico deve ser de longo prazo, de modo a otimizar os benefícios e minimizar os riscos, nomeadamente o de cirurgias repetidas. O objetivo central deve ser a melhoria consistente da qualidade de vida global da doente, colocando-a no centro da decisão, considerando a sua opinião, os seus valores, os seus projetos de vida, nomeadamente no que concerne à fertilidade.