Introdução
Com uma incidência anual de 1:100.000, os schwannomas vestibulares (SV) representam 6-7% de todos os tumores intracranianos e 90% de todas as lesões localizadas no ângulo pontocerebeloso (APC).1 São tumores neuroectodérmicos com origem nas células de Schwann de um dos ramos vestibulares do nervo vestibulococlear, daí o termo schwannoma vestibular. (2 Os SV apresentam habitualmente um crescimento lento ao nível do canal auditivo interno (CAI), APC, cóclea e/ou labirinto. Tumores maiores podem comprimir o tronco cerebral. (1
Os sintomas de apresentação mais comuns são a perda auditiva progressiva (90%) e o zumbido (>60%). Desequilíbrio, tonturas ou vertigem podem também ocorrer. Até 12% dos doentes podem apresentar alteração da sensibilidade facial devido à compressão do nervo trigémeo e até 6% podem apresentar uma parésia do nervo facial, habitualmente, em doentes com SV maiores. A cefaleia ocorre como consequência da hidrocefalia ou em tumores de maiores dimensões que provoquem maior compressão das estruturas envolventes. (2,3
As escalas mais utilizadas para a classificação do tumor de acordo com as suas dimensões são as de House4 , Koos2 e Samii5. Na decisão terapêutica, além das dimensões, são tidos em consideração, entre outros fatores, a velocidade de crescimento do tumor, o grau de audição útil, a idade e as comorbilidades do doente. A probabilidade de ressecção total do tumor com preservação da função auditiva e do nervo facial também devem ser levados em consideração. A preferência e escolha do doente, corretamente informado, é também um fator relevante na decisão final do tratamento ou da decisão entre os vários tratamentos ou as diferentes abordagens cirúrgicas nesta patologia. (1
As três principais opções de tratamento para doentes com SV esporádico são a vigilância ou espera vigilante, também chamada de “wait and scan”; a cirurgia; e a radiocirurgia estereotáxica (RCE). (6 A maioria dos doentes com tumores pequenos e médios apresenta altas taxas de controlo do tumor e excelentes resultados do nervo facial, independentemente da modalidade de tratamento. (7
O objetivo deste trabalho é o de reportar a experiência do Hospital Egas Moniz na abordagem diagnóstica, decisão terapêutica e seguimento dos doentes com schwannoma vestibular esporádico, tratados entre 2007 e 2021.
Material e Métodos
Estudo retrospetivo dos doentes com neurinoma do acústico (shwannoma vestibular) tratados no Hospital de Egas Moniz entre 2007 e 2021.
Foi feita uma pesquisa inicial dos doentes na base de dados informática dos doentes da instituição Sonho®, para o período de 2007 a 2021 (15 anos) utilizando os vários códigos diagnósticos possíveis para identificar os shwannomas vestibulares esporádicos, na Classificação Internacional de Doenças (9ª e 10ª revisões) (Tabela 1).
Tabela 1: Códigos diagnósticos ICD9 e ICD10 utilizados na pesquisa:
| 225 | NEOPLASIA BENIGNA DO ENCEFALO E DE OUTRAS PARTES DO SIST.NERVOSO |
| 2251 | NEOPLASIA BENIGNA DOS NERVOS CRANEANOS |
| 3529 | TRANSTORNOS NAO ESPECIFICADOS DOS NERVOS CRANIANOS |
| 3885 | TRANSTORNOS DO NERVO ACUSTICO |
| 9515 | LESAO DO NERVO ACUSTICO (OITAVO PAR) (NERVO AUDITIVO) |
| 23773 | SCHWANOMATOSE |
| 38916 | SURDEZ SENSORIAL, ASSIMETRICA |
| D333 | Neopl benigna nervos cranianos |
| H90A21 | Surdez neuro-sensorial, unil, ouvido DIR, c/audição LM no lado contral |
| H90A22 | Surdez neuro-sensorial, unil, ouvido ESQ, c/audição LM no lado contral |
| H933X1 | Patolo nervo acústico DIR |
| H933X2 | Patolo nervo acústico ESQ |
| H933X9 | Patolo nervo acústico NE |
| R42 | Tonturas e vertigens |
| S0461XA | Lesão nervo acústico, lado DIR, AI |
| S0462XA | Lesão nervo acústico, lado ESQ, AI |
A pesquisa inicial identificou 111 processos clínicos que foram consultados e analisados. Desses, foram excluídos 32 processos pelas seguintes razões: 23 por terem diagnósticos diferentes (6 schwannomas do nervo facial, 5 neoformações do gânglio geniculado, 3 neurofibromatoses tipo 2, 3 paralisias faciais iatrogénicas, 2 paralisias de Bell, 2 meningiomas, 1 colesteatoma do ápex petroso e 1 schwannoma do nervo trigémeo) e 9 por apresentarem informação clínica insuficiente ou por terem perdido o seguimento. A amostra final analisada foi de 79 doentes.
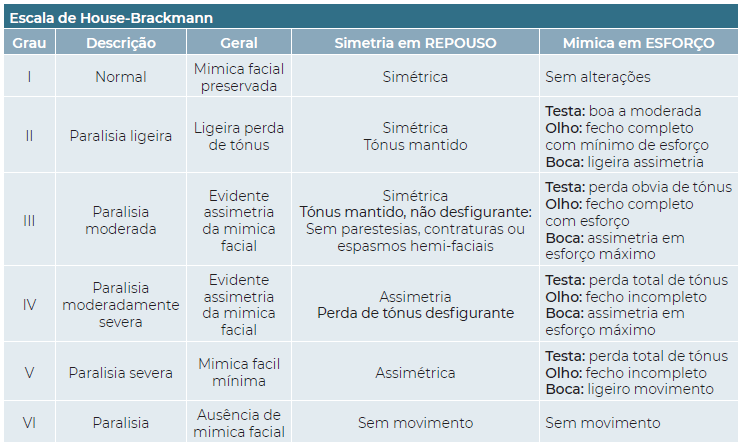
Foram consultados os respetivos processos clínicos dos 79 doentes e, depois de anonimizados, foram recolhidos os seguintes dados demográficos e clínicos: idade, sexo, lateralidade da lesão, principal sintoma de apresentação, outros sintomas, grau de perda de audição, grau de paralisia facial. Para o registo destas manifestações foram usadas, sempre que disponíveis, escalas internacionais validadas, tais como a proposta pela American Academy of Otolaryngology-Head and Neck Surgery para classificar a perda auditiva do ouvido afetado a partir do audiograma tonal (limiar tonal médio) e vocal (discriminação da fala máxima) (Figura 1), a escala usada para classificar o acufeno de acordo com o Consenso proposto na 7ª Conferência Internacional do Neurinoma do Acústico relativamente aos SV esporádicos (Figura 2), a escala usada para classificar o desequilíbrio de acordo com a mesma fonte (Figura 3), ou a escala de House-Brackmann, usada universalmente para classificar a severidade da paralisia facial e também reconfirmada no Consenso proposto na 7ª Conferência Internacional do Neurinoma do Acústico (Figura 4)
Quanto à classificação do tumor de acordo com as suas dimensões identificadas na ressonância magnética (RM), foi usada a escala de Samii. (Figura 5, que sumariza as várias classificações e sua correspondência).
Foram definidos como os outcomes principais do estudo os seguintes: grau de resseção do tumor (total; quase total; ou subtotal); perda de audição no pré-operatório e no pós-operatório imediato; e grau de paralisia facial no pré-operatório, no pós-operatório imediato e no seguimento a 1 ano.
Todos estes dados tiveram uma análise estatística realizada usando a versão 26 do programa IBM SPSS statistics. Os testes de qui-quadrado (X2) com respetivos ajustes foram usados na avaliação estatística entre variáveis não quantitativas - o teste de Fisher e a correção de Monte Carlo foram utilizados respetivamente nas análises de tabelas 2x2 ou >2x2, quando os requisitos da frequência esperada não foram cumpridos. As variáveis quantitativas, depois de excluída uma distribuição normal, foram avaliadas com os testes de Kruskall-Wallis e Mann-Whitney e Spearman.. O valor de p < 0.05 foi considerado estatisticamente significativo.
Foram seguidos todos os procedimentos éticos recomendados pela Declaração de Helsínquia da Associação Médica Mundial e todos os dados foram previamente anonimizados e tratados de forma anonimizada.
Resultados
Baseline: Trinta (38%) doentes eram do sexo masculino e 49 (62%) do sexo feminino. Trinta e cinco (44%) doentes apresentaram tumor no ouvido direito e 44 (56%) doentes no ouvido esquerdo. A média da idade foi de 59 anos e a mediana de 61 anos.
O sintoma de apresentação mais comum foi a hipoacusia unilateral progressiva, registada em 61 (77%) doentes. Sete (9%) doentes apresentaram-se com um quadro de surdez súbita.
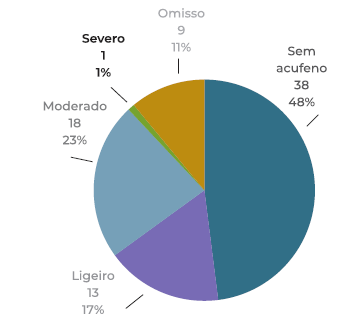
Relativamente ao acufeno, 38 (48%) dos doentes não apresentaram este sintoma e em 9 (11%) doentes não se encontrou qualquer informação clínica. Em 13 (17%) o acufeno era ligeiro, em 18 (23%) doentes era moderado e em 1 (1%) doente era severo. (Figura 7)
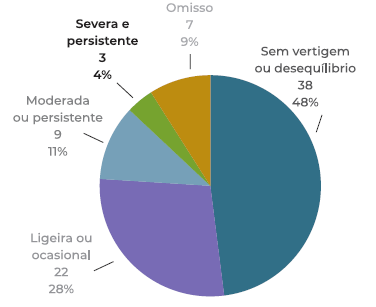
No que toca ao desequilíbrio ou vertigem, 38 (48%) doentes não apresentaram este sintoma e em 7 (9%) doentes não se encontrou informação clínica relevante. Em 22 (28%) doentes o desequilíbrio era ligeiro ou ocasional, em 9 (11%) doentes era moderado ou persistente e em 3 (4%) doentes era severo e persistente. (Figura 8)
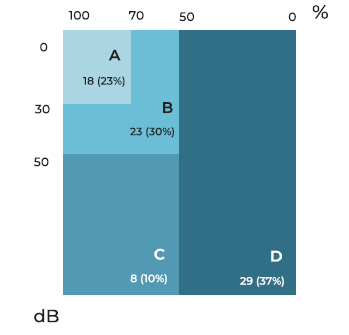
No que respeita ao défice auditivo, 18 doentes (23%) apresentaram-se com grau A, 23 doentes (30%) com grau B, 8 doentes (10%) com grau C e 29 doentes (37%) com grau D. (Figura 9)
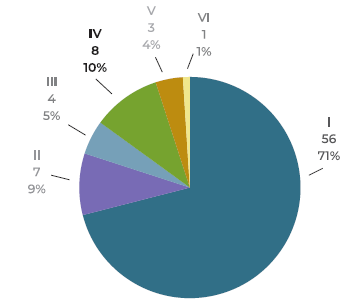
Relativamente à mímica facial, 56 (71%) doentes apresentaram-se com grau I na escala de House-Brackmann, 7 com grau II, 4 com grau III, 8 com IV, 3 com V e 1 com VI. (Figura 10)
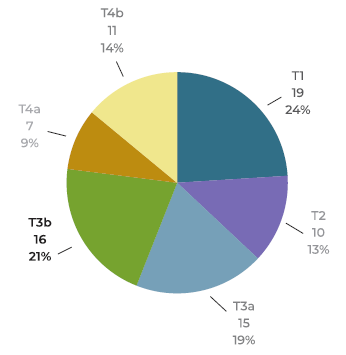
Segundo a classificação Samii, 19 doentes (24%) doentes apresentaram-se com um estadiamento T1, 10 (13%) com T2, 15 (19%) com T3a, 16 (21%) com T3b, 7 (9%) com T4a e 11 (14%) com T4b. (Figura 11)
Tratamento: A decisão inicial foi de espera vigilante (wait-and-scan) em 61 (51%) doentes, de tratamento cirúrgico em 16 (20%) doentes, e 1 (1%) doente realizou radiocirurgia logo na altura do diagnóstico (por opção do doente).
Dos 61 doentes em que se optou por wait-and-scan inicial, por crescimento durante o seguimento, 21 acabaram por ter de ser intervencionados cirurgicamente, e em 2 doentes realizou-se radiocirurgia.
Das 37 cirurgias foram realizadas 3 vias de abordagem na seguinte proporção: 22 vias retrosigmoideias (60%), 12 vias translabirínticas (32%) e 3 vias da fossa média (8%). (Tabelas 2,3 e 4)
Avaliação: Relativamente à resseção do tumor, dos 25 doentes com informação clínica adequada, verificou-se uma excisão total do tumor em 2 (18%) das 11 abordagens translabirínticas. E um excisão quase total em 5 doentes, 3 (27%) das 11 abordagens translabirínticas, 1 (9%) das 11 abordagens por via retrosigmoideia e 1(33%) das 3 abordagens por via da fossa média. Os restantes 18 doentes ficaram com doença residual.
Não foi encontrada diferença estatisticamente significativa (p>0,05) na prevalência da paresia facial entre as várias abordagens, até cerca de 1 ano após a cirurgia. A prevalência de uma paresia superior a grau 3 foi de 33,3%, 27,3% e 66,7% nas abordagens translabiríntica, retrosigmoideia e fossa média, respectivamente.
Verificou-se uma correlação positiva moderada, estatisticamente significativa (rs = 0,446, p<0,05), entre o grau de perda auditiva antes do tratamento cirúrgico e o tamanho do tumor. Todos os 12 doentes com uma abordagem translabiríntica ficaram cofóticos. Na via da fossa média, 2 dos 3 doentes eleitos para esta abordagem com audição útil, também ficaram cofóticos. Através da via retrosigmoideia, apenas 9 desses 22 doentes tinham audição útil. Destes 9 com audição útil, só 2 ficaram com audição preservada.
Discussão
A forma de apresentação clínica dos SV mais comum na nossa série foi a hipoacusia unilateral progressiva, presente em 61 (77%) doentes deste estudo.
A idade média de diagnóstico situou-se aproximadamente nos 50 anos. Um maior acesso a exames audiológicos e de imagem, associado a uma suspeição nos doentes com critério (surdez súbita; surdez sensorineural unilateral ou assimétrica) permite que sejam diagnosticados cada vez mais tumores, de menores dimensões e em idades mais avançadas em que tradicionalmente os diagnósticos não eram realizados. (8
Nesta amostra houve uma distribuição grosseiramente equitativa entre os graus de audição. O grau D (já com perda de discriminação da fala), com maior número de doentes, justifica-se pela tendência de agravamento da audição com a história natural da doença.
O acufeno esteve presente em 34 (41%) dos doentes, com diferentes graus de intensidade. O acufeno unilateral é o segundo sintoma auditivo mais comum, presente desde 12% a 60% dos doentes, frequentemente acompanhados de sintomas inespecíficos compatíveis com plenitude auricular. (9,10,11,12
Apesar deste tumor se desenvolver a partir de um dos nervos vestibulares, as queixas vestibulares não são comuns, uma vez que o crescimento lento permite uma adaptação por mecanismos centrais ao défice vestibular progressivo crónico desenvolvido. Aproximadamente, metade dos doentes (48%) não apresentaram sintomas de vertigem ou tonturas no nosso estudo.
Apesar da surdez súbita ser uma forma de apresentação pouco frequente, foi encontrada em 7 (9%) doentes. Esta forma menos frequente de apresentação, manifesta-se em 2% a 7 % dos doentes, sobretudo em tumores de menores dimensões ainda limitados ao CAI. (9,10,13,14
Em 61 doentes (51%), optou-se inicialmente por uma abordagem conservadora (wait-and-scan) mas, no seguimento, cerca de metade destes, 23, acabaram por ter uma decisão de tratamento, por cirurgia ou radiocirurgia, pois tornaram-se sintomáticos ou adquiriram dimensões e crescimentos demasiado agressivos.
A literatura relata que a proporção de tumores que crescem durante o follow-up varia consideravelmente entre 30-70% ao longo de diferentes períodos. Esta variação pode dever-se aos métodos e critérios utilizados no seguimento. (15, 169 Segundo uma revisão sistemática da literatura, que incluiu cerca de 6,000 doentes em 53 artigos de 1984 a 2014, demostrou-se uma média de crescimento de 33% para tumores pequenos e médios, com um follow-up de 3,3 anos. (7 Outros estudos identificaram um crescimento de 50% dos tumores ao longo de 5 anos. (17,18,19
Após o diagnóstico é imprevisível saber quanto e até quando o tumor pode crescer, não havendo aparente relação com fatores clinico-demográficos como a idade, sexo, tamanho do tumor ou sintomas quando do diagnóstico. O crescimento pode ser contínuo, mas também pode só acontecer depois de um período de inatividade. Tumores com características quísticas costumam ter crescimentos maiores e mais rápidos. (20
A vigilância apertada dos SV com RM seriadas e exames audiológicos (espera vigilante ou wait and scan) é considerada uma estratégia apropriada nos SV esporádicos e assintomáticos (grau de recomendação III, nível de evidência C). (21 O crescimento médio de SV esporádicos é 1,1 mm/ano em diâmetro. (22 Numa abordagem conservadora, existem estudos que demonstram que um crescimento maior que 2,5 mm/ano tem significativamente maior taxa de perda auditiva comparativamente com taxas de crescimento menores, 75% e 32%, respetivamente, com um período de follow-up de 26 a 52 meses. (23 No nosso estudo, a idade, a clínica e crescimento maior ou igual 2,5mm/ano, foram fatores de decisão terapêutica, principalmente em tumores borderline.
Como alternativa à espera vigilante nos doentes com tumores pequenos e assintomáticos (Koos I e II, Samii T1-T3a), a Radiocirurgia Estereotáxica (RCE) é considerada válida, por parar o crescimento do tumor e preservar a função do nervo a longo prazo. No entanto, existe um pequeno risco dessa deterioração acontecer, afetando a qualidade de vida do doente. (grau de recomendação II, nível de evidência B)
A Radiocirurgia Estereotáxica é uma modalidade terapêutica não invasiva que utiliza a administração, de uma só vez ou em várias sessões, de uma fracção de alta dose de radiação externa com uma extrema precisão a alvos bem localizados e com limites bem definidos, geralmente intracranianos. Uma característica fundamental desta técnica e que a distingue da radioterapia externa (RTE) convencional é a obtenção de um elevado gradiente de dose para além dos limites da lesão, isto é, uma poupança máxima de irradiação dos tecidos normais vizinhos adjacentes às lesões, devido à utilização de múltiplos feixes centrados no alvo. (24
A maioria das séries na passada década, reportam controlo do tumor em 92 até 98% com um período de seguimento entre 3 a 10 anos. (25-30 Há uma tendência á perda de audição progressiva após a RCE: um estudo com 44 doentes com SV que apresentavam audição útil e foram tratados entre 1997 e 2002, com um follow-up de 9,3 anos, tiveram taxas de audição útil de 80, 55, 48, 38 e 23% aos 1, 3, 5, 7 e 10 anos, respetivamente. (31
No nosso estudo, todos os doentes eleitos para RCE possuíam audição útil. Um deles tinha um tumor (Koos III - Samii T3b) que se optou por tentar controlar o crescimento com RCE; acabou por ter que ser intervencionado cirurgicamente. Outro doente com um tumor (Koos II - Samii T3a) com sintomas vestibulares, preferiu ser tratado, primeiramente, com RCE. Contudo, este caso também acabou por ter que ser intervencionado cirurgicamente, por crescimento tumoral. Por último, um caso de um tumor (Koos II - Samii T2) que realizou RCE, encontra-se ainda em seguimento e sem necessidade de intervenção cirúrgica. Os poucos doentes eleitos para RCE acabam por ser uma limitação deste estudo.
A maioria dos doentes com tumores de média dimensão apresentam sintomas auditivos ou vestibulares. Mesmo nestes, a paresia facial é rara e, se presente, deve ser feito o diagnóstico diferencial com schwannoma do facial (SF). No nosso estudo, a parésia facial apenas esteve presente em tumores de grandes dimensões que tiveram de ser intervencionados cirurgicamente. Devido aos sintomas e dimensão do tumor, nos doentes com tumores médios a abordagem deve ser interventiva. Quer a cirurgia quer a RCE pode ser recomendada. (nível de evidência C) (32
Os riscos são menores com a RCE; no entanto, apenas a cirurgia tem intuito curativo com remoção completa do tumor. A resseção subtotal para preservar a função pode ser uma opção, com RCE subsequente. (grau de recomendação C) (339
A escolha de uma abordagem cirúrgica depende da audição e da preferência do doente, das características do tumor e da experiência do cirurgião. A experiência da equipa cirúrgica é um fator importante que afeta o resultado final, pelo que os SV apenas devem ser tratados em centros especializados com maior volume cirúrgico. (grau de recomendação IV) (34,35,36
A cirurgia pode ser considerada até em pequenos tumores, se existir degeneração quística ou se o objectivo principal do tratamento for a cura (grau de recomendação III, nível de evidência C). (37,38,39 O objetivo da cirurgia deve ser a ressecção total ou quase-total (near-total resection - NTR), uma vez que o tamanho da doença residual correlaciona-se com a probabilidade de recorrência (grau de recomendação III, nível de evidência B). (40 Nos tumores de grandes dimensões (Koos IV, Samii T4a e T4b), a cirurgia é o tratamento de eleição para remover a lesão sintomática ou potencialmente fatal devido ao efeito de compressão no tronco cerebral. (41
A abordagem suboccipital ou retrosigmoideia (retromastoideia) é preferida pelos neurocirurgiões e é particularmente indicada para tumores localizados no APC ou tumores com um grau de compressão do tronco significativo. Esta abordagem permite a remoção de tumores de várias dimensões e oferece teoricamente a possibilidade de preservação da audição, mas já vimos, pelos resultados da nossa série e por outros estudos, que a preservação da audição não é obtida na maior parte dos casos. É uma abordagem que oferece uma visualização privilegiada sobre o tronco cerebral, pares cranianos e estruturas vasculares vizinhos, mas requer alguma retração do cerebelo e tem apenas um acesso limitado ao fundo do CAI, onde muitas vezes é deixado um volume variável de tumor residual. (42,43
A abordagem translabiríntica é realizada por otorrinolaringologistas com competência otoneurocirúrgica a trabalhar em equipa com neurocirurgiões. Pode remover tumores de todos os tamanhos. Esta abordagem permite acesso ao CAI e a visualização de todo o trajeto do nervo facial, incluindo a porção localizada no canal de Falópio, após realizada a labirintectomia. Esta via tem a vantagem de oferecer um acesso privilegiado ao tumor sem necessidade de retração dos lobos occipital ou temporal. (44,45 É tradicional dizer-se que esta via resulta numa perda completa da função do ouvido interno, não sendo assim adequada a doentes com audição residual útil, que requerem uma via preservadora da audição, mas também se tem que considerar que mesmo as vias teoricamente preservadoras da audição acabam muitas vezes por não o ser, pelo que a via translabiríntica é uma via que pode ser oferecida a doentes com audição útil mas com poucas possibilidades de a preservar por qualquer via que seja considerada (tumores grandes, por exemplo).
A via da fossa média pode ser considerada para doentes com pequenos tumores que requeiram uma abordagem preservadora da audição. Esta oferece um acesso ao CAI superiormente, sendo necessária uma craniotomia acima da apófise zigomática e dissecção extradural até à eminência arqueada e ao bordo superior do rochedo. A seleção dos doentes é chave para esta abordagem, pois tumores com extensão ao fundo do CAI ou abaixo da crista transversa do CAI apresentam uma dificuldade acrescida com esta abordagem, especialmente se compararmos com aqueles em que o tumor não chega ao fundo do CAI, que são as melhores indicações para esta via de abordagem. (44,45,46,47
Os resultados auditivos das três abordagens demonstraram que a via translabiríntica deixa inevitavelmente os doentes cofóticos, mas a via da fossa média e a retrosigmoideia apresentaram taxas de cofose de dois terços e sete oitavos, respectivamente. Estas taxas variam com as séries, mas são invariavelmente altas mesmo nos centros internacionais considerados de excelência.
O grau de resseção do tumor, classificado em total, quase total (se menor que 5x2x2mm), ou subtotal (igual ou maior que 5X2X2 mm) relaciona-se com o probabilidade de recidiva. (48,49,50,51 Um estudo com 116 doentes demonstrou uma taxa de recorrência de 3,8%, 9,4% e 27,6% nos SV tratados com resseção total, quase-total subtotal, respetivamente. (52 No nosso estudo, a via translabiríntica foi a via de abordagem que apresentou melhores resultados na exérese tumoral, tendo portanto sido considerada a mais controlada e precisa na ressecção tumoral
Como os SV apresentam, tipicamente, um crescimento lento, vários doentes vão ser capazes de compensar o défice vestibular periférico, através das vias centrais. Por esta razão, à medida que o tumor cresce, poucos relatam tontura ou dificuldades de equilíbrio. O grau de assimetria calórica, ou seja, de défice vestibular documentado, presente no pré-operatório é um dado importante, pois permite-nos prever a intensidade vertigem imediatamente após a ressecção cirúrgica do tumor. A intensidade da vertigem será tanto maior, quanto menor o défice causado pelo tumor antes da cirurgia. Independentemente do resultado desta avaliação, a maioria dos doentes irá beneficiar de uma reabilitação vestibular. (53 Um pequeno estudo demonstrou que testes de potenciais miogénicos evocados vestibulares cervical (cVEMP), juntamente com testes calóricos, conseguem prever se existe envolvimento do tumor em ambos os nervos vestibulares ou apenas no inferior. (54 Torna-se controverso, uma vez que existem estudos que referem não existir qualquer correlação entre os testes de potenciais miogénicos evocados vestibulares: cervicais e ocular (oVEMP e cVEMP), mesmo que em conjunto com testes calóricos, relativamente à origem nervosa do tumor. (55 Por outro lado, quando estes testes estão associados ao Video Head Impulse Test (vHIT) são vários os estudos que documentam elevados graus de sensibilidade e especificidade relativos à origem nervosa do tumor. (56), (57 Quando um doente com SV apresenta défice vestibular unilateral nas provas calóricas, a restante da avaliação por videonistagmografia (VNG) pode fornecer informações sobre o estado de compensação do mesmo. Por exemplo, ao observar movimentos oculares anormais na forma de nistagmo espontâneo, posicional e/ou headimpulse test (HIT), o défice vestibular é considerado não compensado do ponto de vista fisiológico.
A Ressonância Magnética é o método diagnóstico de eleição em doentes com suspeita de SV. A ponderação T1 com administração intravenosa de gadolíneo é o gold standart. (58,59 Os potenciais evocados auditivos do tronco cerebral também devem ser avaliados quando se tenta preservar a audição. Maiores alterações nos potenciais evocados indicam menor possibilidade de preservar a audição mesmo usando uma via potencialmente preservadora da audição (grau de recomendação III, nível de evidência B). (60), (61,62
Este estudo apresenta, porém, algumas limitações: natureza retrospetiva, estudo realizado num único centro, ausência de avaliação dos resultados do tratamento na perspetiva da qualidade de vida e o pequeno número de doentes submetidos a RCE.
Conclusão
Esta é uma das maiores séries reportada a nível nacional sobre o tratamento dos SV.
Os resultados desta série demonstram o que já tem vindo a ser relatado noutros trabalhos e defendido em documentos de consenso internacionais, a saber: o objetivo do tratamento do SV não deve ser primariamente a exérese completa do tumor a todo o custo, mas sim o evitar de complicações e a preservação das funções do nervo facial e auditiva o maior tempo que for possível. Para isso, os médicos que ajudam os doentes a decidir sobre o tratamento da sua doença devem usar a melhor evidência e ser capazes, não só de tratar, mas também de gerir um aconselhamento, no qual todas as opções, que incluem a espera vigilante, a cirurgia, a radiocirurgia ou combinações destas opções (sequenciais ou planeadas ao longo da evolução da doença primária ou já previamente tratada) sejam explicadas e disponibilizadas. Para tal, é necessária uma colaboração entre otorrinolaringologistas, neurocirurgiões e médicos com competência na radiocirurgia, que deve ser sistemática e organizada.
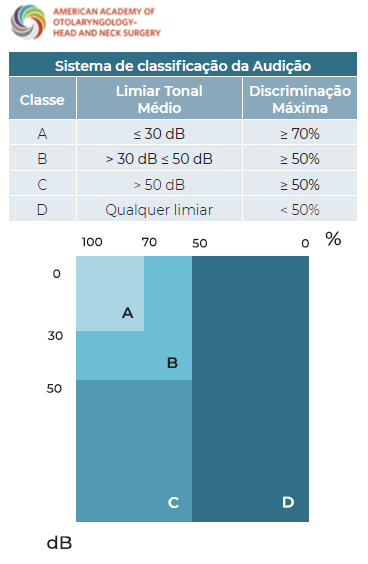
Figura 1 Sistema de classificação de Audição da American Academy of Otolaryngology-Head and Neck Surgery (AAO - HNS)

Figura 2 Sistema de classificação do acufeno segundo a 7ª Conferência Internacional do Neurinoma do Acústico

Figura 3 Sistema de classificação do desequilíbrio segundo a 7ª Conferência Internacional do Neurinoma do Acústico
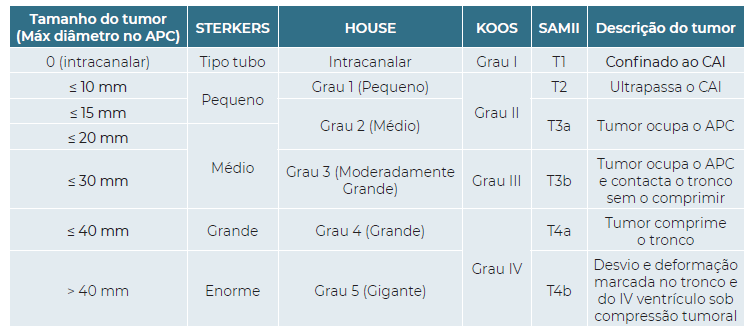
Figura 5 Várias classificações do tamanho dos Schwannomas Vestibulares segundo a 7ª Conferência Internacional do Neurinoma do Acústico
Tabelas com os doentes com as várias abordagens cirúrgicas
Tabela 2 Doentes que a abordagem cirúrgica foi a Via da Fossa Média
| Estadiamento (Samii) | Idade | Sexo | Lateralidade | Audição (AAO-HNS) | House-Brackmann (pós-operatório imediato) | House-Brackmann (6-12 meses) | Audição após cirurgia (AAO-HNS) | Complicações | RM controlo |
| T1 | 39 | F | Direito | A | I | I | D | Défice Vestibular | R |
| T1 | 65 | M | Direito | B | IV | III | B | Queratite de Exposição. | R |
| T1 | 63 | F | Esquerdo | A | IV | IV | D | - | NTR |
F - Feminino; M - Masculino; NRT - Near-total resection; R - Residual; T - Total.
Tabela 3 Doentes que a abordagem cirúrgica foi a Translabiríntica
| Estadiamento (Samii) | Idade | Sexo | Lateralidade | Audição (AAO-HNS) | House-Brackmann (pós-operatório imediato) | House-Brackmann (6-12 meses) | Complicações | RM controlo |
| T2 | 64 | F | Esquerdo | B | V | IV | Hematoma Abdominal; Queratite de exposição. | Total |
| T2 | 49 | M | Direito | B | II | I | - | R |
| T2 | 54 | M | Esquerdo | B | II | I | - | R |
| T3a | 43 | F | Esquerdo | A | I | I | - | Total |
| T3a | 62 | F | Direito | A | I | I | Fistula de LCR | NTR |
| T3a | 62 | M | Esquerdo | B | I | I | - | NTR |
| T3a | 54 | M | Esquerdo | B | I | I | - | NTR |
| T3a | 46 | M | Esquerdo | D | I | I | - | R |
| T3a | 67 | M | Esquerdo | D | IV | IV | - | - |
| T3b | 61 | F | Esquerdo | C | II | I | - | R |
| T4a | 55 | F | Esquerdo | D | V | II | - | R |
F - Feminino; M - Masculino; NRT - Near-total resection; R - Residual; T - Total.
Tabela 4 Doentes que a abordagem cirúrgica foi a Retrossigmoideia
| Estadiamento Samii | Idade | Sexo | Lateralidade | Audição (AAO-HNS) | House-Brackmann (pós-operatório imediato) | House-Brackmann (6-12 meses) | Audição Preservada (AAO-HNS) | Complicações | RM controlo |
| T3a | 50 | F | Esquerdo | B | II | I | D | Trombose do Seio Lateral | R |
| T3a | 65 | F | Direito | D | IV | V | Sem audição útil para preservar | - | - |
| T3b | 71 | F | Direito | A | I | I | B | - | R |
| T3b | 34 | M | Direito | B | IV | II | D | - | - |
| T3b | 44 | F | Direito | - | III | III | - | - | - |
| T3b | 81 | M | Direito | D | I | I | Sem audição útil para preservar | - | - |
| T3b | 25 | F | Direito | B | I | I | D | - | - |
| T4a | 41 | F | Direito | B | I | I | C | Trombose do seio transverso e sigmoide | - |
| T4a | 52 | F | Direito | D | I | I | Sem audição útil para preservar | - | R |
| T4a | 71 | F | Esquerdo | D | VI | VI | Sem audição útil para preservar | R | |
| T4a | 52 | M | Direito | A | I | I | D | - | R |
| T4a | 45 | M | Esquerdo | D | I | I | Sem audição útil para preservar | - | R |
| T4b | 75 | M | Direito | D | IV | IV | D | Hidrocefalia | R |
| T4b | 18 | F | Esquerdo | D | III | I | Sem audição útil para preservar | - | R |
| T4b | 70 | M | Direito | D | IV | III | D | - | NRT |
| T4b | 41 | F | Direito | D | II | I | D | Trombose dos seios lateral e sigmoide; Isquemia do PCerebeloso; Hemiparesia; Disfagia. | R |
| T4b | 49 | F | Esquerdo | B | V | V | D | - | R |
| T4b | 59 | F | Esquerdo | B | III | III | D | - | - |
| T4b | 72 | F | Esquerdo | C | I | I | D | - | - |
| T4b | 83 | F | Esquerdo | D | III | III | Sem audição útil para preservar | - | - |
| T4b | 59 | F | Direito | D | IV | - | Sem audição útil para preservar | - | - |
| T4b | 52 | F | Esquerdo | D | II | - | Sem audição útil para preservar | - | - |
F - Feminino; M - Masculino; NRT - Near-total resection; R - Residual.
Agradecimentos
A todo o serviço de Otorrinolaringologia do Hospital Egas Moniz que permitiu a elaboração deste trabalho científico.
Em particular, ao Prof. Doutor Luís Roque Reis, apesar de não constar nos autores foi uma preciosa ajuda na elaboração e estruturação do artigo.
Conflito de Interesses
Os autores declaram que não têm qualquer conflito de interesse relativo a este artigo.