Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Acessos
Acessos
Links relacionados
-
 Similares em
SciELO
Similares em
SciELO
Compartilhar
Jornal Português de Gastrenterologia
versão impressa ISSN 0872-8178
J Port Gastrenterol. vol.21 no.4 Lisboa ago. 2014
https://doi.org/10.1016/j.jpg.2014.05.002
ARTIGO ORIGINAL
Azatioprina na doença inflamatória intestinal: fatores preditivos da resposta sustentada a longo prazo
Azathioprine in inflammatory bowel disease: Predictors of sustainded long-term response
Ana Lúcia Sousaa,∗, Paulo Caldeiraa, Marta Eusébioa, Alda Martinsb, Teresa Beloa e Horácio Guerreiroa
a Serviço de Gastrenterologia, Departamento de Medicina, Hospital de Faro - Centro Hospitalar do Algarve, E.P.E., Faro, Portugal
b Departamento de Psicologia, Universidade do Algarve, Faro, Portugal
*Autor para correspondência
RESUMO
Introdução: A azatioprina (AZA) é uma opção terapêutica de manutenção na doença inflamatória intestinal (DII). Contudo, os fatores que influenciam ou predizem a sua resposta são pouco conhecidos.
Objetivo: Avaliar os fatores preditivos de sucesso terapêutico da AZA a longo prazo.
Métodos: Análise retrospetiva de todos os doentes com DII seguidos no nosso hospital medicados com AZA (2-2,5 mg/Kg/dia) por doença corticodependente ou corticorrefratária e, na doença de Crohn (DC), por comportamento fistulizante ou após cirurgia. Registámos o tipo de doença (DC/colite ulcerosa [CU]/DII indeterminada), parâmetros clínicos, parâmetros laboratoriais (PL) - leucócitos, PCR, hemoglobina, plaquetas e VGM - antes e aos 3 meses de tratamento, bem como terapêutica concomitante com 5-ASA e corticoide. O tratamento foi considerado eficaz quando os doentes mantinham o controlo da doença por critérios clínicos/endoscópicos, com manutenção da AZA ou com cessação da mesma após 3 meses de tratamento, e sem necessidade de escalar a terapêutica. Excluímos os doentes com intolerância à AZA nos primeiros 3 meses e os tratados concomitantemente com agentes biológicos.
Resultados: Setenta e dois doentes (37 mulheres e 35 homens); idade média de 38,0±13,8 anos; 35 doentes com DC, 34 com CU e 3 com DII indeterminada. Duração média de tratamento com AZA de 35,1±30,6 meses. A AZA foi eficaz em 48 doentes (66,7%). A idade no início da AZA prediz o sucesso terapêutico (R = 0,303, p = 0,019). O sexo, o tipo de doença e os PL antes do tratamento não tiveram relação com a eficácia. Aos 3 meses de tratamento, os PL mostraram relação com o sucesso terapêutico a longo prazo: leucócitos (r = -0,295, p = 0,013), PCR (r = -0,332, p = 0,005), hemoglobina (r = 0,307, p = 0,010), plaquetas (r = -0,360, p = 0,003) e VGM (r = 0,255, p = 0,047); no seu conjunto os PL predizem a eficácia (R = 0,517; p = 0,005). Existe associação entre a localização da CU (r = -0,381; p = 0,026), o tempo de tratamento concomitante com 5-ASA (r = 0,258, p = 0,029) e a suspensão de corticoides (r = 0,265, p = 0,04) com a eficácia do tratamento.
Conclusão: O tratamento com a AZA foi eficaz na maioria dos doentes com DII. A idade avançada no início da terapêutica e os PL aos 3 meses foram preditivos de resposta sustentada da AZA.
Palavras-Chave: Doença inflamatória intestinal; Azatioprina; Eficácia do tratamento
ABSTRACT
Introduction: Azathioprine (AZA) is an option for maintenance therapy in Inflammatory Bowel Disease (IBD). However, the factors which influence or predict its response are poorly understood.
Aim: Evaluate the predictive factors for a successful long-term therapeutic response of AZA.
Methods: Retrospective analysis of all patients with IBD followed up in our hospital treated with AZA (2-2.5 mg/Kg/day) due to steroid dependent or resistent disease or, in Crohn disease (CD), due to fistulizing behavior or post-surgery. We recorded the type of disease (DC/ ulcerative colitis (UC), indeterminate IBD), clinical parameters, laboratory parameters (LP) - WBC, CRP, hemoglobin, platelets and MCV - before and after 3 months of treatment, as well as concomitante usage of 5-ASA and steroids. The treatment was considered effective when patients maintained control of the disease by clinical/endoscopic criteria, with continued maintainance of AZA or cessation of therapy after 3 months of treatment, and without escalation of therapy. We excluded patients who show intolerance to AZA in the first 3 months and patients treated concomitantly with biological agents.
Results: 72 patients (37 women and 35 men); mean age 38.0±13.8 years; 35 patients with CD, 34 with UC and 3 with indeterminate IBD. The average duration of treatment with AZA was 35.1±30.6 months. AZA was effective in 48 patients (66.7%). The age at onset of AZA predicts therapeutic sucess (R = 0.303, p = 0.019). The sex, type of disease and LP before treatment did not correlate with efficacy. The LP after 3 months of therapy correlated with therapeutic sucess in the long-term: WBC (r = -0.295, p = 0.013), CRP (r = -0.332, p = 0.005), hemoglobin (r = 0.307, p = 0.010), platelets (r = -0.360, p = 0.003) and MCV (r = 0.255, p = 0.047). In combination, LP predict the efficacy of treatment (R = 0.517, p = 0.005). There is also an association between the location of UC (r = -0.381, p = 0.026), as well as the duration of concurrent treatment with 5-ASA (r = 0.258, p = 0.029) and the suspension of steroids (r = 0.265, p = 0.04) with the efficacy of the treatment.
Conclusion: AZA proved to be an effective treatment in the majority of patients with IBD. The old age of onset of the therapy and LP at 3 months were predictive of a sustained response of AZA.
Keywords: Inflammatory bowel disease; Azathioprine; Treatment efficacy
Introdução
A azatioprina (AZA) é um fármaco utilizado desde há longa data no tratamento da doença inflamatória intestinal (DII). Com a introdução de agentes biológicos a AZA, como fármaco isolado, perdeu um pouco a sua expressão.
Nos estudos SONIC1 e SUCESS2 foi demonstrado que os doentes com doença de Crohn (DC) e colite ulcerosa (CU), respetivamente, de gravidade moderada a severa, tratados com infliximab (IFX) em associação à AZA tiveram maior probabilidade de remissão clínica livre de corticoides relativamente aos doentes sob monoterapia com AZA.
Contudo, o valor da AZA no tratamento de manutenção da DII é sobejamente reconhecido e com custos muito inferiores comparativamente aos agentes biológicos3-8. Já a sua capacidade de indução de remissão foi questionada em meta-análise recente9. Além disso, as tiopurinas mostraram apresentar um impacto positivo na qualidade de vida dos doentes com DII10.
Infelizmente, as tiopurinas provocam efeitos adversos que frequentemente conduzem à diminuição da dose ou descontinuação do fármaco11. Segundo uma casuística holandesa12, os efeitos secundários das tiopurinas conduzem à descontinuação do fármaco em 39% dos doentes apesar de noutros estudos as taxas de intolerância serem geralmente inferiores13. Ainda que haja uma grande experiência com as tiopurinas na DII, remontando o seu uso desde 196214, os fatores que predizem a sua resposta a longo prazo são pouco conhecidos.
Uma das desvantagens da terapêutica com AZA é a dificuldade em avaliar os fatores preditivos de resposta clínica a longo prazo. Alguns parâmetros analíticos, nomeadamente os leucócitos, os neutrófilos, o Volume Globular Médio (VGM), a Proteína C Reativa (PCR), a Velocidade de Sedimentação (VS) e a concentração de nucleótidos 6-tioguanina (6-TGN) foram propostos como fatores de resposta clínica11,15-17.
Dado que a terapêutica atempada pode modificar o curso da DII, consideramos importante avaliar precocemente a probabilidade de eficácia a longo prazo da AZA, julgando que essa avaliação aos 3 meses de tratamento será adequada e vantajosa.
O objetivo do nosso trabalho é avaliar os fatores preditores de resposta a longo prazo da AZA na DII.
Material e métodos
Seleção de doentes
Partindo de uma base de 360 doentes seguidos em consulta de DII, identificámos 85 que em algum momento do curso da sua doença realizaram tratamento com AZA. O nosso critério de seleção foi o uso da AZA na dose de 2-2,5 mg/Kg/dia, sem biológico e por um período superior a 3 meses. As indicações para o início da AZA foram doença corticodependente ou corticorrefratária e, no caso particular da DC, por comportamento fistulizante ou após a cirurgia.
Treze doentes foram excluídos, 11 dos quais por efeitos secundários que ocorreram nos primeiros 3 meses de tratamento e 2 por terapêutica concomitante com agentes biológicos. Os efeitos adversos que conduziram à descontinuação da terapêutica foram os seguintes: 5 doentes com toxicidade hepática, 4 doentes com intolerância gástrica, um doente com pancreatite aguda minor e outro com reação alérgica (febre, mal-estar geral, diarreia e dor abdominal).
Estudámos assim, retrospetivamente, 72 doentes. Registámos os parâmetros demográficos, o tipo de doença (DC, CU, DII indeterminada), os parâmetros laboratoriais (PL) - leucócitos, PCR, hemoglobina, plaquetas e VGM - antes e aos 3 meses de tratamento com AZA, bem como terapêutica concomitante com 5-ASA e corticoide.
Definições
Considerámos o tratamento eficaz: 1) doentes que mantiveram o controlo da DII, por critérios clínicos/endoscópicos, sem necessidade de escalada terapêutica, mantendo a AZA por período superior ou igual a 3 meses; 2) suspensão do fármaco por decisão médica, na presença de controlo clínico e na ausência de efeitos secundários.
Considerámos o tratamento não eficaz: 1) doentes com necessidade de escalada terapêutica por mau controlo clínico, após o uso da AZA num período superior ou igual a 3 meses; doentes com mau controlo endoscópico após o uso da AZA num período superior a 6 meses, nos casos em que a remissão foi induzida cirurgicamente; 2) ocorrência de efeitos secundários após esse período de utilização do fármaco que conduziram à suspensão do mesmo.
Análise estatística
Comparámos os 2 grupos (tratamento eficaz vs. Tratamento não eficaz) e usámos análise univariada e multivariada através do SPSS, versão 16,0. No nosso estudo foram usados os testes de correlação de Pearson, qui-quadrado de Pearson, teste t e regressão linear (métodos enter e stepwise). O valor de p < 0,05 foi considerado estatisticamente significativo.
Resultados
Foram incluídos 72 doentes sob terapêutica com AZA, 37 mulheres e 35 homens. A idade média de introdução da AZA foi de 38,0±13,8 (18-73) anos e a idade média de diagnóstico da DII de 31,8±12,8 (12-65) anos. O tempo de evolução médio entre o diagnóstico da DII e o início da AZA foi 74,3±81,2 meses. Trinta e cinco doentes apresentavam DC, 34 doentes tinham CU e em 3 doentes a DII era indeterminada.
Na maioria dos doentes com DC a doença tinha comportamento inflamatório (57,1%), com localização sobretudo cólica e ileocólica (80%), em 17,1% existia evidência de doença perianal e em 34,3% a AZA foi introduzida após cirurgia (tabela 1). Na maioria dos doentes com CU a doença localiza-se à esquerda (67,6%) (tabela 1).
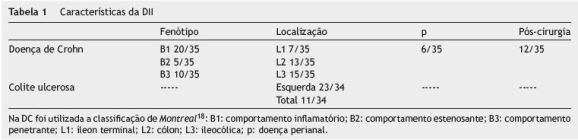
A duração média de tratamento com AZA foi de 35,1±30,6 meses. A duração mínima de utilização do fármaco foi 3 meses e a duração máxima foi 136 meses. Em um doente a AZA foi utilizada apenas por 3 meses por mielotoxicidade e em 3 doentes foi usada por 4 meses (em 2 dos quais por mielotoxicidade e em outro por hepatotoxicidade). Os restantes doentes estiveram medicados com a AZA por períodos superiores a 6 meses.
A taxa global de efeitos secundários foi de 30,6% (em 11 doentes os efeitos secundários surgiram antes dos 3 meses de tratamento e em 4 doentes surgiram após esse período). Nenhum doente havia sido tratado previamente com biológicos ou metotrexato.
A maioria dos doentes (83,3%) estava medicada concomitantemente com 5-ASA. Na altura da introdução da AZA, a mesma percentagem de doentes (83,3%) estava também medicada com corticoides, com uma duração média de 6,8±10,0 meses.
A AZA foi eficaz em 48 doentes (66,7%). Na CU a AZA foi eficaz em 70,6% dos doentes e na DC em 60%.
A tabela 2 caracteriza de forma discriminada a população estudada, de acordo com a eficácia do tratamento a longo prazo.
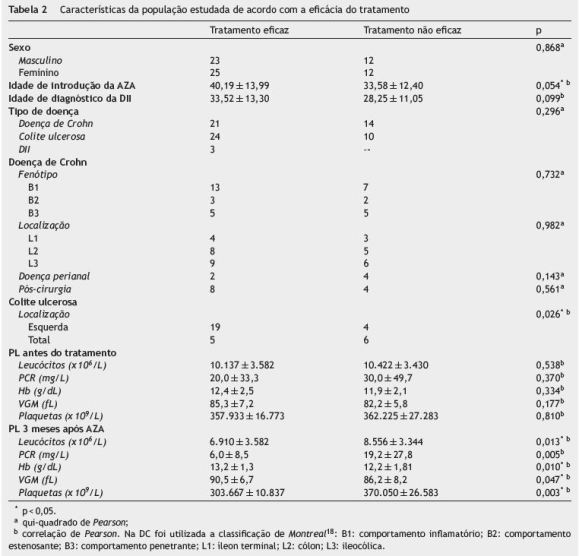
O sexo, o tipo de doença (DC/CU/DII) e a idade de diagnóstico da DII não têm relação com a eficácia da AZA a longo prazo.
Existe relação entre a idade de introdução da AZA e a resposta a longo prazo do fármaco, embora esta relação seja sustentada estatisticamente por uma significância marginal (r = 0,228, p = 0,054). Quanto mais avançada a idade do doente na altura da introdução da AZA, maior a eficácia do fármaco a longo prazo. No que respeita ao tempo de evolução da doença, não se verificou correlação com a eficácia sustentada da AZA (r = 0,097, p = 0,416).
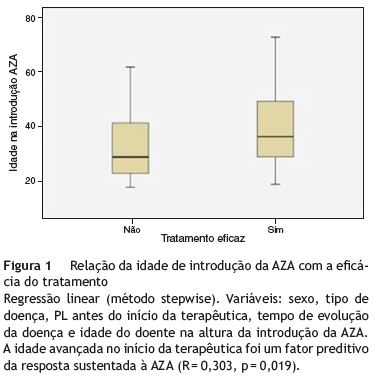
Utilizando a regressão linear, pelo método stepwise, verificou-se que a única variável que prediz o sucesso a longo prazo da AZA aquando do início da terapêutica é a idade mais avançada na altura da introdução do fármaco (R = 0,303, p = 0,019) (fig. 1). Neste modelo utilizaram-se como variáveis o sexo, o tipo de doença, os PL antes do início da terapêutica, o tempo de evolução da doença e a idade do doente na altura da introdução da AZA.
Além disso, avaliando o subgrupo de doentes com CU, verificou-se também associação entre a localização da doença e a eficácia da AZA a longo prazo, sendo que os doentes com colite esquerda respondem de forma mais favorável do que os doentes com pancolite (r = -0,381, p = 0,026).
Já nos doentes com DC, não se observou relação com a eficácia da AZA no que respeita ao fenótipo, à localização e à presença de doença perianal, tal como se verifica na tabela 2.
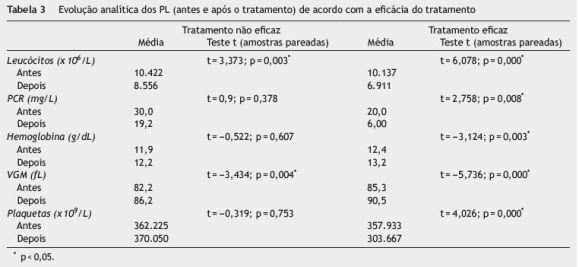
Usando a correlação de Pearson (tabela 2), verificou-se não existir associação estatística entre o valor inicial dos PL e o sucesso terapêutico a longo prazo da AZA. Ao contrário, os PL após 3 meses de tratamento com a AZA mostraram relação com resposta sustentada ao fármaco. Portanto, quando a AZA foi eficaz a longo prazo, verificou-se descida dos valores dos leucócitos (r = -0,295, p = 0,013), da PCR (r = -0,332, p = 0,005) e das plaquetas (r = -0,360, p = 0,03) e houve aumento da hemoglobina (r = 0,307, p = 0,010) e do VGM (r = 0,255, p = 0,047), de forma estatisticamente significativa.
A tabela 3 mostra a evolução analítica dos PL (antes e após o tratamento), de acordo com a eficácia do tratamento. No grupo de doentes em que o tratamento não foi eficaz verificou-se também descida do valor dos leucócitos e aumento do VGM com significância estatística, contudo, em menor grandeza relativamente ao grupo de doentes em que o tratamento foi eficaz a longo prazo.
Com base em análise multivariada, através da regressão linear (método enter) confirmou-se que os PL aos 3 meses predizem o sucesso terapêutico (R = 0,517, p = 0,005), ao contrário dos PL antes do tratamento (r = 0,287; p = 0,444). Através da regressão linear (método stepwise), verificou-se que os PL aos 3 meses que predizem mais o sucesso terapêutico a longo prazo da AZA são a PCR e os leucócitos (r = 0,501, p = 0,000).
Verificou-se ainda que a duração do tratamento com 5-ASA se correlacionou com a eficácia a longo prazo da AZA, sendo que quanto maior a duração do 5-ASA maior a eficácia da AZA (r = 0,258, p = 0,029).
A suspensão dos corticoides também se correlacionou com a eficácia a longo prazo da AZA (r = 0,265, p = 0,041).
Discussão
A AZA mostrou ser efetiva na terapêutica de manutenção da DC e da CU3-8,19. Contudo, os fatores preditivos de resposta sustentada são pouco conhecidos, existindo escassos estudos que avaliam como end-point primário esta problemática. Na nossa série avaliámos a eficácia e os fatores de resposta sustentada à AZA numa população de doentes com DII seguidos em consulta no Hospital de Faro. Nesta população, 23,6% dos doentes iniciaram imunossupressão com AZA, tendo sido o fármaco eficaz em 66,7% dos doentes. Discriminado, de acordo com o tipo de doença, a AZA foi eficaz em 70,6% dos doentes com CU e em 60% dos doentes com DC. Noutros estudos a eficácia da AZA foi avaliada entre 40-81% dos casos4,8,11-13,20-22, sendo, contudo, usadas diferentes definições de resposta ao fármaco.
De facto, uma das desvantagens do uso das tiopurinas é a dificuldade em avaliar a resposta clínica. No nosso estudo, a avaliação foi retrospetiva e os critérios utilizados foram critérios clínicos/endoscópicos com a subjetividade inerente. No único estudo recente que tem como objetivo primário, a avaliação dos fatores preditivos de resposta à AZA11 foram utilizados como indicadores de resposta clínica, no caso da DC, o Crohns disease activity index (CDAI) inferior a 150 pontos e o Harvey-Bradshaw index (HBI) inferior a 4 pontos e, no caso da CU, o score Mayo parcial (inferior a 3 pontos), após 4-6 meses de introdução de tiopurinas, sendo, por isso, uma forma mais objetiva de avaliação da resposta. Além disso, a nossa amostra é pequena e algo heterogénea, ao incluir doentes com CU e com DC e, neste último caso, com 34,3% de doentes com remissão induzida através de cirurgia. Contudo, estes aspetos não nos parecem ser limitações major do nosso estudo, pois a eficácia das tiopurinas foi semelhante em ambos os grupos e concordante com a encontrada no estudo de Constantino11 (69% na CU e 66,7% na DC).
Na nossa série a taxa de efeitos secundários foi de 30,6%, a maioria ocorrendo nos primeiros 3 meses de tratamento. Todos os efeitos secundários levaram à descontinuação da terapêutica; estes valores são concordantes com outros estudos12,22,23.
No nosso estudo, o sexo e o tipo de doença não apresentaram relação com a eficácia da AZA a longo prazo. No que respeita ao tipo de doença, os nossos dados são concordantes com uma série do Hospital John Radcliffe, em Oxford22, que visou a avaliação retrospetiva da utilização da AZA durante 30 anos. Neste estudo, a CU foi um fator favorecedor para a obtenção da remissão, mas não se verificou diferença entre DC e CU na manutenção da remissão. O mesmo é referido no estudo de Constantino11 onde, e de forma semelhante à nossa série, não se observou relação entre o tipo de doença e a eficácia a longo prazo da AZA. Já no que respeita ao sexo encontram-se dados algo contraditórios na literatura: no estudo de Oxford22 os doentes do sexo masculino com DC foram os que tiveram maior probabilidade de se manterem em remissão a longo prazo sob terapêutica com AZA; pelo contrário, no estudo italiano supracitado11 e num outro estudo asiático24, o sexo feminino esteve associado positivamente à resposta à terapêutica.
Subdividindo os doentes de acordo com o tipo de doença, também não verificamos diferença na resposta de acordo com o fenótipo, localização e presença de doença perianal na DC; os nossos dados são concordantes com um estudo prévio francês25, que visou estudar 157 doentes com DC em remissão por mais de 6 meses e em que o local de envolvimento da doença não apresentou relação com a resposta à AZA; já no estudo de Costantino11, nos doentes com DC, observou-se resposta significativamente mais favorável quando a localização era ileal. Por fim, na nossa série, verificou-se que os doentes com colite esquerda apresentam significativamente melhor resposta sustentada à AZA, contrariamente ao estudo de Costantino11 e a um outro estudo espanhol de Lopez-Sanroman21. Já Saibeni26 mostrou que a eficácia das tiopurinas seria independente da localização da doença, independentemente de se tratar de CU ou DC.
Os PL antes do início da AZA não predizem a resposta à terapêutica, pelo que os valores das análises, antes de iniciar a AZA, não são úteis como preditores de resposta a longo prazo a este fármaco. Antes de iniciar a AZA, a única variável que prediz a resposta sustentada é a idade de introdução do fármaco, pois quanto maior a idade do doente à data da introdução da AZA, maior a probabilidade de resposta clínica/endoscópica a longo prazo; julgamos que este achado se poderá relacionar com a maior gravidade da doença em doentes mais jovens. Na revisão de Fraser22 a idade mais avançada foi também um fator que favoreceu a remissão clínica. Ao contrário do estudo de Costantino11, no nosso estudo a duração da doença, isto é, o tempo que medeia entre o diagnóstico e a introdução da AZA, não se correlacionou com a resposta sustentada ao fármaco; já os resultados da série espanhola21, que avaliou prospetivamente a eficácia da AZA na colite ulcerosa, foram concordantes com os do nosso estudo.
Para avaliar a resposta à terapêutica destacamos os PL ao fim de 3 meses de tratamento: todos eles se correlacionaram com a eficácia do tratamento e, no seu conjunto, predizem a eficácia da AZA a longo prazo. Os 2 PL que mais fortemente predizem a resposta são a PCR e os leucócitos, confirmando a validade dos parâmetros inflamatórios, nomeadamente da PCR na avaliação da atividade clínica e endoscópica da DII27-29. Contudo, utilizando a PCR na prática clínica como marcador de atividade da DII, deverá ter-se presente que esta aumenta de forma mais marcada na DC do que na CU30. A diminuição do valor dos leucócitos como fator preditivo de resposta sustentada à AZA está de acordo com os dados da série de Fraser22, Candy31 e Colonna32. Contudo, os estudos de Candy31 e Colonna32 mostraram uma correlação fortemente positiva entre o sucesso da terapêutica e a indução de leucopenia pela AZA; já no nosso estudo verificou-se efetivamente uma redução dos leucócitos sem que fosse atingida necessariamente leucopenia. Verificou-se também aumento do VGM e descida dos leucócitos em ambos os grupos de doentes (os que responderam e os que não responderam à terapêutica de forma sustentada), ainda que o grau de variação seja mais forte nos doentes que responderam à terapêutica. Estudos prévios mostraram que o VGM seria um fraco marcador preditivo de resposta à terapêutica24. Já no estudo espanhol10, em que doentes com CU corticodependentes foram avaliados prospetivamente, o VGM foi um fator preditivo de resposta. Na nossa série as plaquetas e a hemoglobina mostraram ser também fatores que se correlacionam com a resposta a longo prazo à AZA, isto é, nos doentes em que o tratamento foi eficaz registou-se diminuição das plaquetas e aumento da hemoglobina de forma estatisticamente significativa. Assim, e dado que é recomendada a vigilância analítica aquando da terapêutica com a AZA33, destaca-se a importância dos nossos achados, visto que cada um dos PL aos 3 meses se correlaciona com a eficácia da AZA a longo prazo e sobretudo pela utilidade da aplicação destas variáveis em conjunto, uma vez que são bons preditores da resposta sustentada, permitindo assim perspetivar, de forma objetiva, a eficácia a longo prazo da AZA num determinado doente.
Nos dias de hoje cada vez mais é valorizada a cicatrização da mucosa como objetivo terapêutico e fator preditor de resposta sustentada a longo prazo ao(s) fármaco(s) utilizado(s)1,2. A análise dos PL aos 3 meses não substitui a avaliação endoscópica, contudo, a nossa série demostra que a avaliação laboratorial poderá ser um fator complementar de eficácia sustentada à terapêutica com AZA.
Em conclusão, com as limitações de se tratar de um estudo retrospetivo e com uma amostra reduzida, a AZA mostrou ser eficaz na maioria dos doentes com DII. A idade avançada no início da terapêutica mostrou ser um fator preditivo de resposta sustentada. O sexo, a duração e o tipo de doença, bem como os PL antes do início da terapêutica, não se correlacionaram com a eficácia a longo prazo. Já os PL aos 3 meses de tratamento correlacionam-se per si com a eficácia da AZA a longo prazo e, no seu conjunto, são bons preditores do sucesso terapêutico.
Referências
1. Colombel JF, Sandborn WJ, Reinish W, Mantzaris GJ, Kornbluth A, Rachmilewitz D, et al. Infliximab, azathioprine, or combination therapy for Crohns disease. N Engl J Med. 2010;362:1383-95. [ Links ]
2. Panaccione R, Ghosh S, Middleton S, Velazquez JRM, Khalif I, Flint L, et al. Infliximab, azathioprine, or infliximab + azathioprine for treatment of moderate to severe ulcerative colitis: the UC SUCCESS trial. ECCO. 2012, oral presentations abstract number 13. [ Links ]
3. Prefontaine E, Macdonald JK, Sutherland LR. Azathioprine or 6-mercaptopurine for induction of remission in Crohn disease. Cochrane Database Syst Rev. 2010;16:CD000545. [ Links ]
4. Gisbert JP, Linares PM, McNicholl AG, Maté J, Gomollón F. Meta-analysis: The efficacy of azathioprine and mercaptopurine in ulcerative colitis. Aliment Pharmacol Ther. 2009;30:126-37. [ Links ]
5. Bär F, Sina C, Fellermann K. Thiopurines in inflammatory bowel disease revisited. World J Gastroenterol. 2013;19:1699-706. [ Links ]
6. Timmer A, McDonald JW, Tsoulis DJ, Macdonald JK. Azathioprine and 6-mercaptopurine for maintenance of remission in ulcerative colitis. Cochrane Database Syst Rev. 2012;9:CD000478. [ Links ]
7. Chebli LA, Chaves DL, Pimental FF, Guerra DM, Barros RM, Gaburri PD, et al. Azathioprine maintains long-term steroid-free remission through 3 years in patients with streoid-dependent ulcerative colitis. Inflamm Bowel Dis. 2010;16:613-9. [ Links ]
8. Leite S, Ribeiro JM, Lima SC, Barroso S, Cotter J. Azathioprine in inflammatory bowel disease. Acta Med Port. 2009;22:33-40. [ Links ]
9. Khan KJ, Dubinsky MC, Ford AC, Ullman TA, Talley NJ, Moayyedi P. Efficacy of immunossupresive therapy for inflammatory bowel disease; a systematic review and meta-analysis. Am J Gastroenterol. 2011;106:630-42. [ Links ]
10. Bastida G, Nos P, Aguas M, Beltrán B, Iborra M, Ortiz V, et al. The effects of thiopurine theraphy on healh-related quality of life in inflammatory bowel disease patients. BMC Gastroenterol. 2010;10:26. [ Links ]
11. Costantino G, Furfaro F, Belvedere A, Alibrandi A, Fries W. Thiopurine treatment in inflammatory bowel disease: Response predictors, safety, and withdrawal in follow-up. J Crohns Colitis. 2012;6:588-96. [ Links ]
12. Jharap B, Seinen ML, de Boer NK, van Ginkel JR, Linskens RK, Kneppelhout JC, et al. Thiopurine therapy in inflammatory bowel disease patients: Analyses of two 8-year intercept cohorts. Inflamm Bowel Dis. 2010;16:1541-9. [ Links ]
13. Frei P, Biedermann L, Nielsen OH, Rogler G. Use of thiopurines in inflammatory bowel disease. World J Gastroenterol. 2013;19:1040-8. [ Links ]
14. Bean RH. The treatment of chronic ulcerative colitis with 6-mercaptopurine. Med J Aust. 1962;49:592-3. [ Links ]
15. DHalluin PN, Tribut O, Branger B, Lebreton C, Bretagne JF, Bentue-Ferrer D, et al. RBC 6-TGN and hematological parameters in patients with Crohns disease treated by azathioprine. Gastroenterol Clin Biol. 2005;29:1264-9. [ Links ]
16. Achkar JP, Stevens T, Easley K, Brzezinski A, Seidner D, Lashner B. Indicators of clinical response to treatment with six-mercaptopurine or azathioprine in patients with inflammatory bowel disease. Inflamm Bowel Disease. 2004;10:339-45. [ Links ]
17. Decaux G, Prospert F, Hormans Y, Desager JP. Relationship between red cell mean corpuscular volume and 6-thioguanine nucleotides in patients treated with azathioprine. J Lab Clin Med. 2000;135:256-62. [ Links ]
18. Satsangi J, Silverberg MS, Vermeire S, Colombel JF. The Montreal classification of inflammatory bowel disease: Controversies, consensus, and implications. Gut. 2006;55:749-53. [ Links ]
19. Lichtenstein GR, Abreu MT, Cohen R, Tremaine W. American Gastroenterology Association Institute technical review on corticosteroids, immunomodulators, and infliximab in inflammatory bowel disease. Gastroenterology. 2006;130:940-87. [ Links ]
20. Chebli JM, Gaburri PD, de Souza AF, Pinto AL, Chebli LA, Felga GE, et al. Long-term results with azathioprine therapy in patients with corticoid-dependent Crohns disease: Open-label prospective study. J Gastroentrol Hepatol. 2007;22:268-74. [ Links ]
21. Lopez-Sanroman A, Bermejo F, Carrera E, Garcia-Plaza A. Efficacy and safety of thiopurinic immunomodulators (azathioprine and mercaptopurine) in steroid-dependent ulcerative colitis. Aliment Pharmacol Ther. 2004;20:161-6. [ Links ]
22. Fraser AG, Orchard TR, Jewell DP. The efficacy of azathioprine for the treatment of inflammatory bowel disease: A 30 year review. Gut. 2002;50:485-9. [ Links ]
23. Hindorf U, Lindqvist M, Hildebrand H, Fagerberg U, Almer S. Adverse events leading to modification of therapy in a large cohort of patients with inflammatory bowel disease. Aliment Pharmacol Ther. 2006;24:331-42. [ Links ]
24. Thia KT, Li M, Ling KL, Kong SC, Ooi CJ. Azathioprine is effective in corticosteroid-dependent Asian inflammatory bowel disease patients. Inflamm Bowel Dis. 2011;17:809-15. [ Links ]
25. Bouhnik Y, Lémann M, Mary JY, Scemama G, Taï R, Matuchansky C, et al. Long-term follow-up of patients with Crohn disease treated with azathioprine or 6-mercaptopurine. Lancet. 1996;347:215-9. [ Links ]
*Autor para correspondência
Correio eletrónico: ana.e.sousa@hotmail.com (A.L. Sousa).
Responsabilidades éticas
Proteção de pessoas e animais. Os autores declaram que para esta investigação não se realizaram experiências em seres humanos e/ou animais.
Confidencialidade dos dados. Os autores declaram ter seguido os protocolos do seu centro de trabalho acerca da publicação dos dados de pacientes.
Direito à privacidade e consentimento escrito. Os autores declaram ter recebido consentimento escrito dos pacientes e/ ou sujeitos mencionados no artigo. O autor para correspondência deve estar na posse deste documento.
Conflito de interesses
Os autores declaram não haver conflito de interesses.
Recebido a 22 de setembro de 2013; aceite a 8 de maio de 2014













