Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Acessos
Acessos
Links relacionados
-
 Similares em
SciELO
Similares em
SciELO
Compartilhar
Corrosão e Protecção de Materiais
versão On-line ISSN 2182-6587
Corros. Prot. Mater. vol.34 no.1 Lisboa jun. 2015
ARTIGO
Corrosão pelos depósitos salinos nos geradores de vapor (comunicação breve)
Corrosion by salt deposits in boilers
C. Sequeira*1, E. Aghaie2, D. Cardoso1 e L. Amaral1
(1) ICEMS, Instituto Superior Técnico, Universidade de Lisboa, Av. Rovisco Pais, 1049-001 Lisboa, Portugal, e-mail: david.p.cardoso@tecnico.ulisboa.pt; luis.m.amaral@tecnico.ulisboa.pt
(2) Department of Materials Science and Engineering, Saveh Branch, Islamic Azad University, Saveh, Iran, e-mail: ermia.aghaee@gmail.com
(*) A quem a correspondência deve ser dirigida, e-mail: cesarsequeira@tecnico.ulisboa.pt
RESUMO
Os depósitos de vanadatos e sulfatos de sódio, líquidos a alta temperatura, localizados nos tubos das caldeiras causam corrosões severas. A análise das propriedades e da corrosão eletroquímica no vanadato de sódio fundido permite compreender, num caso simples, um processo complexo e comparar a resistência à corrosão de metais diferentes por um método rápido e simples.
Palavras-chave: Vanadato Alcalino Fundido, Depósitos Líquidos, Corrosão Eletroquímica, Propriedades Físicas, Materiais Metálicos
ABSTRACT
Sodium vanadate and sulphate form deposits, liquid at high temperature, which cause corrosion of boiler pipes. The analysis of properties and of electrochemical corrosion in melted sodium vanadate allows to understand, in a simple case, a complex process, and to compare corrosion resistance of different metals by a quick and simple method.
Keywords: Melted Sodium Vanadate, Liquid Deposits, Electrochemical Corrosion, Physical Properties, Metallic Materials
1. INTRODUÇÃO
A presença de impurezas minerais, de que se destacam as de enxofre, vanádio e sódio, nos combustíveis líquidos tais como os óleos de fuel pesados que são queimados nos geradores de vapor, traduz-se pela formação de misturas complexas de sulfatos e vanadatos alcalinos, que arrastadas pelos gases de combustão, são susceptíveis de se depositar nas superfícies de permuta a alta temperatura [1-3]. Por vezes, resultam corrosões significativas ao nível dos sobreaquecedores e aquecedores que podem conduzir a indisponibilidades de material necessário para a substituição de tubos que só pode efectuar-se quando a tarefa operativa é concluída [4, 5]. As três etapas destas corrosões são as seguintes: (1) depósito salino a partir da fase de vapor; (2) equilíbrio entre as fases sólida e líquida em função da temperatura da superfície e da composição química e (3) corrosão electroquímica de materiais metálicos na fase fundida.
Estes meios complexos têm composições variáveis e mal conhecidas. Uma primeira aproximação ao seu estudo consiste em examinar as propriedades respectivas dos seus constituintes e, mais particularmente, dos vanadatos alcalinos, uma vez que a experiência tem mostrado que a corrosão é tanto mais agressiva quanto mais elevada é a relação vanádio/sódio. Num primeiro período, houve interesse na determinação de propriedades químicas e electroquímicas de metavanadato de sódio, NaVO3, fundido, o qual é frequentemente detectado nos depósitos, assim como no comportamento de diversos materiais metálicos nesse meio cuja interpretação está ligada ao conhecimento dos mecanismos de corrosão [6-8].
Este artigo consiste numa revisão de vários trabalhos sobre a corrosão de metais em vanadatos fundidos realizados ao longo das últimas décadas pelo primeiro autor e outros membros do Grupo de Electroquímica de Materiais, MEG, do Instituto Superior Técnico e pretende resumir as suas principais conclusões.
A necessidade para melhor localizar os fenómenos e de operar a temperaturas ligeiramente mais baixas compatíveis com as dos tubos de permuta em funcionamento a cerca de 600 ºC conduziu-nos a considerar um solvente mais complexo que o eutéctico binário NaVO3 + Na2SO4 (86 % M em vanadato).
2. PROPRIEDADES FÍSICAS ESSENCIAIS DO NaVO3 FUNDIDO
Um estudo preliminar indispensável consistiu na medida da massa volúmica, da tensão de vapor e da condutibilidade eléctrica do meio fundido em função da temperatura [9-11].
O conhecimento da massa volúmica é necessário ao estudo das reacções em solução que faz apelo à noção de concentração molar. Entre 700 e 1000 ºC:
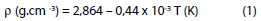
A medida da tensão de vapor mostra que o solvente é estável a alta temperatura. Entre 980 e 1200 ºC:
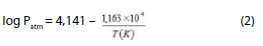
Os valores apreciáveis da condutibilidade eléctrica confirmam a hipótese do carácter iónico do NaVO3 fundido entre 650 ºC e 1100 ºC:
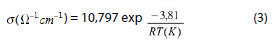
3. ANÁLISE DAS REACÇÕES EM MEIO DE NaVO3 FUNDIDO
Considerações teóricas sobre as reacções ácido-base nos solventes oxigenados fundidos a propósito do desempenho da partícula O2- solvatada conduzem a considerar o equilíbrio químico ao nível do solvente NaVO3 sob a forma [12, 13]:

A constante de dissociação correspondente traduz a amplitude da escala de acidez ou de pO2- (transposição da noção de pH dos meios aquosos):

e do número de unidades de pO2-:

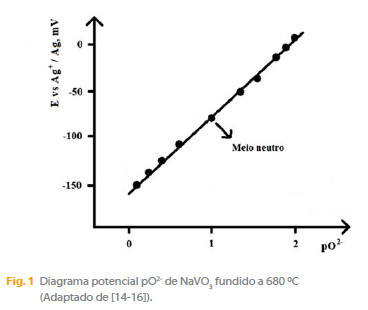
limitando as concentrações da base forte (O2-) e do ácido forte (V2O5) a valores molares (1 M). Resultados descritos em publicações dos autores [14, 15], com o apoio do Manual 2.1 de Bale e colaboradores [16], permitem-nos traçar a Figura 1 que indica os valores de potencial e pO2- para os domínios de acidez e basicidade do metavanadato de sódio fundido.
Os estudos electroquímicos foram conduzidos a 680 ºC usando métodos clássicos (traçado de curvas de polarização, potenciometria, determinação das correntes de corrosão) com ajuda duma montagem de três eléctrodos conduzida por um potenciostato e controlada por um milivoltímetro digital, sendo o eléctrodo de referência do tipo Rey- Danner [17], baseado no sistema Ag+/Ag.
O domínio de electroactividade, independente do pO2-, é da ordem de 450 mV e mostra o carácter facilmente redutível do meio (Fig. 2). Para o traçado da Figura 2 recorreu-se ao Manual de Bale e colaboradores [16].
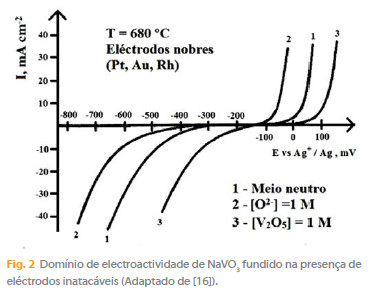
A oxidação anódica do NaVO3 conduz a uma libertação de oxigénio de acordo com as reacções:

O domínio de acidez deduzido de medidas potenciométricas a corrente nula usando um eléctrodo de platina onde opera o sistema O2/O2-, traduz-se por uma escala de pO2- da ordem de 2 unidades. Em meio neutro, tem-se portanto [O2-] = [V2O5] = 10-1 M, o que implica uma notável dissociação ácido-base (Fig. 1).
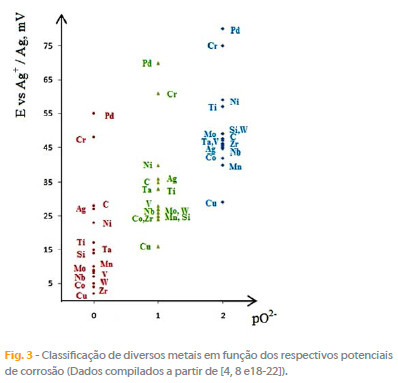
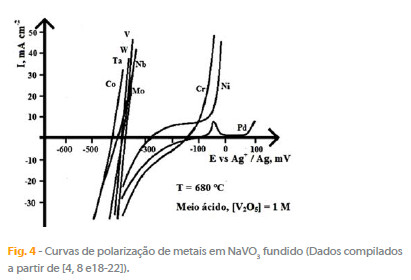
O comportamento de diversos metais puros estudado por meio do traçado de curvas de potenciometria e de polarização permitem uma classificação comparativa desses metais, a oxidabilidade aumentando dos metais nobres Pt, Au, Rh, em geral isentos de ataque, para os mais corrosivos: cobre e metais refractários. Recorrendo aos estudos dos autores [4, 8] e a dados compilados da literatura [18-22] foi possível estimar os potenciais de corrosão e os correspondentes valores de pO2- para uma serie de metais puros imersos em NaVO3 fundido a 680 ºC (Fig. 3), bem como obter informação cinética do comportamento desses metais por via de curvas de polarização (Fig. 4).
4. COMPORTAMENTO EXPERIMENTAL DE DIVERSOS AÇOS E LIGAS
Medidas electroquímicas e estudos de corrosão estáticos e isotérmicos foram efectuados usando compostos metálicos diversos (aços e outras ligas), de fabricação industrial, susceptíveis de serem usados nos geradores de vapor [23-28], tais como ferro-aço ordinário e pouco ligado, aços ferríticos e martensíticos de crómio e ligas (inconel, incoloy, monel e Ni-Cr 50/50 e 80/20).
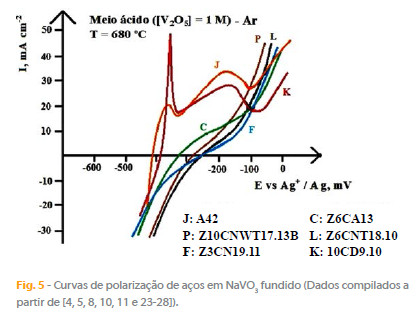
Estes materiais foram testados em NaVO3 puro e modificado pela adição de óxidos metálicos para alterar o pO2- do solvente. Detalhes dos procedimentos experimentais e dos materiais utilizados poderão ser consultados nas referências previamente publicadas [4, 5, 8, 10, 11 e 23-28]. A Figura 5 mostra curvas de polarização em NaVO3 ácido, a 680 ºC, para aços ferríticos e martensíticos de crómio, que reproduzem o comportamento típico das curvas de polarização observadas. A designação dos aços apresentada na Fig. 5 segue as normas AFNOR (Associação Francesa de normalização).
A Tabela 1 indica a composição química dos seis aços identificados e as correspondentes designações de acordo com as normas actuais.
Meios fundidos de diferente acidez foram também ensaiados com os materiais referidos, bem como com outras ligas comerciais [2, 6, 9, 15 e 24]. Essencialmente, os resultados obtidos nos trabalhos citados conduziram a valores para os potenciais de corrosão a variarem de 5 a 75 mV (vs. EAg+/Ag), como se mostra nas Figuras 4 e 5, e fizeram sobressair os seguintes pontos principais:
- As ligas são as que apresentam melhor comportamento anticorrosivo, particularmente as de níquel-crómio 50-50 at%;
- Os aços austeníticos inoxidáveis e refractários têm comportamentos semelhantes, corroendo-se de forma apreciável, mas menos que os ferríticos e martensíticos de crómio que têm uma ligeira tendência à passivação em meio básico;
- Os aços ordinários e pouco ligados são rapidamente e notoriamente corroídos;
- O crómio é certamente o elemento mais favorável para minimizar a corrosão no vanadato fundido, minimização que progride à medida que aumenta o teor em crómio dos materiais;
- O níquel é um elemento igualmente favorável mas a minimização da corrosão não progride à medida que aumenta a concentração de níquel nos materiais testados;
- Molibdénio, nióbio e tungsténio não inibem a corrosão no vanadato fundido, mas a estabilização por acção do titânio favorece francamente o comportamento dos aços;
- As amostras metálicas com um baixo teor de carbono (0,03 %) resistem melhor à corrosão que as amostras com teores de carbono mais elevados (0,1- 0,2 %);
- As conclusões que precedem aparecem directamente ligadas às condições de oxidabilidade dos elementos puros estudados electroquimicamente [3, 4, 6, 7 e 23];
- O meio fundido NaVO3 ácido (V2O5 =1 M) é o mais corrosivo para a maior parte dos materiais testados;
- A atmosfera gasosa por cima do banho fundido (pressão parcial variável de oxigénio) não altera significativamente o comportamento dos materiais;
- A adição ao solvente de óxidos metálicos com carácter básico ou ácido (CaO, MgO, SiO2, Al2O3, ZrO2), modifica o comportamento à corrosão dos materiais estudados, parecendo que a acção mais favorável é a provocada pela cal (protóxido de cálcio).
5. CONCLUSÕES
A exposição apresentada neste artigo constitui um resumo alargado de trabalhos que o primeiro autor e outros membros do Grupo de Electroquímica de Materiais, MEG, do Instituto Superior Técnico, têm vindo a desenvolver ao longo das últimas décadas quer no âmbito das actividades deste grupo, quer noutros âmbitos, particularmente em cooperação com o Materials Research & Development Co. (USA) [29].
Trata-se duma aproximação aos mecanismos de corrosão pelos vanadatos alcalinos fundidos. As conclusões aqui expostas demonstram a acção corrosiva de tais compostos evidenciando algumas possibilidades de passivação mais afirmativas. No entanto, deve ter-se em atenção que a noção de passivação não tem exactamente o mesmo significado em meios fundidos a altas temperaturas, como em meios aquosos a baixas temperaturas [4].
REFERÊNCIAS
[1] C. A. C. Sequeira, Técnica, 91 (1), 27-30 (1991). [ Links ]
[2] G. Y. Lai (High-Temperature Corrosion and Materials Applications), ASM International, Materials Park, Ohio, USA (2007). [ Links ]
[3] W. Gao and Z. Li (Development in High-Temperature Corrosion and Protection of Materials), Woodhead Publishing Ltd., Abington, Cambridge CB21, UK (2008). [ Links ]
[4] C. A. C. Sequeira (High Temperature Corrosion in Molten Salts), Trans. Tech. Publications, Uetikon-Zuerich (2003). [ Links ]
[5] C. A. C. Sequeira, Molten Salt Forum, 7, 105-115 (2003). [ Links ]
[6] C. A. C. Sequeira and G. S. Picard, (Electrochemical Technology of Molten Salts), Trans. Tech. Pubications, Aedermannsdorf-Switzerland (1993). [ Links ]
[7] C. A. C. Sequeira, Técnica, 37 (429), 33-46 (1975). [ Links ]
[8] M. M. S. Puga and C. A. C. Sequeira, (Free corrosion potential measurements of nickel, cobalt and iron in sulphate-vanadatevanadium melts), in 4th Annual Meeting of The Portuguese Chemical Society, Lisbon, Portugal (1981). [ Links ]
[9] Y-S. Hwang and R. A. Rapp, Corrosion-NACE, 45 (11), 933-937 (1989). [ Links ]
[10] C. A. C. Sequeira and F.D.S. Marquis, (Transition semiconductivity of vanadic melts) in Progress in the Understanding and Prevention of Corrosion, Vol 1, The Institute of Materials, London, pp. 730 – 735 (1993). [ Links ]
[11] C. A. C. Sequeira, Y. Chen and F. D. S. Marquis, Molten Salt Forum, 7, 335- 348 (2003). [ Links ]
[12] C. A. C. Sequeira and M. G. Hocking, Electrochim. Acta, 22 (10), 1161- 1165 (1977). [ Links ]
[13] C. A. C. Sequeira and M. G. Hocking, Br .Corros. J., 12 (3), 158-162 (1977). [ Links ]
[14] C. A. C. Sequeira, Br. Corros. J.,16 (2), 94-101 (1981). [ Links ]
[15] C. A. C. Sequeira e M. T. Águas da Silva, Corros. Prot. Mater., 2 (4), 12-26 (1983). [ Links ]
[16] C. W. Bale, A. D. Pelton and W. T. Thompson, (Facility for the analysis of chemical thermodynamics) in Manual 2.1, École Polythecnique de Montreal, McGill University, Montreal (1996). [ Links ]
[17] G. Danner and M. Rey, Electrochim. Acta, 4 (2), 274-287 (1961). [ Links ]
[18] R. A. Rapp, Corros. Sci., 44 (2), 209-221 (2002). [ Links ]
[19] H. W. Halstead, J. Inst. Fuel, 43 (354), 234-239 (1970). [ Links ]
[20] R. A. Rapp and Y. S. Zhang, Trans. Tech. Publications., 5-6, 25-38 (1998). [ Links ]
[21] T. Tzvetkoff and P. Gencheva, Mat. Chem. Phys., 82 (3), 897-904 (2003). [ Links ]
[22] W. U. Weitao and N. Y. Guo, (High-Temperature Corrosion of Advanced Materials and Protective Coatings), Elsevier Science Publishers B. V., Amsterdam (1992). [ Links ]
[23] C. A. C. Sequeira and F. D. S. Marquis, Sci. Soc. Mech. Eng.,1, 307-312 (1991). [ Links ]
[24] M. Seiersten, H-J. Ratzer-Scheibe and Per Kofstad, Mater. Corros, 38 (9), 532-540 (1987). [ Links ]
[25] F. D. S. Marquis and C. A. C. Sequeira, (Corrosion of silica and alumina in sodium sulphate-vanadium pentoxide melts), in Progress in the Understanding and Prevention of Corrosion, Vol. 1, The Institute of Materials, London, pp 815-820 (1993). [ Links ]
[26] M. M. S. Puga and C. A. C. Sequeira, (Electrode-potential behaviour of reactive metals in sodium sulfate-vanadium pentoxide melts), in 32nd Meeting of the International Society of electrochemistry, September, Dubrovnik, pp.1018-2021 (1981). [ Links ]
[27] A. Bahadori, (Corrosion and Materials Selection), in A Guide for the Chemical and Petroleum Industries, John Wiley e Sons Ltd, Chichester West Sussex, UK (2014). [ Links ]
[28] H. Singh, D. Puri and S. Prakash, Rev. Adv. Mater. Sci., 16 (5), 27-50 (2007). [ Links ]
[29] C. A. C. Sequeira and F. D. S. Marquis, in Internal Report, Montery, CA, USA (2010). [ Links ]
Artigo submetido em Julho de 2014 e aceite em Fevereiro de 2015














