Serviços Personalizados
Journal
Artigo
Indicadores
Links relacionados
Compartilhar
Revista Portuguesa de Saúde Pública
versão impressa ISSN 0870-9025
Rev. Port. Sau. Pub. v.28 n.2 Lisboa dez. 2010
Efeito genotóxico do etanol em neuroblastos de Drosophila melanogaster
Ilda Patrícia Ribeiroa, Isabel Gaivãob
aDepartamento de Genética e Biotecnologia (DGB), Universidade de Trás–os–Montes e Alto Douro, Vila Real, Portugal, ildaribeiro.patricia@gmail.com
bDepartamento de Genética e Biotecnologia (DGB), Universidade de Trás–os–Montes e Alto Douro, Vila Real, Portugal. Centro de Ciência Animal e Veterinária (CECAV), Universidade de Trás–os–Montes e Alto Douro, Vila Real, Portugal
Resumo
Introdução: O cérebro é um importante alvo do etanol, sendo o consumo excessivo de álcool associado a danos cerebrais. Tem sido demonstrado que os produtos do metabolismo do etanol promovem alterações no DNA. Desta forma, e apesar de se verificar em Portugal uma tendência para a diminuição do consumo de álcool, pensamos ser pertinente a realização deste estudo.
Objectivo: Avaliar a toxicidade e o potencial efeito genotóxico do etanol em Drosophila melanogaster in vivo utilizando o ensaio do cometa.
Métodos: Realizou–se um estudo de toxicidade para o etanol com as concentrações de 0 %; 0,625 %; 1,25 %; 2,5 % e 5 % (v/v), administradas de forma crónica, seguindo–se a contagem dos descendentes adultos para a avaliação da sobrevivência relativa das drosófilas nas diferentes concentrações de etanol. Seguidamente, utilizaram–se neuroblastos de drosófila para a avaliação do efeito genotóxico pelo ensaio do cometa (ensaio de electroforese de células isoladas). Os danos de DNA são reportados através dos seguintes parâmetros: comprimento da cauda, percentagem de DNA na cauda e momento de cauda.
Resultados: O etanol não apresentou toxicidade para a D. melanogaster, verificando–se, pelo contrário, um aumento no número de descendentes em todas as concentrações de etanol testadas, mostrando–se, portanto a presença de etanol benéfica em termos de número de descendentes. A sobrevivência superior ocorreu na concentração de 1,25 %, uma vez que é nesta concentração que se encontraram mais descendentes. No entanto, em termos de genotoxicidade constatou–se nos parâmetros avaliados no ensaio do cometa que, de uma forma genérica, quanto maior a concentração de etanol mais danos são infligidos ao DNA. O etanol evidenciou um efeito genotóxico nas três concentrações mais elevadas em estudo (1,25 %; 2,5 % e 5 %). Os danos foram superiores para a concentração de 5 % de etanol. Por outro lado, a concentração de etanol de 0,625 % não se mostrou genotóxica.
Conclusões: A D. melanogaster exposta a diferentes concentrações de etanol manifestou um aumento significativo de danos no DNA, ao nível dos neuroblastos, verificando–se um aumento dose–dependente, nos parâmetros do ensaio do cometa avaliados. Foi, portanto possível demonstrar que o etanol provoca rupturas no DNA, avaliadas pela presença de cometas.
Palavras-chave: Etanol, Genotóxico, D. melanogaster, Ensaio do Cometa.
Genotoxic effect of ethanol in Drosophila melanogaster neuroblasts
Abstract
Introduction: The brain is an important target to ethanol, being the excessive consumption of alcohol related to brain damage. It has been shown that the metabolic products of ethanol induce DNA alterations. Thus, although in Portugal the consumption of alcohol is decreasing, we believe that the present study is pertinent.
Purpose: To assess the toxicity and the genotoxicity of ethanol in Drosophila melanogaster in vivo using the comet assay.
Methods: The toxicity study of ethanol at 0 %; 0.625 %; 1.25 %; 2.5 % and 5 % (v/v) was conducted; then, we counted the adult descendents to assess the rate of survival of drosophilas in the different concentrations of ethanol. Afterwards, the neuroblasts of drosophila were used to evaluate the genotoxicity of ethanol using the comet assay (single–cell gel electrophoresis). The DNA damage was quantified by determining the following parameters: the percentage of DNA in the tail, tail length, and tail moment.
Results: Ethanol did not present toxicity to D. melanogaster, as the number of descendents were higher in all the concentrations tested comparatively to 0 %, hence, the presence of ethanol was beneficial. The higher survival rate was observed in the concentration of 1.25 %, as in this concentration the number of descendents was higher. The parameters assessed by the comet assay showed that in general higher DNA damage is induced by higher concentrations of ethanol. Ethanol showed genotoxicity in the higher concentrations used in the present study (1.25 %, 2.5 %, 5 %). The damages in DNA were superior in the ethanol concentration of 5 %. Conversely, the ethanol concentration of 0.625 % was not genotoxic.
Conclusions: The D. melanogaster exposed to different concentrations of ethanol revealed a significant increase in the DNA damage, in neuroblasts, being observed a dose–dependent increase in all the parameters assessed in the comet assay. Thus, the present study demonstrated that ethanol induces DNA ruptures, assessed by the presence of comets.
Keywords: Ethanol, Genotoxic, D. melanogaster, Comet assay.
Introdução
A organização mundial de saúde estima que, em todo o mundo, existem cerca de 2 milhares de milhão de pessoas a consumir bebidas alcoólicas, 76,3 milhões com diagnóstico de desordens associadas ao uso de álcool e ainda que o consumo de álcool causa 1,8 milhões de mortes 1.
O consumo de álcool tem efeito deletério em vários órgãos, nomeadamente no fígado e no Sistema Nervoso Central (SNC), originando efeitos adversos agudos e crónicos 2-4, sendo o cérebro um importante alvo do etanol 5. O etanol actua no SNC induzindo diversas respostas comportamentais 6-8. Em doses baixas induz euforia e desinibição, mas em doses elevadas provoca perda do controlo motor, sedação, podendo mesmo ser fatal 9. Adicionalmente, o consumo excessivo de álcool tem sido associado a danos cerebrais 5. De facto, os produtos do metabolismo do etanol promovem alterações no DNA 5, tendo sido demonstrado por Blasiak e colaboradores 10, em 2000, que a genotoxicidade do etanol pode contribuir para a morte celular.
Apesar de em Portugal se verificar uma diminuição no consumo de álcool 11, existe a necessidade de pesquisas que visem a compreensão das doenças ligadas ao uso excessivo de etanol com o intuito de desenvolver estratégias efectivas para prevenir e tratar os diferentes tipos de doenças provocadas pelo álcool. Os pacientes com doenças relacionadas com o álcool apresentam grande impacto na medicina clínica, tendo sido reportado em artigo de revisão que cerca de 8 % dos internamentos hospitalares em Portugal apresentam diagnóstico principal e/ou secundário relacionados com o álcool 12. Deste modo, a investigação científica, com recurso a organismos modelo, surge como uma mais-valia na avaliação e compreensão dos mecanismos de acção dos compostos químicos sobre o DNA. No caso do etanol, poderá ajudar a delinear estratégias que visem o combate das diferentes doenças provocadas pelo etanol nos humanos. Entre estes a D. melanogaster, como oferece uma grande variedade de mutantes disponíveis, um leque de ensaios optimizados e acesso a bases de dados, torna-se, assim, um excelente modelo para investigar mecanismos fisiológicos e genéticos fundamentais e tem sido adoptada para estudar substâncias com efeito aditivo como o álcool, cocaína e metanfetaminas 13-15. De facto, a drosófila é considerada um excelente modelo para estudar a genotoxicidade e os seus mecanismos moleculares, podendo fornecer respostas relevantes, que podem ser extrapoladas para os humanos. Uma vez que a comparação dos dados obtidos através do Projecto Genoma Humano com aqueles observados no programa equivalente desenvolvido com a D. melanogaster demonstra a elevada conservação de genes e funções bioquímicas entre estes dois organismos, caracterizada por uma similaridade genética de 80 %. Embora os humanos apresentem maior número de genes a maioria destes são duplicações dos seus equivalentes encontrados na drosófila 16. Como consequência, existe uma elevada conservação de vias bioquímicas e funções reguladoras entre as duas espécies 17. Todos os organismos produzem etanol em pequenas quantidades nos seus tecidos 18. Este aspecto explica a presença da enzima catabólica de degradação do etanol, álcool desidrogenase (ADH), em todas as espécies animais. Portanto, não é de estranhar que a principal via metabólica para o etanol seja conservada entre seres humanos e D. melanogaster 18.
Desta forma, pelos potenciais efeitos deletérios que o consumo de álcool apresenta a nível celular com consequente implicação no bem-estar físico e psico-social do indivíduo achamos pertinente realizar este estudo, que tem por objectivo a avaliação da toxicidade e do potencial efeito genotóxico do etanol em D. melanogaster.
Materiais e métodos
Neste estudo em modelo animal, utilizou-se a D. melanogaster da linha Oregon K-yellow (OK-y), eficiente para todo o tipo de mecanismos de reparação. As culturas de drosófila foram mantidas em meio de cultura estandardizado; contendo levedura de pão, açúcar branco, agar-agar, e ácido propiónico, a 24 ºC, em frascos de vidro. Todos os procedimentos foram efectuados de acordo com as normas internacionais para experimentação animal.
Adição de etanol ao meio de drosófila
Etanol absoluto (número CAS 64-17-5) foi adicionado ao meio de D. melanogaster em quatro concentrações e controlo: 0 %; 0,625 %; 1,25 %; 2,5 % e 5 % (v/v). Deste modo, a cada frasco de cultura com 30 mL de meio adicionou-se o respectivo volume de etanol, agitou-se e taparam-se os frascos com algodão. Em cada frasco colocaram-se 100 casais de drosófilas, todas com a mesma idade. Após 6 dias em postura retiraram-se os progenitores deixando-se as larvas a desenvolverem-se no mesmo meio de cultura, ou seja, um tratamento crónico, durante todo o desenvolvimento da larva. O ensaio foi realizado em duplicado.
Contagem de adultos eclodidos após tratamento com etanol
O número de adultos eclodidos foi contado em cada frasco e em cada concentração, de modo a fazer uma avaliação semi-quantitativa da toxicidade.
Ensaio do "Cometa"
Aquando da obtenção de larvas no 3º estádio de desenvolvimento, procedeu-se à realização do ensaio do cometa (ensaio de electroforese de células isoladas). Este, inicialmente descrito em 1988 por Singh e outros 19, foi realizado de acordo com as modificações introduzidas por Collins e outros 20, em 2003 e, adaptado para drosófila, em 2005 por Siddique e outros 21. Assim as larvas no 3º estádio de desenvolvimento foram dissecadas em solução de Ringer para insectos (pH 7,2: NaCl 46 mM; KCl 182 mM; CaCl2 13 mM), à lupa e com iluminação por transmissão, com ajuda de duas agulhas. Uma vez isolados os lóbulos cerebrais foram colhidos com uma agulha e colocados num vidro de relógio até se completar lóbulos de três larvas, seguindo-se a sua desagregação física, com as agulhas e a precipitação das células por centrifugação (durante 10 minutos a 200 x g) descartando-se o sobrenadante. Durante este processo os tubos de Eppendorf foram mantidos em gelo, para evitar danos no DNA devido ao calor. Em seguida, adicionou-se ao tubo do passo anterior, 140 μL de agarose 1 % LMP (low melting point), previamente aquecida e mantida a 37 ºC. Recolheram-se os 140 μL da mistura e transferiram-se como duas gotas aproximadamente iguais em cada lâmina. Estas foram tapadas com uma lamela 18 x 18 mm e colocadas no frigorífico durante 5 minutos. As lâminas solidificadas, sem as lamelas foram imersas durante 1 hora na solução de lise, fria e feita recentemente: 89 % de tampão de lise (pH 10,0: 2,5 mM NaCl, 100 mM Na2EDTA, 10 mM Tris, 0,25 M NaOH, 0,77 % N-laurylsarcosinato), 1 % TritonX-100 e 10 % dimetil sulfoxido (DMSO). Após a lise, as lâminas foram colocadas numa tina de electroforese horizontal evitando espaços vazios, e cobertas por tampão alcalino de electroforese, a 4 ºC e feito recentemente (75 mL de NaOH 10 M, 5 mL de EDTA 0,5 M), durante 20 minutos para permitir a desnaturação do DNA. Este processo decorreu a pH > 12,6. A desnaturação e electroforese foram processadas a 4 ºC. Após a electroforese, realizada durante 20 minutos a 25 V e 300 mA, a qual corresponde a um campo eléctrico de 1,04 V/cm, as lâminas foram neutralizadas durante 5 minutos numa solução de 0,4 M Tris-HCl, pH 7,5; seguiu-se mais 5 minutos em água destilada, sendo depois colocadas a secar à temperatura ambiente numa caixa de plástico. A coloração foi efectuada com SYBR Gold (Invitrogen, Paisley, United Kingdom) e a visualização das lâminas foi realizada num microscópio de fluorescência com uma ampliação de 400x com o programa Comet Assay IV (Perceptive instruments, Haverhill, United Kingdom). Foram avaliadas 50 células por gel.
Análise estatística
A análise estatística deste trabalho foi realizada utilizando o software para estatística SPSS versão 16,0. Fez-se uma análise exploratória para verificar a presença de outliers e a normalidade de distribuição dos dados (teste de Shapiro-Wilk). A descrição dos dados é efectuada através da média e do desvio padrão. Para avaliar a viabilidade das concentrações de etanol utilizadas, calculou-se a taxa de sobrevivência relativa da D. melanogaster, representando a razão entre o número de indivíduos eclodidos em cada concentração de etanol e o controlo. A comparação entre os danos no DNA observados em cada concentração de etanol foi efectuada através da análise de variância a 1 factor. Para localizar as diferenças utilizou-se como Post Hoc Tests o teste de Bonferroni. O nível de significância foi estabelecido em 5 %.
Resultados
Toxicidade do etanol em D. melanogaster
Realizou-se um estudo de toxicidade, onde as concentrações de etanol utilizadas (0,625 %; 1,25 %; 2,5 % e 5 %) não se apresentaram tóxicas. Como demonstrado na figura 1, as D. melanogaster sobreviveram e originaram descendência em todas as concentrações de etanol testadas permanecendo assim, vivas na sua totalidade.
Número de indivíduos eclodidos e taxa de sobrevivência relativa da D. melanogaster nas diferentes concentrações de etanol.

Nota: A taxa de sobrevivência relativa representa a razão entre o número de indivíduos eclodidos em cada concentração de etanol e o controlo.
Na figura 1 verifica-se que a taxa de sobrevivência relativa das drosófilas é superior na concentração de etanol de 1,25 %, comparativamente às outras concentrações testadas. Verificando-se igualmente que de todas as concentrações de etanol testadas, aquela que apresenta menor benefício para as drosófilas é a concentração mais elevada (5 %), e ainda que a menor taxa de sobrevivência relativa encontra-se na ausência de etanol.
Genotoxicidade do etanol em D. melanogaster — Ensaio do Cometa
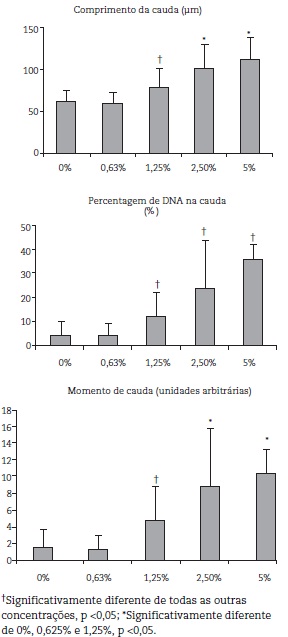
Neuroblastos de D. melanogaster OK-y foram utilizados para realizar o ensaio do cometa, de forma a avaliar o efeito das diferentes concentrações de etanol testadas, ao nível do DNA. Pela análise dos resultados obtidos para as diferentes concentrações de etanol de um modo geral verifica-se que o ensaio do cometa permitiu determinar a existência de um aumento de danos no DNA induzidos pelo etanol, que se verificou genotóxico nas três concentrações superiores testadas (1,25 %; 2,5 % e 5 %). Estes resultados encontram-se bem patentes na figura 2 para os três parâmetros avaliados com este teste: comprimento da cauda, percentagem de DNA na cauda e momento de cauda.
Efeitos do etanol ao nível do cérebro de D. melanogaster, avaliados pelo comprimento da cauda, percentagem de DNA na cauda e momento de cauda.
Discussão
Toxicidade do etanol em D. melanogaster
Após o estudo de toxicidade, e tendo em conta que as concentrações de etanol utilizadas (0,625 %; 1,25 %; 2,5 % e 5 %) não se apresentaram tóxicas para a D. melanogaster, foi possível prosseguir a experiência com estas concentrações de etanol. Deste modo, após o desenvolvimento da prole efectuou-se o estudo dos efeitos das concentrações de etanol testadas, ao nível do número de descendentes gerados. Assim, para além de se verificar que as concentrações de etanol testadas não são tóxicas para a D. melanogaster, podemos igualmente inferir que a presença de etanol é benéfica, visto o número de indivíduos eclodidos ser superior em todas as concentrações de etanol, comparativamente ao controlo (fig. 1). De todas as concentrações testadas, aquela que apresenta maior benefício é a concentração de 1,25 % de etanol, pois é nesta concentração que se encontram mais descendentes. Deste modo será legítimo afirmar que na presença de concentrações moderadas de etanol as drosófilas aumentam o número de descendentes e portanto a sua sobrevivência.
Estes resultados estão de acordo com o esperado, tendo em conta que, durante a vida larvar a D. melanogaster está continuamente exposta a etanol exógeno 22 e portanto a sobrevivência e o vigor das larvas depende em parte da sua capacidade em utilizar o etanol como fonte de alimento. Normalmente, as concentrações de etanol são bastante baixas e as concentrações superiores a 5 % estão raramente presentes no habitat natural 23. Os nossos resultados vão de encontro ao reportado por Hoffmann e Parsons 24, que afirmaram que para as drosófilas fêmeas baixas concentrações de etanol apresentam efeito benéfico (0,1-5 %), enquanto elevadas concentrações (10 %) são prejudiciais.
Em suma, as concentrações de etanol (0,625 %; 1,25 %; 2,5 % e 5 %), não se mostraram tóxicas para a D. melanogaster, visto estas terem sobrevivido e originado descendência, na sua presença.
Genotoxicidade do etanol em D. melanogaster — Ensaio do Cometa
A genotoxicidade manifesta-se em doses sub-tóxicas, sobretudo num ensaio muito sensível como é o cometa, o que reforça a necessidade de avaliar o efeito genotóxico, pois os danos no DNA se não forem reparados, podem dar origem a mutações que podem ser responsáveis por várias doenças. O ensaio do cometa permitiu avaliar o efeito das diferentes concentrações de etanol testadas, ao nível do DNA, verificando-se de uma forma genérica que quanto maior a concentração de etanol maior é a genotoxicidade expressa pelos danos infligidos ao DNA.
A concentração de etanol de 0,625 % não se mostrou genotóxica, uma vez que os danos no DNA observados nesta concentração não são estatisticamente diferentes dos observados no grupo controlo. Os danos obtidos no controlo podem ser atribuídos a uma combinação de danos endógenos, gerados pelo stress oxidativo e de rupturas induzidas no processo de reparação destes danos endógenos. Do mesmo modo o isolamento dos lóbulos cerebrais e a sua desagregação requereu manipulação, o que poderá também ter infligido danos. As concentrações de 1,25 %, 2,5 % e também 5 % de etanol produziram danos significativos no DNA. Para o comprimento da cauda, percentagem de DNA na cauda e momento de cauda (fig. 2) observou-se nitidamente uma relação dose-resposta, isto é, um aumento dos valores relativos a estes parâmetros com o aumento da concentração do etanol, ocorrendo, portanto, rupturas na cadeia e, assim, migração do DNA com o aumento da concentração.
Os nossos resultados vão de encontro aos descritos na literatura. Estudos experimentais mostraram uma ampla gama de alterações estruturais e funcionais em neurónios 25. Estes efeitos deletérios podem resultar de um efeito tóxico directo do álcool ou de um efeito indirecto envolvendo um dos seus metabolitos. Em 1995, Singh, Lai e Khan 25, num estudo in vivo em ratos demonstraram, que ocorriam quebras na cadeia de DNA em células cerebrais 4 horas após a administração de etanol. Lamarche e colaboradores 5, em 2003, confirmaram a genotoxicidade do etanol em cultura de células cerebrais. Os autores avaliaram as alterações no DNA pelo ensaio do cometa e demonstraram que quando a intoxicação aguda ocorre por um período curto/moderado, o aumento de lesões do DNA não excede a capacidade dos sistemas de reparação celular, e as consequências para a célula permaneceram mínimas. Assim, estes autores constataram que os neurónios são mais sensíveis a uma baixa exposição crónica de etanol do que a uma grande exposição aguda. Embora, em ambas, tenha sido observada uma redução significativa da viabilidade celular e alterações no DNA.
O potencial genotóxico do etanol foi demonstrado em diferentes células 26 ou em neurónios em diferentes condições de exposição 27, e quantificados pela determinação da percentagem de DNA na cauda, que é directamente relacionada com a frequência de quebra de DNA. Ao nível hepático, por exemplo, tem sido demonstrada a formação de quebras na cadeia de DNA nuclear e mitocondrial e de aductos de DNA 26.
Os neurónios são sensíveis ao excesso de etanol, o que leva a neuropatologias progressivas e alterações funcionais. Contudo, na prática, é difícil especificar os níveis de consumo de bebidas alcoólicas que são susceptíveis de conduzir à morte neuronal induzida por etanol, sendo necessários futuros estudos para elucidar este aspecto.
Conclusões
Com este trabalho experimental foi possível concluir que a D. melanogaster exposta a diferentes concentrações de etanol, manifestou um aumento significativo de danos no DNA, ao nível dos neuroblastos, verificando-se um aumento dose-dependente, nos parâmetros do ensaio do cometa avaliados (comprimento da cauda, percentagem de DNA na cauda e momento de cauda). Foi, portanto possível demonstrar que o etanol provoca rupturas no DNA, avaliadas pelo ensaio do cometa; sendo estes danos superiores para a concentração de 5 % de etanol.
Conflito de interesse
Os autores declaram não haver conflito de interesse.
Bibliografía
1. WHO. Global status report on alcohol policy. Geneva: World Health Organization Press; 2004.
2. Lieber CS. Alcoholic fatty liver: its pathogenesis and mechanism of progression to inflammation and fibrosis. Alcohol. 2004;34: 9–19. [ Links ]
3. Lieber CS. Metabolism of alcohol. Clin Liver Dis. 2005;9: 1–35. [ Links ]
4. Schuppan D, Atkinson J, Ruehl M, Riecken EO. Alcohol and liver fibrosis–pathobiochemistry and treatment. Z Gastroenterolog. 1995;33:546–50. [ Links ]
5. Lamarche F, Gonthier B, Signorini N, Eysseric H, Barret L. Acute exposure of cultured neurones to ethanol results in reversible DNA single–strand breaks; whereas chronic exposure causes loss of cell viability. Alcohol Alcohol. 2003;38:550–8. [ Links ]
6. Koob GF. A role for GABA mechanisms in the motivational effects of alcohol. Biochem Pharmacol. 2004;68:1515–25. [ Links ]
7. Lovinger DM, Crabbe JC. Laboratory models of alcoholism: treatment target identification and insight into mechanisms. Nat Neurosci. 2005;8:1471–80. [ Links ]
8. Weiss F, Porrino LJ. Behavioral neurobiology of alcohol addiction: recent advances and challenges. J Neurosci. 2002;22:3332–7. [ Links ]
9. Lee HG. Young–Cho Kim, Y–C, Dunning, JS, Han, K–A. Recurring ethanol exposure induces disinhibited courtship in Drosophila. PLoS One. 2008;3(1):e1391. doi:10.1371/journal.pone.0001391. [ Links ]
10. Blasiak J, Trzeciak A, Malecka–Panas E, Drzewoski J, Wojewódzka M. In vitro genotoxicity of ethanol and acetaldehyde in human lymphocytes and the gastrointestinal tract mucosa cells. Toxicol in Vitro. 2000;14:287–95. [ Links ]
11. IAS. Alcohol consumption and harm in the UK and EU. St Ives, Cambridgeshire: Institute of Alcohol Studies; 2009.
12. Matos LC. Doença hepática alcoólica (DHA). Medicina Interna. 2006;13:207–16. [ Links ]
13. Andretic R, Van Swinderen B, Greenspan RJ. Dopaminergic modulation of arousal in Drosophila. Curr Biol. 2005;15: 1165–75. [ Links ]
14. McClung C, Hirsh J. Stereotypic behavioral responses to free–base cocaine and the development of behavioral sensitization in Drosophila. Curr Biol. 1998;8:109–12. [ Links ]
15. Wolf FW, Heberlein U. Invertebrate models of drug abuse. J Neurobiol. 2003:54:161–78. [ Links ]
16. Miklos GL, Rubin GM. The role of the genome project in determining gene function: insights from model organisms. Cell. 1996;86:521–9. [ Links ]
17. St. John MAR, Xu T. Insights from model systems: understanding human cancer in a fly? Am J Hum Genet. 1997;61:1006–10. [ Links ]
18. Holmes RS. Alcohol dehydrogenases: a family of isozymes with differential functions. Alcohol Alcohol Suppl. 1994;2:127–30. [ Links ]
19. Singh NP, McCoy MT, Tice RR, Schneider EL. A simple technique for quantitation of low levels of DNA damage in individual cells. Exp Cell Res. 1988;175:184–91. [ Links ]
20. Collins AR, Harrington V, Drew J, Melvin R. Nutritional modulation of DNA repair in a human intervention study. Carcinogenesis. 2003;24:511–5. [ Links ]
21. Siddique HR, Chowdhuri DK, Saxena DK, Dhawan A. Validation of Drosophila melanogaster as an in vivo model for genotoxicity assessment using modified alkaline Comet assay. Mutagenesis. 2005;20:285–90. [ Links ]
22. Geer BW, Heinstra PW, Mckechnie SW. The biological basis of ethanol tolerance in Drosophila. Comp Biochem Physiol B. 1993;105: 203–29. [ Links ]
23. Gibson JB, Oakeshott JG. Genetics of biochemical and behavioural aspects of alcohol metabolism. Aust N Z J Med. 1981;11128–31. [ Links ]
24. Hoffmann AA, Parsons PA. Olfactory response and resource utilization in Drosophila: interspecific comparision. Biological Journal of the Linnean Society.1984;22:43–53. [ Links ]
25. Singh NP, Lai H, Khan A. Ethanol–induced single–strand DNA breaks in rat brain cells. Mutat Res. 1995;345:191–6. [ Links ]
26. Navasumrit P, Ward TH, O''Connor PJ, Nair J, Frank N, Bartsch H. Ethanol enhances the formation of endogenously and exogenously derived adducts in rat hepatic DNA. Mutat Res. 2001;479:81–94. [ Links ]
27. Vaudry D, Rousselle C, Basille M, Falluel–Morel A, Pamantung TF, Fontaine M, et al. Pituitary adenylate cyclase–activating polypeptide protects rat cerebellar granule neurons against ethanol–induced apoptotic cell death. Proc Natl Acad Sci U SA. 2002;99:6398–403. [ Links ]
Recebido em 21 de Janeiro de 2010
Aceite em 8 de Julho de 2010













