Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Acessos
Acessos
Links relacionados
-
 Similares em
SciELO
Similares em
SciELO
Compartilhar
Revista Portuguesa de Saúde Pública
versão impressa ISSN 0870-9025
Rev. Port. Sau. Pub. vol.34 no.1 Lisboa mar. 2016
https://doi.org/10.1016/j.rpsp.2015.06.005
ARTIGO ORIGINAL
Tuberculose latente em profissionais de saúde: concordância entre 2 testes diagnósticos
Latent tuberculosis (LTB) in healthcare workers: Agreement between two diagnostic tests
Olena Shapovalova a, Ema Sacadura‐Leite a, b, c,*, Luís Mendonça Galaio a, Isabel Pereira a, Regina Rocha a, António Sousa‐Uva b, c
a Serviço de Saúde Ocupacional, Centro Hospitalar Lisboa Norte EPE, Lisboa, Portugal
b Departamento de Saúde Ocupacional e Ambiental, Escola Nacional de Saúde Pública, Universidade NOVA de Lisboa, Lisboa, Portugal
c Centro de Investigação em Saúde Pública, Escola Nacional de Saúde Pública, Universidade NOVA de Lisboa, Lisboa, Portugal
RESUMO
O diagnóstico de tuberculose latente (TL), designadamente em profissionais de saúde, tem sido efetuado ao longo dos anos através da prova de tuberculina (PT). Mais recentemente, surgiram os testes Interferon‐¿ Release Assays (IGRA) que, ao contrário da PT, não positivam com a vacina Bacillus Calmette‐Guérin (BCG) nem com a maioria das micobactérias não tuberculosas.
Na ausência de um gold standard para o diagnóstico de TL, o objetivo deste estudo consistiu em analisar a concordância entre as 2 técnicas de diagnóstico da TL, através da determinação do coeficiente Kappa e da taxa de concordância entre a PT e o teste IGRA em profissionais de saúde de um hospital central universitário português.
Trata‐se de um estudo transversal, retrospetivo, em que se efetuou a análise dos registos das PT e dos testes IGRA realizados em simultâneo (até 15 dias de intervalo) no serviço de saúde ocupacional, em 2010 e 2011 (n = 137).
A grande maioria tinha efetuado BCG e 44,5% tinham efetuado 2 ou mais inoculações. O diâmetro médio da PT foi de 17,5 mm (DP 4,3). Apenas 2 profissionais apresentaram PT < 10 mm, sendo o teste IGRA negativo. Dos 135 participantes com PT positivo, apenas 53 (39,3%) apresentaram também o teste IGRA positivo.
O nível de concordância entre a PT e o teste IGRA foi determinado através do coeficiente Kappa. Respetivamente, para um cut off da PT de 10, de 15 e de 20 mm, os níveis de concordância foram de 0,019 (p = 0,26), 0,19 (p = 0,001) e de 0,26 (p = 0,003). As taxas de concordância foram, respetivamente de 40, 54 e 65%.
Verificou‐se que a concordância entre os 2 métodos aumentou quando o cut off para a PT também aumentou. Contudo, seria expectável uma taxa de concordância mais elevada para cut off‘s de 15 mm e, sobretudo, de 20 mm, uma vez que a vacina BCG administrada na infância habitualmente induz respostas menores. É possível que a existência de mais do que uma inoculação de BCG na amostra estudada, especialmente depois da infância, possa ser responsável pela baixa concordância entre os 2 métodos, não se podendo também excluir a possibilidade de falsos negativos do teste IGRA.
Na decisão de tratar TL, é necessário ter em consideração as limitações de ambos os testes e o seu nível de concordância, devendo ainda ser ponderados fatores individuais, ocupacionais e epidemiológicos.
Palavras‐chave: Tuberculose latente. Profissionais de saúde. Prova tuberculínica. Testes in vitro de libertação do interferão‐gama. Tuberculose.
ABSTRACT
The diagnosis of latent tuberculosis infection (LTBI), namely in healthcare workers, has been done by tuberculin skin test (TST). Recently, Interferon‐¿ Release Assays (IGRA tests) have been introduced. Unlike TST, they do not turn positive after BCG vaccine or after most of non‐tuberculous mycobacteria infections.
In the absence of a gold standard for the diagnosis of LTB, the aim of this study was to analyze the correlation between the two LTB diagnostic techniques, by determining Kappa coefficient and concordance rate between TST and IGRA test, in healthcare workers of a Portuguese university hospital.
We carried out a cross‐sectional and retrospective study, and we analysed TST and IGRA tests records, that are performed simultaneously (up to 15 days apart) in Occupational Health Department, in 2010 and 2011 (n 137).
Most of the sample did BCG and 44.5% did two or more inoculations. The average diameter of PT was 17.5 mm (SD 4.3). Only two subjects reported TST < 10 mm, both showing a negative IGRA test. Only 53 (39.3%) of the 135 participants with positive PT had a positive IGRA test too.
The level of agreement between TST and the IGRA test was determined by Kappa coefficient. Respectively to a cut off for PT of 10 mm, 15 mm and 20 mm, the degree of agreement was 0.019 (p = 0.26), 0,19 (p = 0.001) and 0.26 (p = 0.003). Concordance rates were respectively 40%, 54% and 65%.
It was found that the concordance between the two methods increased as the cut off for TST also increased. Nevertheless, a higher concordance rate would be expected with cut off of 15 mm, and particularly of 20 mm, since BCG vaccine administered in childhood usually induce smaller reactions. The existence of more than one BCG inoculation in the sample, especially after childhood, can be partly responsible for the low concordance between the two methods. Nevertheless, we cannot also exclude IGRA test's false negatives.
In the decision to treat LTB, it is necessary to take into account the limitations of both tests, their level of agreement and weighting individual, occupational and epidemiological factors.
Keywords: Latent tuberculosis infection. Healthcare workers. Tuberculin skin test. Interferon‐¿ release assays. Tuberculosis.
Introdução
A tuberculose (TB) é uma doença infeciosa originada pelo bacilo Mycobacterium tuberculosis (M. tuberculosis) que infeta predominantemente o pulmão, podendo ainda atingir outros órgãos. Em 2012, constituiu a segunda causa de morte no mundo, tendo morrido 1,3 milhões de pessoas devido a esta doença e tendo surgido 8,6 milhões de novos casos1.
Nesse mesmo ano, a incidência de TB ativa em Portugal foi de 22,8 casos/100 000 habitantes2, pelo que Portugal pode ser classificado como um país de média incidência de TB. Contudo, verificaram‐se algumas assimetrias a nível regional, em que as regiões do Porto (incidência de 37,4 casos/100.000 habitantes) e de Lisboa (incidência de 34,9 casos/100.000 habitantes) foram aquelas que apresentaram os valores mais elevados2.
Na tuberculose latente (TL) os indivíduos estão infetados pelo M. tuberculosis, mas o bacilo está controlado pelo sistema imunitário do indivíduo. De facto, o sistema imunitário mantém as bactérias quiescentes, contendo a sua multiplicação e impedindo o desenvolvimento de lesões orgânicas com significado patológico. Dessa forma, não apresenta qualquer sintoma ou sinal de TB ativa e não contagia outros indivíduos3.
Cerca de 10% dos indivíduos infetados, e não tratados, desenvolvem doença ativa durante a sua vida. No entanto, o risco de evolução de TL para TB ativa é mais elevado em indivíduos com sistemas imunitários debilitados ou com exposições recorrentes. Esse risco é superior nos 2 primeiros anos após a ocorrência da infeção primária, declinando nos anos seguintes, a não ser que surja diminuição da atividade do sistema imunitário por fatores diversos, tais como a idade avançada, a desnutrição, doenças concomitantes ou a utilização de fármacos imunossupressores3.
A TB é considerada uma doença profissional em trabalhadores cuja atividade profissional implique exposição ao agente, designadamente em trabalhadores da saúde, e a sua transmissão, nas instituições de saúde, constitui um problema importante. Alguns serviços hospitalares poderão proporcionar maior risco de exposição, especialmente se as medidas de prevenção não estiverem devidamente implementadas4,5.
Em países com uma taxa de incidência inferior a 50/100.000 habitantes, como é o caso de Portugal, a incidência de TB em profissionais de saúde parece ser significativamente superior à da população em geral. Baussano et al. estimaram uma incidência nesse grupo de trabalhadores de aproximadamente 67 casos/100.000 habitantes6. De acordo com Duarte e Diniz7, Portugal tem registado, nos últimos anos, uma incidência inferior de TB entre profissionais de saúde, comparativamente à estimada por Baussano et al., à exceção de 2013, ano no qual se registou uma incidência superior.
O controlo da TB em profissionais de saúde implica a adoção de medidas de proteção eficazes, o reconhecimento precoce dos possíveis contactos, o despiste dos casos de TL e, particularmente, de TL recente entre esse grupo de profissionais8,9. O diagnóstico dos casos de TL efetua‐se através da realização da prova de tuberculina (PT) e, em casos duvidosos, em testes in vitro de libertação do interferão‐gama (IGRA) após estimulação por antigénios apropriados10.
A PT é um teste cutâneo (in vivo) intradérmico, em que o antigénio (tuberculina) induz localmente um processo inflamatório de tipo retardado em pessoas infetadas com o M. tuberculosis. Este processo é mediado por linfócitos T com memória imunológica, que produzem linfocinas. Essas linfocinas atraem linfócitos sensibilizados que causam a induração e, por vezes, vesiculação e necrose. Atualmente, utiliza‐se a proteína purificada PPD RT 23, que é doseada em unidades de tuberculina (UT)11, sendo adotada nos serviços de saúde de Portugal a tuberculina PPD RT 23 SSI a 2 UT.
A PT é usada mundialmente há mais de uma centena de anos e as suas características (e limitações) são bem conhecidas8,10. É de fácil execução, não exige uma infraestrutura laboratorial para a sua realização e é de baixo custo. Contudo, apresenta possibilidade de má realização técnica e exige que a leitura seja efetuada por um técnico treinado. Além do mais, apresenta a dificuldade na definição de um valor objetivo de positividade e requer 2 visitas a uma unidade de saúde para a sua realização e interpretação.
No entanto, a maior dificuldade poderá relacionar‐se com a ocorrência de falsos negativos (relacionados essencialmente: i) com casos de imunossupressão, mas também ii) com infeções víricas recentes, iii) crianças com idade inferior a 3 anos ou iv) fase inicial da TB) e, sobretudo, a taxa elevada de falsos positivos. A especificidade é condicionada por reações cruzadas com a vacinação Bacillus Calmette‐Guérin (BCG) e com a infeção por micobactérias não tuberculosas (MNT). Em Portugal, a elevada taxa de vacinação pelo BCG faz com que, frequentemente, sejam encontradas reações positivas à PT, pelo que se prefere considerar um valor de PT com maior especificidade e menor sensibilidade (≥ 15 mm) para a deteção de TL em profissionais de saúde8.
O valor preditivo positivo da PT é influenciado pela especificidade do teste e pela prevalência da TL na população testada. Quanto mais baixa for a prevalência da TL numa determinada população ou quanto mais elevada for a exposição a MNT ou à vacinação BCG, mais resultados falsos positivos ocorrerão, implicando uma diminuição da especificidade e um baixo valor preditivo positivo. Contrariamente, o valor preditivo positivo da PT será elevado quando a prevalência da TL for elevada e em populações não vacinadas com a vacina BCG8,10.
Mais recentemente, surgiram os IGRA após estimulação por antigénios apropriados, considerados especialmente úteis para o diagnóstico de TL. Atualmente, são comercializados o QuantiFERON®‐ TB Gold Cellestis (Austrália) e o T–SPOT.TB Immunotec® Oxford Immunotec (Grã‐Bretanha)12.
Os novos testes baseiam‐se na resposta imunológica celular a antigénios específicos do M. tuberculosis: «early secretion antigenic target 6‐kDa» (ESAT‐6) e «culture filtrate protein 10‐kDa» (CFP‐10), que são codificados na região de diferença 1 (RD‐1) do genoma do M. tuberculosis13. Estes antigénios são específicos, uma vez que não estão presentes nem no BCG nem na memória da maioria das MNT14. Os IGRA baseiam‐se no princípio de que as células T de indivíduos previamente sensibilizados por antigénios do M. tuberculosis libertam interferão gama (IFN‐gama) quando reestimuladas por antigénios específicos. O IFN‐gama pode então ser medido pelos métodos «Enzym‐Linked Immunosorbent Assay» (ELISA) (no QuantiFERON® ‐ TB Gold) e pelo «Enzyme‐Linked ImmunoSPOT Assay» (ELISPOT) no T‐SPOT.TB®12.
A principal vantagem dos testes IGRA reside na sua maior especificidade relativamente à PT, uma vez que o BCG e a maioria das infeções por micobactérias atípicas não positivam estes testes. O facto de a sua leitura não depender da interpretação do observador e não ser necessária uma segunda visita à instituição de saúde também parecem constituir vantagens importantes. Contudo, são testes dispendiosos, que necessitam de laboratórios diferenciados para a sua realização e que não estão isentos da possibilidade de erro laboratorial. Tal como a PT, os IGRA não distinguem infeção latente de infeção ativa8.
Várias revisões têm sido efetuadas no sentido de avaliar a utilidade dos IGRA na TL, revelando que estes testes são particularmente importantes em indivíduos vacinados com o BCG15–18.
Na verdade, a determinação do valor destes testes na avaliação de TL é difícil de obter pela inexistência de um gold standard para a TL, embora se tenha encontrado que os testes IGRA são pelo menos tão sensíveis e mais específicos que a PT16. De acordo com outro estudo, os testes IGRA correlacionam‐se melhor que a PT com a exposição a doentes infetados e apresentam uma maior sensibilidade para TB ativa19. A concordância desses 2 testes parece ser limitada20, especialmente em países como Portugal, em que se efetua o BCG logo à nascença. Alguns artigos determinaram uma elevada proporção de PT positiva com IGRA negativo19–21, apesar desses resultados dependerem do critério de positividade utilizado para a interpretação da PT.
A utilização dos IGRA na prática clínica para o diagnóstico e gestão da TL tem seguido orientações muito diversas: 1) PT inicial seguida de IGRA quando a PT é negativa (para aumentar a sensibilidade, principalmente em imunocomprometidos) ou quando é positiva (para aumentar a especificidade, principalmente em indivíduos com BCG); 2) PT ou IGRA, mas não os 2 testes; 3) IGRA e PT em simultâneo (para aumentar a sensibilidade); 4) apenas IGRA22. As recomendações europeias publicadas em 2006 pelo «National Institute for Health and Clinical Excellence» (NICE) recomendam o seu uso nos indivíduos em risco de TL com PT positiva e nos indivíduos nos quais a PT é pouco fiável23. Esses testes parecem ser particularmente úteis na confirmação de um resultado tuberculínico positivo, em indivíduos previamente vacinados com a vacina BCG.
O presente estudo teve como objetivo principal analisar a concordância entre as 2 técnicas de diagnóstico da TL, através da determinação do coeficiente Kappa (K) e da taxa de concordância entre a PT e o teste IGRA em profissionais de saúde de um hospital central.
Material e métodos
Desenho do estudo
Trata‐se de um estudo transversal, retrospetivo, em que se efetuou a análise dos registos das PT e dos testes IGRA realizados a profissionais de saúde de um hospital central universitário português, entre o início de janeiro de 2010 e o final de dezembro de 2011.
População e amostra em estudo
De entre os profissionais do hospital em estudo (cerca de 5.000 trabalhadores) foram incluídos todos os trabalhadores que efetuaram a PT e, simultaneamente, o teste IGRA (até 15 dias de intervalo) no serviço de saúde ocupacional, entre o início de janeiro de 2010 e o final de dezembro de 2011 (n = 137). Trata‐se, pois, de uma amostra de conveniência.
Os 2 testes foram realizados sempre no âmbito de uma exposição profissional não protegida ao M. tuberculosis ou no âmbito de exames médicos de admissão ou periódicos de profissionais que trabalhavam em serviços considerados de risco elevado à data do estudo (serviço de Pneumologia, serviço de doenças infeciosas, serviço de urgência central, serviço de anatomia patológica e laboratório de microbiologia).
Critérios de exclusão
Profissionais que apresentaram critérios de TB ativa e profissionais que apresentaram registo de PT anterior ao início do estudo ≥ 15 mm.
Variáveis em estudo
Variáveis sociodemográficas: idade, sexo, grupo profissional (médico, enfermeiro, assistente técnico, assistente operacional, técnico de diagnóstico e terapêutica).
- Prova tuberculínica
Foram definidos os seguintes cut off's para os diâmetros transversais da PT, tendo em consideração os vários cut off's para a sua positividade8 e ainda tendo em consideração que a vacina BCG, a qual positiva a PT, habitualmente não induzir respostas superiores a 20 mm20.
-
5 mm (< 5 mm ou ≥ 5 mm)
-
10 mm (< 10 mm ou ≥ 10 mm)
-
15 mm (< 15 mm ou ≥ 15 mm)
-
20 mm (< 20 mm ou ≥ 20 mm)
-
- Teste IGRA
Os cut off's usados para o teste IGRA foram os indicados pelo fabricante QuantiFERON®‐ TB Gold.
-
IGRA positivo (≥ 0,35 UI/mL)
-
IGRA negativo (< 0,35 UI/mL)
-
- Vacinação anterior pelo BCG
-
Registo de uma dose de vacina de BCG
-
Registo de 2 ou mais vacinas de BCG
-
Situação desconhecida da vacinação BCG
-
Procedimentos
A PT foi executada através da injeção intradérmica na face anterior do antebraço de 0,1 ml de 2 UT de PPD RT SSI 23, e foi efetuada a leitura do resultado às 72 horas, por uma de 2 profissionais de enfermagem, devidamente treinadas para o efeito.
A colheita de sangue para o teste IGRA (QuantiFERON®‐ TB Gold Cellestis, Austrália) foi realizada quando a PT foi ≥ 10 mm (à exceção de 2 casos que apresentaram PT ≥ 5 mm e < 10 mm) e foi ponderada a terapêutica de TL. O sangue foi transportado para o laboratório e processado no próprio dia da colheita. O método utilizado foi o ELISA. O teste IGRA foi considerado positivo quando o resultado obtido foi ≥ 0,35 UI/mL.
A vacinação BCG foi avaliada através do registo da vacinação individual nos boletins da vacinação, ou através da verificação da existência das cicatrizes. Em Portugal, a vacinação com BCG é obrigatória para recém‐nascidos e, até há alguns anos, administrava‐se uma segunda dose de BCG caso a PT fosse negativa. Assim, cada profissional incluído no estudo tinha, teoricamente, sido vacinado com BCG pelo menos uma vez. Mesmo assim, decidiu‐se considerar a situação da vacinação com BCG desconhecida, caso não existisse registo de vacinação ou cicatriz.
Análise estatística
Os dados foram recolhidos em suporte informático e o tratamento estatístico dos dados realizou‐se no programa Statistical package for Social Sciences‐SPSS®, versão 17.0 para Windows.
De forma a analisar as variáveis numéricas, procedeu‐se ao cálculo da média, mediana, desvio padrão (DP) e identificação de máximos e mínimos.
Para variáveis nominais e categóricas, procedeu‐se ao cálculo da distribuição de frequências.
Realizou‐se a análise de concordância entre as 2 técnicas de diagnóstico (PT e IGRA), através da determinação do coeficiente K e análise da taxa de concordância.
Classificou‐se o nível de concordância de acordo com o sugerido por Altman24 e Landish e Kock25:
-
baixo: K < 0,20;
-
ligeiro: K entre 0,21‐0,40;
-
moderado: K entre 0,41‐0,60;
-
bom: K entre 0,61‐0,80;
-
muito bom: K entre 0,81 e 1,0.
Aspetos éticos
Sem qualquer conflito de natureza ética. O estudo, de natureza retrospetiva, envolveu dados referentes à vigilância de saúde de trabalhadores sujeitos a vigilância do seu estado de saúde pelo serviço de saúde ocupacional que realizou o estudo. Não existe qualquer referência a dados individuais dos trabalhadores da saúde estudados.
Resultados
A amostra (n = 137) foi constituída predominantemente por mulheres (n = 110; 80,3%), com uma média etária de 30,5 anos (mínimo = 20 anos; máximo = 57 anos) e DP de 7,24.
Os grupos profissionais dos assistentes operacionais (n = 48) e dos enfermeiros (n = 38) representaram mais de metade da amostra, seguidos do grupo dos médicos (n = 19), dos assistentes técnicos (n = 19) e dos técnicos de diagnóstico e terapêutica (n = 13).
Uma percentagem elevada da amostra em estudo (61 participantes, 44,5%) tinha feito 2 ou mais inoculações da vacina BCG. Cinquenta (36,5%) fizeram apenas uma dose e 26 (18,8%) não tinham qualquer registo vacinal.
O diâmetro médio da PT realizada na amostra em estudo foi de 17,5 mm (mínimo = 5 mm; máximo = 30 mm, DP = 4,3). Da totalidade da amostra considerada, apenas 2 profissionais apresentaram PT < 10 mm, nos quais o teste IGRA foi negativo. Dos 137 participantes que efetuaram PT, 84 (61,3%) apresentaram um resultado do teste IGRA negativo e 53 (38,7%) positivo.
A tabela 1 sintetiza os resultados encontrados das PT e dos testes IGRA na amostra em estudo, tendo em consideração os diferentes cut off‘s considerados para a PT.
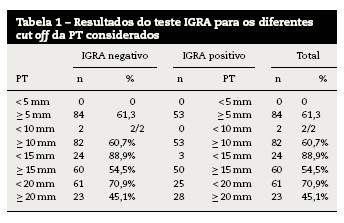
Nenhum dos profissionais de saúde incluídos apresentou PT com diâmetro inferior a 5 mm (PT < 5 mm), pelo que não foi possível calcular o coeficiente K para o cut off de 5 mm. Dos 137 profissionais com PT ≥ 5 mm, apenas 53 (38,7%) apresentaram teste IGRA positivo.
Somente 2 profissionais de saúde apresentaram PT inferior a 10 mm, tendo tido ambos um teste IGRA negativo. Contudo, apenas 53 (39,3%) dos 135 profissionais com PT ≥ a 10 mm apresentaram IGRA positivo. O nível de concordância entre a PT e o teste IGRA para um cut off da PT de 10 mm, determinado através do coeficiente K, foi de 0,019 (p = 0,26). A taxa de concordância foi de 40%.
Dos profissionais de saúde estudados, somente 27 (19,7%) tinham PT inferior a 15 mm. Desses, 88,9% apresentaram teste IGRA negativo. Contudo, entre aqueles que apresentaram PT ≥ 15 mm (110; 80,3%), menos de metade apresentaram teste IGRA positivo. Para um cut off de 15 mm da PT o nível de concordância determinado através do coeficiente K foi de 0,19 (p = 0,001) e a taxa de concordância foi de 54%.
Entre os profissionais incluídos no estudo, 86 (62,8%) apresentaram PT < 20 mm. Desses, 70,9% dos profissionais de saúde apresentaram também IGRA negativo. No entanto, entre aqueles que apresentaram PT ≥ 20 mm, pouco mais de metade (54,9%) apresentou igualmente IGRA positivo. Para PT com cut off de 20 mm, o coeficiente K foi de 0,26 (p = 0,003) e a taxa de concordância foi de 65%.
Discussão e conclusões
O diâmetro médio da PT realizada pela amostra em estudo foi elevado (17,5 mm), tendo 98,5% dos participantes apresentado PT ≥ 10 mm e 80,3% PT ≥ 15 mm. Esta situação provavelmente não representa os resultados dos profissionais de saúde do hospital, uma vez que este estudo é retrospetivo e é efetuado pela análise dos registos do serviço de saúde ocupacional do hospital em estudo. Os procedimentos desse serviço determinavam a realização do IGRA em caso de PT positiva em que se ponderava a possibilidade de efetuar tratamento da TL, pelo que, nestes profissionais, existia história de contacto não protegido documentada por esse serviço ou possibilidade de contacto a nível epidemiológico nos últimos 2 anos. Os profissionais que nele foram incluídos foram, unicamente, os que tinham efetuado a PT e o teste IGRA em simultâneo (até 15 dias de intervalo) e, embora se tenha confirmado o registo de vacinação anterior pelo BCG apenas em 81% dos participantes, possivelmente todos eles estariam vacinados, uma vez que a vacina BCG faz parte do plano nacional de vacinação português. Além do mais, em 44,5% dos profissionais verificou‐se o registo de mais do que uma inoculação de BCG. Apesar do efeito da vacina BCG nas reações tuberculínicas ser maioritariamente modesta 10 anos após a vacinação efetuada na infância15, a inoculação de mais doses de vacina BCG poderá associar‐se a respostas tuberculínicas superiores. Por outro lado, a amostra estudada era relativamente jovem, sendo também por isso expectável uma boa resposta imunitária à tuberculina.
De facto, num estudo efetuado num hospital universitário com características semelhantes ao hospital onde decorreu o nosso estudo, em que foi efetuada a PT e o teste IGRA a todos os profissionais, independentemente da existência ou não existência de história de exposição não protegida, a percentagem de profissionais de saúde com PT ≥ 10 mm e PT ≥ 15 mm, apesar de ser elevada, foi inferior (entre 1.829 profissionais que efetuaram PT, 924 (50,5%) apresentaram PT ≥ 10 mm e 223 (12,2%) apresentaram PT ≥ 15 mm)26.
Relativamente ao cut off de 10 mm para a PT, pôde observar‐se um resultado positivo do teste IGRA em apenas 39,3% dos profissionais de saúde que apresentaram PT ≥ 10 mm. Num estudo realizado com profissionais de saúde portugueses, 33,1% dos participantes apresentaram PT ≥ 10 mm e < 15 mm e tiveram teste IGRA positivo27. Num outro estudo, também realizado em profissionais de saúde desse mesmo hospital, foram efetuadas 490 PT, entre as quais 175 apresentaram diâmetro transversal entre 10‐14 mm. Desses 175, apenas 36 (20,6%) apresentaram teste IGRA positivo28. Uma explicação provável relaciona‐se com o facto da vacina BCG positivar a PT, mas não o teste IGRA. Contudo, não podemos deixar de admitir a possibilidade da ocorrência de alguns falsos negativos para TL associados ao teste IGRA. Uma vez que não existe, atualmente, um teste gold standard para o diagnóstico de TL, não é possível conhecer a frequência de falsos negativos do teste IGRA, mas apenas compará‐lo com o teste mais antigo de diagnóstico da TL: a PT.
Num estudo francês, a percentagem de profissionais da saúde com PT ≥ 10 mm que apresentou teste IGRA positivo foi ainda inferior (19,1%)20. Tal poderá relacionar‐se com uma menor prevalência de TB em França (8,9 casos/100.000 habitantes em 2007), relativamente a Portugal. Até 2010, a vacinação com o BCG também foi obrigatória para profissionais de saúde em França29. Nesse mesmo estudo, o nível de concordância entre PT com cut off de 10 mm e o teste IGRA também foi considerado fraco (coeficiente K = 0,11)20.
Num outro estudo que incluiu trabalhadores da saúde portugueses, franceses e alemães, 40,2% dos profissionais que apresentaram PT positiva tinham teste IGRA negativo. A proporção de trabalhadores que apresentaram PT negativa e teste IGRA positivo foi apenas de 2,5%30.
É de realçar que nem a PT nem o IGRA são capazes de diferenciar uma infeção tuberculosa recente de uma infeção antiga. Tal como foi salientado num documento de consenso publicado no European Respiratory Journal, dada a ausência de um teste gold standard para diagnóstico de TL, a presença de uma PT ou de um teste IGRA positivos poderão significar a presença de infeção latente, de doença ativa ou a presença de uma resposta de memória imunológica persistente31.
Uma vez que a probabilidade de evolução para TB ativa é mais elevada nos 2 primeiros anos após ter ocorrido a infeção, o tratamento da TL deverá ser cuidadosamente ponderado tendo em consideração fatores de natureza individual, profissional e epidemiológica. Esse tratamento implica 6‐9 meses de isoniazida ou, alternativamente, outros esquemas mais curtos, mas que incluem vários antibacilares18,32.
A Orientação da Direção‐Geral da Saúde n.° 010/2014 de 25/6/201433 refere que «em contexto de rastreio de contactos e perante impossibilidade de utilizar os testes IGRA em indivíduos imunocompetentes, o teste tuberculínico com o cut off de 15 mm demonstrou melhor valor preditivo positivo de evolução para doença do que cut off's inferiores». Nos resultados obtidos no presente estudo, apesar de 88,5% dos indivíduos com PT < 15 mm terem IGRA negativo, apenas 45,5% dos profissionais com PT ≥ 15 mm apresentaram teste IGRA positivo, com um nível de concordância fraco (taxa de concordância de 54%). Estes resultados fazem‐nos questionar se, na ausência da realização de um teste IGRA, não poderemos estar a sujeitar ao tratamento de TL uma percentagem elevada de indivíduos para a qual ela seria desnecessária. Contudo, e apesar de alguns estudos referirem uma sensibilidade semelhante entre a PT e os testes IGRA16, teremos que admitir a hipótese de corresponderem a falsos negativos para TL dos testes IGRA.
De acordo com os resultados obtidos no nosso estudo, quanto maior for o cut off considerado para a PT maior será a concordância entre os 2 métodos. Mesmo assim, seria espectável uma maior taxa de concordância para cut off's de 15 mm e, sobretudo de 20 mm (taxa de concordância encontrada de 65%), uma vez que a vacina BCG, a qual positiva a PT, habitualmente não induz respostas superiores a 20 mm20,34.
No entanto, estes 2 testes podem não estar a medir exatamente o mesmo fenómeno. Acredita‐se que a nova geração de testes de IFN‐gama, com os seus curtos períodos de incubação, medem principalmente respostas de células T na presença de antigénios, ao contrário da PT, que mede essencialmente a memória das células T e a ativação macrofágica35. Por outro lado, a leitura da PT comporta em si mesmo alguma subjetividade, uma vez que depende da experiência de quem a efetua. Apesar de a leitura ter sido feita por 2 enfermeiras com alguma experiência, existe sempre este potencial fator de confundimento que deve ser tido em conta.
Como foi anteriormente referido, entre as principais limitações da PT encontram‐se a necessidade da realização correta da técnica, a dificuldade de interpretação dos resultados e existência de um número não desprezível de falsos negativos e, essencialmente, de falsos positivos, relativamente ao diagnóstico de TL.
Enquanto os falsos negativos poderão ser um problema em indivíduos imunodeprimidos, não parecem ser tão relevantes em profissionais de saúde imunocompetentes, tanto mais que perante um resultado negativo da PT está indicada a repetição da prova nos 5‐7 dias seguintes, aproveitando a possibilidade de ocorrência de efeito booster (potenciação da reação à tuberculina na ausência de infeção, resultante de um efeito memória da imunidade celular, secundário a uma vacinação anterior pelo BCG). Contudo, os falsos positivos constituem uma limitação importante na vigilância de profissionais de saúde expostos ao bacilo da TB em ambiente ocupacional e relacionam‐se, essencialmente, com a vacinação prévia pelo BCG, embora também se possam relacionar com infeções por MNT, responsáveis por cerca de 5% de todas as reações superiores a 10 mm8,36.
A TB continua a ser um problema importante de saúde ocupacional entre os profissionais de saúde portugueses7. Considerando as limitações que a PT e os testes IGRA apresentam, a melhor solução parece ser o uso de ambos, utilizando a maior especificidade do IGRA para confirmar uma PT positiva, aproveitando as melhores características de cada teste, tal como recomendado pelas orientações da Direção‐Geral da Saúde33. Contudo, considera‐se fundamental ter em consideração o contexto epidemiológico e ocupacional na interpretação destes testes quando se pretende decidir sobre o tratamento de uma TL, já que a medicação antibacilar apresenta efeitos colaterais importantes e implica, obrigatoriamente, tratamento por tempo prolongado, não isenta de efeitos secundários.
Referências bibliográficas
1. Health World Global tuberculosis report 2013. Geneva: World Health Organization, (2013) . [ Links ]
2. Diniz A., Duarte R. Portugal: infeção VIH/SIDA e tuberculose em números 2013. Lisboa: Direção‐Geral da Saúde. Ministério da Saúde, (2013) . [ Links ]
3. Meyer J.D. Occupational tuberculosis. Occupational and environmental infections diseases, Beverly, MA: OEM Press., 2000. pp. 195-207. [ Links ]
4. Saleiro S., Santos A.R., Vidal O., Carvalho E., Costa J.T., Marques J.A. Tuberculose em profissionais da saúde de um serviço hospitalar. Rev Port Pneumol. 2007;:789-99. [ Links ]
5. Fernandes MH. Tuberculose nosocomial. (Em linha). Covilhã: Faculdade de Ciências da Saúde. Universidade da Beira Interior; 2009. Dissertação de Mestrado Integrado em Medicina, 2009. (citado 10 Dez 2014). Disponível em: http://www.fcsaude.ubi.pt/thesis/upload/118/803/marta_fernandespdf.pdf.
6. Baussano I., Nunn P., Williams B., Pivetta E., Bugianni M., Scano F. Tuberculosis among healthcare workers. Emerg Infect Diseases J. 2011;17:488-94. [ Links ]
7. Duarte R., Diniz A. Programa Nacional de Luta Contra a Tuberculose: ponto de situação epidemiológica e de desempenho: dados provisórios. Lisboa: Direção‐Geral da Saúde. Ministério da Saúde, (2013) . [ Links ]
8. Duarte R., Amado J., Lucas H., Sapage J.M. Comissão de Trabalho de Tuberculose da Sociedade Portuguesa de Pneumologia. Tratamento da tuberculose latente: revisão das normas. Rev Port Pneumol. 2007;:397-406. [ Links ]
9. Horsburgh C.R. Priorities for the treatment of latent tuberculosis infection in the United States. New Engl J Med. 2004;350:2060-7. [ Links ]
10. Duarte R. Teste tuberculínico: como optimizar?. Rev Port Pneumol. 2009;:295-304. [ Links ]
11. Simões A, Santos IA, Afonso A. MGF 201: prova tuberculínica: última atualização em Dezembro de 2000. (Em linha). In: Gonçalves C, Silva ML. Manual de medicina geral e familiar; 2000. (citado 28 Dez 2014). Disponível em: http://csgois.web.interacesso.pt/MGFV001MASTER/textos/43/201_texto.html.
12. Direcção‐Geral da Saúde. Utilização dos testes de interferão‐gama para o diagnóstico da tuberculose latente e ativa, na prática clínica. Lisboa: Direcção‐Geral da Saúde, (2007) . [ Links ]
13. Targeted tuberculin skin test and treatment of latent tuberculosis infection in children and adolescents. Pediatrics. 2004;114:1175-201. [ Links ]
14. Shingadia D., Novelli V. The tuberculin skin test: An hundred, not out. Arch Dis Child. 2008;93:189-90. [ Links ]
15. Trajman A., Steffen R.E., Menzies D. Interferon‐gamma release assays versus tuberculin skin testing for the diagnosis of latent tuberculosis infection: An overview of the evidence. Pulm Med. 2013; [ Links ].
16. Pai M., Zwerling A., Menzies D. Systematic review: T‐cell based assays for the diagnosis of latent tuberculosis infection: An update. Ann Intern Med. 2008;149:177-84. [ Links ]
17. Denkinger C.M., Dheda K., Pai M. Guidelines on interferon ¿ release assays for tuberculosis infection: Concordance, discordance or confusion. Clin Microbiol Infect. 2011;17:806-14. [ Links ]
18. Zwerling A., van S., Scholten J., Cobelens F., Menzies D., Pai M. Interferon‐gamma release assays for tuberculosis screening of healthcare workers: A systematic review. Thorax. 2012;67:62-70. [ Links ]
19. Diel R., Loddenkemper R., Meywald-Walter K., Nieman S., Nienhaus A. Predictive value of a whole blood IFN‐gamma assay for the development of active tuberculosis disease after recent infection with Mycobacterium tuberculosis. Am J Respir Crit Care Med. 2008;177:1164-70. [ Links ]
20. Tripodi D., Brunet-Courtois B., Nael V., Audrain M., Chailleux E., Germaud P., et al. Evaluation of the tuberculin skin test and interferon‐gama release assay for TB screening in French healthcare workers. J Occup Med Toxicol. 2009;4:30. [ Links ]
21. Schablon A., Harling M., Diel R., Ringshausen F.C., Costa J.T., Nienhaus A. Serial testing with an interferon‐gama release assay in German healthcare workers. GMS Krankenhhyg Interdiszip. 2010;5:2. [ Links ]
22. Peter J.G., van R.N., Denkinger C.M., Pai M. Diagnosis of TB: State of the art. Tuberculosis., Norwich: European Respiratory Society, 2012. pp. 124-43. [ Links ]
23. Tuberculosis: Clinical diagnosis and management of tuberculosis, and measures for its prevention and control. London: National Institute for Health and Clinical Excellence, (2006) . [ Links ]
24. Altman D.G. Practical statistics for medical research. London: Chapman and Hall, (1991) . [ Links ]
25. Landish J.R., Kock G.G. The measurement of observer agreement for categorical data. Biometrics. 1977;33:159-74. [ Links ]
26. Costa J.T., Silva R., Vaz M., Nienhaus A. Tuberculose continuada em profissionais de saúde. Saúde e Trabalho. 2012;8:47-63. [ Links ]
27. Costa J.T., Silva R., Ringshausen F., Nienhaus A. Screening for tuberculosis and prediction of disease in Portuguese healthcare workers. J Occupat Med Toxicology. 2011;6:19. [ Links ]
28. Costa J.T., Silva R., Sá R., Cardoso M.J., Ferreira J., Ribeiro C., et al. Tuberculosis: Risk of continued transmission in healthcare workers. Rev Port Pneumol. 2013;16:5-21. [ Links ]
29. France. Ministère de la Santé et des Sports. Haut Conseil de la Santé Publique. Avis relatif à l’obligation de vaccination par le BCG des professionnels listés aux articles L. 3112‐1, R.3112‐1 C et R. 3112‐2 du Code de la santé publique de 5 mars 2010. (Em linha). Paris: Haut Conseil de la Santé Publique; 2010. (citado 27 Dez 2014). Disponível em: http://www.hcsp.fr/docspdf/avisrapports/hcspa20100305_BCG.pdf.
30. Nienhaus A., Schablon A., Tripodi D., Torres J. The prevalence of latent tuberculosis infections among health‐care workers: A three‐country comparison. Pneumologie. 2011;65:726-9. [ Links ]
31. Mack U., Migliori G., Sester M., Rieder H., Lange C. LTBI: Latent tuberculosis infection or lasting immune responses to M. tuberculosis? A TBNET consensus statement. Eur Respir J. 2009;33:956-73. [ Links ]
32. Ringshausen F.C., Schablon A., Nienhaus A. Interferon‐gamma release assays for the tuberculosis serial testing of health care workers: A systematic review. J Occup Med Toxicol. 2012;7:6. [ Links ]
33. Portugal. Ministério da Saúde. Direção‐Geral da Saúde. Vigilância da tuberculose nos profissionais de saúde. Lisboa: Direção‐Geral da Saúde; 2014. 1‐10. (Orientação; 010/2014 de 25/6/2014).
34. Diel R., Golleti D., Ferrara G., Bothamley D., Cirillo B., Kampmann C., et al. Interferon‐y release assays for the diagnosis of latent Mycobacterium tuberculosis infection: A systematic review and meta‐analysis. Eur Resp J. 2011;37:88-99. [ Links ]
35. US Centers for Disease Control and Prevention. Guidelines for using the QuantiFERON®‐TB Gold Test for Detecting Mycobacterium tuberculosis infection, United States. MMWR. 2005; Recomm Rep 54:49‐55.
36. Nienhaus A., Schablon A., Ringsausen F.C., Costa J.T., Tripodi D., Diel R. TB as an occupational disease. Tuberculosis, Norwich: European Respiratory Society, 2012. pp. 219-29. [ Links ]
Conflito de interesses
Os autores declaram não haver conflito de interesses.
*Autor para correspondência: Correio eletrónico: ema.leite@chln.minsaude.pt
Recebido 2 de Fevereiro de 2015 . Aceito 23 de Junho de 2015













