Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Acessos
Acessos
Links relacionados
-
 Similares em
SciELO
Similares em
SciELO
Compartilhar
Revista de Ciências Agrárias
versão impressa ISSN 0871-018X
Rev. de Ciências Agrárias v.33 n.1 Lisboa jan. 2010
Efeito da temperatura, pH e vestígios de Hg2+ e Pb2+ na actividade de desidrogenases e urease num solo da região deÉvora
M. R. Martins1,2, F. Santos1, P. Candeias1 & J. Cruz-Morais1,2
1 Departamento de Química, Universidade de Évora, Rua Romão Ramalho, 7000-671 Évora, e-mail: cmorais@uevora.pt;
2ICAM, Universidade de Évora, Apartado 94, 7002-554 Évora
RESUMO
As actividades das enzimas no solo são um importante indicador da sua qualidade. Neste estudo procedeu-se à caracterização da actividade enzimática de desidrogenases (EC 1.1.1) e da urease (EC 3.5.1.5) de um solo sob Olea europeae L. da região de Évora. As constantes cinéticas Km e Vmáx, foram determinadas usando como substratos o cloreto de p-iodonitrotetrazolio (INT) e a ureia, respectivamente. Foi avaliado o efeito nas referidas actividades provocado pelo pH, temperatura e vestígios de Hg2+ e de Pb2+.
As actividades máximas obtiveram-se a pH = 8,5 e 40 ºC, com Km= 0,5 mM e Vmáx = 5,4 µmol min-1 g-1, para a actividade de desidrogenases e a pH = 10 e 37 ºC, com Km = 25,7 mM e Vmáx = 2,0x10-2 µmol min-1 g-1, para a urease. Estas actividades foram inibidas por diferentes concentrações de Hg2+, mas apenas a actividade da urease foi inibida pelo Pb2+. Estes resultados são comparáveis com os referidos na literatura para estes enzimas.
Palavras-chave: Desidrogenases, Enzimas do solo, Qualidade do solo, Urease.
Effect of temperature, pH and Hg2+ and Pb2+ traces in dehydrogenaseand urease activities of a soil from Évora region
ABSTRACT
Enzyme activities are often used as indicator of soil quality. This study reports on dehydrogenase (EC 1.1.1) and urease (EC 3.5.1.5) activities of a soil under Olea europaea L. from Évora region. Kinetic constants Km and Vmax were determined using p-iodonitrotetrazolium chloride (INT) and urea, respectively. Effects of pH, temperature and Hg2+ and Pb2+ traces on both activities were determined.
Maximal activity was obtained at pH = 8.5 and 40ºC, Km = 0.5 mM and Vmax=5,4µmol min-1 g-1 , for dehydrogenase and at pH = 10 and 37 ºC, Km = 25.7 mM and Vmax = 2.0x10-2 µmol min-1 g-1, for urease. These activities were inhibited by different concentrations of Hg2+, but only the urease activity was inhibited by Pb2+. Results of this study are comparable to those reported in the literature for these enzymes.
Key-words: Dehydrogenases, Soil enzyme, Soil quality, Urease.
INTRODUÇÃO
A qualidade do solo depende de propriedades físico-químicas e biológicas relacionadas com a sua textura, composição, humidade, pH, microrganismos e enzimas activos nele presentes, os quais podem ser influenciados pelo tipo de culturas, mobilização do solo e aplicação de xenobióticos, como produtos fitofarmacêuticos, poluentes de origem industrial, municipal ou outros. Os enzimas do solo têm um papel relevante na libertação dos nutrientes necessários ao crescimento microbiano e das plantas e na biotransformação de xenobióticos (Dick, 1998). As actividades enzimáticas do solo podem resultar de células activas (animais, plantas e microrganismos), células inteiras já mortas, detritos celulares ou, ainda, de complexos enzima-argila ou colóides húmicos (Taylor et al., 2002).
As actividades enzimáticas de desidrogenases (E.C. 1.1.1), fosfatases (EC 3.1.3.), arilsulfatase (EC. 3.1.6.1.), celulase (E.C. 3.2.1.4), β-glucosidase (E.C. 3.2.1.21) e urease (E.C. 3.5.1.5) têm sido utilizadas, nalguns estudos, como indicadores da qualidade do solo. Desidrogenases, por exemplo, são enzimas endocelulares, presentes apenas nas células viáveis e a sua actividade no solo está descrita como reflexo da actividade de microrganismos, incluindo bactérias e fungos, pelo que é frequentemente utilizada como indicador do metabolismo oxidativo microbiano em função do tipo, profundidade, conteúdo de matéria orgânica e poluentes do solo (Camiña et al. 1998; Trasar-Cepeda et al., 2000; Monkiedje et al., 2002; Taylor et al., 2002; Sukul, 2006).
A urease é um enzima extracelular, também presente no interior das células, responsável pela hidrólise da ureia no solo, com formação de ião amónio e carbonato. A sua actividade está correlacionada com o processo de mineralização do N no solo e a sua presença aqui é originada principalmente a partir de plantas e microrganismos (Marzadori et al., 1998; Sinsabaugh et al., 2000).
A acumulação de metais pesados no solo em quantidades elevadas é um dos factores de maior impacte nos seus processos bioquímicos. Alguns estudos mostram que a presença de metais pesados inibe a actividade de diversos enzimas do solo (Mora et al., 2005; Chaperon et al., 2007, 2008). O grau de inibição das actividades enzimáticas do solo pelos metais pesados está estreitamente correlacionado com o tipo de solo (Brady & Ray, 1999). Mora et al. (2005) refere que solos contaminados com os metais As, Cd, Cu, Mn, Pb e Zn apresentaram actividades enzimáticas de desidrogenases, arilsulfatase e β-glucosidase muito baixas, as quais aumentaram após remediação in situ (Sevilha, Espanha). Segundo Chaperon et al. (2007, 2008), a presença de Ag, Cu, Pb, Zn e Hg influenciou as actividades de desidrogenases e da urease em solos de floresta (Canadá), dependendo da concentração, da presença simultânea de alguns destes metais e do tipo de solo.
Estudos de caracterização de actividades de desidrogenases e urease nos solos de Portugal são muito escassos, pelo que foi objectivo do presente estudo caracterizar a actividade enzimática de desidrogenases e da urease num solo da região de Évora (Alentejo) e avaliar o efeito de Hg2+ e Pb2+, nessas actividades. A actividade de desidrogenases foi determinada pelo método de von Mersi & Schinner (1991) modificado (Camiña et al., 1998) e a da urease pelo método de Kandeler & Gerber (1988) modificado. As constantes cinéticas, Km e Vmáx foram determinadas utilizando como substratos o p-iodonitrotetrazolio (INT) e a ureia, para desidrogenases e urease, respectivamente. Foi ainda avaliado o efeito da temperatura, pH e de vestígios de Hg2+ e Pb2+ nas referidas actividades.
MATERIAL E MÉTODOS
Estudou-se um solo do sudoeste de Portugal situado em Évora, Alentejo (38º36N, 1º16W) com cultura de olival (Olea europeae L.) em pousio, sem quaisquer tratamentos com pesticidas, adubos ou fertilizantes, durante os últimos 10 anos. De acordo com a carta de solos 36 C dos Solos de Portugal, trata-se de um solo litólico, não húmico de rochas eruptivas (Pmg) (Cardoso, 1974). As amostras foram recolhidas entre os 5 – 15 cm de profundidade, secas ao ar, crivadas por tamiz de malha < 2 mm e guardadas a 4ºC, para análise.
As principais características físicoquímicas do solo foram determinadas de acordo com os métodos de referência para análises do solo (Carter, 1993; Rowell, 1994). Os dados da textura foram obtidos por sedimentometria com raios X (Sedigraph, 5100), corrigidos para o método da análise mecânica, sem destruição de carbonatos. O azoto total foi determinado pelo método de Kjeldahl, o azoto nítrico por potenciometria, utilizando um eléctrodo selectivo de iões, e o fósforo pelo método espectrométrico de Egner-Riehm (Greenberg et al., 1992). A capacidade de troca foi determinada pelo método do acetato de amónio a pH = 7 (Rowell, 1994). O Ca2+ foi quantificado por espectrometria de absorção atómica em câmara de grafite e o Na+ e K+ por fotometria de emissão de chama (Rowell, 1994).
A actividade de desidrogenases foi determinada em 1 g de solo (p.s.) pelo método de von Mersi & Schinner (1991) modificado por Camiña et al. (1998), utilizando como substrato o cloreto de 2-p-iodofenil-3-pnitrofenil-5-feniltetrazolio (INT), que é convertido por desidrogenases em iodonitrotetrazólio-formazão (INTF). Este foi extraído com uma mistura de dimetilformamida e etanol, de modo a minimizar a adsorção do INTF aos minerais do solo (Camiña et al., 1998) e quantificado a 490 nm (Taylor et al., 2002). Foi efectuado um ensaio em branco nas mesmas condições, tendo-se adicionado o substrato só após a adição da solução extractante.
A actividade da urease foi quantificada pelo método de Kandeler & Gerber (1988) modificado, sendo o amónio libertado determinado pela reacção de Berthelot, na qual o salicilato de sódio reage com o ácido dicloroisocianúrico, na presença de nitroprussiato de sódio, formando um complexo esverdeado em meio alcalino (Kandeler & Gerber, 1988; Taylor et al., 2002). Neste ensaio, adicionou-se 1 g de solo (p.s.) a 0,5 mL de solução de ureia 720 mM e 4 mL de solução tampão borato 75 mM, pH 10 e incubação a 37 ºC (b.a.) durante 2 horas, sob agitação. A reacção foi terminada com a adição de 6mL de KCl/HCl pH ~ 2 e, após 30 minutos, procedeu-se à leitura da absorvência a 690nm. Foi efectuado um ensaio em branco nas mesmas condições, tendo-se adicionado o substrato só após a adição da solução de KCl/HCl. Em todas as determinações enzimáticas, foram efectuados 4 replicados.
O efeito da temperatura nas actividades enzimáticas de desidrogenases e urease foi avaliado fazendo variar a temperatura de incubação do solo entre 20 -50 ºC e o pH entre 6,5 e 12, respectivamente, com base em estudos prévios e nos valores indicados na literatura para estes enzimas (Trevors, 1984; Kandeler & Gerber, 1988; Subhani et al., 2001; Taylor et al., 2002).
As constantes cinéticas Km e Vmáx foram determinadas recorrendo à linearização de Lineweaver-Burk, usando INT (0,25 -1,25 mM) ou ureia (80 – 2560 mM) como substrato, para as actividades de desidrogenases e urease, respectivamente.
Os efeitos do Hg2+ e Pb2+ nas actividades enzimáticas de desidrogenases e urease do solo foram determinados adicionando à solução do solo, soluções de HgCl2 (0,2310,91 mM) e soluções de PbCl2 (0,14 10,91 mM). Nos ensaios em que se observou um efeito inibitório, procedeu-se à determinação dos valores de IC50 (concentração que levou a uma diminuição de 50% na actividade enzimática, como resposta dos microrganismos sensíveis ao respectivo metal).
Para avaliação do efeito do Hg2+ e Pb2+ nas actividades enzimáticas de desidrogenases e urease, procedeu-se à análise de variância (ANOVA -One way) para um intervalo de confiança de 95 % (P < 0,05), usando o programa SPSS® 16.0 para Windows.
O efeito inibitório sobre as actividades de desidrogenases e urease provocado por cada um dos metais em estudo foi determinado usando a correlação dose-resposta para cada um dos metais adicionado ao solo. A Equação 1 foi utilizada para cálculo da resposta da actividade enzimática (Greco et al., 1995)
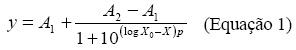
em que A2 e A1 são, respectivamente, as respostas máxima e mínima dos enzimas do solo obtidas com uma amostra controlo, p é o parâmetro de declive da curva dose-resposta, X é a dose aplicada e log X0 é a concentração que corresponde a 50 % da actividade enzimática. Este modelo não linear foi ajustado utilizando o Origin 7.1 (OriginLab® Corporation, 2003).
RESULTADOS E DISCUSSÃO
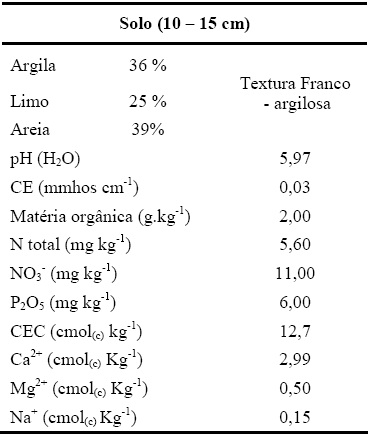
O Quadro 1, mostra que o solo apresentou uma textura franco-argilosa, com pH 6,0, baixos valores de condutividade eléctrica e de matéria orgânica, valores estes que se encontram dentro dos limites referidos para um solo do tipo litólico, não húmico de rochas eruptivas (Pmg), como foi o caso do solo em estudo (Cardoso, 1974).
Quadro 1-Principais características do solo em estudo
Neste estudo, as actividades de desidrogenases e urease do solo, foram determinadas a diferentes valores de temperatura, utilizando um valor de pH de ensaio de 8,5 para desidrogenases e de 10,0 para a urease, valores estes seleccionados tendo em conta estudos prévios e também o que se encontra referido na literatura sobre o efeito do pH na actividade destes enzimas (Trevors, 1984; Kandeler & Gerber, 1988).
Na Figura 1, estão representados os valores médio ± desvio-padrão da variação das actividades de desidrogenases e urease no solo em função da temperatura (Figura 1-A) e do pH (Figura 1-B).
Figura 1 -Representação gráfica do efeito da temperatura (A) e do pH (B) nas actividades de desidrogenases e urease no solo em estudo.
Os valores de temperatura para os quais se obteve a maior actividade de desidrogenases e urease foram, respectivamente, de 40ºC e de 37ºC (Figura 1-A). Estes valores estão muito próximos, no entanto, como se observa na referida figura, o efeito da temperatura foi muito mais acentuado para a actividade da urease do que para a actividade de desidrogenases, o que poderá significar que, sendo a urease um enzima predominantemente extracelular, estará menos protegido do que as desidrogenases face a alterações da temperatura ambiental (Dick, 1998; Nannipieri et al., 2003).
Uma vez determinadas as temperaturas para as quais as actividades de desidrogenases e urease foram máximas, procedeu-se a um estudo do efeito da variação do pH sobre as actividades destes enzimas a essas temperaturas (40 ºC e 37 ºC, respectivamente).
Os resultados deste estudo estão apresentados na Figura 1-B, mostrando que estes enzimas apresentaram um perfil semelhante de variação da actividade em função do pH do meio, o que poderá ser devido ao facto de, tanto nos microrganismos (desidrogenases), como no solo (urease), existirem sistemas tampão que moderam o impacte da variação do pH do meio na actividade destes enzimas (Taylor et al., 2002).
Para a actividade de desidrogenases, o valor máximo foi obtido a pH 8,5, enquanto que para a urease a actividade máxima foi obtida a pH 10,0, mostrando que, no solo em estudo, a actividade destes enzimas face ao pH seguiu um padrão de comportamento dentro do que está referido para estes enzimas (Dick, 1998; Taylor et al., 2002).
Os parâmetros cinéticos das actividades de desidrogenases e urease foram determinados a 40ºC, pH = 8,5 e 37 ºC, pH = 10, respectivamente. Para este estudo foram usadas diferentes concentrações dos substratos ([S]) característicos destes enzimas e os correspondentes valores das velocidades inicias de reacção (V). Os valores das constantes cinéticas, Km e Vmáx foram, então, determinados recorrendo à equação de Lineweaver-Burk: 1/V = {(Km/Vmáx). (1/[S]) + (1/Vmáx)} (Equação 2.), a qual usa o inverso da equação de Michaelis-Menten (Tabatabay & Bremner, 1971). Na Figura 2, Vmáx corresponde ao valor de 1/[S] =0 e Km ao valor de 1/V=0 da equação anterior.
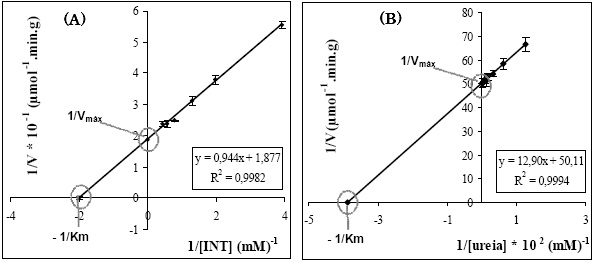
Figura 2 -Representação gráfica de Lineweaver-Burk para determinação das constantes cinéticas Km e Vmáx da reacção de desidrogenases (A) e urease (B) do solo em estudo.
Os valores obtidos foram, para as desidrogenases, Km = 0,50 mM e Vmáx = 5,33 µmol min-1 g-1 e, para a urease, Km = 25,73 mM e Vmáx = 2,00x10-2 µmol min-1 g-1. Utilizando a equação de Michaelis-Menten os valores obtidos para as constantes cinéticas foram semelhantes (Km = 0,49 ± 0,17 mM; Vmáx = 5,31 ± 0,18 µmol min-1 g-1 para a actividade de desidrogenases, e Km = 25,78 ± 0,27 mM; Vmáx = 2,00x10-2 ± 0,03x102µmol min-1 g-1 para a actividade da urease), o que mostra que a equação de Lineweaver-Burk é aplicável neste caso.
Para as actividades de desidrogenases e urease, não se encontram descritos na literatura estudos para este tipo de solos. Os resultados do presente estudo mostram um valor de actividade de desidrogenases 102 vezes mais elevado do que os valores obtidos em outros tipos de solo. Tal diferença poderá ter-se devido ao facto de no nosso estudo existir uma flora microbiana mais abundante do que no caso descrito na literatura (Taylor et al. 2002; Roldán et al, 2005), o que não foi estudado em ambos os casos; termos utilizado um solo em pousio há 10 anos, pois a actividade de desidrogenases pode diminuir significativamente com a frequência e profundidade da lavoura do solo (Roldán et al., 2005); termos utilizado o INT, pois a maioria dos estudos publicados foram obtidos com TTC (cloreto de 3,5trifeniltetrazónio) e com este substrato os resultados são normalmente inferiores aos que se obtêm com INT (Trevors, 1984; Friedel et al., 1994); ou, finalmente, termos usado uma mistura extractante constituída por dimetilformamida/etanol, a qual permite quantificar valores mais elevados, nomeadamente em solos com teores médios ou elevados de argila (Camiña et al., 1998), como no solo que estudámos.
Relativamente à urease, os valores de actividade que obtivemos são da mesma ordem de grandeza de alguns descritos por outros investigadores, embora estes valores também sejam dependentes do tipo de solo, profundidade e vegetação (Sinsabaugh et al., 2000; Taylor et al., 2002; Roldán et al., 2005).
A velocidade máxima, Vmáx, mede a quantidade máxima de substrato que é transformado por uma quantidade fixa de enzima, por unidade de tempo, o que nos permite determinar experimentalmente se uma determinada substância é capaz de actuar modificando a actividade enzimática. Sabese que numerosas substâncias com circulação ambiental são capazes de inibir a actividade de desidrogenases, da urease e de outros enzimas, afectando os processos naturais em que estes estão envolvidos e, consequentemente, a qualidade do solo.
No presente trabalho, depois de termos caracterizado as actividades de desidrogenases e urease do solo em estudo, através da determinação do seu Vmáx e Km, procedemos à avaliação do efeito de quantidades crescentes de Hg2+ e Pb2+ sobre as actividades dos referidos enzimas, tendo em vista a determinação da concentrações efectivas para as quais se obteria 50% de inibição dessa actividade (IC50), parâmetro este que permite comparar o efeito deletério dos xenobióticos sobre os microrganismos que lhes são sensíveis.
O efeito de Hg2+ e Pb2+ nas actividades de desidrogenases e da urease estão ilustrados no Quadro 2., mostrando que o Hg2+ diminuiu significativamente as actividades de desidrogenases e urease (P < 0,05), enquanto que o Pb2+ apenas diminuiu significativamente a actividade da urease (P < 0,05).
Nos estudos em que se observou uma correlação dose-resposta significativa (P<0,05), os valores de actividade foram analisados de acordo com a Equação 1, referida anteriormente, tendo em vista o cálculo dos valores de IC50, e construíramse as curvas dose-resposta das actividades de desidrogenases e urease versus concentrações de Hg2+ ou Pb2+ , como ilustrado na Figura 3.
Figura 3 -Representação gráfica das curvas dose-resposta das actividades de desidrogenases e urease sensíveis à presença de Hg2+ e Pb2+.
A actividade de desidrogenases mostrouse sensível à presença de Hg2+, com um valor de IC50 de 0,249 ± 0,018 mM, mas não se mostrou significativamente sensível à presença de quantidades vestigiais de Pb2+ (P > 0,05). Relativamente à actividade da urease, para concentrações até 1,4 mM de Hg2+ e 0,7 mM de Pb2+, observou-se um efeito potenciador desta actividade. No entanto, para concentrações mais elevadas destes metais observou-se uma diminuição da actividade da urease, com valores de IC50 de 3,47 ± 0,17 mM e de 3,31 ± 0,45 mM, para o Hg2+ e para o Pb2+, respectivamente.
Os estudos referidos na literatura que mais se aproximam do aqui descrito foram efectuados por Chaperon & Sauvé (2007, 2008). Estes investigadores utilizaram quantidades muito menores destes metais e outro tipo de solo com uma ocupação diferente, tendo obtido valores de IC50 cerca de cem vezes inferiores aos que obtivemos neste trabalho, o que pode querer significar que os enzimas do solo que analisámos são muito mais estáveis à presença de Hg2+ e Pb2+ do que no caso referido.
CONCLUSÕES
No trabalho que aqui apresentamos, diferentes concentrações de Hg2+ e Pb2+ produziram, face a desidrogenases e urease, uma diminuição da actividade enzimática, mas em nenhum caso se obteve uma inibição total das referidas actividades. Isso mostra que num solo em pousio pode existir uma flora resistente à acção do Hg2+ e Pb2+ . Além disso, observou-se que o Pb2+ não inibiu a actividade de desidrogenases, o que levanta a questão da flora microbiana do solo estudado ou de pelo menos uma parte importante da mesma, poder vir a ter interesse para beneficiar solos poluídos pelo Pb2+ em que esta actividade seja muito baixa. É neste sentido que os nossos estudos futuros se irão dirigir.
REFERÊNCIAS BIBLIOGRÁFICAS
Brady, N. W. & Ray, R. 1999. The Nature and Properties of Soils, 12th Edition, MacMillan Publishing Co., New York. [ Links ]
Camiña, F., Trasar-Cepeda, C., Gil-Sotres, F. & Leirós, C. 1998. Measurement of dehydrogenase activity in acid soils rich in organic matter. Soil Biology & Biochemistry, 30: 1005-1011.
Cardoso, J. C. 1974. A Classificação dos Solos de Portugal – Nova Versão. Boletim de Solos, 17: 14-46. SROA, Secretaria de Estado da Agricultura, Lisboa.
Carter, M.R. 1993. Soil Sampling and Methods of Analysis. Canadian Society of Soil Science, Lewis Publishers, CRC Press Inc., USA.
Chaperon, S. & Sauvé, S. 2007. Toxicity interaction of metals (Ag, Cu, Hg, Zn) to urease and dehydrogenase activities in soils. Soil Biology & Biochemistry, 39: 2329-2338.
Chaperon, S. & Sauvé, S. 2008. Toxicity interactions of cadmium, copper, and lead on soil urease and dehydrogenase activity in relation to chemical speciation. Ecotoxicology and Environmental Safety, 70 (1): 1-9.
Dick, R. P. 1998. Soil Enzymes Activities as Integrative Indicators of Soil Health. In C. Pankhurst, B. M. Doube & V. V. S. R Gupta (eds.) Biological Indicators of Soil Health, pp.121-156. CAB International, New York, USA.
Friedel, J.K., Mölter K. & Fischer W. R. 1994. Comparison and improvement of methods for determining soil dehydrogenase activity by using triphenyltetrazolium chloride and iodonitrotetrazolium chloride. Biology and Fertility of Soils, 18 (4): 291-296.
Greco, W.R., Bravo, G. & Parsons, J.C. 1995. The search for synergy: a critical review from a response surface perspective. Pharmacology Review, 47: 331-385.
Greenberg, A. E., Clesceri, L.S. & Eaton, A.D. 1992. Standard Methods for the Examination of Water and Wastewater, 18th edition. APHA, AWWA, WEF. USA.
Kandeler, E. & Gerber, H. 1988. Short-term assay of soil urease activity using colorimetric determination of ammonium. Biology and Fertility of Soils, 6: 68-72
Marzadori, C., Miletti, S., Gessa, C. & Ciurli, S. 1998. Immobilization of Jack Bean Urease on hydroxyapatite: urease immobilization in alkaline soils. Soil Biology & Biochemistry, 30: 1485-1490.
Monkiedje, A., Ilori, M.O. & Spiteller, M. 2002. Soil quality changes resulting from the application of the fungicides mefenoxam and metalaxyl to a sandy loam soil. Soil Biology & Biochemistry, 34: 1939-1948.
Mora, A. P., Calvo, J. J. O., Cabrera, F. E & Madejón, E. 2005. Changes in enzyme activities and microbial biomass after in situ remediation of a heavy metalcontaminated soil. Applied Soil Ecology, 28: 125-137.
Nannipieri, P., Ascher, J., Ceccherini, M.T., Landi, L., Pietramellara, G. & Renella, G. 2003. Microbial diversity and soil functions. European Journal of Soil Science, 54: 655-670.
Roldán, A., Salinas-García, J. R., Alguacil, M. M. & Caravaca, F. 2005. Changes in soil enzyme activity, fertility, aggregation and C sequestration mediated by conservation tillage practices and water regime in a maize field. Applied Soil Ecology, 30: 11-20.
Rowell, D.L. 1994. Soil Science. Methods and Applications. Longman Scientific Technical, Harlow, England.
Sinsabaugh, R. L., Reynolds, H. & Long, T. M. 2000. Rapid assay for amidohydrolase (urease) activity in environmental samples. Soil Biology & Biochemistry, 32: 2095-2097.
Sukul, P. 2006. Enzymatic activities and microbial biomass in soil as influenced by metalaxyl residues. Soil Biology & Biochemistry, 38: 320-326.
Taylor, J. P., Wilson, B., Mills, M. S. & Burns, R. G. 2002. Comparison of microbial numbers and enzymatic activities in surface soils and subsoils using various techniques. Soil Biology & Biochemistry, 34: 387-401.
Tabatabai, M. A. & Bremner, J. M. 1971. Michaelis Constants of soil enzymes. Soil Biology & Biochemistry, 3: 317-323.
Trasar-Cepeda, C., Leirós, S., Seoane, S. & Gil-Sotres, F. 2000. Limitations of soil enzymes as indicators of soil pollution. Soil Biology & Biochemistry, 32: 18671875.
Trevors, J.T., 1984. Dehydrogenase activity in soil. A comparison between the INT and TTC assay. Soil Biology & Biochemistry, 16: 673-674.
von Mersi, W. & Schinner, F., 1991. An improved and accurate method for determining the dehydrogenase activity of soils with iodonitrotetrazolium chloride. Biology and Fertility of Soils, 11: 216-220.














