Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Acessos
Acessos
Links relacionados
-
 Similares em
SciELO
Similares em
SciELO
Compartilhar
Revista de Ciências Agrárias
versão impressa ISSN 0871-018X
Rev. de Ciências Agrárias vol.35 no.1 Lisboa jun. 2012
Diversidad y proporción sexual de syrphidae en cultivos de leguminosas y plantas espontáneas, en León (España)
Diversidade e razão sexual de syrphidae em leguminosas e plantas espontâneas, em León (Espanha)
Isabel Bertolaccini1, Etelvina Núñes-Pérez2 e Emilio Jorge Tizado2
1Zoología Agrícola, Facultad de Ciencias Agrarias, Universidad Nacional del Litoral. R. P. Kreder, 2805, 3080- Esperanza, Santa Fe, Argentina. E-mail: isabelb@fca.unl.edu.ar
2Departamento de Biología Animal, Zoología, Universidad de León, Campus de Ponferrada, E-24400 Ponferrada, León, España. E-mail: etelvinanunez@unileon.es;
3E-mail: ejtizado@unileon.es
RESUMEN
Los adultos de sírfidos visitan las flores para obtener néctar y polen. La disponibilidad de plantas en floración es esencial para la supervivencia de estos insectos. El objetivo del trabajo fue determinar el efecto de las plantas espontáneas en la diversidad de sírfidos y su influencia en la proporción sexual. Para ello se identificaron y se sexaron los adultos capturados en cultivos de leguminosas y en las plantas espontáneas asociadas.
En ambos la proporción sexual fue 1,4♀:1,0♂, pero la diversidad específica de hembras fue mayor en las plantas espontáneas. La diversidad de Shannon (H) fue apenas mayor en las plantas espontáneas que en los cultivos (2,12 vs. 2,13). El índice de equidad fue mayor en los cultivos y, en las hembras en las plantas espontáneas. La diversidad vegetal contribuye a mantener la diversidad de los sírfidos, especialmente de las hembras. Las familias de plantas espontáneas Umbelliferae, Asteraceae y Chenopodiaceae, fueron en orden decreciente de importancia, donde se efectuaron más observaciones.
Palabras claves: Diversidad, Leguminosae, plantas espontáneas, proporción de sexos.
RESUMO
Os sirfídeos adultos visitam flores para obter néctar e pólen. A disponibilidade de plantas em floração é essencial para a sobrevivência destes insectos. O presente estudo teve como objectivo determinar o efeito de plantas espontâneas na diversidade de sirfideos e sua influência na proporção sexual. Para o feito, foram identificados e sexados adultos capturados em culturas leguminosas e plantas espontâneas associadas. Em ambos os casos, a proporção entre os sexos foi de 1,4♀:1,0♂, mas a diversidade específica foi maior nas fêmeas. O índice de diversidade de Shannon (H) foi ligeiramente maior nas plantas espontâneas, do que nas culturas (2,12 contra 2,13). O índice de equidade foi maior nas culturas, e no caso das fêmeas nas plantas espontâneas. A diversidade vegetal ajuda a manter a diversidade de sirfideos, especialmente do sexo feminino. As famílias de plantas espontâneas, Umbelliferae, Asteraceae e Chenopodiaceae foram, por ordem decrescente de importância, aquelas onde se efectuaram mais observação.
Palavras-chave: Biodiversidade, Leguminosae, plantas silvestres, proporção sexual.
INTRODUCCIÓN
Muchas plantas espontáneas son consideradas malezas, aunque ninguna es nociva por completo. Existen factores a considerar para que una maleza llegue a ser un componente más en el manejo integrado de las plagas (Tizado Morales et al. 1992).
Los insectos predadores en muchas ocasiones se comportan como omnívoros al alimentarse de más de un nivel trófico, de tal modo que además de presas lo hacen de plantas (Coll y Izraylevich, 1997; Coll et al., 1997; Gravensen y Toft, 1987). Las especies predadoras pueden poseer diferentes regímenes alimenticios en sus diferentes estados de desarrollo, siendo para algunos de ellos, de fundamental importancia contar en el adulto con fuentes de néctar y polen (Garcia, 1991). Tal es el caso de los sírfidos, en que si bien hay especies de hábitos alimenticios coprófagos, fitófagos, acuáticos (Frank, 1999), los adultos en todos los casos necesitan de proteínas y aminoácidos, indispensables para la maduración de los huevos, ya que la fecundidad depende de esos recursos alimenticios (Branquart y Hemptinne, 2000) provenientes del néctar y del polen (Ssymank y Gilbert 1993). Según Gilbert (1986) los machos probablemente sólo visitan las flores como lugar de encuentro con las hembras.
Las plantas espontáneas pueden actuar manteniendo a los enemigos naturales en el medio, al proporcionarles refugio, como las brasicas (Cruciferae) (Idris y Grafius, 1996) y/o presas o huéspedes alternativos o por atracción por las sustancias secundarias que poseen (Wnuk y Wojciechowicz-Zytko, 1991). Las flores de Polygonum aviculare L. son fuente de alimento para 36 taxones de insectos (Bugg et al., 1987); Cirsium arvense (L.) Scop. para los sírfidos (Starý, 1986), al igual que las flores de las umbelíferas (Salto et al., 1991; Wnuk y Gut, 1994). Wyss (1995) menciona que las franjas marginales de malezas reduce la densidad de áfidos al aumentar el número de predadores afidófagos, contribuyendo en la calidad del suplemento alimenticio que provee a los adultos (Salveter, 1998). Debido a que los adultos de sírfidos son buenos voladores, pueden colonizar ambientes agrícolas después de aplicaciones de plaguicidas, Sommaggio (1999) propone que se intensifiquen los estudios para su utilización como bioindicadores. Debido a que la diversidad florística de los sistemas agrícolas contribuyen a la diversidad de la entomofauna, el objetivo del presente trabajo fue determinar como la diversidad vegetal contribuye a la diversidad de sírfidos en los sistemas agrícola con leguminosas y la proporción sexual de los principales sírfidos predadores de pulgones de los cultivos de leguminosas y en sus plantas espontáneas asociadas.
MATERIALES Y MÉTODOS
Región estudiada: La provincia de León, en España ocupa 15.648 Km2, cuenta con 230 municipios, en los que los principales cultivos son los cereales, las leguminosas, los tubérculos para el consumo humano, los cultivos industriales y los forrajeros.
Muestreos: Desde mediados de primavera a mediados de verano de los años 1998, 1999 y 2000, se recorrió semanalmente la provincia tomando diferentes municipios al azar. Se recorrieron 114 municipios y en cada uno de ellos se realizaron observaciones de los cultivos de leguminosas. En los recuentos se consideraron dos sitios de muestreos: cultivos y plantas espontáneas. En el primer caso se llevaron registros del estado fenológico y de los adultos de sírfidos. Las plantas espontáneas estaban preferentemente en floración, aunque también se considerados las que estaban en el inicio de floración, tanto las de crecimiento intercalar como las presentes en los bordes de los campos.
Los recuentos de los adultos de sírfidos se realizaron en las horas más soleadas del día, comprendida entre las 11 h a las 14 hs. En cada planta espontánea de los bordes de los lotes se realizaron observaciones de adultos durante 10 minutos, mientras que para monitorear las que crecían en los cultivos de leguminosas se realizaron transectas diagonales en los campos, observándose las plantas en tres estaciones de muestreos tomadas al azar. En los cultivos destinados a grano, en que la siembra es en líneas, se tomaron tres plantas al azar, con igual tiempo de observación mencionado para los cultivos, mientras que en las forrajeras, las observaciones se realizaron en las transectas mencionadas.
Se realizaron 309 observaciones en los cultivos de leguminosas de las cuales el 73,0% correspondieron a Medicago sativa L., mientras que a Phaseolus vulgaris L., Pisum sativum L., Cicer arietinum L. y Trifolium repens L. el 11,0%, 3,3%, 3,0%, respectivamente. El 2,0% a Vicia faba L. y a T. pratense L. Los restantes cultivos observados fueron Lathryrus cicera L., L. sativus L., Lens esculenta L., Lupinus albus L., L. angustifolius L., L. luteus L., Trigonella foenum-graecum L., Vicia ervilia (L.) Willd. y V. sativa L. correspondiendo, cada uno, el 0,3% de las observaciones.
De las plantas espontáneas se observaron 23 familias, con un número variable de especies en cada una de ellas, aunque solo se registró la presencia de adultos en las marcadas con un *:
Amaranthaceae: Amaranthus retroflexus L.*
Apiaceae (= Umbelliferae): Anthriscus caucalis M.Bieb.*, Caucalis platycarpos L., Daucus carota L.*, Eryngium campestre L., Foeniculum vulgare Miller*, Tordylium maximum L.*
Asteraceae (= Compositae): Achillea millefolium L.*, Anacyclus clavatus (Desf.) Pers.*, Andryala integrifolia L., Anthemis arvensis L.*, Arctium minus (Hill) Bernh.*, Carduus tenuiflorus Curtis, Carlina corymbosa L., Centaurea calcitrapa L., Chondrilla juncea L.*, Cirsium arvense (L.) Scop.*, C. odontolepis Boiss. ex DC., C. sp. *, C. vulgare (Savi) Ten.*, Conyza canadensis (L.) Cronq*, Crepis capillaris (L.) Wallr.*, C. vesicaria L.*, Galinsoga parviflora Cav.*, Helianthus annuus L., Hypochoeris radicata L.*, Lactuca virosa L.*, Mantisalca salmantica (L.) Briq. & Cavill.*, Onopordum acanthium L.*, Picris echioides L.*, Scolymus hispanicus L., Senecio jacobaea L.*, Sonchus asper (L.) Hill*, S. oleraceus L.*, Sonchus sp., Taraxacum officinale Webb*.
Boraginaceae: Echium italicum L., E. vulgare L.*
Brassicaceae (= Cruciferae): Brassica sp.*, B. nigra (L.) K.Koch*, Capsella bursa-pastoris (L.) Medik.*, Hirschfeldia incana (L.) Lagr.-Foss.*, Raphanus raphanistrum L., Sisymbrium austriacum Jacq.*
Caryophylaceae: Petrorhagia prolifera (L.) P.W. Ball & Heywood*, Saponaria officinalis L., Stellaria media (L.) Will.
Chenopodiaceae: Chenopodium album L.*
Convolvulaceae: Convolvulus arvensis L.*
Dipsacaceae: Dipsacus fullonum L., Scabiosa atropurpurea L., S. columbaria L.*
Fabaceae (= Leguminosae): Adenocarpus complicatus (L.) Gay, Trifolium resupinatum L., T. pratense L., T. repens L.*
Hypericaceae (= Guttiferaceae): Hypericum perforatum L.
Lamiaceae (= Labiatae): Mentha x rotundifolia (L.) Huds.*
Malvaceae: Malva sylvestris L.*
Papaveraceae: Papaver rhoeas L.
Plantaginaceae: Plantago lanceolata L.*
Poaceae (= Gramineae): Lolium perenne L.
Polygonaceae: Polygonum aviculare L.*, P. persicaria L.*, Rumex conglomeratus Murray*, R. crispus L.*, Rumex sp.*
Resedaceae: Reseda luteola L., R. ulmifolius
Rosaceae: Fillipendula ulmaria (L.) Maxim.*, Rubus ulmifolius Schott*.
Rubiaceae: Galium sp.*, G. mollugo L.*, G. verum L.
Salicaceae: Salix neotricha Görz, S. triandra L.
Scrophulariaceae: Verbascum pulverulentum Vill.
Verbenaceae: Verbena officinalis L.*
En todos los casos se recolectaron los sírfidos adultos, utilizando para ello red de arrastre y frascos plásticos para la captura. Los representantes capturados se conservaron en alcohol 70º. Las identificaciones a nivel especie y la determinación del sexo, se realizaron bajo lupa binocular de 40x. Para ello se siguiendo las claves de Stubbs y Falk (1983) y el criterio de estos autores en la determinación del sexo de los sírfidos en función a la distancia entre los ojos compuestos. Se obtuvo la proporción de machos y hembras en cada situación analizada. Los cultivos y las plantas espontáneas fueron identificados con la colaboración de los docentes del Departamento de Biología Vegetal (Universidad de León).
Análisis de los datos: A partir del análisis de las muestras se confeccionaron tablas de abundancias relativas de las especies por sitio, lo cual permitió la estimación de los siguientes índices ecológicos (Martinez et al. 2009; Armendano y González, 2010):
1- Abundancia relativa: representa el porcentaje de una especie sobre el total, incluyendo a todas las especies observadas.
2- Diversidad de especies: se aplicó el índice de Shannon-Wiener, utilizado para caracterizar la diversidad de especies en una comunidad, es estimado como:
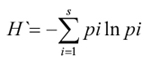
donde: H’ = índice de diversidad; S= número de especies (riqueza); pi = proporción de individuos de la especie i respecto al total de individuos (es decir la abundancia relativa
de la especie 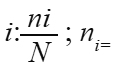 número de individuos de la especie i; N = número de todos los individuos de todas las especies. De esta forma, el índice contempla la cantidad de especies presentes en el área de estudio (riqueza de especies), y la cantidad relativa de individuos de cada una de esas especies (abundancia).
número de individuos de la especie i; N = número de todos los individuos de todas las especies. De esta forma, el índice contempla la cantidad de especies presentes en el área de estudio (riqueza de especies), y la cantidad relativa de individuos de cada una de esas especies (abundancia).
pi = Proporción del total de la muestra perteneciente a las "i" especies. El valor del índice de Shannon-Wiener se incrementa con el número de especies en la comunidad y, si bien en teoría pueden alcanzar valores muy altos, en la práctica, para comunidades biológicas, este índice no parece exceder de 5,0.
3- Índice de equidad de Shannon (EH): asume valores entre 0 y 1, en donde cuando más cercano a 1 es el valor, mayor es la uniformidad, se calcula del siguiente modo, a partir de los datos de H´:
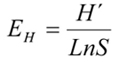
RESULTADOS
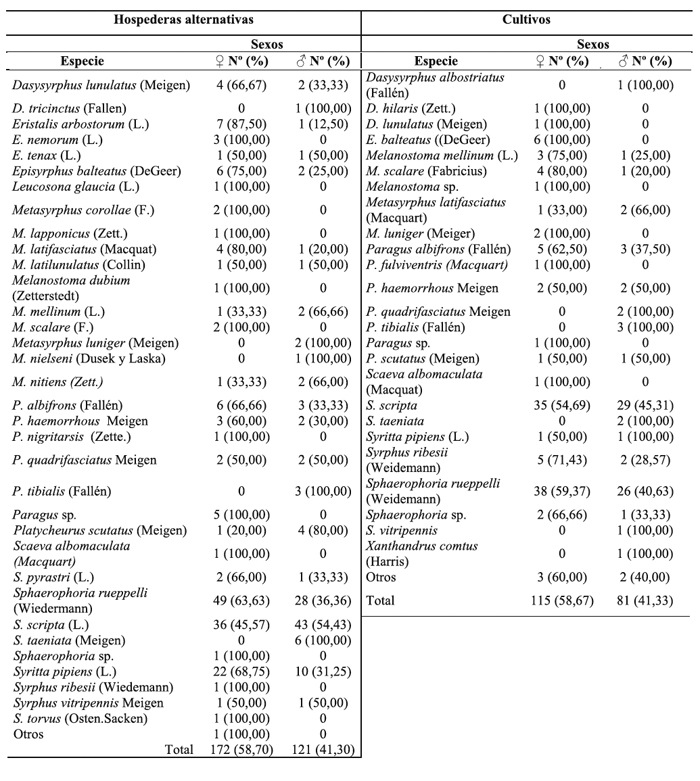
Especies de sírfidos y frecuencia relativa Cultivos de leguminosas: Se capturaron 196 adultos de 27 diferentes especies (Tabla 1). Del total, el 58,7% fueron hembras. De la mayoría de las especies se registró la presencia de ambos sexos. Las especies más frecuentes fueron Sphaerophoria rueppelli (Wiedemann) y Syritta scripta (L.). Cuando se hallaron solamente machos fue en especies que se registraron en una sola observación, con excepción de Paragus tibialis (Fallén), P. quadrifasciatus Meigen y Sphaerophoria taeniata (Meigen), aunque con pocos registros. La proporción de sexos fue de 1,4:1,0 (♀:♂).
Tabla 1 - Nº y porcentaje por especies de Syrphidae en las hospederas alternativas y cultivos de leguminosas, por sexos.
El cultivo con más observaciones fue M. sativa, en el que la mayoría de las observaciones fueron de sírfidos predadores, en solo una oportunidad se halló a Syritta pipiens (L.), cuyas larvas se alimentan de materia orgánica en descomposición.
Plantas espontáneas: El 95,0% de las plantas se encontraban en floración en el momento de las capturas, las restantes en el inicio de este estado fenológico. Se determinó el sexo de 293 adultos que correspondieron a 36 especies (Tabla 1). La proporción entre sexos se mantuvo igual a la observada en los cultivos.
Las especies predadoras más frecuentes fueron Sphaerophoria rueppelli (Wiedemann) y S. scripta (L.). Otro género importante fue Paragus, con cuatro especies, mientras que la aparición de las restantes especies afidófagas fue esporádica. A diferencia de lo observado en los cultivos las especies coprófagas se presentaron con mayor frecuencia en las plantas espontáneas. La especie más frecuente fue Syritta pipiens (L.), y la familia de adventicia en que más se observó fue Umbelliferae, con 21 recuentos. También se la encontró, aunque en baja densidad, en Asteraceae, Chenopodiaceae, Borraginaceae, Dipsacaceae y Verbenaceae. El género Eristalis con las especies E. arbustorum (L.) y E. tenax (L.) solo se encontró en una oportunidad en la familia Asteraceae.
Índice de diversidad: La diversidad de especies resultó semejante en ambos sitios (Tabla 2), sin embargo, cuando se analizan los sexos por separado, en el caso de las plantas espontáneas las hembras tuvieron mayor diversidad, con respecto a los cultivos, mientras que en los machos, si bien la diversidad fue mayor en las plantas espontáneas, la diferencia fue menor que en las hembras.
Tabla 2 - Índice de diversidad (H´) y de equidad (EH) de Shannon-Wiener para adultos de sírfidos, valores totales y por sexo, en las plantas espontáneas y en los cultivos de leguminosas.
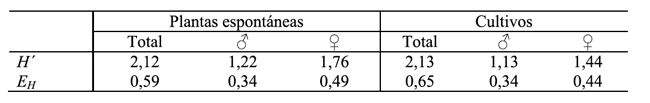
Índice de equidad: En cuanto a la equidad los valores demuestran que la uniformidad en las especies fue mayor en los cultivos (Tabla 2). Los machos tuvieron en ambos sitios valores semejantes.
En cuanto a la frecuencia de observación de sírfidos por familia de planta espontánea, en Umbelliferae se registró el 42,3% de las observaciones; siguen en importancia Asteraceae y Chenopodiaceae, con el 31,7 y 7,3%, respectivamente. En Cariophylaceae, Polygonaceae y Amaranthaceae se realizaron 6, 5 y 4 observaciones, respectivamente, mientas que en las restantes familias no superanron las tres observaciones.
DISCUSIONES
Tanto los cultivos de leguminosas como las plantas espontáneas se observó una proporción de 1,4:1,0 (♀:♂) en los adultos de sírfidos. Aproximadamente el 60% de los adultos en los cultivos de leguminosas fueron hembras, las que pudieron haber estado buscando colonias de pulgones plaga para colocar los huevos. Los machos pudieron ser atraídos por la presencia de las hembras. Según White et al. (1995) los adultos se mueven desde las adyacencias de los cultivos, ricos en flores, pero depositan los huevos en los cultivos, donde se desarrollan las larvas disminuyendo la población de plagas. Además las plantas que crecen en los bordes sufren menos el impacto de los insecticidas permitiendo que los sírfidos estén disponibles en el medio para una rápida colonización de los ambientes que han sufrido contaminación con agroquímicos (Sommaggio, 1999). Por lo tanto con un manejo adecuado de la diversidad vegetal se podría contribuir en la conservación de estos enemigos naturales de los áfidos.
La cantidad de especies, tanto de sírfidos afidófagos como coprófagos, fue mayor en las franjas marginales de malezas que en los cultivos, 36 y 27, respectivamente, coincidiendo con lo hallado por Frank (1999) y Sajjad y Saeed (2010) presumiblemente en respuesta a la diversidad de nutrientes que ofrecen las plantas espontáneas (Sutherland et al. 2001), especialmente de néctar y polen (Garcia, 1991; Ssymank y Gilbert 1993). Por lo tanto los hábitats no cultivados tendrían un papel importante en la conservación de la diversidad específica de sírfidos (Gravensen y Toft, 1987; Wyss, 1995).
La diversidad específica hallada en ambos hábitats es solo una pequeña fracción del total registrado para la diversidad total de especies presentes en la Península Ibérica, ya que Carles-Tolrá (2006) menciona que son 348 las especies citadas de Syrphidae, lo que indica que, posiblemente, los diferentes hábitats tienen un efecto diferente en la riqueza especifica, ya que existen especies que se presentan en bajo número debido a restricciones espaciales o temporales o a que poseen especialización en el hábitat en que se desarrollan. Ricarte et al. (2011) estudiaron tres paisajes diferentes (matorrales, pastizales y bosques), cada uno con diferente vegetación dominante, concluyendo que para conservar la diversidad y la función ecológica de los sírfidos hay que centrarse en ecosistemas de alta calidad que favorezcan la dispersión de las especies menos frecuentes.
No todos los adultos hallados correspondieron a especies predadoras, Syritta pipiens (L.) y Eristalis tenax (L.) se desarrollan sobre material en descomposición en compost, plantas en descomposición y Eristalis tenax (L.) en medios acuáticos (Rotheray, 1993, Frank, 1999). La mayor cantidad de representantes hallados en las plantas de los bordes se debió, probablemente a que prefieren las franjas marginales de malezas de los campos cultivados como sitio de oviposición, debido a la mayor cantidad de fitomasa (Frank, 1999).
El índice de diversidad de Shannon-Wiener permite conocer no solo el número de especies, sino que como la abundancia de una especie se distribuye entre todas las que conforman una comunidad. Si bien en ambos ambientes los valores fueron similares, 2,12 en las plantas espontáneas y 2,13 en los cultivos, cuando se analizan los sexos por separado el valor de H fue considerablemente mayor en las adventicias, algo similar se observó en los machos.
Los resultados de equidad de Shannon, que mide la abundancia relativa de las especies que conforman la riqueza de un área, llega al valor máximo (EH=1) cuando todas las especies tienen un tamaño poblacional igual. Los resultados revelaron una mayor equidad en los cultivos de leguminosas que en las plantas espontáneas, relacionada con la mayor cantidad de especies. Esta uniformidad está representada por la mayor cantidad de observaciones del género Sphaerophoria, que en este sitio representa el 65% del total de las especies, mientras que en las plantas espontáneas el 53%, ante una variación de 36 y 27 especies, respectivamente. El valor de EH para las hembras fue mayor en ambos sitios, lo que demuestra que una mayor diversidad en la flora aumenta la diversidad de hembras, que buscan alimento en forma de aminoácidos y azúcares, esenciales para la oviposición. La diversidad de los machos no se vio afectada por la diversidad florística, lo contrario ocurrió con las hembras.
CONCLUSIONES
La diversidad específica de sírfidos fue mayor en las plantas espontáneas adyacentes a los cultivos de leguminosas.
La proporción de machos y hembras se mantuvo en ambos ambientes estudiados. La diversidad de hembras fue mayor que en los machos.
Las familias de especies espontáneas en las que se realizaron más observaciones de sírfidos fueron, en primer lugar Umbelliferae, seguida por Asteraceae y Chenopodiaceae.
REFERENCIAS BIBLIOGRÁFICAS
Armendano A. y González, A. (2010) - Comunidad de arañas (Arachnida, Araneae) del cultivo de alfalfa (Medicago sativa) en Buenos Aires, Argentina. Rev. Biología Tropical, 58, 2: 757-767.
Branquart, E. y Hemptinne, J.-L. (2000) - Development of ovaries, allometry of reproductive traits and fecundity of Episyrphus balteatus (Diptera: Syrphidae). European Journal of Entomology, 97, 2: 165-170. [ Links ]
Bugg, R.L.; Ehler, L.E. y Wilson, I.T. (1987) - Effect of common knotweed (Polygonum aviculare) on abundance and efficiency of insect predators of crop pests. Hilgardia, 55, 7: 1-53. [ Links ]
Carles-Tolrá, M. (2006) – Sírfidos nuevos para Andorra y la Península Ibérica (Diptera Syrphidae). Heteropterus Revista de Entomología 6: 145- 156. [ Links ]
Coll, M. y Izraylevich, S. (1997) - When predators also feed on plants: effects of competition and plant quality on omnivore-prey population dynamics. Annals of the Entomological Society of American, 90, 2: 155-161. [ Links ]
Coll, M.; Smith, L.A. y Ridgway, R.L. (1997) - Effect of plants on the searching efficiency of a generalist predator: the importance of predator-prey spacial association. Entomologia Experimentalis et Applicata, 83: 1-10. [ Links ]
Frank, T. (1999) - Density of adult hoverflies (Dipt., Syrphidae) in sown weed strips and adjacent fields. Journal of Applied Entomology, 123: 351-355. [ Links ]
Garcia, M.A. (1991) - Ecologia nutricional de parasitóides e predadores terrestres. In: Panizzi A.R. y Parra, J.P.R. (Eds.) - Introdução à ecologia nutricional de insetos e suas implicações no manejo de pragas. São Paulo, Manole, p. 289-312. [ Links ]
Gilbert, F.S. (1986) - Hoverflies. Cambridge, Cambridge University Press, 66p. (Naturalist’s Handbooks 5).
Gravensen, E. y Toft, S. (1987) - Grass fields as reservoirs for polyphagous predators (Arthropoda) for aphids (Homopt., Aphididae). Journal of Applied Entomology, 104: 461-473. [ Links ]
Idris, A.B. y Grafius, E. (1996) - Effects of wild and cultivated host plants on oviposition, survival, and development of diamondback moth (Lepidoptera: Plutellidae) and its parasitoid Diadegma insulare (Hymenoptera: Ichneumonidae). Environmental Entomology, 25, 4: 825-833. [ Links ]
Martínez, N.J.; García, H.; Pulido, L.A.; Ospinio, D. y Narváez, J.C. (2009) - Escarabajos Coprófagos (Coleoptera: Scarabaeinae) de la Vertiente Noroccidental, Sierra Nevada de Santa Marta, Colombia. Neotropical Entomology, 38, 6:708-715. [ Links ]
Ricarte, A.; Marcos-García, M.A. y Moreno, C.E. (2011) - Assessing the effects of vegetation type on hoverfly (Diptera: Syrphidae) diversity in a Mediterranean landscape: implications for conservation. Journal of Insect Conservation (en línea) <http://dx.doi.org/10.1007/s10841-011-9384-9> (Aceso en 2.06.2011). Disponível em < http://www.springerlink.com/content/u3r7400k48117mt0/fulltext.pdf >.
Rotheray, G.E. (1993) - Colour guide to hoverfly larvae (Diptera: Syrphidae). Dipterists Digest, 9: 1-155. [ Links ]
Sajjad, A. y Saeed, S. (2010) - Floral host plant range of syrphid flies (Diptera: Syrphidae) under natural conditions in southern Punjab, Pakistan. Pakistan Journal of Botany, 42, 2: 1187-1200. [ Links ]
Salto, C.E.; López, J.A.; Bertolaccini, I.; Quaino, O. y Imwinkelried, J.M. (1991) - Preferencia de adultos de Allograpta exotica (Diptera, Syrphidae) por flores de malezas. In: Actas de la XII Reunión Argentina sobre la maleza y su control. Mar del Plata, Buenos Aires, ASAM, vol. 1, p. 113-118. [ Links ]
Salveter, R. (1998) - The influence of sown herb strips and spontaneous weeds on the larval stages of aphidophagous hoverflies (Diptera: Syrphidae). Journal of Applied Entomology, 122: 103-114. [ Links ]
Sommaggio, D. (1999) - Syrphidae: can they be used as environmental bioindicators? Agriculture, Ecosystems y Environment, 74: 343-356. [ Links ]
Ssymank, A. y Gilbert, F. (1993) - Anemophilous pollen in the diet of Syrphid flies with special reference to the leaf feeding strategy occurring in Xylotini (Diptera, Syrphidae). Deutsche Entomogische Zeitschrft, 40, 2: 245-258. [ Links ]
Starý, P. (1986) - Creeping thistle, Cirsium arvense, as a reservoir of aphid parasitoids (Hymenoptera, Aphidiidae) in agroecosystems. Acta Entomologica Bohemoslov, 83: 425-431. [ Links ]
Stubbs, A.E. y Falk, S.J. (1983) - British hoverflies. An illustrated identification guide. Londres, British Entomological and Natural History Society, 253 p. [ Links ]
Sutherland, J.P.; Sullivan, M.S. y Poppy, G.M. (2001) - Distribution and abundance of aphidophagous hoverflies (Diptera: Syrphidae) in wild flower patches and field margin habitats. Agricultural and Forest Entomology, 3: 57-64. [ Links ]
Tizado Morales, E.J.; Núñez Pérez, E. y Nieto Nafría, J.M. (1992) - Reservorios silvestres de parasitoides de pulgones del género Aphis con interés agrícola en la provincia de León. (Hym., Braconidae: Aphidiinae; Hom. Aphididae). Boletín de Sanidad Vegetal. Plagas, 18: 309-313. [ Links ]
Von Klinger, K. (1987) - Effects of margin-strips along a winter wheat field on predatory arthropods and the infestation by cereal aphids. Journal of Applied Entomology, 104: 47-58. [ Links ]
White, A.J.; Wratten, S.D.; Weigman, U. y Berry, N.A. (1995) - Habitat manipulation to enhance biological control of Brassica pests by hoverflies (Diptera: Syrphidae). Journal of Economic Entomology, 88: 1171-1176. [ Links ]
Wnuk, A. y Gut, B. (1994) - The attractiveness of wild Umbelliferae flowers to aphidophagous Syrphidae (Dipt.). Polskie Pismo Entomologiczne, 63: 197-206. [ Links ]
Wnuk, A. y Wojciechowicz-Zytko, E. (1991) - The attractiveness of flowers of Cruciferae for the aphidophagous Syrphidae. Folia Horticulturae, 3, 2: 29-36. [ Links ]
Wyss, E. (1995) - The effects of weed strips on aphids and aphidophagous predators in an apple orchard. Entomologia Experimentalis et Applicata, 75: 43-49. [ Links ]
AGRADECIMIENTOS
A FOMEC, a la Universidad Nacional del Litoral (Argentina) y a la Universidad de León (España).
Recepção/Reception: 2011.02.10
Aceitação/Acception: 2011.07.20














