Serviços Personalizados
Journal
Artigo
Indicadores
Links relacionados
Compartilhar
Revista de Ciências Agrárias
versão impressa ISSN 0871-018X
Rev. de Ciências Agrárias vol.36 no.2 Lisboa abr. 2013
Biorremediação de áreas contaminadas com cobre
Bioremediation of copper contaminated areas
Robson Andreazza2, Flávio Anastácio de Oliveira Camargo2, Zaida Inês Antoniolli3, Maurízio Silveira Quadro1 e Amauri Antunes Barcelos1
1 Centro de Engenharias, Universidade Federal de Pelotas, Rua Almirante Barroso 1734, 96010-280, Pelotas, RS, Brasil. E-mail: robsonandreazza@yahoo.com.br, author for correspondence.
2 Departamento de Solos, Universidade Federal do Rio Grande do Sul, Bento Gonçalves 7712, Agronomia, 91540-000, Porto Alegre, RS, Brasil.
3 Departamento de Solos, Universidade Federal de Santa Maria, Av. Rorâima 1000, Camobi, Santa Maria, RS, Brasil.
RESUMO
O cobre é um micronutriente essencial para todos os seres vivos, porém em grandes concentrações pode causar sérios problemas ambientais. Áreas de vitivinicultura são áreas com contaminação potencial de cobre, devido a intensa e contínua aplicação de produtos agrícolas contendo este elemento em sua formulação. Áreas de rejeito de mineração de cobre também são áreas de grande risco à saúde dos seres vivos, pois são extensões com altas concentrações de cobre e com potencial para a contaminação de áreas adjacentes. A utilização de técnicas eficazes para a remediação destas áreas é necessária para a redução do impacto negativo e melhoria das condições ambientais. O objetivo desta revisão foi abordar os principais aspectos envolvidos na biorremediação de áreas contaminadas com cobre e indicar possibilidades para a melhoria da eficiência do processo. A biorremediação de áreas contaminadas pode ser mais eficaz quando utilizados microrganismos resistentes e eficientes, isolados de áreas contaminadas, juntamente com a utilização de plantas remediadoras e hiperacumuladoras de cobre.
Palavras-chave: Fitorremediação, mecanismos de resistência, microrganismos, poluição, toxicologia
ABSTRACT
Copper is an essential micronutrient to all living organisms, although in high concentrations it can cause environmental problems. Vineyard areas are potential copper-contaminated sites due to intense and constant use of sprays containing copper in formulation. Copper mining waste areas also have high copper concentrations with high potential to contaminate adjacent areas. Use of efficient techniques for remediation of these areas is necessary to reduce negative impacts and improve environmental conditions. Organisms such as plants, fungus and bacteria are efficient alternatives and coast-friendly to all involved parts. The objective of this review is to discuss the main aspects of bioremediation of copper-contaminated areas and show some research aspects to optimize the process. Bioremediation of contaminated areas can be more efficient when efficient and resistant microorganisms isolated from copper-contaminated areas are used together with copper hyperaccumulator plants.
Keywords: Microorganisms, phytoremediation, pollution, resistance mechanisms, toxicology
Introdução
Devido à intensa e contínua utilização de metais pesados pela atividade antrópica, têm-se aumentado a contaminação ambiental, tornando-se um problema pertinente e motivo de intensa pesquisa. Para os seres humanos, a contaminação com cobre (Cu) leva a graves complicações à saúde, podendo causar câncer e até mesmo a morte. Para organismos como plantas, fungos e bactérias, altas concentrações de cobre promovem uma pressão de seleção, mantendo somente os organismos resistentes neste local contaminado (Atlas e Bartha, 1997). Essa pressão de seleção pode ser utilizada para selecionar organismos resistentes a estas condições e para testá-los posteriormente quanto ao seu uso na biorremediação.
A biorremediação de áreas contaminadas com cobre, como áreas de vitivinicultura e áreas de rejeito de mineração de Cu, pode ser uma alternativa viável para a recuperação destas; e para isto é necessário avaliar a utilização de organismos resistentes e eficientes (Andreazza et al., 2010a; 2011a) e de baixo custo. Contudo, é necessário o isolamento de microrganismos resistentes e eficazes na remoção do Cu, bem como na transformação deste elemento em formas mais biodisponíveis para a biorremediação. Estes microrganismos resistentes também podem ser úteis quando testados e estudados para a utilização em espécies vegetais que crescem em áreas contaminadas com Cu. Espécies vegetais podem ser utilizadas para a remoção ou estabilização destas áreas, desde que previamente selecionadas para a resistência nestes ambientes.
Os principais aspectos envolvidos na biorremediação de áreas contaminadas com cobre, como a toxicologia, as fontes de poluição, os mecanismos biológicos de resistência e as estratégias para o uso de microrganismos e de plantas para a remediação de áreas contaminadas com cobre foi o objetivo da presente revisão.
Desenvolvimento
Aspectos toxicológicos do cobre
O Cu é um elemento essencial a todos os seres vivos, inclusive aos humanos, pois atua como co-fator de uma série de metaloenzimas envolvidas na formação da hemoglobina e no metabolismo de carboidratos, xenobióticos e drogas, bem como nos mecanismos de antioxidação celular (ATSDR, 2004). Nos Estados Unidos da América, a média de ingestão de cobre pela alimentação é entre 0,93 a 1,3 mg de Cu por dia para adultos, sendo recomendado uma dieta com no máximo 0,9 mg dia-1 de Cu. O cobre é rapidamente absorvido no estômago e no intestino, tendo sua concentração controlada no organismo por um mecanismo de homeostase que envolve a indução e síntese de metalotioneínas (ATSDR, 2004). Apesar deste mecanismo prevenir parte da toxicidade de cobre, a exposição níveis excessivos pode resultar em vários efeitos à saúde, incluindo danos ao fígado e aos rins, anemia, imunotoxicidade e desenvolvimento da toxicidade (ATSDR, 2004). Os sintomas mais comuns relacionados à exposição de altas concentrações de cobre é a disfunção intestinal, seguida de náusea, vômito e dor abdominal. Em casos de super exposição ao cobre e de outros elementos têm sido constatado o risco de câncer de pulmão e de estômago (ATSDR, 2004). O cobre é um dos metais cuja concentração é controlada pela legislação brasileira nos corpos hídricos, o qual se situa em um limite de 5 mg L-1 (BRASIL, 1974).
Produtos e resíduos contendo cobre estão presentes em inúmeras atividades agrícolas, urbanas e industriais, com grande potencial para a contaminação do solo e da água. Entre as atividades específicas com potencial poluidor, destacam-se as áreas de mineração de cobre, áreas de rejeito de mineração, lodo de esgoto, dejeto de suínos, resíduos industriais e a vitivinicultura.
Os fungos também são afetados pelo cobre e esse fato tem sido levado em consideração no caso do controle de microrganismos patogênicos. Entretanto, as células procarióticas são mais resistentes e toleram elevadas concentrações de cobre no meio. Estas células possuem um mecanismo de resistência ao cobre (homeostase do cobre), pode ser controlada pela atividade de metalotioneínas e chaperonas, que retém o cobre no citosol (Arredondo e Núñez, 2005). Por este motivo, é possível supor que o uso de microrganismos tolerantes ao cobre e dos genes envolvidos nesta resistência a altas concentrações possam ser úteis para o estabelecimento de estratégias para a remoção deste metal de áreas contaminadas.
Caracterização da contaminação do cobre no solo e na água
O cobre é um micronutriente essencial para as plantas, mas também é um metal pesado. A alta concentração de cobre na solução do solo pode ser tóxica aos microrganismos, plantas, animais e humanos. O teor natural de cobre em solos é muito variável, dependendo da rocha matriz e da intensidade dos processos de formação do solo (físico-químico e biológico) sobre a rocha e está predominantemente associado à fase sólida do solo. As formas solúveis e trocáveis representam menos que 10% do teor total do cobre em solos e, normalmente são encontrados teores entre 1 a 3%. Na litosfera o teor médio total é de 70 mg kg-1, no solo varia de 2 a 100 mg kg-1 e nas águas superficiais as concentrações são menores que 0,020 mg L-1 (King, 1996; CETESB, 2007).
O cobre é influenciado pelas seguintes propriedades: pH, potencial redox, textura, composição mineral (conteúdo e tipos de argilas e de óxidos de Fe, Al e Mn), capacidade de troca de cátions, quantidade e tipo de componentes orgânicos no solo e na solução, presença de outros metais pesados, temperatura do solo, conteúdo de água e outros fatores que afetam a atividade microbiana (Adriano, 1986). No solo, a adsorção é o principal processo para o entendimento da disponibilidade do cobre, pois indica a solubilidade, a mobilidade e a disponibilidade para os organismos.
A matéria orgânica possui grande superfície específica, carga líquida negativa dependente do pH do meio e capacidade de formar quelatos orgânicos (Sposito, 1989). Os principais responsáveis pela ligação do cobre com a matéria orgânica são os ácidos húmicos e fúlvicos, formando complexos estáveis. Em solos do Rio Grande do Sul cultivados há mais de 15 anos com videira tratada com fungicida cúprico, verificou-se que mais de 70% do cobre estava associado a matéria orgânica (Nachtigall et al., 2007).
Principais áreas contaminadas com cobre no Rio Grande do Sul
No estado do Rio Grande do Sul, a contaminação com elevadas concentrações de Cu ocorrem na serra do nordeste, nas áreas de vitivinicultura, e na serra do sudeste, nas áreas de mineração de cobre. A videira é uma cultura que apresenta grande incidência de doenças. Entre as mais importantes está o míldio, ou mofo, causado pelo fungo Plasmopara viticola. Existem vários produtos recomendados para a prevenção e eliminação do míldio. Todavia, os produtores utilizam ainda em grande escala a calda bordalesa [CuSO4 + Ca(OH)2] - mistura de sulfato de Cu e cal, diluídos em água, como fungicida preventivo da doença (Murayama, 1980).
Embora seja um fungicida de uso relativamente antigo, a calda bordalesa é considerada um dos produtos mais eficientes no combate de algumas doenças de plantas, principalmente das frutíferas. Assim, a utilização continuada da calda nas áreas de vitivinicultura para o controle de doenças fúngicas promove o acúmulo de Cu nos solos. O teor de Cu nos solos pode atingir níveis muito elevados, o que prejudica o desenvolvimento e a produção das plantas de cobertura. Conforme Kabata-Pendias e Pendias (2001), o teor de cobre superior a 100 mg kg-1 no solo é considerado excessivo e pode ocasionar fitotoxidez. Plantas de aveia cultivadas com adição de doses crescentes de Cu apresentaram grande redução do crescimento e desenvolvimento na dose de 100 mg de cobre kg-1 de solo (Santos et al., 2004). Nos solos da região existem levantamentos que relatam teores acima de 1200 mg de cobre total kg-1 de solo (Matsuoka, 2006).
As áreas de rejeito de mineração de cobre do Estado do Rio Grande do Sul estão localizadas na Microbacia do Arroio São João, no município de Caçapava do Sul. Durante o processo de exploração do minério de cobre, boa parte dos efluentes e rejeitos foram lançados diretamente neste arroio (Laybauer, 1998), tornando desta forma, um ambiente contaminado e potencialmente tóxico aos seres vivos. Além disso, a atividade de mineração de cobre aumenta os teores naturais de Cu, Fe, Al e Zn, assim como os valores de pH, condutividade elétrica e sólidos em suspensão na água. O impacto desta atividade é evidenciado tanto pelo acréscimo significativo das concentrações médias, quanto por altos valores de dispersão na região sob influência da mineração, o que é característico da influência antrópica (Laybauer, 1998), produzindo também, grandes quantidades de rejeito de mineração com alto potencial de contaminação ao ambiente.
O cobre em organismos e mecanismos de resistência
A grande maioria dos microrganismos necessita do cobre em pequenas quantidades, mas podem ser afetadas pela superexposição a este metal. Para resolver este problema, os organismos desenvolveram mecanismos de resistência para sobreviver em ambientes, tanto limitantes em cobre, como em concentrações tóxicas às células. A homeostase das células procarióticas é conferida por quatro genes arranjados no operon cop. Este operon possui um sistema de regulação gênica que é expresso em função da quantidade de cobre na célula. O gene copA capta o cobre quando limitante e transporta para o citoplasma, ao passo que o copB remove o cobre de dentro das células quando há concentrações tóxicas. O gen copY é o gen repressor, e copZ ativador, e regulam a concentração de cobre na célula (Solioz e Stoyanov, 2003). O mecanismo de proteção das células ao cobre é feito pelo gene copY que reprime as ATPases copA e copB, diminuindo o transporte deste elemento para o citoplasma, evitando a morte celular pela exposição a concentrações tóxicas de cobre (Figura 1). O cobre só pode ser transportado pelas ATPases quando está na forma reduzida Cu(I), e deste modo, as células necessitam de enzimas como a cobre redutase para reduzir o Cu(II), disponibilizando o cobre para o transporte intracelular (Solioz e Stoyanov, 2003). A enzima cobre redutase é codificada pelo gene ndh em Escherichia coli, e foi demonstrado que a redução do cobre pode ocorrer em dois sítios. No sítio I, o cobre é reduzido entre NADH e quinona, e no sítio II, entre quinonas e citocromo bo e bd no ciclo do cobre (Rodríguez-Montelongo et al., 2006). A enzima redutase de cobre pode estar associada a mecanismos do transporte de cobre, provavelmente quando o microrganismo cresceu em concentrações elevadas do metal. A homeostase do cobre celular pode ser controlada pela atividade das metalotioneínas e chaperonas, que retém o íon cobre não livre no citosol (Arredondo e Núñez, 2005).
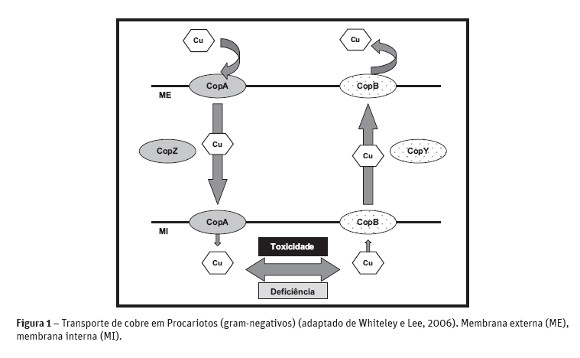
Bactérias podem desenvolver diferentes mecanismos de resistência ao cobre, tanto no cromossomo como no plasmídeo contendo genes de resistência a concentrações tóxicas de cobre. Estes mecanismos também incluem a redução do transporte do cobre, complexação pelos componentes celulares e acúmulo de concentrações de cobre internamente na célula. Alguns destes plasmídeos já foram identificados como o plasmídeo R124 de E. coli que codifica a repressão da síntese da proteína OmpF e o plasmídeo Rts1 que reduz a acumulação do cobre.
A resistência encontrada no plasmídeo pVT1, isolado de Mycobacterium scrofulaceum precipita sulfato de cobre e o no plasmídeo pPT23 encontrado no isolado de Pseudomonas syringae forma quelatos de proteínas com cobre, entre outros (Cervantes e Gutierrez-Corona, 1994). Similar às bactérias, os fungos podem desenvolver vários mecanismos de resistência ao cobre, como engrossamento da parede celular, a redução de citosina e quitina e o aumento da proporção de metalotionéinas.
Altas concentrações de íons de cobre no ambiente exercem uma pressão de seleção promovendo a sobrevivência de microrganismos que tenham determinantes genéticos para a resistência ao metal. Como exemplos, a bactéria Desulfovibrio spp. complexa o cobre pela produção de sulfato, reduzindo o potencial tóxico do cobre para a bactéria, ao passo que a Klebsiella pneumoniae tem uma adaptação transitória fisiológica, a Escherichia coli tem um aumento de proteínas na membrana, provavelmente envolvendo o transporte do cobre, as cianobactérias formam complexos de cobre com metalotianeínas e o Vibrio algynolyticus forma complexos do cobre com proteínas excretadas (Cervantes e Gutierrez-Corona, 1994). De modo geral, o potencial de uso dos mecanismos de resistência ao cobre conferido pelos microrganismos é muito grande e podem ser utilizados nas estratégias para a remoção do cobre de ambientes contaminados.
Em relação às plantas, o cobre é um elemento essencial para o crescimento, participando da síntese de proteínas, do metabolismo de carboidratos e da fixação simbiótica de N2 (Marschner, 1995). O cobre é absorvido pelas plantas como íon ou como quelato e geralmente é pouco móvel na planta. A concentração nas plantas não é tão expressiva e varia entre 2 à 20 mg kg-1 na matéria seca; embora, concentrações mais elevadas podem ser tóxicas para algumas plantas como citros e leguminosas (Kabata-Pendias e Pendias, 2001).
Eucariotos como fungos, algas e plantas são mais sensíveis à toxidez de cobre, comparadas às bactérias que além da homeostase, apresentam outro mecanismo de resistência que é a expressão de uma família de proteínas queladoras de metais chamadas de metalotioneínas (Camargo et al., 2007). Estas proteínas são sintetizadas especificamente para ligar-se a metais e são induzidas pela presença dos mesmos (Mejare e Bülow, 2001). Entre essas moléculas, a produção de metalotioneínas ou de fitoquelatinas constitui o principal mecanismo de resistência a metais em eucariotos.
Metalotioneínas são pequenos peptídeos (6 - 7 kDa), ricos em cisteína, encontradas em animais, plantas, microrganismos eucariotos e alguns procariotos. A biossíntese de metalotioneínas é regulada em nível de transcrição e é induzida por vários fatores, como hormônios, agentes citogênicos e metais, incluindo o cádmio, zinco, mercúrio, cobre, ouro, prata, cobalto, níquel e bismuto. As metalotioneínas são divididas em três diferentes classes de acordo com o conteúdo de cisteína e da estrutura peptídica (Hamer, 1986). As metalotioneínas produzidas por mamíferos compreendem a classe I e são compostas de cerca de 61 aminoácidos, sendo 35 % de cisteínas, com dois domínios distintos, que podem coordenar sete metais divalentes e 12 monovalentes. As metalotioneínas produzidas por leveduras, cianobactérias e algumas plantas pertencem à classe II e são também de baixo peso molecular e ricas em cisteína, que, diferentemente daquelas da classe I, apresentam distribuição diferenciada das cisteínas na estrutura protéica. Os membros da terceira classe de metalotioneínas são responsáveis pela formação de complexos metálicos com metais pesados em plantas e, usualmente, chamadas de fitoquelatinas (Zenck, 1996). A biossíntese das fitoquelatinas é induzida por vários metais como o cádmio, mercúrio, prata, cobre, níquel, ouro, chumbo e zinco, sendo o cádmio o maior indutor.
Uso de microrganismos e plantas para a remediação de cobre
A biorremediação é uma disciplina que combina processos biotecnológicos com a engenharia ambiental, que visa solucionar ou atenuar os problemas causados pela contaminação ambiental. É definida como a aplicação de processos biológicos à conversão de contaminantes ambientais em substâncias inertes. Geralmente, a remediação de ambientes contaminados por meio de métodos químicos e físicos é de custo elevado e de pouca eficiência e geralmente geram produtos secundários que necessitam de tratamento adicional. O uso de organismos (microrganismos ou plantas) ou de seus processos para atenuar ou remover um contaminante ambiental é uma alternativa de baixo custo, eficiente e ecologicamente aceitável. Para a adoção da biorremediação como prática, devem ser obedecidos alguns critérios como: a) o contaminante deve estar biodisponível; b) o solo deve apresentar condições satisfatórias para manter o crescimento de microrganismos, plantas e atividade de enzimas; c) o custo da biorremediação deve ser menor do que as demais tecnologias para remover o contaminante. A biorremediação de metais é mais complexa que a de compostos orgânicos, uma vez que metais não se degradam quimicamente e/ou biologicamente. Todavia, a biorremediação de áreas contaminadas com cobre pode ser possível em função das estratégias a serem adotadas (Camargo et al., 2007).
Inicialmente se faz necessário a seleção de organismos tolerantes ao cobre e a identificação de mecanismos de resistência. Isso é possível de ser obtido em áreas contaminadas que podem ter pré-selecionado organismos resistentes em função da exclusão exercida pela presença de cobre em concentrações tóxicas (Atlas e Bartha, 1997). As estratégias para a remoção de metais podem envolver a biossorção (uso de biomassa viva ou morta, livre ou imobilizada, onde os organismos podem estar absorvendo ou adsorvendo o metal), precipitação (em presença de sulfetos solúveis), complexação (na parede ou em materiais extracelulares) e enzimas (redução ou oxidação do metal para formas menos tóxicas ou atóxicas), entre outras (Camargo et al., 2007).
Em relação ao cobre, existe uma série de resultados que indicam o potencial do uso de microrganismos para a remoção/imobilização deste metal pelos microrganismos. Esta remoção pode ser realizada por diferentes microrganismos como Pseudomonas, Bacillus, Staphylococcus, Cândida, Saccharomyces, Kluyveromyces, Schizosaccharomyces entre outros (Quadro 1). Os microrganismos podem ser resistentes até 6000 mg kg-1 de cobre, como descrito por Umrania (2006), que absorveram 97,5% do cobre nesta concentração e foi verificado que o mecanismo de resistência estava relacionado à adsorção e compartimentalização do cobre dentro da célula.
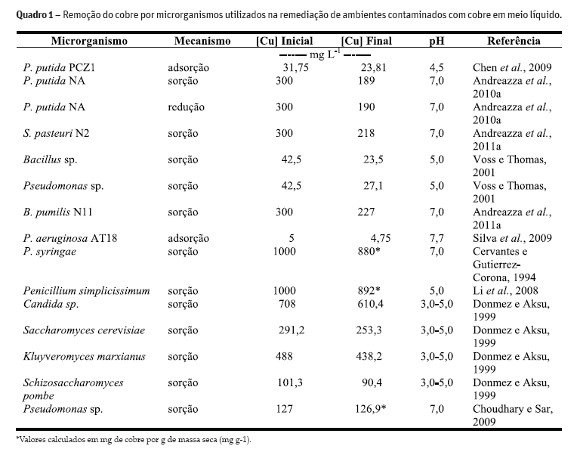
Alguns organismos podem ser grandes acumuladores de cobre dentro da célula, como no caso da Pseudomonas syringae van Hall. que pode acumular cerca de 120 mg de cobre (12%) por grama de massa seca celular (Cervantes e Gutierrez-Corona,1994), podendo ser uma alternativa de remoção do cobre do ambiente. Quando estudado a sorção de cobre por bactérias da rizosfera de trigo, foram isoladas as bactérias Bacillus sp. e Pseudomonas sp. foi demonstrado que o Bacillus adsorveu mais Cu(II) e Mn(II) do que a Pseudomonas em todas as concentrações estudadas desse metal e o maior tempo de exposição aos metais implicou em maior sorção de cobre pelos isolados (Voss e Thomas, 2001). Essa grande gama de microrganismos e condições para remoção do cobre, como pH, temperatura e concentração de cobre, torna eficiente a utilização de organismos resistentes para a biorremediação de ambientes contaminados com cobre (Andreazza et al., 2010a).
Outra condição que favorece esta sorção do cobre é a redução por microrganismos, onde esta transformação do cobre divalente (Cu(II)) para o cobre monovalente (Cu(I)) facilita a entrada do cobre nas células, e também pode melhorar a mobilidade do cobre no ambiente, consequentemente, aumentando a capacidade de remoção do cobre pelos microrganismos (Andreazza et al., 2011c).
Como na biorremediação de áreas contaminadas são utilizados organismos vivos, as condições ambientais são essenciais para o crescimento destes organismos. Entre as condições ambientais que influenciam a redução microbiológica do cobre, destacam-se o pH, a temperatura, a concentração do metal pesado e a quantidade de inóculo resistente (Shakoori et al., 2000; Camargo et al., 2007; Andreazza et al., 2010a), o solo, a água de irrigação, a quantidade de matéria orgânica e os óxidos mangânicos (Cifuentes et al., 1996). Além disso, as enzimas também são sensíveis às condições ambientais, como os microrganismos.
A fitorremediação é um processo de biorremediação que utiliza plantas para remover metais pesados do ambiente pela absorção, acumulação ou transformação do metal em sua biomassa vegetal, sendo uma ferramenta que pode ser usada para a remediação de áreas contaminadas com metais pesados (Quadro 2). Algumas espécies vegetais podem ter maior ou menor tolerância aos metais pesados existentes no solo (Mccutcheon e Schnoor, 2003), sendo necessária a seleção de espécies vegetais para avaliar o maior potencial para absorver estes metais do solo. Com base nisto, Coates (2005) avaliou o potencial de 16 espécies arbóreas para a fitorremediação de metais pesados da água escoada de antigas minas de cobre no Peru. Observou que somente três delas foram eficientes para o crescimento e produção de massa vegetal irrigado com o líquido remanescente da mina. A espécie Tamarix aphylla (L.) H.Karst. foi a que obteve melhores resultados de crescimento e produção de massa entre todas as espécies estudadas.
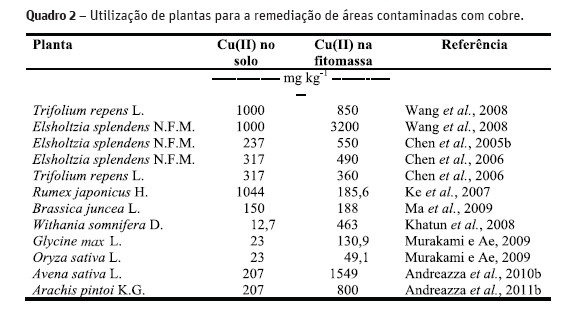
Algumas espécies vegetais são mais resistentes e podem ter uma maior capacidade de extração de metais pesados como o cobre, quando em comparação a outras espécies. Uma planta com alta capacidade de extração de cobre é a Elsholtzia splendens Nakai ex F.Maek., pois reduziu em 30% a quantidade de cobre na rizosfera em comparação aos teores iniciais do solo contaminado, associado a uma grande produção de fitomassa neste ambiente (Jiang et al., 2004). A aveia preta é uma planta de alta produção de massa e de grãos (Santos et al., 2004) e deste modo, pode ser uma alternativa para a fitorremediação.
A fitorremediação pode apresentar baixa eficiência na remoção dos metais pesados do solo. Esta limitação pode ser diminuída quando é utilizada juntamente com alternativas que envolvam o estímulo da microbiota rizosférica da planta, podendo ser uma estratégia mais eficaz a médio e longo prazo para a biorremediação in situ de locais contaminados com metais pesados (Khan e Saillion, 2000). A rizosfera é um ambiente diferenciado no solo, pois as plantas modificam o ambiente em vários aspectos de concentrações de nutrientes, pH, temperatura e exsudatos radiculares como ácidos orgânicos de baixo peso molecular (Mccutcheon e Schnoor, 2003). A rizosfera também é o local onde há maior contato entre planta e solo, agindo diretamente na absorção de nutrientes e metais pesados pela planta. Os organismos que estão localizados na região da rizosfera podem melhorar ou aumentar a absorção e a biodisponibilidade de metais pesados, como o Cu e Zn que estão contaminando o solo, retirando estes metais pela solução do solo (Chen et al., 2005a). Alguns destes organismos podem ser os fungos micorrízicos arbusculares e algumas bactérias promotoras de crescimento, favorecendo o crescimento de plantas hiperacumuladoras como a Elsholtzia splendens (Khan, 2005). Recentemente, Andreazza et al. (2010a) verificou que a fitoaumentação da rizosfera de aveia com Stenotrophomonas maltophilia A2 melhorou o crescimento e aumentou a capacidade desta planta em acumular até 1549,91 mg of Cu kg-1 do solo.
Considerações finais
O cobre é um metal pesado tóxico a todos os seres vivos quando encontrado em altas concentrações no ambiente. Além disso, os ambientes contaminados modificam a população normal de organismos e selecionam organismos resistentes como plantas e microrganismos. É necessário a remediação destes locais contaminados com a utilização de técnicas eficientes e com um menor grau de impacto negativo ao ambiente. A biorremediação é uma alternativa que pode ser utilizada devido ao baixo custo, eficiência, e alta aceitação. O entendimento dos mecanismos para a remoção de cobre pelos microrganismos e plantas é importante para estabelecer as melhores condições para a biorremediação de áreas contaminadas. Deste modo, o isolamento de organismos resistentes que mantenham o seu desenvolvimento nestas áreas impactadas torna-se uma alternativa eficaz para a biorremediação destes ambientes.
Áreas de rejeito de mineração são diferentes de áreas de vitivinicultura, tanto fisicamente quanto quimicamente, o que deve ser considerado quando forem estabelecidas estratégias para a remoção de cobre destes locais. Áreas de rejeito são áreas com substrato, totalmente desestruturada e imprópria para o desenvolvimento de organismos, pois apresentam baixas concentrações de nutrientes e altas concentrações de cobre. Os solos das áreas vitivinícolas contaminados com cobre são localizados em regiões e com uma cultura permanente (videiras) de alto valor comercial, que deve ser considerada no estabelecimento da estratégia de remediação. As características e peculiaridades de áreas contaminadas com cobre como: concentração de cobre, declividade, características físicas e químicas, umidade, temperatura, entre outras, é fundamental para o planejamento da descontaminação destas áreas. Os microrganismos isolados destes locais devem ser selecionados e estudados quanto às condições ambientais ótimas de crescimento e remoção do cobre, visando aumentar a eficiência e o sucesso da biorremediação.
Agradecimentos
À CAPES e ao CNPq pela concessão das bolsas de estudo e auxílio financeiro.
Referências Bibliográficas
Adriano, D.C. (1986) - Trace elements in the terrestrial environment. New York, Springer-Verlag, 533p. [ Links ]
Andreazza, R.; Pieniz, S.; Wolf, L.; Lee, MK.; Camargo, F.A.O. e Okeke, B.C. (2010a) - Characterization of copper biosorption and bioreduction by a highly copper resistant bacterium isolated from copper-contaminated vineyard soil. Science of the Total Environment, 408, 7: 1501-1507. [ Links ]
Andreazza, R.; Okeke, B.C.; Lambais, M.R.; Bortolon, L.; Melo, G.W.B. e Camargo, F.A.O. (2010b) - Bacterial stimulation of copper phytoaccumulation by bioaugmentation with rhizosphere bacteria. Chemosphere, 81, 9: 1149-1154. [ Links ]
Andreazza, R.; Pieniz, S.; Okeke, B.C. e Camargo, F.A.O. (2011a) - Evaluation of copper resistant bacteria from vineyard soils and mining waste for copper biosorption. Brazilian Journal of Microbiology, 42, 1: 66-74. [ Links ]
Andreazza, R.; Bortolon, L.; Pieniz, S.; Giacometti, M.; Roehrs, D.D.; Lambais, M.R. e Camargo, F.A.O. (2011b) - Potential phytoextraction and phytostabilization of perennial peanut on copper contaminated vineyard soils and copper mining waste. Biological Trace Element Research, 143, 3: 1729-1739. [ Links ]
Andreazza, R.; Okeke, B.C.; Pieniz, S.; Brandelli, A.; Lambais, M.R. e Camargo, F.A.O. (2011c) - Bioreduction of Cu(II) by cell-free copper reductase from a copper resistant Pseudomonas sp. NA. Biological Trace Element Research, 143, 2: 1182-1192. [ Links ]
Arredondo, M. e Núñez, M.T. (2005) - Iron and copper metabolism. Molecular Aspects of Medicine, 26: 313-327. [ Links ]
Atlas, R.M. e Bartha, R. (1998) - Microbial Ecology: Fundamentals and Applications. 4ª ed. Menlo Park, Benjamin/Cummings Science Publishing, 694p. [ Links ]
ATSDR (2004) - Toxicological profile for copper. New York, Agency for Toxic Substances and Disease Registry, 314 p. [ Links ]
BRASIL, Ministério da Agricultura (1974) - Portaria nº. 371, 1974. Diário Oficial da República Federativa do Brasil, Brasília, 17 julho, 1974. [ Links ]
Camargo, F.A.O.; Bento, F.M.; Jaccques, R.J.S.; Roesch, L.F.W. e Frankenberger, W.T. (2007) - Uso de microrganismos para a remediação de metais. Tópicos Especias em Ciência do Solo, 5: 467-496. [ Links ]
Cervantes, C. e Gutierrez-Corona, F. (1994) - Copper resistance mechanisms in bacteria and fungi. FEMS Microbiology Reviews, 14, 2: 121-137. [ Links ]
CETESB [Centro Tecnológico de Saneamento Ambiental] (2007) - Variáveis de qualidade das águas (em linha). São Paulo, Secretaria Estadual do Meio Ambiente. (Acesso em 2007.06.09). Disponível em http://www.cetesb.sp.gov.br/agua/rios/variaveis.asp. [ Links ]
Chen, X.C.; Wang, Y.P.; Lin, Q.; Shi, J.Y.; Wu, W.X. e Chen, Y.X. (2005a) - Biosorption of copper (II) and zinc (II) from aqueous solution by Pseudomonas putida CZ1. Colloids and Surfaces B: Biointerfaces, 46, 2: 101-107. [ Links ]
Chen, Y.X.; Wang, Y.P.; Lin, Q. e Luo, Y.M. (2005b) - Effect of cooper-tolerant rhizosfere bacteria on mobility of copper in soil and copper accumulation by Elsholtzia splendens. Environment International, 31, 6: 861-866. [ Links ]
Chen, Y.X.; Wang, Y.P.; Wu, W.X.; Lin, Q. e Xue, S.G. (2006) - Impacts of chelate-assisted phytoremediation on microbial community composition in the rhizosphere of a copper accumulator and non-accumulator. Science of the Total Environment, 356, 1-3: 247- 255. [ Links ]
Chen, X.C.; Hu, S.P.; Shen, C.F.; Dou, C.M.; Shi, J.Y. e Chen, Y.X. (2009) - Interaction of Pseudomonas putida CZ1 with clays and ability of the composite to immobilize copper and zinc from solution. Bioresource Technolology, 100, 1: 330-337. [ Links ]
Choudhary, S. e Sar, P. (2009) - Characterization of a metal resistant Pseudomonas sp. isolated from uranium mine for its potential in heavy metal (Ni2+, Co2+, Cu2+, and Cd2+) sequestration. Bioresource Technology, 100, 9: 2482-2492. [ Links ]
Cifuentes, F.R.; Lindermann, W.C. e Barton, L.L. (1996) - Chromium sorption and reduction in soil with implications to bioremediation. Soil Science, 161, 4: 233-241. [ Links ]
Coates, W. (2005) - Tree species selection for a mine tailings bioremediation project in Peru. Biomass and Bioenergy, 28, 4: 418-423. [ Links ]
Donmez, G. e Aksu, Z. (1999) - The effect of copper (II) ions on the growth and bioaccumulation properties of some yeasts. Process Biochemistry, 35, 1-2: 135-142. [ Links ]
Hamer, D.H. (1986) - Metallothionein. Annual Review of Biochemistry, 55: 913-951. [ Links ]
Jiang, L.Y.; Yang, X.E. e He, Z.L. (2004) - Growth response and phytoextraction of cooper at different levels in soils by Elsholtzia splendens. Chemosphere, 55, 9: 1179-1187. [ Links ]
Kabata-Pendias, A. (2001) - Trace elements in soils and plants. 3.ª ed. Boca Raton, Florida, USA, CRC Press, 413p. [ Links ]
Ke, W..; Xion, Z-T.; Chen, S.; Chen, J. (2007) - Effects of copper and mineral nutrition on growth, copper accumulation and mineral element uptake in two Rumex japonicus populations from a copper mine and an uncontaminated field sites. Environmental and Experimental Botany, 59, 1: 59-67. [ Links ]
Khan, M. e Scullion, J. (2000) - Effect of soil on microbial responses to metal contamination. Environmental Pollution, 110, 1: 115-125. [ Links ]
Khan, A.G. (2005) - Role of soil microbes in the rhizospheres of plants growing on trace metal contaminated soils in phytoremediation. Journal of Trace Elements in Medicine and Biology, 18, 4: 355-364. [ Links ]
Khatun, S.; Ali, M.B.; Hahn, E.J. e Paek, K.Y. (2008) - Copper toxicity in Withania somnifera: Growth and antioxidant enzymes responses of in vitro grown plants. Environmental and Experimental Botany, 64, 3: 279-285. [ Links ]
King, L.D. (1996) - Soil heavy metals. In: Alvarez, V.H.; Fontes, L.E.T. e Fontes, M.P.F. (Eds.) - O solo nos grandes domínios morfoclimáticos do Brasil e o desenvolvimento sustentado. Viçosa, SBCS, p.823-836. [ Links ]
Laybauer, L. (1998) - Incremento de metais pesados na drenagem receptora de efluentes de mineração – Minas do Camaquã, Sul do Brasil. Revista Brasileira de Recursos Hídricos, 3, 3: 29-36. [ Links ]
Li, X.M; Liao, D.X; Xu, X.Q; Yang, Q; Zeng, G.M; Zheng, W. e Guo, L. (2008) - Kinetic studies for the biosorption of lead and copper ions by Penicillium simplicissimum immobilized within loofa sponge. Journal of Hazardous Materials, 159, 2-3: 610-615. [ Links ]
Ma, Y; Rajkumar, M. e Freitas, H. (2009) - Inoculation of plant growth promoting bacterium Achromobacter xylosoxidans strain Ax10 for the improvement of copper phytoextraction by Brassica juncea. Journal of Environmental Management, 90, 2: 831-837. [ Links ]
Marschner, H. (1995) - Mineral nutrition of higher plants. 2nd ed. London, Academic Press, 889 p. [ Links ]
Matsuoka, M. (2006) - Atributos biológicos de solos cultivados com videira na região da serra gaúcha. Dissertação de doutoramento. Porto Alegre, Universidade Federal do Rio Grande do Sul, 173 p. [ Links ]
McCutcheon, S.C. e Schnoor, J.L. (2003) - Phytoremediation: Transformation and control of contaminants. Hoboken, New Jersey, Wiley-Interscience, 987 p. [ Links ]
Mejare, M. e Bulow, L. (2001) - Metal-binding proteins and peptides in bioremediation and phytoremediation of heavy metals. Trends in Biotechnology, 19, 2: 67-73. [ Links ]
Rodríguez-Montelongo, L., Volentini, S.I; Farías, R.N.; Massa, E.M. e Rapisarda, V.A. (2006) - The Cu(II)-reductase NADH dehydrogenase-2 of Escherichia coli improves the bacterial growth in extreme copper concentrations and increases the resistance to the damage caused by copper and hydroperoxide. Archives of Biochemistry and Biophysics, 451, 1: 1-7. [ Links ]
Murakami, M. e Ae, N. (2009) - Potential for phytoextraction of copper, lead, and zinc by rice (Oryza sativa L.), soybean (Glycine max [L.] Merr.), and maize (Zea mays L.). Journal of Hazardous Materials, 162, 2-3: 1185-1192. [ Links ]
Murayama, S. (1980) - Fruticultura. 2.ª ed. Campinas, Instituto Campineiro de Ensino Agrícola, 385 p. [ Links ]
Nachtigall, G.R; Nogueirol, R.C. e Alleoni, L.R.F. (2007) - Formas de cobre em solos de vinhedos em função do pH e da adição de cama-defrango. Pesquisa Agropecuária Brasileira, 42, 3: 427-434. [ Links ]
Santos, H.P; Melo, G.W.B; Luz, N.B. e Tomasi, R.J. (2004) - Comportamento fisiológico de plantas de aveia (Avena strigosa) em solos com excesso de cobre. Bento Gonçalves, Embrapa. 10p. (Comunicado técnico 49). [ Links ]
Shakoori, A.R; Makhdoom, M. e Haq, R.U. (2000) - Hexavalent chromium reduction by a dichromate-resistant gram-positive bacterium isolated from effluents of tanneries. Applied Microbiology and Biotechnology, 53, 3: 348-351. [ Links ]
Silva, R.M.P; Rodríguez, A.A; Oca, J.M.G.M. e Moreno, D.C. (2009) - Biosorption of chromium, copper, manganese and zinc by Pseudomonas aeruginosa AT18 isolated from a site contaminated with petroleum. Bioresource Technology, 100, 4: 1533-1538. [ Links ]
Solioz, M. e Stoyanov, J.V. (2003) - Copper homeostasis in Enterococcus hirae. FEMS Microbiology Reviews, 27, 2-3: 183-195. [ Links ]
Sposito, G. (1989) - The chemistry of soils. New York, Oxford University Press, 277 p. [ Links ]
Umrania, V.V. (2006) - Bioremediation of toxic heavy metals using acidothermophilic autotrophes. Bioresource Technology, 97, 10: 1237-1242. [ Links ]
Voss, M. e Thomas, R.W.S.P. (2001) - Sorção de cobre e manganês por bactérias rizosféricas do trigo. Ciência Rural, 31, 6: 947-951. [ Links ]
Zenk, M.H. (1996) - Heavy metal detoxification in higher plants – A review. Gene, 179, 1: 21-30. [ Links ]
Wang, Y.P; Li, Q.B.; Shi, J.Y.; Lin, Q., Chen, X.C; Wu, W.X. e Chen, Y. (2008) - Assessment of microbial activity and bacterial community composition in the rhizosphere of a copper accumulator and a non-accumulator. Soil Biology and Biochemistry, 40, 5: 1167-1177. [ Links ]
Whiteley, C.G. e Lee, D.J. (2006) - Enzyme technology and biological remediation. Enzyme and Microbial Technology, 38, 3-4: 291-316. [ Links ]
Recebido/Received: 2012.07.02
Aceitação/Accepted: 2013.01.23














