Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Acessos
Acessos
Links relacionados
-
 Similares em
SciELO
Similares em
SciELO
Compartilhar
Revista de Ciências Agrárias
versão impressa ISSN 0871-018X
Rev. de Ciências Agrárias vol.36 no.3 Lisboa jul. 2013
Biocontrole de Fusarium spp. com Trichoderma spp. e promoção de crescimento em plântulas de soja
Biocontrol of Fusarium spp. with Trichoderma spp. and growth promotion in soybean seedlings
Paola M. Milanesi1, Elena Blume1, Zaida Inês Antonioli2, Marlove Fátima B. Muniz1, Ricardo Feliciano dos Santos1, Geísa Finger1 e Miria Rosa Durigon1
1 Laboratório de Fitopatologia, Universidade Federal de Santa Maria (UFSM), Centro de Ciências Rurais (CCR), Departamento de Defesa Fitossanitária, 97105-900, Camobi, Santa Maria, RS, Brasil. E-mails: paola.milanesi@gmail.com, author for correspondence; elenablu@gmail.com; marlovemuniz@yahoo.com.br; ricardoijui@hotmail.com; ge_finger@yahoo.com.br; midurigon@yahoo.com.br
2 Laboratório de Biologia do Solo e do Ambiente, UFSM, CCR, Departamento de Solos, 97105-900, Camobi, Santa Maria, RS, Brasil. E-mail: zantoniolli@gmail.com.
RESUMO
A patogenicidade e o biocontrole de Fusarium oxysporum (F1s, F3s e F4s) e F. proliferatum (F2s) por Trichoderma koningiopsis (T1s e T3s), T. tomentosum (T2s e T4s) e T. asperellum (T5s) foi avaliada. Testes in vitro, confrontação direta, e in vivo, por inoculação de substrato com Fusarium spp. e Trichoderma spp., isolados e combinados, foram conduzidos em condições controladas. A habilidade de Fusarium spp. causarem damping off em plântulas de soja, cv. FT-Estrela, foi avaliada in vivo em tratamentos que receberam apenas inóculo de Fusarium spp. isolados de Trichoderma spp. promoveram o crescimento de raiz e incrementaram o peso fresco e seco de plântulas de soja. Os isolados de Fusarium spp. F1s e F4s foram os mais agressivos, com 100 e 75% de damping off, respectivamente. Algumas combinações com Trichoderma spp. potencializaram a patogenicidade de F1s e F3s, com 100 e 75% de damping off, respectivamente. Os isolados de Trichoderma spp. podem controlar Fusarium spp. avaliados neste estudo.
Palavras-chave: Glycine max L. [Merril], micoparasitismo, antibiose, damping off
ABSTRACT
Pathogenicity and biocontrol of Fusarium oxysporum (F1s, F3s and F4s) and F. proliferatum (F2s) by Trichoderma koningiopsis (T1s and T3s), T. tomentosum (T2s and T4s) and T. asperellum (T5s) was evaluated. In vitro tests, direct confrontation, and in vivo, substrate inoculation with Fusarium spp. and Trichoderma spp., isolated or combined, were conducted under controlled conditions. The ability of Fusarium spp. cause damping off in seedlings of soybean cv. FT-Estrela, was evaluated in vivo in treatments that received only inoculum of Fusarium spp. Trichoderma spp. isolates promoted root growth and increased the fresh and dry weight of soybean seedlings. Fusarium spp. isolates F1s and F4s were the most aggressive, with 100 and 75% of damping off, respectively. Some combinations with Trichoderma spp. potentiated the pathogenicity of F1s and F3s, with 100 and 75% of damping off, respectively. The Trichoderma spp. can control Fusarium spp. evaluated in this study.
Keywords: Glycine max L. [Merril], mycoparasitism, antibiosis, damping off
Introdução
Fusarium é um dos mais abundantes gêneros de fungos de solo, englobando espécies de importância ambiental, agrícola e, até mesmo, relacionadas a doenças em humanos e animais (Wakelin et al., 2008). Podem ser patogênicos a uma grande variedade de plantas, muitas delas de interesse econômico, provocando doenças como murcha vascular, damping off e podridões de raiz e colo (Agrios, 2005; Wakelin et al., 2008). Esses fatores combinados com a densidade populacional podem estar relacionados ao clima, ao tipo de vegetação, à microbiota, aos nutrientes e ao tipo de solo (Saremi et al., 1999). Algumas interações entre patógenos e raízes de plantas ocorrem conforme a resposta dos micro-organismos a condições de aeração e penetração, além de estresse causado pela umidade do solo. Esses fatores podem proporcionar maior severidade da doença, tais como observado na podridão de raízes do feijoeiro, causada por Fusarium solani f. sp. phaseoli (Burkh.) W.C. Snyder & H.N. Hansen 1941, em condições de atmosfera com deficiência de O2 e com abundância de N2 (Allmaras et al., 1988). Adicionalmente, sintomas típicos de Podridão Vermelha da Raiz (PVR) em soja, provocada por Fusarium solani Species Complex (Aoki et al., 2003; Aoki et al., 2005; Scandiani et al., 2010), foram mais evidentes em parcelas conduzidas sob irrigação e com compactação do solo (Neto et al., 2006).
A complexidade do sistema solo e a variabilidade genética existente no gênero Fusarium, tornam as doenças causadas por esses fungos de difícil controle. Dessa forma, recomenda-se a combinação de várias medidas que, conjuntamente, podem fornecer resultados positivos. Entre essas, pode-se citar o controle biológico, que preconiza o uso de micro-organismos antagonistas capazes de interferir na sobrevivência ou nas atividades determinantes da doença provocadas pelo fitopatógeno (Bettiol e Ghini, 1995). A seleção de um bom agente de controle biológico deve levar em consideração as interações entre o antagonista e o patógeno, além das condições ambientais que podem influenciar essas interações (Palazzini et al., 2007).
O gênero fúngico Trichoderma inclui espécies antagonistas a vários fitopatógenos, sendo que os principais mecanismos empregados por esses fungos são o micoparasitismo e a antibiose (Woo et al., 2005; Hermosa et al., 2012), contudo ainda faltam informações de sua utilização no controle de damping off provocado por Fusarium spp. em plântulas de soja. As espécies de Trichoderma com potencial antagonista também têm sido utilizadas como promotoras de crescimento de plantas e na melhoria da germinação e sanidade de sementes (Ethur et al., 2006). Além disso, esses fungos são capazes de suprimir o desenvolvimento de vários fungos fitopatogênicos e sua atividade como antagonista é influenciada pelo tipo de solo, condições de temperatura e humidade, e, também, pela microflora associada (Howel, 2003). No entanto, sua dinâmica e sobrevivência em solos, cujo sistema de cultivo é o de plantio direto na palha, ainda é pouco estudada, principalmente em lavouras que apresentam zonas compactadas.
A forma de ação de Trichoderma como agente de controle biológico pode estar associada à competição por nutrientes, produção de metabólitos antifúngicos, enzimas hidrolíticas da parede celular, quitinases, proteases e glucanases (Papavizas, 1985; Melo, 1991). Além disso, alguns isolados de Trichoderma spp. produzem, in vitro, enzimas quitinolíticas e glucanases que são capazes de degradar a parede celular de alguns fitopatógenos (Elad et al., 1983). A capacidade antagonística de Trichoderma harzianum Rifai 1969 ITEM 3636 é superior a de T. longibrachiatum Rifai 1969 ITEM 3635 em cultivo de amendoim com histórico de podridão radicular causada por Fusarium solani (Rojo et al., 2007). O controle biológico de damping off de pré-emergência por isolados de T. virens estaria relacionado à sua capacidade de degradar compostos produzidos pela semente e que estimulariam a germinação de propágulos do patógeno (Howell, 2002).
Resultados que contemplem o potencial de controle biológico por isolados de Trichoderma spp. advindos de solo compactado ainda são pouco relatados. Além de contribuir com o conhecimento de quais espécies do antagonista habitam esses locais, poderão informar a eficiência desses indivíduos em testes de laboratório, resultando em uma possível indicação para seu uso in vivo. O objetivo deste trabalho foi avaliar a capacidade antagonista de Trichoderma spp. contra Fusarium spp., obtidos de solo compactado, tanto in vitro como in vivo, sobre plântulas de soja.
Material e Métodos
Solo e isolados de Trichoderma e Fusarium
Amostras de solo foram coletadas em uma área conduzida sob sistema plantio direto na palha localizada no município de Victor Graeff, RS, Brasil. No local, foi realizado previamente um levantamento da condição de compactação do solo, representado por níveis de Resistência a Penetração (Rp, MPa) (Girardelo et al., 2011).
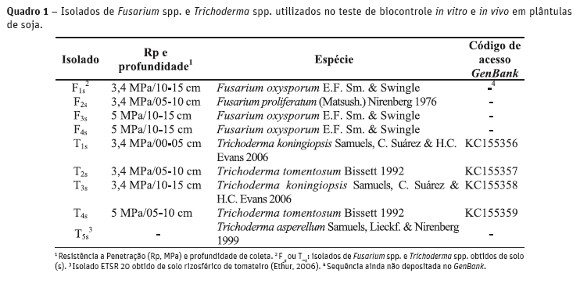
Os isolados de Fusarium spp. e Trichoderma spp. (Quadro 1) foram obtidos a partir de diluições seriais do solo (Carter, 1993), advindo dos pontos de coleta com maiores níveis de Rp. A identificação dos isolados foi realizada, em um estudo anterior (Milanesi, 2012), através de PCR e sequenciamento do gene Fator de Elongação-1a (TEF-1a), para Fusarium spp., e da região ITS 1 e ITS 2 para Trichoderma spp. Estes isolados fazem parte da coleção de fungos do Laboratório de Fitopatologia da Universidade Federal de Santa Maria, RS, Brasil.
Teste de pareamento de culturas
Através do teste de cultura pareada (Dennis e Webster, 1971), avaliou-se a ação antagônica de Trichoderma spp. contra isolados de Fusarium spp. Um disco de meio de cultura batata-dextrose-ágar (BDA), com 12 mm de diâmetro, contendo micélio de Fusarium sp. foi transferido para placas de Petri (9,0 cm de diâmetro), também contendo meio BDA, a 0,5 cm da borda da placa. As placas foram incubadas durante 72 h a 25 °C com fotoperíodo de 12 h. Após esse período, um disco de meio de cultura BDA com 12 mm de diâmetro, contendo micélio de Trichoderma sp., foi transferido para a posição oposta ao disco de micélio de Fusarium sp. nas placas de Petri. As placas foram novamente incubadas a 25 °C com fotoperíodo de 12 h. Sete dias após a repicagem dos isolados de Trichoderma spp., foram realizadas medições do diâmetro das colônias do patógeno, com o auxílio de um paquímetro digital, e agrupamento dos isolados do antagonista em classes, conforme a escala proposta por Bell et al. (1982). A avaliação da classe de antagonismo foi novamente realizada aos 13 dias após a repicagem dos isolados de Trichoderma spp. O ensaio foi realizado no delineamento experimental inteiramente casualizado com cinco repetições por tratamento.
Teste in vivo de isolados de Trichoderma spp. e Fusarium spp. em plântulas de soja
Nesse experimento, foram utilizados cinco isolados de Trichoderma sp., sendo quatro de pontos de coleta com média/alta Rp (3,4 e 5,0 MPa) e diferentes profundidades e o isolado ETSR 20 (de solo rizosférico de tomateiro cultivado em estufa) que pertence à coleção de isolados fúngicos do Laboratório de Fitopatologia da UFSM. Este isolado mostrou-se eficiente no controle de F. solani e F. oxysporum em tomateiro e pepineiro (Ethur, 2006). Foram utilizados quatro isolados de Fusarium sp., a fim de testá-los quanto à capacidade de serem ou não causadores de damping off em plântulas de soja (Quadro 1).
Os isolados de Fusarium spp. foram cultivados em grãos de milho esterilizados (Klingelfuss et al., 2007). Para isso, os grãos foram embebidos em água durante 24 h e, no dia seguinte, o excesso de água foi drenado. Aproximadamente 150 cm3 desses grãos foram colocados, separadamente, em frascos Erlenmeyer, com capacidade para 250 mL, que foram autoclavados por duas vezes, com intervalo de 24 h. Após o resfriamento, foram transferidos para cada frasco, dez discos de meio de cultura, com 12 mm de diâmetro, contendo o micélio do patógeno. Os frascos foram incubados a 25 °C, com fotoperíodo de 12 h, durante 14 dias. Isolados de Trichoderma spp. selecionados para esse estudo foram cultivados em meio de cultura BDA durante 14 dias a 25 °C e fotoperíodo de 12h.
Em câmara climatizada, copos plásticos com capacidade para 200 mL foram preenchidos com substrato (marca Carolina Soil®) esterilizado por duas vezes (120 ºC e 1 atm durante uma hora com intervalo de 24 h). Para a inoculação do substrato, 100 g de grãos de milho colonizados por Fusarium sp. foram colocados em 500 mL de água destilada esterilizada e a mistura foi batida em liquidificador até a formação de uma suspensão homogênea. Antes da adição da suspensão de Fusarium sp., foi medida a quantidade de substrato necessária para cada tratamento sendo o mesmo colocado em bandejas e humedecido com 1 L de água destilada esterilizada e homogeneizado para melhor distribuir a humidade. Em seguida, foi medida a quantidade de suspensão do patógeno, utilizando proveta graduada, suficiente para preencher todos os copos plásticos de cada tratamento, sendo que para cada copo foram colocados 10 mL da suspensão que foi misturada ao substrato. Para determinação da quantidade de inóculo adicionada ao substrato, uma alíquota de cada suspensão foi diluída (Ethur, 2006) e plaqueada em meio de cultura Nash & Snyder, seletivo para Fusarium sp., conforme metodologia de diluições seriais proposta por Carter (1993). Foram contabilizadas 107 UFCs de Fusarium sp.
As unidades experimentais inoculadas com o patógeno, a testemunha absoluta e aquelas preenchidas com substrato para os tratamentos que receberiam somente Trichoderma spp. foram acondicionados em sacos plásticos devidamente fechados. Os mesmos foram levados para a câmara de incubação (25 °C e fotoperíodo de 12 h) durante cinco dias. Nos tratamentos testemunha absoluta e somente Trichoderma spp. foram adicionados apenas 10 mL de água destilada esterilizada. Após esse período de incubação, foram adicionados 10 mL da suspensão de esporos do antagonista, para cada tratamento, e a mesma foi incorporada ao substrato.
A contagem de UFCs de Trichoderma spp. para os isolados utilizados foi feita através de um hemacitômetro. Todas as concentrações foram ajustadas para 108 esporos/mL. Após a adição do antagonista, os copos foram novamente colocados em sacos plásticos em câmara climatizada. Após três dias de incubação (25 °C e fotoperíodo de 12h) foram feitas covas de semeadura com, aproximadamente, 3 cm de profundidade em que foram depositadas duas sementes de soja (cv. FT-Estrela)/tratamento.
No decorrer do experimento, foi contabilizada a presença ou ausência de sintomas de damping off de plântulas/tratamento e, aos 30 dias após a semeadura, foi avaliado o comprimento de raiz (cm) e o peso fresco e seco (g) das plântulas.
Análise estatística
As médias das notas obtidas no teste de confrontação direta e os dados de comprimento de raiz (cm), peso fresco e peso seco (g), foram submetidas à análise da variância e comparação de médias através do teste de Scott-Knott com 5% de significância, com o auxílio do software Sisvar versão 5.3 (Ferreira, 2000). Os dados de ocorrência de damping off foram convertidos para percentagem (%)/tratamento.
Resultados e Discussão
Seleção in vitro de isolados de Trichoderma spp. com antagonismo a Fusarium sp. em soja
A caracterização do potencial antagonista de espécies de Trichoderma é a primeira etapa para avaliação da capacidade de biocontrole desses micro-organismos (Mbarga et al., 2012). Os isolados F1s (F. oxysporum), independentemente do isolado de Trichoderma spp. utilizado, e F2s (F. proliferatum), exceto quando em combinação com o isolado de Trichoderma spp. T1s (T. koningiopsis) foram os que apresentaram os menores valores médios de crescimento micelial aos sete dias de avaliação (Quadro 2). Para F3s (F. oxysporum) não houve redução significativa do crescimento e em F4s (F. oxysporum) pode-se observar uma pequena redução que foi dependente do isolado de Trichoderma spp. com que foi confrontado. Diferenças no grau de micoparasitismo podem estar associadas ao maior ou menor crescimento micelial de Fusarium spp., o que provavelmente é devido às variações na atividade de biocontrole desempenhadas por isolados de Trichoderma spp. (Sivan e Chet, 1989).
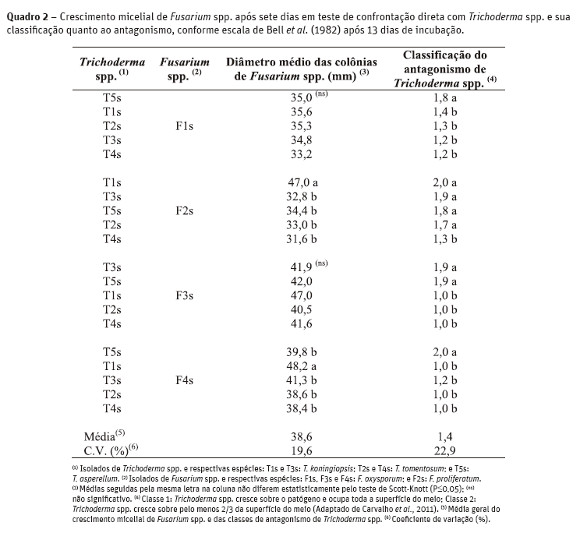
Em relação à classificação do antagonismo de Trichoderma spp., os isolados T2s e T4s, ambos identificados como T. tomentosum, foram agrupados na classe 1,0, sendo capazes de crescer sobre todo o patógeno. Esta classificação aplicou-se aos isolados de Fusarium sp. F3s e F4s, identificados como F. oxysporum. Entretanto, foi observado que o isolado T4s, quando confrontado com F1s (F. oxysporum) e F2s (F. proliferatum) apresentou uma classificação muito próxima a 1,0 (1,2 e 1,3, respectivamente), o que o tornaria eficiente no biocontrole dessas espécies de Fusarium. Esses resultados contrariam os observados por Lopes et al. (2012) em que o isolado de T. tomentosum 29/11, entre outros avaliados em confrontação direta com Sclerotinia sclerotiorum, obteve um score muito baixo entre as classes de antagonismo de Bell et al. (1982).
Em uma análise filogenética baseada na região ITS de 170 espécies de Trichoderma, observou-se que T. tomentosum foi agrupado no clado Harzianum, que inclui T. harzianum (Blaszczyk et al., 2011), espécie comumente relacionada ao biocontrole de uma série de patógenos (Harman, 2000; Inam-Ul-Haq et al., 2009; Bomfim et al., 2010; Steindorff et al., 2012). Essa proximidade genética pode ter contribuído para o bom desempenho de T. tomentosum como agente de controle biológico, conforme os resultados observados neste trabalho. Contudo, ainda são poucos os relatos dessa espécie e sua utilização no biocontrole de doenças.
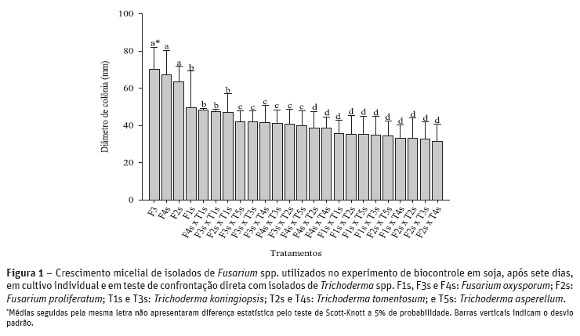
Os demais isolados (T1s, T3s e T5s) apresentaram potencial de antagonismo contra Fusarium spp., sendo agrupados dentro da classe 2,0, embora para F1s o isolado T3s tenha ficado dentro da classe 1,0 (média das classificações 1,2) (Quadro 2). Com esses resultados iniciais, pode-se observar que todos os isolados de Trichoderma spp. avaliados podem ser utilizados como agentes de controle biológico contra as espécies de Fusarium testadas, pois a maioria das classes de antagonismo ficaram entre 1,0 e 2,0. Os isolados F3s, F4s e F2s diferenciaram-se de F1s por apresentarem maior crescimento micelial (Figura 1). Entretanto, o isolado F1s não diferiu estatisticamente de tratamentos em que Fusarium sp. foi combinado com Trichoderma spp. (F4s x T1s, F3s x T1s e F2s x T1s). Além disso, os tratamentos com o isolado F1s em combinação com todos isolados de Trichoderma spp. testados tiveram os menores crescimentos, assim como as combinações F2s x T2s, F2s x T3s e F2s x T4s. Estes resultados apontam que in vitro F1s (F. oxysporum) e F2s (F. proliferatum) seriam mais facilmente controlados pelos possíveis antagonistas testados.
Entre os principais mecanismos envolvidos em testes de biocontrole (como o de confrontação direta) em que Trichoderma spp. é utilizado, destacam-se o micoparasitismo (Papavizas, 1985; Harman e Kubicek, 1998; Howell, 2003; Hermosa et al., 2012) e a antibiose (Howell, 1998; Sivasithamparam e Ghisalberti, 1998; Hermosa et al., 2012). Além disso, verifica-se que fungos do gênero Trichoderma são hábeis na produção e liberação de enzimas hidrolíticas o que os auxilia na detecção da presença de outro fungo pela sensitividade de moléculas liberadas a partir do hospedeiro (planta) por degradação enzimática (Vinale et al., 2008).
Teste in vivo de isolados de Trichoderma spp. e Fusarium spp. em plântulas de soja
Os resultados de alguns tratamentos não são apresentados nas figuras em função da elevada incidência de damping off, que foi quantificada em percentagem (%) (Quadro 3).
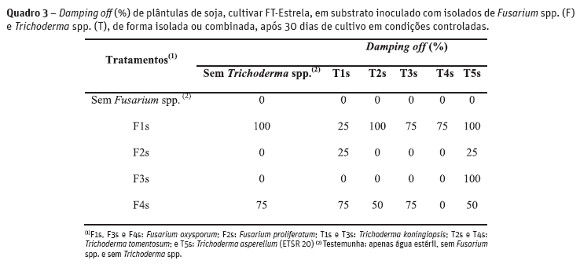
O tratamento F1s (F. oxysporum), isolado ou combinado com Trichoderma spp. (F1s x T2s e F1s x T5s) foi o mais agressivo, originando 100% de damping off. As combinações F1s x T3s e F1s x T4s também originaram grande incidência da doença, assim como F4s x T1s e F4s x T3s, todos com 75% de damping off. Em comparação aos resultados obtidos no teste de confrontação direta in vitro, foi possível destacar algumas diferenças. A combinação F2s x T1s, que obteve um dos maiores crescimentos miceliais (Quadro 2 e Figura 1), foi uma das que apresentou piores resultados in vivo, pois teve baixas médias de comprimento de raiz (cm) e peso fresco e seco (g) de plântulas (Figura 2). O isolado F2s (F. proliferatum) prejudicou o desenvolvimento de plântulas, o que pode ser comprovado por sua recorrência entre os piores tratamentos in vivo.
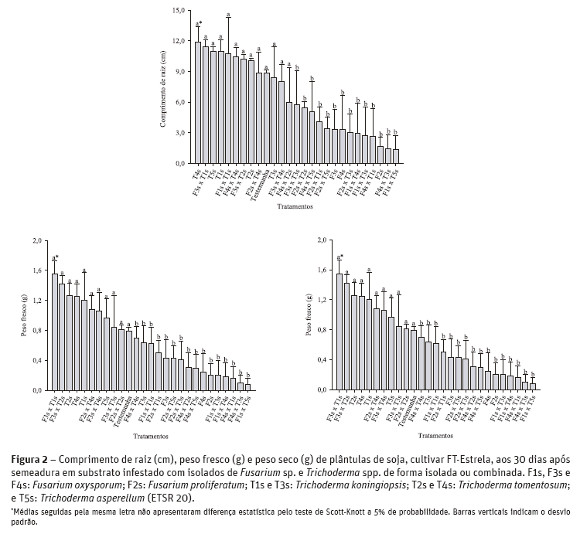
In vitro, o isolado F3s (F. oxysporum) em combinação com Trichoderma spp., não apresentou diferenças quanto ao crescimento micelial, mas in vivo sua combinação com o isolado T1s (F3s x T1s) foi uma das melhores, assim como F3s x T2s. O isolado F4s (F. oxysporum), tanto no teste in vitro quanto in vivo, não se destacou. Não houve damping off nos tratamentos Testemunha, apenas suspensão de Trichoderma spp. e somente suspensão de Fusarium sp. dos isolados F2s e F3s (Quadro 3). Além disso, não foi observado damping off em algumas combinações entre esses isolados de Fusariumspp. e Trichoderma spp., tais como F3s combinado com T1s, T2s, T3s e T4s e para o tratamento F4s x T4s.
Com relação a Trichoderma spp., os melhores isolados in vitro (T2s e T4s) também foram responsáveis por alguns dos resultados mais promissores in vivo. Além deles, T1s e T5s, agrupados na classe 2 de antagonismo (Quadro 2), obtiveram destaque para a variável comprimento de raiz (Figura 2). Ainda, o isolado T3s (classe 2 de antagonismo) não foi um dos melhores tratamentos in vivo, embora tenha sido eficiente in vitro contra o isolado F1s de Fusarium sp. Não foi observado damping off para as combinações entre o isolado F3s e T1s, T2s, T3s e T4s, tendo esse último se destacado, pois quando combinado com F2s e F4s, não houve incidência da doença (Quadro 3). Combinações envolvendo o isolado T5s (F1s x T5s; F3s x T5s; F2 x T5 e F4 x T5) apresentaram 100, 50 e 25% de damping off, respectivamente.
Nos tratamentos em que se realizou a avaliação em plântulas, foi possível observar que embora os isolados de Trichoderma spp. tivessem sido aplicados de maneira isolada, algumas combinações entre o antagonista e o patógeno foram capazes de promover um melhor desenvolvimento da plântula. Para a variável comprimento de raiz (cm) (Figura 2), por exemplo, os únicos tratamentos combinados que induziram sua redução foram F2s x T2s, F2s x T1s e F2s x T5s. Os demais não diferiram estatisticamente entre si. Os tratamentos que se destacaram pelo aumento do comprimento de raiz foram T4s, F3s x T1s, T5s, T1s, F1s x T1s, F4s x T4s, F3s x T2s e T2s, em que as médias ficaram acima de 10 cm.
Para o peso fresco de plântulas (Figura 2), os tratamentos F3s x T1s, F3s x T2s e T2s tiveram as melhores médias, acima de 1,2 g, e os tratamentos F4s, F2s, F1s x T3s, F1x T4s, F4s x T1s, F4s x T3s e F1s x T5s foram os que apresentaram as menores médias. O isolado de Fusarium sp. F2s, mesmo em combinação com Trichoderma spp. (T1s e T5s) foi capaz de prejudicar o desenvolvimento de plântulas. Esse resultado pode ser justificado por possíveis relações antagônicas entre os metabólitos produzidos por ambos os fungos e isso se refletiu sobre o peso fresco das plântulas tratadas com tais micro-organismos. Em estudo com maracujazeiro e isolados de Trichoderma spp. avaliando o enraizamento de estacas, Santos et al. (2010) verificaram que os isolados utilizados não promoveram o enraizamento, embora Trichoderma spp. tenha incrementado o peso fresco e seco de plantas advindas das estacas. Na variável peso seco de plântulas de soja, verificou-se que os tratamentos F3s x T1s, T2s, F3s x T2s e T1s foram os melhores, enquanto que F1s x T5s, F4s x T3s, F1s x T4s, F4s x T1s, F1s x T3s, F2s e F4s apresentaram as menores médias. Entre os isolados de Trichoderma spp. aplicados de forma isolada, T2s (T. tomentosum), obteve destaque com relação ao peso fresco e seco de plântulas. Nesse caso, a habilidade deste isolado poderia ser atribuída a sua capacidade de associação simbiôntica com as raízes da plântula que, aliada a sua ação decompositora, disponibilizaria nutrientes prontamente absorvíveis para o vegetal. Além disso, atuando como agente de controle biológico, inibiria a ação do fitopatógeno (no caso Fusarium sp.) que pode interferir no desenvolvimento normal da plântula (Santos, 2008).
A aplicação de Trichoderma spp. pode ser eficiente no controle de damping off causado pelo gênero Fusarium em plântulas de soja, já que a busca por métodos de manejo de doenças menos agressivos ao meio ambiente têm sido bastante enfatizados nas últimas décadas. Os resultados apresentados neste trabalho apontam que em alguns tratamentos, as quais houve combinação entre Trichoderma spp. e Fusarium spp., houve percentuais elevados de damping off, bem como redução de comprimento de raiz, peso fresco e seco de plântulas. Contudo, a explicação para esses resultados ainda é limitada, visto que até o momento, os processos bioquímicos relacionados ao micoparasitismo foram relatados de uma forma muito fragmentada (Seidl et al., 2009).
Conclusões
1. Os isolados de Trichoderma spp. oriundos de solo compactado (T1s e T3s-T. koningiopsis; T2s e T4s-T. tomentosum; e T5s-T. asperellum) testados, tanto in vitro quanto in vivo, apresentam potencial para controle de Fusarium spp. (F1s, F3s e F4s-F. oxysporum; F2s-F. proliferatum) em soja.
2. Os isolados de Trichoderma spp. (T1s, T2s, T3s, T4s e T5s) atuam como promotores de crescimento de plântulas de soja, cv. FT-Estrela, nas condições testadas.
3. As espécies Fusarium oxysporum e Fusarium proliferatum avaliadas neste estudo são patogênicos para a cultivar de soja FT-Estrela e provocam damping off em plântulas nas condições testadas.
Agradecimentos
Os autores agradecem à Coordenação de Aperfeiçoamento de Pessoal de Nível Superior (CAPES) pela concessão de Bolsa de Doutorado para o primeiro autor, ao Conselho Nacional de Desenvolvimento Científico e Tecnológico (CNPq), pela concessão de Bolsa de Iniciação Científica e aos revisores anônimos pelas importantes sugestões e correcções.
Referências Bibliográficas
Allmaras, R.R.; Kraft, J.M. e Miller, D.E. (1988) Effects of soil compaction and incorporated crop residue on root health. Annual Review of Phytopathology, vol.26, p. 219-243. [ Links ]
Agrios, G.N. (2005) Plant Pathology. 5.ª ed. Burlington, USA, Elsevier Academic Press, 922p. [ Links ]
Aoki, T.; ODonnell, K. e Scandiani, M.M. (2005) Sudden death syndrome of soybean in South America is caused by four species of Fusarium: Fusarium brasiliense sp. nov., F. cuneirostrum sp. nov., F. tucumaniae, and F. virguliforme. Mycoscience, vol.46, n.3, p. 162-183. [ Links ]
Aoki, T.; ODonnell, K.; Homma, Y. e Lattanzi, A.R. (2003) Sudden death syndrome of soybean is caused by two morphologically and phylogenetically distinct species within the Fusarium solani species complex-F. virguliforme in North America and F. tucumaniae in South America. Mycologia, vol.95, n.4, p. 660-684. [ Links ]
Bell, D.K.; Wells, H.D. e Markham, C.R. (1982) – In vitro antagonism of Trichoderma species against six fungal plant pathogens. Phytopathology, vol.72, n.4, p. 379-382. [ Links ]
Bettiol, W. e Ghini, R. (1995) Controle Biológico. In: Bergamin, A.F.; Kimati, H. e Amorin, L. (Eds.)Manual de fitopatologia. Vol. 1 Princípios e Conceitos. 3.ª ed. São Paulo, Agronômica Ceres, p.717-728. [ Links ]
Blaszczyk, L.; Popiel, D.; Chelkowski, J.; Koczyk, G.; Samuels, G.J.; Sobieralski, K. e Siwulski, M. (2011) Species diversity of Trichoderma in Poland. Journal of Applied Genetics, vol.52, n.2, p.233–243. [ Links ]
Bomfim, M.P.; São José, A.R.; Rebouças, T.N.H.; Almeida, S.S.; Souza, I.V.B. e Dias, N.O. (2010)-Avaliação antagônica in vitro e in vivo de Trichoderma spp. a Rhizopus stolonifer em maracujazeiro amarelo. Summa Phytopathologica, vol.36, n.1, p.61-67. [ Links ]
Carvalho, D.D.C.; Mello, S.C.M.; Lobo Júnior, M. e Silva, M.C. (2011) Controle de Fusarium oxysporum f.sp. phaseoli in vitro e em sementes, e promoção do crescimento inicial do feijoeiro comum por Trichoderma harzianum. Tropical Plant Pathology, vol.36, n.1, p. 28-34. [ Links ]
Carter, M.R. (Ed.) (1993) Soil sampling and methods of analysis. Boca Raton, USA, Lewis Publishers. 823 p. [ Links ]
Dennis, C. e Webster, J. (1971) Antagonistic properties of species groups of Trichoderma: III – Hyphal interactions. Transactions of the British Mycological Society, vol.57, n.DEC, p. 363-369. [ Links ]
Elad, Y.; Chet, I.; Boyle, P. e Henis, Y. (1983) Parasitism of Trichoderma spp. on Rhizoctonia solani and Sclerotium rolfsii – Scaning electron microscopy and fluorescence microscopy. Phytopathology, vol.73, n.1, p. 85-88. [ Links ]
Ethur, L.Z.; Rocha, E.K.; Milanesi, P.; Muniz, M.F.B. e Blume, E. (2006) Sanidade de sementes e emergência de plântulas de nabo forrageiro, aveia preta e centeio submetidas a tratamentos com bioprotetor e fungicida. Ciência e Natura, vol.28, n.2, p. 17-27. [ Links ]
Ethur, L.Z. (2006) Dinâmica populacional e ação de Trichoderma no controle de fusariose em mudas de tomateiro e pepineiro. Tese de doutoramento. Santa Maria, Universidade Federal de Santa Maria, 153p. [ Links ]
Ferreira, D.F. (2000) Análises estatísticas por meio do Sisvar para Windows versão 4.0. In: Anais da 45ª Reunião anual da Região Brasileira da Sociedade Internacional de Biometria. São Carlos, Universidade Federal de S. Carlos (UFSCar), p. 255-258. [ Links ]
Girardello, V.C.; Amado, T.J.C.; Nicoloso, R.S.; Hörbe, T.A.N.; Ferreira, A.O.; Tabaldi, F.M. e Lanzanova, M.E. (2011) Alterações nos atributos físicos de um latossolo vermelho sob plantio direto induzidas por diferentes tipos de escarificadores e o rendimento da soja. Revista Brasileira de Ciência do Solo, vol.35, n.6, p. 2115-2126. [ Links ]
Harman, G.E.; Kubicek, C.P. (Eds.) (1998) Trichoderma and Gliocladium. Vol. 2: Enzymes, biological control and commercial applications. London, Taylor & Francis. 393 p. [ Links ]
Harman, G.E. (2000) Myths and dogmas of biocontrol: Changes in perceptions derived from research on Trichoderma harzianum T-22. Plant Disease, vol.84, n.4, p. 377-393. [ Links ]
Hermosa, R.; Viterbo, A.; Chet, I. e Monte, E. (2012)Plant-beneficial effects of Trichoderma and of its genes. Microbiology, vol.158, n.1, p. 17–25. [ Links ]
Howel, C.R. (2003) Mechanisms employed by Trichoderma species in the biological control of plant diseases: the history and evolution of current concepts. Plant Disease, vol.87, n.1, p. 4-10. [ Links ]
Howell, C.R. (2002) Cotton seedling preemergence damping-off incited by Rhizopus oryzae and Pythium spp. and its biological control with Trichoderma spp. Phytopathology, vol.92, n.2, p. 177–180. [ Links ]
Howell, C.R. (1998) The role of antibiosis in biocontrol. In: Harman, G.E.; Kubicek, C.P. (Eds.)Trichoderma and Gliocladium. Vol.2: Enzymes, biological control and commercial applications. London: Taylor & Francis, p. 173-184. [ Links ]
Inam-Ul-Haq, M.; Javed, N.; Khan, M.A.; Jaskani, M.J.; Khan, M.M.; Khan, H.U.; Irshad, G. e Gowen, S.R. (2009) Role of temperature, moisture and Trichoderma species on the survival of Fusarium oxysporum ciceri in the rainfed areas of Pakistan. Pakistan Journal of Botany, vol.41, n.4, p. 1965-1974. [ Links ]
Klingelfuss, L.H.; Yorinori, J.T. e Destro, D. (2007) Métodos de inoculação para quantificação de resistência em soja à Fusarium solani f. sp. glycines, em casa-de-vegetação. Fitopatologia Brasileira, vol.32, n.1, p. 50-55. [ Links ]
Lopes, F.A.C.; Steindorff, A.S.; Geraldine, A.M.; Brandão, R.S.; Monteiro, V.N.; Lobo Júnior, M.; Coelho, A.S.G.; Ulhoa, C.J. e Silva, R.N. (2012) Biochemical and metabolic profiles of Trichoderma strains isolated from common bean crops in the Brazilian Cerrado, and potential antagonism against Sclerotinia sclerotiorum. Fungal Biology, vol.116, n.7, p. 815-824. [ Links ]
Mbarga, J.B.; Ten Hoopen, G.M.; Kuaté, J.; Adiobo, A.; Ngonkeu, M.E.L.; Ambang, Z.; Akoa, A.; Tondje, P.R. e Begoude, B.A.D. (2012) Trichoderma asperellum: A potential biocontrol agent for Pythium myriotylum, causal agent of cocoyam (Xanthosoma sagittifolium) root rot disease in Cameroon. Crop Protection, vol.36, p. 18-22. [ Links ]
Melo, I.S. (1991) Potencialidades de utilização de Trichoderma spp. no controle biológico de doenças de plantas. In: Bettiol, W. (Ed.) Controle biológico de doenças de plantas. Jaguariúna, EMBRAPA – CNPDA. p. 7-23. [ Links ]
Milanesi, P.M. (2012) Aspectos biológicos da interação Fusarium spp. e Trichoderma spp. em solo compactado de aveia preta e soja sob plantio direto. Tese de doutoramento. Santa Maria, Universidade Federal de Santa Maria, 131 p. [ Links ]
Neto, A.L.F.; Hartman, G.L.; Pedersen, W.L.; Li, S.; Bollero, G.A. e Diers, B.W. (2006) Irrigation and inoculation treatments that increase the severity of soybean sudden death syndrome in the field. Crop Science, vol.46, n.6, p. 2547-2554. [ Links ]
Palazzini, J.M.; Ramirez, M.L.; Torres, A.M. e Chulze, S.N. (2007) Potential biocontrol agents for Fusarium head blight and deoxynivalenol production in wheat. Crop Protection, vol.26, n.11, p. 1702–1710. [ Links ]
Papavizas, G.C. (1985) Trichoderma and Gliocladium: biology, ecology, and potencial for biocontrol. Annual Review of Phytopathology, vol.23, p. 23-54. [ Links ]
Rojo, F.G.; Reynoso, M.M.; Ferez, M.; Chulze, S.N. e Torres, A.M. (2007) Biological control by Trichoderma species of Fusarium solani causing peanut brown root rot under field conditions. Crop Protection, vol.26, n.4, p. 549-555. [ Links ]
Santos, H.A.; Mello, S.C.M. e Peixoto, J.R. (2010) Associação de isolados de Trichoderma spp. e Ácido Indol-3-Butírico (AIB) na promoção de enraizamento de estacas e crescimento de maracujazeiro. Bioscience Journal, vol.26, n.6, p. 966-972. [ Links ]
Santos, H.A. (2008) Trichoderma spp. como promotores de crescimento em plantas e como antagonistas a Fusarium oxysporum. Dissertação de mestrado, Brasília, Universidade de Brasília. 94 p. [ Links ]
Saremi, H.; Burgess, L.W. e Backhouse, D. (1999) Temperature effects on the relative abundance of Fusarium species in a model plant-soil ecosystem. Soil Biology and Biochemistry, vol.31, n.7, p. 941-947. [ Links ]
Scandiani, M.M.; Aoki, T.; Luque, A.G.; Carmona, M.A. e ODonnell, K. (2010) First report of sexual reproduction by the soybean sudden death syndrome pathogen Fusarium tucumaniae in nature. Plant Disease, vol.94, n.12, p. 1411-1416. [ Links ]
Seidl, V.; Song, L.; Lindquist, E.; Gruber, S.; Koptchinskiy, A.; Zeilinger, S.; Schmoll, M.; Martínez, P.; Sun, J.; Grigoriev, I.; Herrera-Estrella, A.; Baker, S.E. e Kubicek, C.P. (2009) Transcriptomic response of the mycoparasitic fungus Trichoderma atroviride to the presence of a fungal prey. BMC Genomics [em linha], vol.10:567. Disponível em: http://www.biomedcentral.com/1471-2164/10/567. [ Links ]
Sivasithamparam, K. e Ghisalberti, E.L. (1998) Secondary metabolism in Trichoderma and Gliocladium. In: Kubicek, C.P. e Harman, G.E. (Eds.). Trichoderma and Gliocladium. Vol. 1: Basic biology,taxonomy and genetics. London, CRC Press, p.139–191. [ Links ]
Sivan, A. e Chet, I. (1989) Degradation of fungal cell walls by lytic enzymes of Trichoderma harzianum. Journal of General Microbiology, vol.135, n.675-682. [ Links ]
Steindorff, A.S.; Silva, R.N.; Coelho, A.S.G.; Nagata, T.; Noronha, E.F. e Ulhoa, C.J. (2012) Trichoderma harzianum expressed sequence tags for identification of genes with putative roles in my coparasitism against Fusarium solani. Biological Control, vol.61, n.2, p. 134-140. [ Links ]
Vinale, F.; Sivasithamparam, K.; Ghisalberti, E.L.; Marra, R.; Woo, S.L. e Lorito, M. (2008) Trichoderma-plant-pathogen interactions. Soil Biology & Biochemistry, vol.40, n.1, p. 1-10. [ Links ]
Wakelin, S.A.; Warren, R.A.; Kong, L. e Harvey, P.R. (2008) Management factors affecting size and structure of soil Fusarium communities under irrigated maize in Australia. Applied Soil Ecology, vol.39, n.2, p. 201–209. [ Links ]
Woo, S.L.; Scala, F.; Ruocco, M. e Lorito, M. (2005) The molecular biology of the interactions between Trichoderma spp., phytopathogenic fungi, and plants. Phytopathology, vol.96, n.2, p. 181–185. [ Links ]
Recebido/Received: 2012.12.13
Aceitação/Accepted: 2013.06.03














