Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Acessos
Acessos
Links relacionados
-
 Similares em
SciELO
Similares em
SciELO
Compartilhar
Revista de Ciências Agrárias
versão impressa ISSN 0871-018X
Rev. de Ciências Agrárias vol.38 no.2 Lisboa jun. 2015
ARTIGO
Identificação e caracterização de Pseudomonas syringae pv. actinidiae (Psa) na Região do Entre Douro e Minho (Portugal)
Identification and characterization of Pseudomonas syringae pv. actinidiae Psa) in Entre Douro e Minho region (Portugal)
Luísa Moura1,2,*, Eva Garcia1, Olga Aguín3, Aitana Ares3, Adela Abelleira3 e Pedro Mansilla3
1 Centro de Investigação de Montanha (CIMO); Escola Superior Agrária, Instituto Politécnico de Viana do Castelo, Refóios, 4990-706 Ponte de Lima, Portugal. * E-mail: luisamoura@esa.ipvc.pt, author for corresponcence
2 Estación Fitopatolóxica do Areeiro, Diputación Pontevedra, 36153 Pontevedra, Espanha
RESUMO
Pseudomonas syringae pv. actinidiae (Psa) é o agente causal do cancro bacteriano da actinídea, doença mais grave desta cultura na atualidade que provoca importantes perdas económicas nos principais países produtores de kiwi. Os sintomas mais característicos da doença incluem pequenas necroses castanhas rodeadas de um halo amarelo nas folhas e exsudados avermelhados nos caules, podendo conduzir à morte da planta. Em Portugal, a doença foi detetada pela primeira vez em 2010, na Região do Entre Douro e Minho. Com este estudo pretende-se identificar e caracterizar isolados de Psa da Região do Entre Douro e Minho. A partir de material vegetal com sintomas da doença proveniente de diferentes pomares de Actinidia deliciosa, isolou-se o agente patogénico e realizou-se a sua identificação e caracterização morfológica e fenotípica através de testes LOPAT, utilização de fontes de carbono (sistema Biolog), perfis de ácidos gordos e através de técnicas moleculares (PCR e BOX-PCR). Os resultados obtidos mostram que os isolados estudados apresentam características morfológicas idênticas, existindo variabilidade ao nível das características fenotípicas. A caracterização molecular mostra que os isolados de Psa da Região do Entre Douro e Minho são semelhantes, sendo idênticas a populações de Psa conhecidas como virulentas (Psa3) identificadas na Europa e na Nova Zelândia.
Palavras-chave: actinídea; Biolog; BOX-PCR, cancro bacteriano; kiwi.
ABSTRACT
Pseudomonas syringae pv. actinidiae (Psa) is the causal agent of bacterial canker of kiwifruit, the most severe disease of this culture at the moment, causing significant economic losses in the main kiwi producing countries. The most characteristic symptoms are leaves with small dark-brown necrotic spots surrounded by a yellow halo and red-rusty exudation on the trunks. This disease was detected in Portugal in 2010 in Entre Douro e Minho (EDM) region. This study aims to identify and characterize the Psa population present in this region. The pathogen was isolated from plant material with symptoms of the disease from different Actinidia deliciosa orchards. Identification and characterization was done by morphological and phenotypical tests (LOPAT, Biolog system, fatty acids profile) and molecular techniques (PCR and BOX-PCR). The results showed that the Psa isolates have similar morphological characteristics, however variability at this level was observed. Results of molecular characterization indicate that Psa isolates from EDM region are similar to the most virulent Psa population (Psa3) identified in Europe and New Zealand.
Keywords: bacterial canker, Biolog, BOX-PCR, kiwifruit
Introdução
A bactéria Pseudomonas syringae pv. actinidiae (Psa), agente causal do cancro bacteriano da actinídea, foi isolada pela primeira vez em 1984 no Japão (Takikawa et al., 1989). Desde então, e especialmente nos últimos anos, tem manifestado elevada agressividade e uma dispersão muito rápida, tendo, nos dias de hoje, distribuição generalizada nas principais regiões produtoras de kiwi, incluindo Portugal (Balestra et al., 2010).
A produção de kiwi é uma importante atividade económica em diversos países, sendo a China, a Itália e a Nova Zelândia os principais produtores mundiais (FAOSTAT, 2014). Em Portugal, as principais regiões produtoras são o Entre Douro e Minho e a Beira Litoral (European Commission, 2014). Em 2013, foram produzidas 21306 t de kiwi no território nacional, das quais 16695 toneladas foram produzidas apenas na zona Norte, tendo sido atingido um valor de 11212000 € em exportações deste fruto (INE, 2014).
O cancro bacteriano da actinídea é considerado, atualmente, a maior causa de perdas na produção de kiwi dado que diminui a produção dos pomares, pode levar à morte das plantas e não são conhecidos métodos curativos (Abelleira et al., 2014). Esta doença foi já responsável por perdas económicas importantes em França, Espanha, Portugal, Chile, Coreia do Sul e Japão, mas principalmente em Itália e na Nova Zelândia onde a produção de kiwi é bastante importante (Scortichini et al., 2012). Tendo em vista a limitação da dispersão da doença, a EPPO (European and Mediterranean Plant Protection Organization) adicionou em 2009, a doença na lista de alerta A2, lista que inclui os organismos recomendados para regulação como organismos de quarentena (EPPO, 2012).
Entre os sintomas da doença (Figura 1), podem ser referidos especialmente a produção de exsudados avermelhados ou esbranquiçados associados a cancros e feridas, coloração vermelha-acastanhada por baixo da casca nos troncos e ramos infetados, pintas e manchas necróticas angulares nas folhas, que podem ou não apresentar um halo amarelo, necroses castanhas e abortamento de botões florais, morte de rebentos e de plantas (Vanneste et al., 2011; Abelleira et al., 2014; Moura, 2013).
Atualmente são conhecidas quatro populações de Psa (Psa1, Psa2, Psa3 e Psa4). Estas populações estão presentes em diferentes países produtores de kiwi e têm agressividades distintas (Quadro 1), causando prejuízos também distintos, pelo que é importante conhecer a prevalência das populações de Psa numa região ou país. As estirpes de Psa pertencentes à população Psa1 estão presentes no Japão e em Itália (responsável pelo surto de Psa em 1992) e a sua virulência parece variar com a região geográfica em que se encontra. Embora geneticamente as estirpes isoladas nos dois países sejam muito semelhantes, no Japão causou importantes perdas económicas, o que não aconteceu em Itália onde não provocou grande impacto na produção de kiwi (Scortichini et al., 2012). Esta situação pode sugerir que as condições climáticas ou as técnicas de produção utilizadas nos dois países podem ter influência na agressividade com que a bactéria infeta a planta (Scortichini et al., 2012).
As estirpes da população Psa2 encontram-se apenas na Coreia do Sul. A população Psa3, a mais virulenta e responsável por perdas económicas importantes, está oficialmente presente no Chile, China, Espanha, França, Itália, Portugal e Nova Zelândia (Chapman et al., 2012). A população Psa4 caracteriza-se por causar apenas sintomas nas folhas, não conduzindo à morte das plantas (Scortichini et al., 2012; Cunty et al., 2014), tendo já sido isolada na Nova Zelândia, Austrália e França, embora se pense que esteja presente em todos os países produtores de kiwi da Europa (Cunty et al., 2014).
Este trabalho, realizado em 2013 e 2014, teve por objetivo identificar e estudar a estrutura de populações de Psa na Região do Entre Douro e Minho (EDM).
Material e Métodos
A partir de material vegetal com sintomas da doença proveniente de diferentes pomares de Actinidia deliciosa, isolou-se o agente patogénico e realizou-se a sua identificação, caracterização morfológica, fenotípica e de patogenicidade.
Obtenção da coleção e isolamento de Pseudomonas syringae pv. actinidiae
A obtenção da coleção de bactérias de Psa foi feita através da análise de amostras de folhas, ramos, flores e caules evidenciando sintomas típicos da doença, obtidas a partir de plantas masculinas e femininas de diferentes cultivares de actinídea. As amostragens foram realizadas durante os anos de 2013 e 2014 em pomares de diferentes idades, localizados em vários concelhos da região do EDM. Dos isolados obtidos, e considerando o ano do isolamento, a cultivar, a localização geográfica dos pomares e a parte da planta utilizada, foram selecionados para este estudo 23 isolados do EDM, descritos na Quadro 2.
Adicionalmente, incluíram-se neste estudo cinco estirpes de referência descritas no Quadro 3. As estirpes CFBP 4909T e CFBP 7286 foram adquiridas na coleção de culturas CFBP/CIRM (Collection Française de Bactéries associées aux Plantes) e as estirpes K-Psa2, 10627 e 10880 foram cedidas por J. Vanneste.
Para o isolmento do patogéneo, foram selecionadas pequenas porções de tecidos de folhas, ramos, caules ou flores, apresentando sintomas da doença. Os tecidos foram desinfetados externamente com etanol a 95%, macerados em 5 mL de água destilada esterilizada e, posteriormente, cerca de 50 µL da suspensão bacteriana obtida foi inoculada em meio B de King modificado (Mohan e Shaad, 1987). As placas foram incubadas a 28ºC e observadas após 24, 48 e 72 horas de incubação. As colónias que apresentaram morfologia idêntica à descrita para Psa foram repicadas em meio B de King (King et al., 1954), até se obterem culturas puras.
Caracterização morfológica e cultural
As características morfológicas e culturais das colónias foram analisadas após 48 horas do seu crescimento a 28ºC em meio B de King, no que respeita à sua forma, consistência, tamanho, relevo, contornos das colónias, cor, transparência, brilho e presença/ausência de pigmentos difusíveis. Na caracterização da parede celular utilizou-se o método do KOH a 3% (Suslow, 1982), em alternativa ao método de coloração de Gram.
Caracterização Bioquímica dos isolados
Para a caracterização bioquímica dos isolados, foram efetuados os testes LOPAT (Lelliott et al., 1966), produção de levana, oxidase, dihidrólise da arginina, atividade pectinolítica e reação de hipersensibilidade em folhas de tabaco.
A análise da capacidade para a utilização de fontes de carbono (açúcares, álcoois, aminoácidos e ácidos orgânicos), a determinação de propriedades fisiológicas (sais, pH e tolerância ao ácido láctico), do poder redutor e da sensibilidade química foi feita através do Sistema Biolog (Biolog, 2011). As amostras foram analisadas utilizando microplacas “GEN III” inoculadas com o fluido de inoculação “IF-A”, no qual se incorporou previamente uma suspensão bacteriana, seguindo as recomendações do fabricante. As microplacas inoculadas foram incubadas a 28ºC e a absorvância (590 nm) lida e registada após 24, 48 e 72 horas utilizando a Micro Estação ID System e o software MicroLogTM. Os resultados obtidos foram analisados recorrendo ao software Past 3.04. A comparação dos isolados bacterianos estudados utilizou o coeficiente de Correlação (Bartko, 1966), e o método UPGMA (Unweigted Pair-Group Method using arithmetic Averages) (Sneath e Sokal, 1973).
Caracterização dos ácidos gordos
Para a caracterização bacteriana utilizando a análise dos ácidos gordos seguiu-se o método descrito por Stead (1992) para espécies de Pseudomonas. A quantificação foi feita recorrendo a um cromatógrafo de fase gasosa Hewlett Packard 6890 e a identificação dos picos obtidos foi feita usando o Sistema MIDI v. 4.5 (System for Microbiological Identification Sherlock (MIS;MIDI).
Identificação molecular dos isolados
A obtenção de ADN para a realização das amplificações por PCR foi feita utilizando culturas bacterianas em meio B de King incubadas durante 48 horas a 28ºC. Prepararam-se suspensões bacterianas com uma concentração de 108 ufc.mL-1 (DO600=0,5) numa solução de 10% de NaOH a 0,5M. As suspensões foram colocadas a 95ºC durante 15 minutos, e de seguida colocadas no frigorífico a 4ºC até utilização nas reações de amplificação.
A identificação das estirpes foi feita através de reações de PCR com o par de primers Psa-F1/Psa-R2 (Rees-George, 2010) e de duplex-PCR com os dois pares de primers KN-F/KN-R e AvrDdpx-F/AvrDdpx-R (Gallelli et al., 2011). Em cada reação foi incluído um controlo negativo, em que o ADN foi substituído por água ultrapura esterilizada, e controlos positivos utilizando ADN de estirpes de referência de Psa. As amplificações obtidas por PCR e duplex-PCR foram observadas através da eletroforese em gel de agarose a 2% em tampão de TBE 0,5x (Sambrook et al., 1989). Os produtos de amplificação foram corados por imersão do gel numa solução “GelRed” (Biotium Inc.) e visualizados com luz ultra violeta (Sambrook et al., 1989).
Análise de sequências repetitivas de ADN por BOX-PCR
Foi utilizado o primer BOXA1R, de acordo com o protocolo adaptado de Louws e seus colaboradores (1994). Foram incluídas na análise da diversidade genética 5 estirpes representativas das 4 populações de Psa descritas no Quadro 3.
Foi também utilizado um controlo negativo, utilizando água ultra pura estéril no lugar da suspensão bacteriana, de forma a garantir a ausência de contaminações por ADN exógeno.
Caracterização da patogenicidade
A patogenicidade dos isolados foi testada em plantas de actinídea da cultivar Hayward com dois anos, durante o mês de Outubro de 2014. As plantas foram inoculadas com dois isolados portugueses do EDM (P85 e VV12) com diferentes origens geográficas, e com a estirpe italiana CFBP 7286. As culturas bacterianas a inocular foram obtidas a partir de colónias puras, inoculadas em meio B de King com 24 horas de crescimento a 28ºC. Para cada estirpe estudada, inocularam-se 3 plantas (uma planta por vaso), pulverizando 5 folhas com uma suspensão bacteriana (108 ufc.mL-1). Três plantas inoculados com água destilada esterilizada, mantidos nas mesmas condições das plantas inoculadas, constituíram o controlo negativo. As plantas foram observadas 15 dias e um mês após inoculação e foram anotados os sintomas observados. A partir dos sintomas observados nas folhas as bactérias foram reisoladas em laboratório seguindo o procedimento descrito anteriormente.
Resultados e Discussão
Caracterização morfológica e cultural
As estirpes isoladas na região EDM apresentaram colónias com morfologia bastante semelhante entre si, mostrando uma cor esbranquiçada com transparência, lisas e margens circulares. A maior parte das colónias apresentaram brilho e dimensões que variaram entre 4 e 6 mm de diâmetro. Apenas uma estirpe (B65) apresentou características mucoides, dimensões superiores (7 a 8 mm de diâmetro) e uma aparência mais baça e amarelada. Relativamente à formação de pigmentos fluorescentes visíveis sob luz ultravioleta (λ = 560 nm), verificou-se que esta é uma característica variável entre as estirpes estudadas.
Caracterização Bioquímica dos isolados
De acordo com a classificação das bactérias fitopatogénicas fluorescentes proposta por Lelliott et al. (1966), todos os isolados estudados pertencem ao grupo LOPAT Ia (Lelliott et al., 1966). O resultado da análise de 56 características fisiológicas e bioquímicas de 23 isolados do EDM e de duas estirpes de referência (CFBP 4909 e CFBP 7286) testadas através do sistema BIOLOG GEN III (Biolog, 2011) deu origem ao dendrograma apresentado na Figura 2.
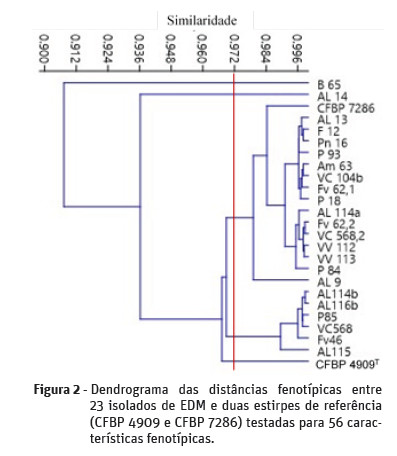
Pode constatar-se que para um valor de similaridade de 0,972 se obtêm 2 fena e 3 estirpes não agrupadas. O fenon 1 agrupa 15 estirpes portuguesas e a estirpe italiana CFBP 7286 pertencente à população Psa3. O fenon 2 agrupa 6 estirpes portuguesas. As estirpes B65, AL14 e CFBP 4909T encontram-se isoladas.
As estirpes isoladas na Região EDM mostraram ser bioquímica e fisiologicamente semelhantes à estirpe tipo de Psa CFBP 4909T e à estirpe italiana CFBP 7286. Todas elas apresentaram a capacidade de utilizar sacarose, mio-inositol, glicerol, L-alanina, ácido L-aspártico, ácido L-glutâmico, L-serina, ácido D-glucónico, ácido D-glucurónico, ácido múcico, ácido quínico, ácido D-sacárico, ácido cítrico, ácido D-málico, ácido L-málico, ácido gama-aminoburítico e ácido acético. Estas apresentaram ainda sensibilidade química quando expostas a NaCl 8%, minociclina, cloreto de lítio, butirato de sódio e bromato de sódio. No entanto, foi possível observar variabilidade fenotípica entre as estirpes de Psa portuguesas através de substratos para os quais a sua capacidade de utilização foi variável, tais como: α-D-glucose, D-manose, D-fucose, inosina, D-sorbitol, D-manitol, D-arabitol, Mio-inositol, D-serina, ácido L-piroglutâmico, pectina, ácido D-galacturonico, ácido D-glucurónico, metil-piruvato, ácido bromo-succínico e ácido acetoacético.
Caracterização dos ácidos gordos
As estirpes estudadas apresentaram um perfil de ácidos gordos semelhante ao de estirpes representantes da população Psa3 isoladas em Espanha, apresentando índices de similaridade (IS) superiores a 0,700. As estirpes do EDM apresentaram dois picos distintivos para os ácidos gordos 16:0 e Sum In Feature 3 (que corresponde aos ácidos gordos 16-1 w7c e/ou 16-1 w6c, que não são possíveis de diferenciar através do sistema utilizado). A estirpe B65 foi uma exceção, apresentando um perfil de ácidos gordos distinto e um IS inferior a 0,500.
Identificação molecular dos isolados
As estirpes portuguesas estudadas foram identificadas molecularmente pela reação de PCR com os primers PsaF1/R2 (Rees-George, 2010), onde foi amplificado o fragmento esperado de 280 pb (pares de bases) e pela reação de duplex-PCR, com os 2 pares de primers KN-F/R e AvrDdpx-F/R, onde se verificou a amplificação dos dois fragmentos esperados de 226 e 492 pb para 22 isolados do EDM e para as estirpes de referência estudadas (Figura 3). Foi exceção a estirpe B65, para a qual não se obtive amplificação destes fragmentos.
Análise de sequências repetitivas de ADN por BOX-PCR
A comparação dos padrões de fragmentos de ADN genómico amplificados com o primer BOXA1R permite verificar que se obtiveram entre 15 e 20 bandas polimórficas, com tamanhos que variaram entre 216 pb e 4038 pb. Da análise dos padrões de fragmentos de ADN genómico amplificados, é possível verificar que as quatro populações de Psa apresentam padrões diferentes entre si. As estirpes representantes das populações Psa1 e Psa2 apresentam um perfil genético muito idêntico, caracterizando-se pela presença de duas bandas distintivas de 300 e 700 pb, e uma banda adicional com cerca de 2500 pb na estirpe da população Psa2 (Figura 4), que as permite diferenciar das restantes populações de Psa. A estirpe 10880 isolada na Nova Zelândia, pertencente à população Psa4, distingue-se das restantes populações por apresentar 3 bandas, únicas desta população, de 2100, 380 e 300 pb, e ainda pela ausência das bandas de 210 e 1000 pb.
Com exceção da estirpe B65, as estirpes isoladas no EDM, apresentam um perfil BOX-PCR semelhante ao da estirpe italiana (CFBP 7286) e da Nova Zelândia (10627) da população Psa3, o que permite caracterizá-las como pertencentes a esta população. Este conjunto de estirpes distingue-se das estirpes das restantes populações Psa1, Psa2 e Psa4 por apresentarem duas bandas adicionais de 200 e 750 pb (Figura 4). No entanto, as estirpes CFBP 7286 e 10627 apresentam variabilidade genética entre si, pois a estirpe isolada na Nova Zelândia é caracterizada pela presença de bandas com 300, 350 e 450 pb, ausentes na estirpe italiana. A análise da diversidade genética obtida por BOX-PCR evidencia igualmente a existência de variabilidade no interior da população portuguesa de Psa da região EDM. As estirpes AL114b, AL116, Am63, F12 e F62 caracterizam-se por apresentarem bandas com 300, 350, 450, 2100, 2200, 2400 pb e 2500 pb (dados não apresentados), que as restantes estirpes de Psa3 isoladas em Portugal e em Itália não apresentam. A estirpe isolada na Nova Zelândia apresenta apenas três (300, 350 e 450 pb) das sete bandas referidas.
A estirpe B65 apresenta um perfil BOX-PCR diferente de todas as outas estirpes incluídas nesse estudo.
Caracterização da patogenicidade
Os resultados obtidos relativos à patogenicidade do conjunto de bactérias testadas mostraram que todos os isolados foram patogénicos em actinídea. Os sintomas causados pelas estirpes P85, VV112 e CFBP 7286 foram idênticos aos previamente descritos por outros autores para Psa3 (Gallelli et al., 2011; Vanneste et al., 2013). Os sintomas caracterizaram-se pela formação de manchas necróticas rodeadas por halo amarelo nas folhas pulverizadas com a suspensão bacteriana após 15 dias da inoculação. As caraterísticas dos isolados obtidos após reisolamento foram idênticas às das bactérias inoculadas em folhas de actinídea.
Conclusões
Com este estudo, foram caracterizadas 23 isolados obtidos de plantas de actinídea com sintomas de cancro bacteriano na região de Entre Douro e Minho. A caracterização através dos testes LOPAT, perfil de ácidos gordos, reação PCR com os primers PsaF1/R2 (Rees-George et al., 2010) e reação de duplex PCR (Gallelli et al., 2011), permitiu identificar 22 isolados como Psa. A análise do perfil genético por BOX-PCR, mostrou que a população de Psa que prevalece nesta região é a população Psa3, a mais virulenta e responsável pelo atual surto da doença na Europa e na Nova Zelândia. O conjunto dos resultados obtidos com a estirpe B65 não são conclusivos, tratando-se de uma estirpe atípica com características que se aproximam das descritas para a População Psa4.
Agradecimentos
Às empresas e entidades que facultaram contactos de produtores e material vegetal para a realização deste trabalho, tais como “Frutas Douro ao Minho”, “Kiwi Greensun”, “Cooperativa Terras de Felgueiras”, “Kiwi 1000”, “Solintenso”, “Delícias do Tojal”, Direção Regional de Agricultura e Pescas do Norte. À Diputación de Pontevedra, agradecemos a oportunidade da realização de parte do trabalho de Mestrado de Eva Garcia, realizado na Estación Fitopatolóxica do Areeiro. Ao Doutor J. Vanneste agradecemos a cedência das estirpes de referência K-Psa, 10627 e 10880.
Referências Bibliográficas
Abelleira, A.; Ares, A.; Aguín, O.; Picoaga, A.; López, M. e Mansilla, P. (2014) - Current situation and characterization of Pseudomonas syringae pv. actinidiae on kiwifruit in Galicia (northwest Spain). Plant Pathology, vol. 63, n. 3, p. 691–699. [ Links ]
Balestra, G.M.; Renzi, M. e Mazzaglia, A. (2010) - First report of bacterial canker of Actinidia deliciosa caused by Pseudomonas syringae pv. actinidiae in Portugal. New Disease Reports, vol. 22, p. 1-10. [ Links ]
Bartko, J. (1966) - The intraclass correlation coefficient as a measure of reliability. Psychological Reports, vol. 19, p. 3–11. [ Links ]
Biolog, I. (2011) - Microbial identification: state-of-the-science performance with unmatched power & versatility. 8 Characterization of Pseudomonas syringae pv. actinidiae (Psa) isolated from France and assignment of Psa biovar 4 to a de novo pathovar: Pseudomonas syringae pv. actinidifoliorum pv. nov. [citado 2014-02-25]. Disponível em http://www.biolog.com/pdf/milit/00A024rBMicroSystemsBrochure.pdf [ Links ]
Chapman, J.; Taylor, R.; Weir, B.; Romberg, M.; Vanneste, J.; Luck, J. e Alexander, B. (2012) - Phylogenetic relationships among global populations of Pseudomonas syringae pv. actinidiae. Phytopathology, vol. 102, p. 1034–1044. [ Links ]
Cunty, A.; Poliakoff, F.; Rivoal, C.; Cesbron, S.; Fischer-Le Saux, M.; Lemaire, C.; Jacques, M. a.; Manceau, C. e Vanneste, J. (2014) - Characterization of Pseudomonas syringae pv. actinidiae (Psa) isolated from France and assignment of Psa biovar 4 to a de novo pathovar: Pseudomonas syringae pv. Actinidifoliorum pv. nov. Plant Pathology, p. 1–15. [ Links ]
European Commission (2014) – Final report of an audit carried out in Portugal from 15 to 25 October 2013 in order to evaluate the situation and official controls for Pseudomonas syringae pv. actinidiae. [citado em 2014-10-09]. Disponível em: http://ec.europa.eu/food/fvo/audit_reports/details.cfm?rep_id=3257 [ Links ]
FAOSTAT (2014) - Food and Agriculture Organization of the United Nations – Statistic division. [citado em 2015-02-09]. Disponível em: http://faostat3.fao.org/home/E. [ Links ]
Gallelli, A.; Aurora, A. e Loreti, S. (2011) - Gene sequence analysis for the molecular detection of Pseudomonas syringae pv. actinidiae: developing diagnostic protocols. Journal of Plant Pathology, vol. 93, n. 2, p. 425–435. [ Links ]
INE, I.P. (2014) – Estatísticas Agrícolas 2013. Lisboa-Portugal, 129 p. [ Links ]
King, E.; Ward, M. e Raney, D. (1954) - Two simple media for the demonstration of pyocyanin and fluorescin. The Journal of laboratory and clinical medicine, vol. 44, n. 2, p. 301–307. [ Links ]
Lelliott, R.; Billing, E. e Hayward, A. (1966) - A determinative scheme for the fluorescent plant pathogenic pseudomonads. Journal of Applied Bacteriology, vol. 29, p. 470–89. [ Links ]
Le-Saux, M. (2006a) - Strain CFBP 4909. [citado em 2014-11-09]. Disponível em: http://www.straininfo.net/strains/761283/browser [ Links ]
Le-Saux, M. (2006b) - Strain CFBP 7286. [citado em 2014-11-09]. Disponível em http://www-intranet.angers.inra.fr/cfbp/resultnum_e.php?r0=7286 [ Links ]
Louws, F.; Fulbright, D.; Stephens, C. e Bruijn, F. (1994) - Specific genomic fingerprints of phytopathogenic Xanthomonas and Pseudomonas pathovars and strains generated with repetitive sequences and PCR. Applied and environmental microbiology, vol. 60, n. 7, p. 2286–2295. [ Links ]
Mohan, S. e Schaad, N. (1987) - An improved Agar Plating Assay for Detecting Pseudomonas syringae pv. syringae and P. s. pv. phaseolicola in Contaminated Bean Seed. Idaho Agricultural Experiment Station Journal, p. 1390– 1395. [ Links ]
Moura, L. (2013). O cancro bacteriano do Kiwi causado por Pseudomonas syringae pv. actinidiae. Vida Rural, p. 36–38. [ Links ]
Rees-George, J.; Vanneste, J.; Cornish, D.; Pushparajah, I.; Yu, J.; Templeton, M. e Everett, K. R. (2010) - Detection of Pseudomonas syringae pv. actinidiae using polymerase chain reaction (PCR) primers based on the 16S-23S rDNA intertranscribed spacer region and comparison with PCR primers based on other gene regions. Plant Pathology, vol. 59, n. 3, p. 453–464. [ Links ]
Sambrook, J.; Fritsch, E. e Maniatis, T. (1989) - Molecular cloning: a laboratory manual. 2ª Ed., Cold Spring Harbor, C. S. H. Laboratory, Ed. [ Links ]
Scortichini, M.; Marcelletti, S.; Ferrante, P.; Petriccione, M. e Firrao, G. (2012).- Pseudomonas syringae pv. actinidiae: a re-emerging, multi-faceted, pandemic pathogen. Molecular plant pathology, vol. 13, n. 7, p. 631–640. [ Links ]
Sneath, P. e Sokal, R. (1973) - Numerical Taxonomy: The Principles and Practice of Numerical Classification. 2ª Ed. WH Freeman and Company, San Francisco, p. 573. [ Links ]
Stead, D. (1992) - Grouping of plant-pathogenic and some other Pseudomonas spp. by using cellular fatty acid profiles. International Journal of Systematic Bacteriology, vol. 42, n. 2, p. 281–295. [ Links ]
Suslow, T. (1982) - Application of a Rapid Method for Gram Differentiation of Plant Pathogenic and Saprophytic Bacteria Without Staining. Phytopathology, vol. 72, n. 7, p. 917. [ Links ]
Takikawa, Y.; Serizawa, S.; Ichikawa, T.; Tsuyumu, S. e Goto, M. (1989) - Pseudomonas syringae pv. actinidiae pv. nov.: The causal bacterium of canker of kiwifruit in Japan. Japanese Journal of Phytopathology, vol. 55, n. 4, p. 437–444. [ Links ]
Vanneste, J.L.; Yu, J. e Cornish, D.A. (2011) - Recent advances in the characterisation and control of Pseudomonas syringae pv. actinidiae, the causal agent of bacterial canker on kiwifruit. Acta Horticulturae (ISHS) 913, p. 443-455. [ Links ]
Vanneste, J.L.; Oldham, J.M.; Clark, G. e Felman, C. M. (2013) - Survival of Pseudomonas syringae pv. actinidiae in non-kiwifruit green compost. New Zealand Plant Protection, vol. 66, p. 178–183. [ Links ]
Recebido/Received: 2015.03.06
Aceite/Accepted: 2015.05.31














