Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Acessos
Acessos
Links relacionados
-
 Similares em
SciELO
Similares em
SciELO
Compartilhar
Revista de Ciências Agrárias
versão impressa ISSN 0871-018X
Rev. de Ciências Agrárias vol.40 no.1 Lisboa mar. 2017
https://doi.org/10.19084/RCA16011
ARTIGO
Uma abordagem sobre caracterização e avaliação do potencial antioxidante de extratos fenólicos de microalgas Spirulina sp. LEB-18 e Chlorella pyrenoidosa
An approach on characteristics and potential assessment of antioxidant extracts from phenolic microalgae Spirulina sp. LEB-18 and Chlorella pyrenoidosa
Adriana R. Machado1,*, Carolina S. Graça, Leticia M. de Assis e Leonor A. de Souza-Soares
1Laboratório de Ciência de Alimentos, Escola de Química e Alimentos, Universidade Federal do Rio Grande – FURG. Avenida Itália KM.8 - Cep: 96203-900 – Rio Grande, Rio Grande do Sul, Brasil. *E-mail: adriana.rodriguesmachado@yahoo.com.br
RESUMO
O objetivo do estudo foi avaliar a composição proximal, perfil de aminoácidos, digestibilidade proteica, quantificação dos fenois individuais e totais e o efeito antioxidante dos extratos fenólicos da Spirulina LEB-18 e Chlorella pyrenoidosa frente a varios metodos. As microalgas Spirulina e Chlorella destacam-se quanto ao seu perfil nutricional e atividade antioxidante, através de diferentes mecanismos, sendo o mais importante o sequestro de radicais livres, que depende da estrutura do composto envolvido. As microalgas foram avaliadas quanto a composição proximal, aminograma, digestibilidade proteica in vitro, extração e quantificação de compostos fenólicos por cromatografia líquida de alta eficiência, como também, determinação da atividade antioxidante através do sequestro dos radicais DPPH (2,2-difenil -1-picril-hidrazil) e ABTS·+ (2,2´-azinobis(3-etilbenzotiazolina-6-ácido sulfônico)), e do sistema ß-caroteno/ácido linoleico. Conclui-se que ambas as microalgas possuem perfil completo de aminoácidos, uma boa atividade antioxidante frente aos métodos utilizados, com destaque para a Spirulina, que apresentou valores superiores comparado a Chlorella.
Palavras-chave: aminoacidos, extratos, perfil, radicais.
ABSTRACT
The object of the study was to evaluate the proximate composition, amino acid profile, protein digestibility, quantification of individual and total phenols and antioxidant effect of phenolic extracts of Spirulina LEB-18 and Chlorella pyrenoidosa front of various methods. The Spirulina and Chlorella microalgae stand out on the nutrient profile and antioxidant activity through different mechanisms, the most important being the scavenging free radicals, which depends on the structure of the compound involved. Microalgae were evaluated for proximate composition, aminogram, protein digestibility in vitro, extraction and quantification of phenolic compounds by high-performance liquid chromatography, as well as, the antioxidant activity through the kidnapping of DPPH (2,2-diphenyl -1 -picrilhidrazil) and ABTS+ (2,2'-azinobis (3-ethylbenzthiazoline sulfonic acid-6)), and ß-carotene / linoleic acid system. It is concluded that both microalgae have complete amino acid profile, a good antioxidant activity against the methods used, especially spirulina, which showed higher values compared to Chlorella.
Keywords: amino acid, extracts, profile, radicals.
INTRODUÇÃO
A procura de novas substâncias antioxidantes, especialmente de origem natural, tem sido objeto de vários estudos (Oliveira et al., 2009; Pessuto et al., 2009), como as microalgas. As microalgas representam os microrganismos fotossintéticos procarióticos (cianobactérias) denominadas algas azul-esverdeadas, e eucarióticos (algas verdadeiras), (Olaizola, 2003), e vivem, em sua maioria, em ambientes aquáticos a partir de sistemas de água doce e marinhos (Tomaselli, 1997; Pignolet et al., 2013). Sua importância na natureza deve-se principalmente à elevada participação no balanço global da fotossíntese, contribuindo com grande parcela da produção primária do planeta. No mar, cerca de 90% da fotossíntese é realizada pelas diversas microalgas que constituem o fito plâncton (Lourenço, 2006). Dentre elas destacam-se a Spirulina platensis e a Chlorella pyrenoidosa.
As microalgas dos gêneros Spirulina e Chlorella têm sido estudadas pelo seu potencial nutricional, por apresentarem principalmente elevada qualidade e quantidade de proteínas, contendo aminoácidos essenciais, vitaminas, minerais e ácidos gordos polinsaturados. Além destes compostos, suas células apresentam produtos do metabolismo secundário, que induzem efeitos fisiológicos, como, por exemplo, os compostos fenólicos (acido cafeico, clorogênico, salicílico, trans-cinâmico), tocoferol e pigmentos (carotenoides, ficocianina e clorofila), aos quais são atribuídas suas propriedades potencialmente funcionais (Parisi et al., 2009; Assis, 2012; Machado et al., 2014).
A Spirulina platensis apresenta propriedades antioxidantes, devido a presença de compostos fenólicos, favorecendo o seu uso como alimento funcional (Abedin & Taha, 2008; Souza et al., 2011; Tantawy, 2011). A microalga Chlorella é uma alga verde unicelular do grupo das clorofíceas, eucariótica, encontrada, tanto em água doce como em ambiente marinho, sendo amplamente utilizada como suplemento alimentar (Kralovec et al., 2005). Esta microalga tem demonstrado excelentes resultados no combate à hipertensão, na redução dos níveis de colesterol e pelo bom funcionamento do organismo (Souza, 2012).
Os compostos fenólicos podem ser uma alternativa promissora, e o seu perfil e mecanismos de ação é fundamental para recomendar a utilização destes compostos (Souza et al., 2015). Para a extração dos compostos fenólicos vêm sendo usadas soluções aquosas, alcoólicas, aceto-etílicas e hexânicas sob diferentes condições de interação entre solventes extratores e matriz. O conhecimento da presença destes compostos em um determinado tipo de tecido, e de seu mecanismo de atuação, além da contribuição científica pode ser subsídio para desenvolvimento de tecnologias que permitam o emprego destas substâncias para fins de produção de insumos alimentícios e medicamentos (Souza, 2012). Com isso, diversos estudos surgem sobre compostos bioativos extraídos de microalgas que têm enfatizado e demonstrado as suas atividades antioxidante, anti-inflamatória, antimicrobiana, antifúngica, citotóxica e propriedades de inibição enzimática, entre outras (Colla et al., 2007; Hajimahmoodi et al., 2010; Souza et al., 2011). Estas propriedades tornaram as microalgas alvo de usos terapêuticos para cura ou prevenção de doenças crônicas tais como diabetes, hipertensão, hipercolesterolemia e outras (Belay, 2002).
O objetivo do estudo foi avaliar a composição proximal, digestibilidade proteica, perfil de aminoácidos, quantificação dos fenois individuais e totais e o efeito antioxidantes dos extratos fenólicos da Spirulina LEB-18 e Chlorella pyrenoidosa frente a varios metodos.
MATERIAL E MÉTODOS
Obtenção e cultivo das microalgas
A microalga Spirulina LEB-18, lote 2013, foi fornecida pelo Laboratório de Engenharia Bioquímica da Universidade Federal do Rio Grande, (FURG), Brasil, e armazenada em recipientes plásticos sob refrigeração, até o momento da extração dos compostos fenólicos. A Spirulina LEB-18 foi isolada da Lagoa Mangueira e cultivada em uma planta piloto localizada próximo da costa dessa lagoa, constituída por três tanques revestidos com fibras, agitados por pás, localizados no interior de uma estufa de filme de polietileno transparente. A cultura foi adicionada aos tanques de produção, em quantidade suficiente para uma produção inicial de 10.000 L em cada tanque. As culturas foram mantidas sob luz natural no tanque por 387 dias. A biomassa de Spirulina LEB-18 foi retirada dos tanques, seca em estufa e triturada em moinho de facas (Costa et al., 2002; 2004; Morais et al., 2009). Foi utilizada a biomassa seca da microalga Chlorella pyrenoidosa, adquirida no comércio da cidade de Pelotas-RS, com granulometria das partículas de 125 µm.
Composição proximal
A amostra de Spirulina LEB-18 e Chlorella pyrenoidosa foram analisadas quanto à humidade conforme a metodologia descrita por AOAC (2000), que consiste na secagem direta em estufa com circulação de ar a 105 °C. O teor de cinzas foi determinado por método gravimétrico em mufla à temperatura de 550 ºC. O teor de proteína bruta foi determinado pelo método micro-Kjeldahl, utilizando-se como fator de conversão 4,92 para todas as amostras. O teor lipídico foi determinado utilizando o extrator de Soxhlet e éter de petróleo como solvente.
Digestibilidade proteica in vitro
A determinação da digestibilidade proteica in vitro das microalgas foi realizada de acordo com Sgarbieri (1987, 1996) e Cintra et al. (2007). Primeiramente foram pesados 1 grama de microalga seca, adicionados 10 mL de solução de pepsina 1.5 mg/mL para cada amostra, seguido de agitação em mesa agitadora orbital, TE - 141 (TECNAL), sob temperatura de 37 °C, durante 150 min. ininterruptos a 150 rpm. Adicionou-se 10 mL de solução de NaOH 0.3 N, para neutralizar o pH (Feddern et al., 2007). Posteriormente, foi realizada a centrifugação a 3220 x g por 15 min., logo se guardou o sobrenadante a 4 ºC. Em seguida adicionou-se aos precipitados 10 mL de solução de pancreatina 1.5 mg/mL em tampão fosfato pH 8.0, agitou-se em mesa agitadora, sob temperatura de 37 °C, durante 24 horas a 150 rpm. Interrompeu-se a reação em banho-maria a 100ºC/20min., centrifugou-se a 5000 rpm por 15min., a seguir foi realizada a filtração e quantificação da proteína por Folin-Ciocalteau (1:2) a 660 nm, conforme Lowry et al. (1951).
Perfil de aminoacidos
A determinação dos aminoácidos essenciais nas amostras foi realizada pela empresa CBO - Análises Laboratoriais (Campinas/SP), utilizando um analisador de aminoácidos SPC1000 adaptado para o método de derivatização pré-coluna com fenilisotiocianato PITC e quantificação por cromatografia líquida de alta eficiência (CLAE) em fase reversa, utilizando detecção em UV a 254 nm. O conjunto é constituído de desgaseificador, módulo de bomba quaternária, válvula de injeção Rheodyne, módulo de forno e modulo de detecção UV, equipado com coluna LUNA C18 100 Å 5u, 250 x 4.6 mm 00G-4252-EQ. O escore de aminoácidos foi calculado através da razão entre os valores de aminoácidos essenciais das amostras (mg/g) e valores padrão FAO/WHO (1991).
Extração dos compostos fenólicos totais
A extração dos compostos fenólicos foi realizada de acordo com Souza (2012), com adaptações, onde foram pesados 3 gramas de microalga seca, adicionados 35 mL de metanol para cada amostra, seguido de agitação em mesa agitadora orbital, TE - 141 (TECNAL), sob temperatura de 45 °C, durante 120 min ininterruptos a 230 rpm. Posteriormente, foi realizada a centrifugação a 3220 x g por 15 min, e os solventes foram evaporados em evaporador rotatório a 50 °C. Os extratos foram filtrados e clarificados com 10 mL de hidróxido de bário 0.1M e 10 mL de sulfato de zinco 5%. As soluções foram filtradas e transferidas quantitativamente para um balão volumétrico de 50 mL, sendo o volume final completado com água.
A determinação quantitativa dos compostos fenólicos nos extratos foi realizada por espectrofotometria de UV/VIS utilizando o reagente de Folin-Ciocalteau. O procedimento consistiu em tomar alíquota de 500 µL do extrato, agitar com 500 µL de água destilada e 4.5 mL de Na2CO3 4% por 1 min, colocando em banho-maria a 40 °C por 15 min. As misturas foram agitadas por 30 segundos, em banho ultra-som, com 500 µL do reagente de Folin-Ciocalteau diluído 1:2 com água destilada. Após 10 min, foi medida a absorvância das soluções em comprimento de onda de 750 nm. O teor de fenóis totais foi determinado por interpolação da absorvância das amostras, a partir de uma curva analítica construída (y=0.034x) com uma solução padrão de ácido gálico contendo 100 µg/mL, da qual foram preparadas diluições variando entre 20 e 80 µg/mL. Os resultados foram expressos como µg de equivalente de ácido gálico (AGE) / g de Spirulina platensis.
Perfil dos ácidos fenólicos
Os ácidos fenólicos das microalgas foram identificados e quantificados por cromatografia liquida de alta eficiência. Uma alíquota de 20 µL de amostra dos extratos de fenólico de Spirulina e Chlorella (diluídos em água:metanol, 1:1) foram injetadas em um cromatógrafo (Shimadzu, Tokyo, Japan, CLASS-M10A), em fluxo de 0,9 mL/minutos,103Kgf, a temperatura de 35 °C. A separação dos ácidos fenólicos foi realizada utilizando uma coluna de fase reversa C18 (4,6 x 250 mm, 5 µm) e um gradiente isocrático de solventes constituído por metanol e água acidificada (ácido acético 1%) na relação 20:80 v/v, durante 25 min, usando detecção a 280 nm até 15 min e 320 nm até 25 min. Os ácidos fenólicos foram identificados por comparação dos tempos de retenção e espectros de absorção com diversos padrões de ácidos fenólicos presentes em farelo de arroz (cafeíco, clorogênico, felúrico, gálico, hidroxibenzóico, protocatecóico e vanilina, obtidos da Sigma- Aldrich USA), conforme descrito na literatura (Zhou et al., 2004; Mira et al., 2008; Poulari et al., 2010). O limite de detecção (LOD) foi calculado pela relação sinal ruído do branco (solução contendo os solventes utilizados na extração dos compostos fenólicos) de 3:1. O limite de quantificação (LOQ) foi estabelecido como sendo três vezes o valor do LOD (Ribani et al., 2004). O método utilizado foi de acordo com Schmidt (2014), com modificações.
Determinação da atividade antioxidante (in vitro)
Sequestro do radical DPPH (2,2-difenil -1-picril-hidrazil)
A atividade antioxidante dos extratos fenólicos das microalgas foi medida utilizando procedimento descrito por Herrero et al. (2005) com modificações, monitorando-se o consumo do radical livre DPPH pela amostra, através da determinação do decréscimo da unidade de absorvância (uA) nas soluções contendo os extratos fenólicos. As medidas foram realizadas em espectrofotômetro UV-Vis (VARIAN/CARY-100) em comprimento de onda 515 nm. Aos tubos contendo 3.0 mL da solução metanólica de DPPH (5,2x10-5 mol/L) foram adicionados 0.5 mL de metanol e 0.5 mL dos extratos fenólicos na concentração de 80 mg/mL. A mistura reativa permaneceu a temperatura ambiente, sem a incidência de luz e a mudança de cor violeta para amarela foi medida após 30, min. de reação. A solução de DPPH foi preparada diariamente e estocada em frascos âmbar cobertos com folhas de alumínio, mantidas no escuro a 4 °C até o momento das determinações. A capacidade de sequestrar radical livre foi expressa como percentual de inibição de oxidação do radical e calculado conforme equação a seguir:
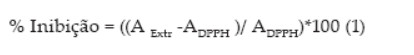
Onde ADPPH é a absorvância da solução de DPPH e A Extr é a absorvância da amostra em solução. AExtr foi calculada com base na diferença entre a absorvância da solução de amostra em teste com o seu branco.
Captura do radical ABTS·+ (2,2´-azinobis (3-etilbenzotiazolina-6-ácido sulfônico))
A capacidade de captura do radical catiônico ABTS·+ pelas amostras foi realizada de acordo com Re et al. (1999). Primeiramente, o ABTS foi dissolvido em água deionizada na concentração de 7mM (p/v), e persulfato de potássio foi adicionado na concentração de 2.45mM (p/v). O radical ABTS·+ foi gerado pela oxidação do ABTS com o persulfato de potássio. A solução foi deixada por 16h no escuro à temperatura ambiente. Após, a solução foi diluída com etanol, até alcançar uma absorvância de 0.700 ± 0.020 a 734 nm. Foram colocadas 3.0 mL de solução diluída de ABTS·+ e 30 µL dos extratos de Spirulina e Chlorella na concentração de 80 mg/mL. As medidas de absorvância foram realizadas a 734nm após 6 min de reação. Os valores foram expressos em atividade antioxidante equivalente ao Trolox (TEAC) como µM Trolox.g-1 de microalga, usando uma curva de calibração de Trolox (de 100 a 2000 µM/ml, y =-0.118x+0.818, R2 = 0.9599).
Sistema ß-caroteno/ácido linoleico
Este método foi originalmente descrito por Marco (1968) e posteriormente modificado por Miller (1971). Para o preparo da mistura reativa, adicionou-se 27µL de ácido linoleico, 0.1 mL de Tween 80 e 1 mL da solução de ß-caroteno a 0.1 mg/mL em clorofórmio. Posteriormente, a mistura foi submetida à completa evaporação do clorofórmio. A esta mistura isenta de clorofórmio, adicionou-se 50 mL de água deionizada sob vigorosa agitação. A mistura reativa apresentou-se límpida e com absorvância entre 0.6 e 0.7nm, a 470nm. O procedimento consistiu em adicionar uma alíquota de 5 mL da mistura reativa em tubos de ensaio contendo 0.5 mL dos extratos na concentração de 80 mg/mL, e a absorvância foi medida imediatamente a 470nm. Após a primeira leitura os tubos foram incubados em banho-maria a 50ºC e medido a absorvância de 15 em 15 min. até completar 120 min. Juntamente com os extratos foi realizada a leitura do branco, sendo que para o preparo da mistura reativa do branco foi adicionado somente o ácido linoleico e Tween 80. O percentual de atividade antioxidante foi determinado pela equação 2:
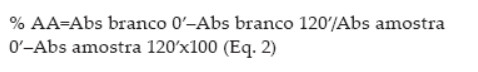
Análise estatística
Para as análises estatísticas foi utilizada a análise de variância (ANOVA), seguida do teste de Tukey com nível de significância p<0,05 (Statistica, ver. 7).
RESULTADOS E DISCUSSÃO
Composição proximal e digestibilidade in vitro
O Quadro 1 apresenta a composição proximal e a digestibilidade proteica das microalgas Spirulina LEB-18 e Chlorella pyrenoidosa.
A composição proximal determinada para as microalgas foi semelhante à encontrada por outros autores, levando-se em conta as diferenças decorrentes do tipo de cultivo e de outras variáveis abióticas (Henrikson, 1994; Colla et al., 2007; Souza et al., 2010; Souza, 2012). De acordo com Souza (2012), os dados obtidos permitem afirmar que as microalgas estudadas são basicamente constituídas por proteínas e hidratos de carbono.
Lisboa et al. (2016), confirmam, em seu trabalho com hidrolisados proteico, que a biomassa de Spirulina sp. LEB 18 tem uma alta concentração de proteína e as condições requeridas para crescimento podem ser alteradas para estimular uma concentração mais elevada deste bioproduto, a concentração obtida por estes autores foi 51.66%, semelhante a este estudo (Quadro 1). Os valores de humidade, cinzas e lipídios encontrados neste trabalho para a Spirulina LEB-18 foram superiores aos obtidos por Assis (2012) para a mesma microalga, que foram de 5.3%, 6.7% e 3.3%, para estes teores, respectivamente. Para Chlorella pyrenoidosa os teores encontrados de proteína, e lipídios, conforme o Quadro 1, foram inferiores aos encontrados por Varandas et al. (2015) que obtiveram teor de lipídos de 8% e de proteína de 68.2%. Essas diferenças encontradas nos resultados desta pesquisa comparados com outros estudos se devem as alterações atribuídas às condições do cultivo e/ou às características genéticas da linhagem de Chlorella estudada.
A digestibilidade proteica é medida pela quantidade de proteína hidrolisada pelas enzimas digestivas até aminoácidos, portanto, disponível para a absorção como aminoácidos pelo organismo animal ou humano (Sgarbieri, 1987). As paredes celulares da Spirulina, assim como da Chlorella, são similares às das bactérias gram-positivas, consistindo no polissacarídeo glicosamina e em ácido murâmico, associados a peptídeos, não contendo celulose como as macroalgas. Os polissacarídeos extracelulares ou exopolissacarídeos (EPS), sintetizados por cianobactérias, podem ser facilmente recuperados e possuem alto potencial de utilização pela indústria farmacêutica, cosmética e alimentícia como estabilizantes, emulsificantes e espessantes (De Philippis & Vincenzini, 1998).
Perfil de aminoácidos das microalgas
No Quadro 2 encontram-se os perfis de aminoácidos e o teor de proteína total realizado por cromatografia de alta eficiência..das microalgas Spirulina LEB-18 e Chlorella pyrenoidosa.
Pode-se observar que os aminoácidos essenciais das proteínas das microalgas Spirulina LEB-18 e Chlorella pyrenoidosa, respectivamente com percentuais mais pronunciados, foram Leucina (4.96 %; 4.75%), Lisina (2.85%; 4.16%); Valina (3.64%; 3.29%); Fenilalanina (2.61%; 2.81%), Treonina (2.65%; 2.40%) e Isoleucina (2.22%; 2.21%). Já os aminoácidos essenciais com índices químicos menores foram metionina (1.01%; 1.13%) e triptofano (0.77%; 0.46%). A carência em aminoácidos sulfurados e lisina é característica do perfil aminoacídico de algas verdes azuis (Jacob-Lopes et al., 2006; Volkmann et al., 2008), como a Spirulina.
Assim os resultados obtidos corroboram os estudos efetuados por Carvajal (2009) sobre a caracterização e modificações químicas da proteína da microlaga Spirulina máxima e Habib et al. (2008), para a Spirulina cultivada na Tailândia e Malásia. Ambos os autores descrevem a leucina como um dos aminoácidos essenciais de maior índice e a metionina e triptofano, com menores índices.
Portanto, de acordo com o Quadro 2 os dados estão conforme as recomendações da FAO/WHO/UNU (1991), para as quantidades necessárias de aminoácidos do adulto, em comparação ao conteúdo de aminoácidos na amostra deste estudo, todos os aminoácidos encontram-se em quantidades maiores que as recomendações nutricionais.
As microalgas têm sido estudadas em pesquisas biotecnológicas devido à sua importância nutricional, econômica e ecológica (Costa et al., 2006). Estudos nutricionais mostram que esses microrganismos têm um dos mais altos teores de proteína já encontrado, boa digestibilidade e todos os aminoácidos essenciais nas proporções recomendadas pela FAO (Avila-Leon, 2010).
No Quadro 2, também se encontra a determinação de proteína das microalgas que foram realizadas por cromatografia liquida de alta eficiência (CLAE), para termos comparativos com o método Kjeldahl (Quadro 1), confirmando o alto conteúdo proteico destas microalgas. Com isso é possível afirmar que a microalga Spirulina LEB-18, assim como Chlorella pyrenoidosa, ambas tem sido amplamente estudadas devido aos seus altos teores de proteína, contendo todos os aminoácidos essenciais e não essenciais (Quadro 2), para o crescimento humano e saúde, com a presença de metionina, aminoácido ausente na maioria das microalgas e algas (Rodrigues, 2008; Lisboa et al., 2016). As espécies Spirulina platensis e Spirulina máxima são as mais estudadas para uso na alimentação humana por apresentarem um perfil nutricional que as torna ideais como suplemento alimentar, pois substituem satisfatoriamente as fontes artificiais de nutrientes, por combinar diversos constituintes de maneira equilibrada. Estes constituintes incluem proteínas de alta qualidade, vitaminas do complexo B, minerais, antioxidantes ß-caroteno e vitamina E (Ambrosi et al., 2008).
Perfil dos ácidos fenólicos das microalgas
No Quadro 3 estão apresentados os valores de tempos de retenção (tR), curvas analíticas e correlação dos padrões avaliados. O teor de fenóis individuais e totais dos extratos, avaliado por cromatografia líquida de alta eficiência, está apresentado no Quadro 4.
De acordo com o Quadro 3 todas as curvas apresentaram valores de correlação que possibilitaram quantificação confiável das amostras na faixa de linearidade determinada no instrumento.
Os métodos cromatográficos são um grupo de técnicas de separação de misturas, de modo que o mesmo instrumento faz a separação dos analitos contidos na amostra e sua quantificação (Doua e Gibala, 2010; Barros et al., 2011; Zhang et al., 2011). O processo da quantificação funciona, basicamente, pela adsorção do analito de interesse na fase estacionária. O tempo de retenção permite a separação das várias substâncias que compõe a amostra: analito(s) e interferentes. A atividade antioxidante de alimentos é basicamente determinada por compostos fenólicos.
O método cromatografia liquida de alta eficiência (CLAE) é bastante sensível e pode ser usado como uma ferramenta valiosa no controle de qualidade para a determinação rápida da atividade antioxidante de uma variedade de produtos incluindo extratos de plantas, alimentos, drogas e formulações que contenham poliherbais (Chandrasekar et al., 2006).
Conforme o Quadro 4, os ácidos fenólicos encontrados para a microalga Spirulina LEB-18, foram ácidos gálico (18.00 µg/g), ácido protocatecoico (15.25 µg/g) e ácido clorogênico (4.5 µg/g), justifica-se a pequena quantidade de ácidos fenólicos presentes devido ao lote de 2013, onde o mesmo foi seco em temperatura elevada, alterando os constituintes fenólicos. Contudo, para o extrato fenólico de Chlorella pyrenoidosa foi encontrado apenas o ácido Protocatecoico (9.75 µg/g), podendo ser justificado pelas condições de cultivo.
Em pesquisas com Spirulina platensis diversos estudos consideram-na uma excelente fonte de ácidos fenólico, incluindo o ácido cafeico, o ácido clorogénico, salicílico, ácido sináptica, e o ácido trans-cinâmico (Colla et al., 2007); Já Souza et al., (2015), afirma que as concentrações dos ácidos fenólicos presentes em Spirulina platensis em extrato bruto determinada por CLAE-UV foram 396; 347; 54.0 e 3.5 para ácido gálico, ácido caféico, ácido salicílico e o ácido trans-cinâmico, respectivamente, totalizando 801 mg/g ácidos fenólicos livres.
De acordo com Souza (2012), durante as determinações do conteúdo total de fenóis são quantificadas todas as substâncias que possuem ao menos um anel fenólico, enquanto que no método por cromatografia líquida são quantificados apenas os compostos possíveis de serem separados e quantificados dentro dos limites de detecção do método adotado.
Para a quantidade de compostos fenólicos totais a concentração foi determinada por espectrofotometria obtendo para cada microalga avaliada 10.92x103 µg AGE/g para Spirulina LEB-18 e 9.10 x103 µg AGE/g para Chlorella Pyrenoidosa. Esta análise foi baseada na reação dos grupos fenólicos com reagente de Folin-Ciocalteau. As diferenças qualitativas e quantitativas na mesma espécie podem ser devido ao efeito de abióticos e bióticos variáveis, que são determinantes da produção de compostos metabólicos com os extratos fenólicos (Souza et al., 2015).
Hajimahmoodi et al. (2010) obtiveram para Chlorella vulgaris valores da ordem de 0.02 a 0.49 (mg AGE/g) para a fração hexânica, 0.02 a 3.59 (mg AGE/g) para a fração aceto-etílica e 3.69 a 19.14 (mg AGE/g) para a fração aquosa. Fato que também demonstra que o conteúdo de compostos fenólicos é fortemente dependente do tipo de solvente extrator.
Li et al. (2007) estudaram o conteúdo de fenóis totais e a atividade antioxidante em µmol Trolox/g das microalgas Chlorella protothecoides, Chlorella pyrenoidosa e Chlorella vulgaris em três sistemas de solventes (hexano, acetato de etila e água), encontrando valores de conteúdo fenólico variando de 0.97 a 2.67 (mg AGE/g) para os extratos aquosos; 1.6 a 8.12 (mg AGE/g) para extratos aceto-etilícos e de 3.12 a 14.35 (mg AGE/g) para os extratos hexânicos.
A quantificação de compostos fenólicos totais de Chlorellla sp. de acordo com o estudo de Baracho et al. (2015), variou de 5 a 12 mg de ácido gálico equivalente (AGE) /g de extrato.
Os resultados de Souza (2012), em seu trabalho para a Chlorella sp. também foram inferiores (0.60 mg/g) aos mencionados pelos autores que utilizaram solventes e condições de cultivo distintas. Como também, Assis et al. (2014), encontraram valores inferiores (0.69 mg/g) a este estudo para extratos fenólicos de Chlorella.
As cianobactérias ou microalgas também têm sido destaque nas indústrias de alimentos para produção de compostos antioxidantes (Richa et al., 2011). A atividade antioxidante de um determinado extrato pode estar relacionada com o conteúdo de compostos fenólicos totais conforme tem sido demonstrado em vários estudos, como os de Colla et al. (2007) e Estrada et al. (2001).
Atividade antioxidante
A Figura 1 apresenta a avaliação da atividade antioxidante de extratos de Spirulina LEB-18 e Chlorella pyrenoidosa frente aos radicais DPPH e ABTS, e ao sistema ß-caroteno/ácido linoleico.
Os métodos DPPH e ABTS são caracterizados por excelente reprodutibilidade em condições certas de ensaio, mas eles também mostram diferenças significativas na sua resposta aos antioxidantes (Assis, 2012).
As respostas deste trabalho assemelham-se às de Vieira et al. (2009) que obteve a mesmas características com relação ao solvente metanol em relação à extração dos compostos fenólicos do pó de erva-mate.
Os radicais livres de DPPH, que inicialmente apresentam cor roxa por possuírem elétron livre, perdem esta cor quando um radical hidrogênio doado por uma molécula antioxidante entra em ressonância com a molécula de DPPH, diminuindo a absorvância. O DPPH é um radical estável, com baixa taxa de deterioração e possui reatividade com a maioria dos compostos. Apenas reagentes redutores fortes são capazes de reagir com estes radicais estáveis estequiometricamente. A baixa absorvância indica atividade sequestrante de radicais livres (Santos et al., 2007).
Sudha et al. (2011) estudou a atividade antioxidante da amostra Spirulina platensis na concentração de 15 mg/ml que exibiu 51.94 % da atividade de eliminação de DPPH.
Custódio et al. (2012), obteve 35.2% de ASR com a utilização de extratos metanólicos (10 mg/ml) para microalga minutíssima. Assis (2012) encontrou 28.65% de ARS com a utilização de extratos metanólicos na concentração de 8.42 mg/mL para microalga Chlorella pyrenoidosa. Estes valores foram superiores aos encontrados neste estudo em diferentes tempos, com a utilização de extratos metanólicos de Spirulina LEB-18 e Chlorella pyrenoidosa.
Estudos com outras espécies verificaram a capacidade antioxidante de extratos aquosos de várias espécies como cianobacterias que apresentaram percentagens de inibição de DPPH entre 50-75%, (Shanab et al., 2012). Xia et al. (2013) também realizaram um estudo sobre a produção, caracterização e atividade antioxidante pelo método de DPPH de fucoxantina obtida da diatomácea Odontella aurita e obtiveram percentagens de inibição de DPPH entre 15-70% dependendo da concentração de fucoxantina (0.02- 0.2mg/mL). Isto significa que compostos antioxidantes obtidos diversas fontes de microalga são efetivos para captura de radicais. Porém, Cepoi (2009) não encontrou, proporcionalmente, maior atividade sequestradora do radical ABTS+, na medida em que, aumentou a concentração do solvente em extratos etanólicos de Spirulina platensis. Logo, Chu et al. (2010) encontraram forte capacidade do extrato aquoso de Spirulina em reduzir significativamente a morte celular induzida por radicais livres DPPH· e ABTS+, como também, uma atividade do extrato bruto muito mais elevada do que os compostos bioativos (ficocianina) isoladamente, sugerindo que uma mistura de compostos é mais ativa do que um único composto puro.
O resultado encontrado, em relação à capacidade antioxidante, determinada pelo método ABTS, foi, em média, 71.75±0.49 (µM Trolox.g-1 de microalga), para Chlorella pyrenoidosa e 85.77±0.29 (µM Trolox.g-1 de microalga), para a Spirulina.
Segundo Christ-Ribeiro et al. (2013), afirmaram que os compostos fenólicos de seu estudo apresentaram para o método de ABTS a inibição de 18 µM Trolox.g-1 de microalga na concentração de 4.25 µg/mL de extrato de microalga Spirulina LEB- 18, sendo este valor inferior ao deste estudo, isto pode ser possível devido as variações das condições de produção desta microalga em diferentes épocas do ano.
Pesquisas realizados por Pereira et al. (2015), com hidrolisados proteicos de Chlorella avaliando a atividade antioxidante frente à captura de radicais livre através dos métodos DPPH e ABTS foram eficazes, ocorrendo um aumento da atividade antioxidante obtendo respectivamente 26.14 e 47.27%.
De acordo com Figura 1, verifica-se que a atividade antioxidante utilizando o sistema ß-caroteno/ácido linoleico, onde o teor de inibição foi maior para extratos fenólicos de Spirulina, significando maior capacidade de inibir a peroxidação do ácido linoleico. O ß-caroteno é o caroteno mais abundante nos alimentos e o mais interessante economicamente, pois apresenta maior atividade vitamínica (Ambrosio et al., 2006). É o único carotenóide que apresenta dois radicais ß-ionona, que ao se romper forma duas moléculas de pró-vitamina A.
Baky et al. (2008) encontraram valores de 87.43%, 92.18 e 89.58 para extratos de Spirulina maxima (diclorometano:metanol (1:1)), BHT e BHA, respectivamente, quanto à capacidade de inibição da peroxidação lipídica, utilizando o mesmo método.
Um estudo in vitro e in vivo conduzido com Spirulina (Arthrospira) revelou a sua ação antioxidante, devido à presença de compostos como ácido fenólico, tocoferóis e ß-caroteno nesta microalga, que são conhecidos por exibirem propriedades antioxidantes. Por outro lado, proteção contra o cancro e o envelhecimento tem sido atribuída a compostos bioativos da Spirulina, mas a sua ação é mais evidente quando é utilizado todo o extrato da microalga em vez de apenas ß-caroteno isoladamente. Isto mostra a possibilidade da existência de efeitos sinergéticos entre os compostos do extrato de Spirulina (Miranda et al., 1998).
Pode-se considerar que substâncias naturais são responsáveis pelo efeito de proteção contra os riscos de muitos processos patológicos, os resultados descritos neste trabalho estimulam a continuidade dos estudos para avaliar a ação antioxidante das microalgas Spirulina LEB-18 e da Chlorella pyrenoidosa.
CONSIDERAÇÕES FINAIS
Os extratos das microalgas analisados neste estudo apresentaram o elevado teor de proteínas com o perfil completo de aminoácidos, como também a atividade antioxidante significativa, demonstrando possível aplicabilidade de seu emprego como antioxidantes naturais.
Agradecimentos
Ao apoio financeiro a FUNDAÇÃO DE AMPARO A PESQUISA DO ESTADO DO RIO GRANDE DO SUL-FAPERGS-Edital 18/2012-PROGRAMA PESQUISADOR VISITANTE SÊNIOR com recursos financeiros e bolsa para Profª. Drª.: Leonor A. Souza-Soares e bolsa de doutoramento para Adriana Rodrigues Machado e ao CONSELHO NACIONAL DE PESQUISA-CNPQ, através da bolsa de iniciação cientifica concedida a Carolina Graça.
REFERÊNCIAS BIBLIOGRÁFICAS
Abedin, R.M.A. & Taha, H.M. (2008) - Antibacterial and antifungal activity of cyanobacteria and green microalgae, evaluation of medium components by Plackett-Burmann Design for antimicrobial activity of Spirulina platensis. Global Journal of Biotechnology & Biochemistry, vol. 3, n. 1, p. 22-31. [ Links ]
Ambrosi, M.A.; Reinehr, C.O.; Bertolin, T.E.; Costa, J.A.V. & Colla, L.M. (2008) - Propriedades de saúde de Spirulina spp. Revista de Ciências Farmarcêuticas, Básica Aplicada, vol. 29, n. 2, p. 109-117. [ Links ]
Ambrosio, C.L.B.; Campos, F.A.C.S. & Faro, Z.P. (2006) - Carotenoides como alternativa contra a hipovitaminose A. Revista de Nutrição, vol. 19, n. 2, p. 233-243. http://dx.doi.org/10.1590/S1415-52732006000200010 [ Links ]
AOAC (2000) - Official Methods of analysis international, 17 th, CD-ROM, Willian Horwitz. Association of Official Analytical Chemists. [ Links ]
Assis, L.M. (2012) - Atividade antioxidante de extratos de microalgas Spirulina LEB-18 e Chlorella pyrenoidosa e estudo da sua nanoencapsulação em lipossomas. Tese de doutoramento. Universidade Federal do Rio Grande. Rio Grande, Rio Grande do Sul. 85 p. [ Links ]
Assis, L.M.; Machado, A.R.; Motta, A.S.; Costa, J.A.V. & Souza-Soares, L.A. (2014) - Development and characterization of nanovesicles containing phenolic compounds of microalgae Spirulina strain LEB-18 and Chlorella pyrenoidosa. Advances in Materials Physics and Chemistry, vol. 4, n. 1, p. 6-12. http://dx.doi.org/10.4236/ampc.2014.41002 [ Links ]
Avila-Leon, I.A. (2010) - Estudo do cultivo de Spirulina platensis por processo contínuo com uréia como fonte de nitrogênio. Dissertação de Mestrado em Tecnologia Bioquímico-Farmacêutica, Universidade de São Paulo, São Paulo. 99 p. [ Links ]
Baky, E.; Hanaa, H.; Baz, E.; Farouk, K.; Baroty, E. & Gamal, S. (2008) - Caracterização de compostos nutracêuticos em azul alga Spirulina maxima verde. Journal of Medicinal Plants Research, vol. 2, n. 10, p. 292-300. [ Links ]
Belay, A. (2002) - The potential application of Spirulina (Arthrospira) as a nutritional and therapeutic supplement in health management. Journal of the American Nutraceutical Association, vol. 5, n. 2, p. 27-48. [ Links ]
Barros, L., Dueñas, M., Ferreira, I.C.F.R., Maria C.A. & Santos-Buelga, C. (2011) - Use of HPLC-DAD-ESI/MS to profile phenolic compounds in edible wild greens from Portugal. Food Chemistry, vol. 127, n. 1, p. 169-173. http://dx.doi.org/10.1016/j.foodchem.2011.01.009 [ Links ]
Costa, J.A.V.; Colla, L.M. & Duarte Filho, P. (2004) - Spirulina platensis growth in open raceway ponds using fresh water supplemented with carbon, nitrogen and metal ions. Zeitschrift für Naturforschung, vol. 58, p. 76-80. http://dx.doi.org/10.1515/znc-2003-1-214 [ Links ]
Costa, J.A.V.; Morais, M.G.; Dalcanton, F.; Reichert, C.C. & Durante, A.J. (2006) - Simultaneous cultivation of Spirulina platensis and the toxigenic cyanobacteria Microcystis aeruginosa. Zeitschrift für Naturforschung, vol. 61, n. 1-2, p. 105-110. http://dx.doi.org/10.1515/znc-2006-1-219 [ Links ]
Custódio, L.; Justo, T.; Silvestre, L.; Barradas, A.; Duarte, C.V.; Pereira, H.; Barreira, L.; Rauter, A.P.; Alberício, F. & Varela, J. (2012) - Microalgae of different phyla display antioxidant, metal chelating and acetylcholinesterase inhibitory activities. Food Chemistry, vol. 131, n. 1, p. 134-140. http://dx.doi.org/10.1016/j.foodchem.2011.08.047 [ Links ]
De Philippis, R. & Vincenzini, M. (1998) - Exocellular polysaccharides from cyanobacteria and their possible applications. FEMS Microbiology Reviews, vol. 22, n. 3, p. 151-175. http://dx.doi.org/10.1111/j.1574-6976.1998.tb00365.x [ Links ]
Doua, M. & Gibala, P. (2010) - Fast HPLC method using ion-pair and hydrophilic interaction liquid chromatography for determination of phenylephrine in pharmaceutical formulations. Journal of AOAC International, vol. 93, n. 5, p. 1436-1442. [ Links ]
Estrada, J.E.P.; Bescós, P.B. & Villar Del Fresno, A.M. (2001) - Antioxidant activity of different fractions of Spirulina platensis protean extract. Il Farmaco, vol. 56, n. 5-7, p. 497-500. http://dx.doi.org/10.1016/S0014-827X(01)01084-9 [ Links ]
Hajimahmoodi, M., Faramarzi, M.A., MohammadI, N., Soltani, N., Oveisi, M.R. & Nafissi-Varcheh, N. (2010) - Evaluation of antioxidant properties and total phenolic contents of some strains of microalgae. Journal Applied Phycology, vol. 22, p. 43-50. http://dx.doi.org/10.1007/s10811-009-9424-y [ Links ]
Recebido/received: 2016.01.25
Recebido em versão revista/received in revised form: 2016.04.09
Aceite/accepted: 2016.04.09














