Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Acessos
Acessos
Links relacionados
-
 Similares em
SciELO
Similares em
SciELO
Compartilhar
Revista de Ciências Agrárias
versão impressa ISSN 0871-018X
Rev. de Ciências Agrárias vol.41 no.spe Lisboa dez. 2018
https://doi.org/10.19084/RCA.17076
ARTIGO
Controlo de Sclerotinia homoeocarpa em relva com compostos orgânicos
Sclerotinia homoeocarpa control on turfgrass with organic composts
Luísa Coelho1,2,3*, Lídia Dionísio1,2, Carlos Guerrero1,2 e Mário Reis1,2
1 Universidade do Algarve, Campus de Gambelas 8005-139 Faro Portugal
2 MeditBio, Universidade do Algarve. Campus de Gambelas, 8005-139 Faro
3 ICAAM, University of Évora, Núcleo da Mitra apartado 94 7006-554, Évora
(*E-mail: lcoelho6@gmail.com)
RESUMO
Os relvados são suscetíveis a doenças causadas por fungos, sendo Sclerotinia homoeocarpa um dos que causa maiores prejuízos em muitos países. A compostagem permite a valorização e tratamento de resíduos orgânicos, originando compostos com aplicações agrícolas, nomeadamente para controlo de doenças causadas por patogénicos do solo. Produziram-se dois compostos, designados P1 e P2, por compostagem de resíduos agroindustriais, em pilhas com arejamento por reviramento. Desde o final da fase termofílica até ao final dos processos de compostagem recolheram-se amostras onde se isolaram e identificaram fungos presentes em ambos os compostos. Dos isolados, 26 apresentaram potencial antagonista, sendo 12 provenientes de P1 e 14 de P2. Realizaram-se ensaios in vitro, pelo método de confrontação direta, para avaliar a capacidade antagonista destes fungos para S. homoeocarpa. Doze dos isolados, dos géneros Trichoderma, Fusarium e Bionectria, impediram o crescimento de S. homoeocarpa, com taxas de inibição entre 52 e 68%. Os compostos obtidos foram também testados, in vivo, em relva (Agrostis stolonifera L.) cultivada em vaso. No cultivo em vaso, usando os compostos como substratos, verificou-se redução da área de relva afetada pela doença, principalmente em P2. Os compostos testados controlaram S. homoeocarpa tanto in vitro como em vaso destacando-se o composto P2.
Palavras-chave: antagonista, biocontrolo, compostagem, sustentabilidade, Agrostis stolonifera L.
ABSTRACT
Turfgrass is susceptible to several fungal diseases, being Sclerotinia homoeocarpa, the causal agent of dollar spot, which causes the greatest turfgrass losses in several countries. Composting allows the valorization and treatment of organic wastes, producing organic composts with agricultural applications as soil amendments and as biological control agents of soil-borne diseases. Two composts were produced, P1 and P2, through the composting of agro-industrial wastes in piles with mechanical turning. From the end of the thermophilic phase until the end of the composting process, fungi from both composts were isolated and identified. From the isolates, twenty-six showed potential antagonistic activity, being 12 from P1 and 14 from P2. Their antagonistic capacity was evaluated using the method of direct confrontation. From the isolates, 12 of them, belonging to the genus Trichoderma, Fusarium and Bionetria, prevented S. homoeocarpa growth and development on turfgrass, with a disease inhibition rate between 52 and 68%. Both composts were also tested as substrates for turfgrass (Agrostis stolonifera L.). In the in vivo trials, the area of turfgrass with disease decreased, particularly in the pots containing P2 compost. The tested composts effectively controlled S. homoeocarpa growth both in vitro and in the pot trials, especially the P2 compost.
Keywords: antagonist, biocontrol, composting, sustainability, Agrostis stolonifera L.
INTRODUÇÃO
A compostagem é um processo biológico controlado, durante o qual a atividade microbiana permiteconverter resíduos diversos num produto final estável, de mais fácil aplicação em agricultura (Barker, 2001; Batista e Batista, 2007). Durante a fase termofílica atingem-se temperaturas elevadas que reduzem ou eliminam a presença de alguns agentes patogénicos (Day e Shaw, 2005). Terminada esta fase, o composto é recolonizado por organismos mesofílicos, nomeadamente: fungos, bactérias, entre as quais actinomicetes, protozoários e nemátodes. Entre estes organismos figuram antagonistas ou agentes de controlo biológico que, colonizando os compostos, podem contribuir para a proteção das plantas, prevenindo, reduzindo ou controlando o desenvolvimento de agentes patogénicos do solo. Esta propriedade, manifestada por alguns compostos e conhecida por capacidade supressiva, permite proteger plantas suscetíveis a determinados agentes patogénicos, mesmo na presença destes (Pane e Zaccardelli, 2014; Reis, 2016). A capacidade supressiva pode ser devida à competição por nutrientes, antibiose ou hiperparasitismo (Hoitink et al., 1997). A compostagem de resíduos ricos em quitina favorece o crescimento de organismos com capacidade para a degradar, reforçando o potencial supressivo dos compostos (Sharp, 2013).
O Algarve é uma região reconhecida como sendo o melhor destino de golfe da Europa, com cerca de 2000 ha de relvados. É importante manter os relvados em boas condições fitossanitárias e reduzir o uso de pesticidas, devido não só aos problemas ambientais que a sua aplicação acarreta, mas também devido ao contacto direto com jogadores e as equipas de manutenção dos relvados. Paralelamente, a aplicação da Diretiva n.º 2009/128/CE, do Parlamento Europeu e do Conselho, de 21 de outubro, através da Lei n.º 26/2013 de 11 de abril, reduziu significativamente a quantidade de substâncias ativas homologadas, disponíveis para a aplicação em relvados.
Sclerotinia homoeocarpa é um fungo fitopatogénico que, a temperaturas entre 15 e 30 ºC e humidade relativa elevada, pode causar uma doença nos relvados, vulgarmente conhecida por “dollar spot”, caracterizada pelo aparecimento de manchas dispersas de pequeno diâmetro (Walsh et al., 1999). O corte frequente do relvado contribui para o desenvolvimento do micélio do fungo, e a sua disseminação faz-se através do equipamento de manutenção do campo, pessoas, animais e água (Walsh et al., 1999). Antes de se recorrer à luta química, o controlo de pragas e doenças deverá passar por diferentes meios de luta, onde a aplicação de compostos orgânicos desempenha um papel importante como medida ecológica e sustentável para a proteção das plantas. Os compostos orgânicos, através da atividade dos microrganismos que transportam ou que estimulam no solo, são uma solução alternativa e atrativa de controlo biológico, reduzindo a utilização de produtos fitofarmacêuticos (Barker, 2001; Trillas et al., 2006; Sant et al., 2011).
Neste trabalho estudou-se a capacidade supressiva de dois compostos orgânicos, provenientes de resíduos agroindustriais, tendo-se isolado e identificado fungos potencialmente antagonistas e testado o seu efeito in vitro. Estudou-se também a capacidade supressiva dos compostos obtidos na cultura de relva em vaso.
MATERIAL E MÉTODOS
Obtenção dos compostos
Obtiveram-se dois compostos, designados por P1 e P2, através da compostagem de resíduos agroindustriais, em pilhas com arejamento por reviramento. O composto P1 resultou da compostagem de laranjas, aparas de relva e bagaço de uva, na proporção de 0,9:1,1:1 (v/v), e o P2 da compostagem de uma mistura com os mesmos resíduos, mas à qual se adicionou o resíduo da produção de cogumelos (0,5 v/v), rico em quitina, obtendo-se a proporção de 1,8:0,2:1,5:0,5 (v/v). Durante a compostagem monitorizaram-se parâmetros físico-químicos das misturas. A temperatura foi medida diariamente na zona central das pilhas (Sonda TP 62, Umwelt Elektronik GmbH & Co.KG, Alemanha); o pH foi medido em extrato aquoso (1:2 p/v) com potenciómetro (Crison Micro pH 2001, Espanha), e a condutividade elétrica (CE) foi medida no mesmo extrato após filtração, com condutivímetro (Crison 522, Espanha). Determinaram-se os teores de matéria orgânica (Ramos et al., 1987), de matéria seca (Martinez, 1992), de azoto Kjeldhal e calculou-se a relação C/N. A nível microbiológico, contou-se o número de unidades formadoras de colónias (ufc) de fungos, bactérias heterotróficas, actinomicetes, organismos celulolíticos e quitinolíticos. Para a quantificação dos fungos usou-se o meio Potato Dextrose Agar (PDA), para as bactérias heterotróficas Plate Count Agar (PCA) e para actinomicetes o meio PCA com metade da concentração recomendada pelo fabricante (1/2 PCA). As culturas de fungos, bactérias heterotróficas e actinomicetes foram incubadas a duas temperaturas: 25 ± 1 e 55 ± 1 °C, durante 24 horas. Os microrganismos quitinolíticos aeróbios foram isolados em Meio Mineral Salino (MSM) sólido com adição de quitosano, durante 5 dias a 28 ± 1 °C, e os celulolíticos aeróbios em MSM líquido (Alfano et al., 2011), durante 15 dias a 37 ± 1 °C. Para avaliar a qualidade agronómica dos compostos fizeram-se testes de fitotoxicidade (Zucconi et al., 1985), aos 42, 77 e 112 dias de compostagem com mastruço (Lepidum sativum L.) como planta indicadora.
Isolamento de antagonistas
Desde o final da fase termofílica até ao final da compostagem foram isolados e identificados os fungos dos compostos com eventual capacidade antagonista. Para tal, estes microrganismos, foram repicados sucessivamente, até à obtenção das suas culturas puras. Por macro e microscopia observaram-se as caraterísticas culturais e morfológicas para identificação dos géneros a que pertenciam os fungos isolados dos compostos. Os isolados que apresentaram potencial antagonista foram numerados de 1 a 26. A identificação a nível das espécies dos fungos com maior capacidade de inibição de S. homoeocarpa, foi realizada através de técnicas de biologia molecular. Procedeu-se à extração do DNA do micélio cultivado em meio PDA. As amostras do DNA obtido foram submetidas à Reação em Cadeia da Polimerase (PCR) usando os primers ITS1 e ITS4 (White et al., 1990), sendo o produto obtido posteriormente sequenciado.
Ensaios de antagonismo in vitro
Para avaliar a capacidade antagonista dos microrganismos isolados, usou-se como agente patogénico um isolado de S. homoeocarpa cedido pela Universidade de Sevilha. Os ensaios efetuaram-se em placas de Petri contendo PDA, pelo método de confronto direto, usando-se para o efeito dois discos com 6,5 mm de diâmetro: um com micélio do agente patogénico e o outro com micélio do antagonista, distanciados 3 cm entre si. Para determinar a percentagem de inibição (IP) em PDA foram também colocados discos de 6,5 mm de cada fungo, que cresceram isoladamente. Diariamente, mediram-se os raios das zonas de crescimento de cada fungo, para determinação da percentagem de inibição, de acordo com a fórmula (1):
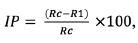 (1)
(1)
em que:
Rc = raio da zona de crescimento, em mm, do patogénico que cresceu isoladamente;
R1 = raio da área de crescimento, em mm, do patogénico que cresceu na presença do antagonista.
No final do ensaio avaliou-se o tipo de interação entre as colónias, de acordo com Magan e Lacey (1984).
Ensaios de supressividade dos compostos orgânicos in vivo
Para avaliar a capacidade supressiva dos compostos obtidos (P1 e P2), usou-se como controlo turfa loira, T (Hansa Torf, Floragard, Alemanha). O delineamento experimental consistiu em blocos completos casualizados, com quatro repetições e seis substratos (modalidades): P1, P2, T e P1t, P2t e Tt, tendo sido os últimos três sujeitos a tratamento térmico (t) a 60 °C durante 7 dias, com o objetivo de eliminar os microrganismos e comprovar a origem biológica da supressividade. Cada substrato foi colocado em vasos de 100 mL (5 vasos por modalidade) e semeado com relva (Agrostis stolonifera L.) numa densidade correspondente a 10 g de semente m-2. Quando a relva ocupou toda a superfície dos vasos, procedeu-se à inoculação com um disco com o micélio de S. homoeocarpa (6,5 mm de diâmetro), cultivadoem meio PDA durante 7 dias. As plantas foram observadas, diariamente, para deteção dos sintomas iniciais da doença e, a partir daí, semanalmente, para determinação da incidência da doença [(número de vasos afetados pela doença/número total de vasos) x 100] e da sua severidade, calculada através da área afetada. Para determinar a área ocupada pela doença comparou-se a área afetada utilizando uma quadrícula inscrita em folha de acetato transparente, com 0,5 cm de lado. Contou-se o número de quadrículas correspondentes à área de expansão da doença e expressou-se a área afetada em cm2. A severidade da doença foi determinada a partir da área afetada, de acordo a escala definida por Baayen e Van der Plas (1992), onde: 0 = sem sintomas (0 % de área afetada); 1 = muito pouco infetada (até 5 % de área afetada); 2 = pouco infetada (≥ 5 e < 20 %); 3 = sintomas bem desenvolvidos (≥ 20 % e < 50 %); 4 = sintomas de doenças fortes em toda a área (≥ 50 % e < 80 %); 5 = área totalmente afetada (≥ 80 % e ≤ 100 %). Determinou-se a variável Área sob a curva de progresso da doença (AUDPC, area under disease progress curve) por vaso, usando a Severidade da doença entre o aparecimento dos sintomas e o final do ensaio, e dividindo pelo número de dias, de acordo com a fórmula:
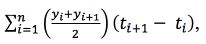 (2)
(2)
em que:
y = severidade da doença
t = tempo (dias)
No final do ensaio, para cada modalidade, foram quantificadas as populações de Trichoderma spp. e de Sclerotinia spp., em meios de cultura semi-seletivos, de acordo com Chung e Hoitink (1990) e Steadman et al. (1994), respetivamente, registando-se também o pH e CE dos substratos.
Analise estatística
As características dos compostos foram sujeitas a uma análise de comparação de médias e ao teste t-student. Os resultados dos ensaios in vitro e in vivo foram sujeitos a uma análise da variância e ao teste de comparação de médias de Duncan (Field, 2009), através do programa de estatística SPSS® (versão 20,0, SPSS Inc.).
RESULTADOS E DISCUSSÃO
Características dos compostos obtidos
Propriedades físico-químicas
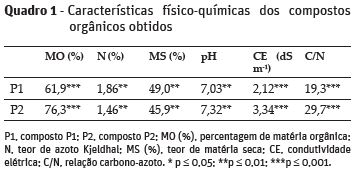
Os compostos obtidos apresentaram teores elevados de matéria orgânica, superiores a 60%, tal como recomendado por Ferreira et al. (2002), atingindo cerca de 76 % em P2. Ambos os compostos apresentaram valores de pH neutro (Quadro 1), que se encontra no intervalo recomendado por Ferreira et al. (2002). A condutividade elétrica apresentou valores compatíveis com a utilização agrícola dos compostos (Brinton, 2000). O teor de azoto total apresentou valores superiores ao valor recomendado por Ferreira et al. (2002), maior em P1, provavelmente devido ao maior conteúdo em aparas de relva na mistura compostada (Quadro 1).
Características microbiológicas
No final da compostagem, no composto P2 quantificou-se um maior número de microrganismos, com exceção de actinomicetes, cujo número não diferiu significativamente (p = 0,908) entre os compostos (Quadro 2).
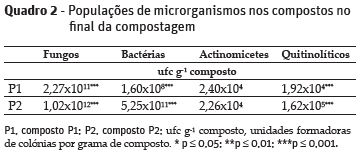
O maior teor de matéria orgânica poderá ter favorecido as populações microbianas em P2 (Antil et al., 2015), e em particular os resíduos de cogumelos, ricos em quitina, com um teor médio de 57,75 mg g-1 (López-Mondéjar et al., 2012). Este fato terá contribuído para a ocorrência de mais microrganismos com capacidade para degradar a quitina, através da quitinase (Sharp, 2013), aumentando a diversidade microbiológica de P2.
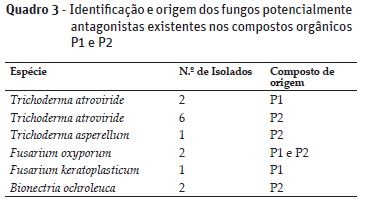
Nos dois compostos obtiveram-se 26 isolados com capacidade antagonista, 12 a partir do composto P1 e 14 do composto P2, pertencentes aos géneros Trichoderma, Gliocladium, Penicillium, Aspergillus, Purpureocillium, Fusarium e Bionetria. Fungos destes géneros ocorrem frequentemente em compostos (Mehta et al., 2014). Recorrendo à análise molecular dos isolados (dados não apresentados), foram identificados os que apresentaram as taxas de inibição mais elevadas nos ensaios in vitro, nomeadamente Trichoderma atriviride (isolados 1, 2, 3, 5, 6, 9, 22 e 23), Trichoderma asperellum (isolado 7), Fusarium oxysporum (isolados 14 e 20), Fusarium keratrosplasticum (isolado 12), Bionectria ochroleuca (isolados 18 e 26), já reconhecidos como agentes de controlo biológico (Cotxarrera et al. 2002; Benítez et al., 2004; Kaur et al., 2010). Em relação a F. oxysporum será ainda necessário avaliar a sua patogenicidade, embora nos ensaios in vivo não se tenham observado, nas plantas, sintomas causados por esta espécie, o que sugere tratar-se de uma estirpe não fitopatogénica, que poderá ter efeito benéfico no controlo biológico de outros agentes patogénicos do solo. Com exceção de F. keratrosplasticum, todos os isolados em P1 foram também identificados em P2. T. asperellum e B. ochroleuca foram isolados apenas de P2 (Quadro 3).
Características biológicas
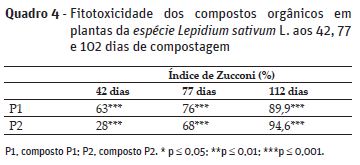
De acordo com Zucconi et al. (1985), o índice de germinação de sementes de mastruço, determinado em composto apto para aplicação ao solo deverá ser superior a 65-70 %. Verificou-se que, 77 dias após o início da compostagem, os compostos já apresentavam valores superiores ao intervalo referido. Aos 112 dias, o índice de germinação ultrapassou esses valores, destacando-se o composto P2, com o valor mais elevado (Quadro 4). Este aumento evidencia, neste caso, a importância do grau de maturação do composto e da sua estabilidade biológica (Sullivan e Miller, 2005).
Capacidade antagonista dos isolados in vitro
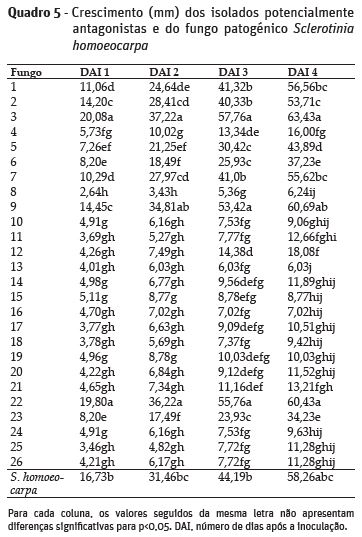
S. homoeocarpa apresentou uma taxa de crescimento elevada, atingindo um raio de 58,3 mm, 4 dias após a inoculação (DAI) do meio de cultura, sendo apenas suplantado por três isolados de T. atroviride, com um crescimento radial superior a 60 mm, no 4º DAI. Muitos dos isolados apresentaram taxas de crescimento baixas, com crescimento radial inferior a 17,5 mm no 4º DAI (Quadro 5), tendo sido identificados neste grupo Fusarium spp., Bionectria ochroleuca, Penicillium spp., Aspergillus spp., Purpureocillium spp.
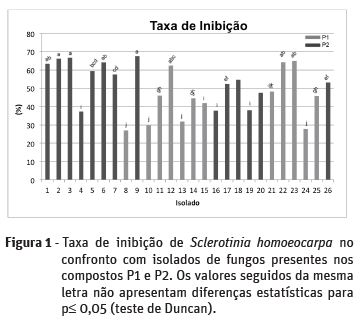
Dos 26 isolados com potencial capacidade antagonista, 13 mostraram taxas de inibição superiores a 50 %, relativamente a S. homoeocarpa (Figura 1), sendo 10 provenientes do composto P2 e apenas 3 do composto P1.
O maior conteúdo de quitina do composto P2, terá contribuído para o crescimento de microrganismos com capacidade para degradar esta molécula. Esta característica pode favorecer o controlo do crescimento de fungos patogénicos das plantas, por estes fungos também apresentarem quitina na sua constituição (Sharp, 2013).
T. atroviride, T. asperellum, F. oxysporum, F. keratoplasticum, B. ochroleuca provocaram maior inibição do crescimento de S. homoeocarpa. F. oxysporum, F. keratoplasticum, B. ochroleuca, controlaram o crescimento do patogénico, apesar de terem apresentado taxas de crescimento baixas, na sua presença. .
Aos 7 DAI, a interação entre os fungos com potencial antagonista e os agentes patogénicos foi do tipo E, de acordo com Magan e Lacey (1984). A interação do tipo E caracteriza-se pela inibição de uma das espécies em contacto, continuando o antagonista a crescer, a uma taxa mais reduzida, sobre a colónia inibida (a do agente patogénico).
Capacidade supressiva dos compostos obtidos para S. homoeocarpa, in vivo
Os primeiros sintomas de doença provocada por S. homoeocarpa surgiram nas modalidades T, Tt, P1t e P2t, aos 12 DAI (Quadro 6).
Analisando a Severidade da doença, verificou-se que o fungo se desenvolveu mais rapidamente nos compostos tratados termicamente e na turfa (tratada e não tratada) (Quadro 6). Estas modalidades favoreceram também o crescimento de S. homoeocarpa com o consequente aumento da área das manchas na relva . A menor diversidade microbiológica nas modalidades T, Tt, P1t e P2t terá favorecido o crescimento do patogénico, tal como verificado por outros autores (Cotxarrera et al., 2002; Trillas et al., 2006; Reis e Coelho, 2013).
No final do ensaio (55 DAI) as modalidades P1 e P2 apresentaram maior capacidade supressiva para S. homoeocarpa, observando-se menor Incidência e Severidade da doença, em comparação com as restantes modalidades que, tal como esperado, apresentaram uma Incidência da doença de 100 % em T, Tt, P1t e P2t (Quadro 6). Na turfa (55 DAI) a área afetada pela doença foi de 95,2 % e de 90,6 %, respetivamente na turfa não tratada e tratada termicamente, o que é significativamente superior (p < 0,05) ao verificado em P1 e P2, onde essa área foi apenas de 19,1 % e 10,8 %, respetivamente. Assim, a severidade da doença, no final do ensaio, foi mais elevada em T e Tt, embora em Tt não tenha diferido significativamente de P2t, que por sua vez, também não diferiu de P1t (Quadro 6). A superioridade da capacidade supressiva das modalidades P1 e P2 destacou-se significativamente das restantes.
No final do ensaio, a capacidade dos compostos P1 e P2 para suprimirem as doenças pode atribuir-se aos microrganismos presentes, com populações mais elevadas de Trichoderma spp., e mais baixas de Sclerotinia spp. (Quadro 7). A presença de T. gamsii e a sua ação antagonista contra S. homoeocarpa, em solos com relvados, já tinha sido observada por Coelho et al. (2016). Em estudos com T. harzianum, Guerrero et al. (2008) constataram igualmente a sua capacidade de controlo de doenças do solo em relvados.
As características físico-químicas dos compostos também podem ter influência no controlo biológico (Walsh et al., 1999; Cotxarrera et al., 2002; Pane et al., 2011), embora isso não tenha sido evidente no presente estudo, quando se compara a severidade da doença em P1t, P2t e Tt. De fato, não se verificaram diferenças significativas entre modalidades no final do ensaio quanto a CE, e o tratamento térmico não alterou o pH dos substratos destas modalidades (Quadro 7).
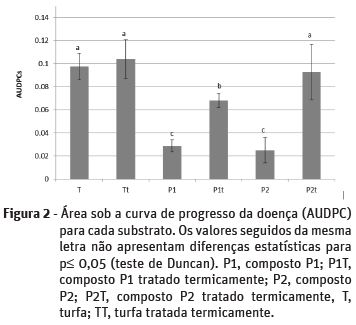
A variável AUDCP, que indica a progressão da doença foi mais elevada em T, Tt e P2t, que não diferiram significativamente entre si (p < 0,05), seguindo-se a observada na modalidade P1t (Figura 2). A progressão da doença foi significativamente menor nas modalidades P1 e P2, compostos não sujeitos a tratamento térmico, o que indicia a natureza microbiológica da supressividade ocorrida.
CONCLUSÕES
A compostagem dos resíduos agroindustriais descritos permitiu a obtenção de dois compostos orgânicos com boa qualidade agronómica, dos quais foram isolados fungos com capacidade para suprimir o crescimento de S. homoeocarpa. Nos ensaios in vitro, verificou-se que o maior número de fungos com capacidade supressiva para S. homoeocarpa foi isolado do composto P2. Nos testes in vivo, ambos os compostos apresentaram capacidade para controlar o desenvolvimento de S. homoeocarpa e a manifestação de doença na relva (Agrostis stolonifera), em particular o composto P2. A presença de resíduos ricos em quitina na mistura compostada poderá ter contribuído para os melhores resultados obtidos em P2. No entanto, será necessário confirmar o efeito dos resíduos com quitina no aumento da supressividade do composto orgânico P2.
Referências Bibliográficas
Alfano, G.; Lustrato, G.; Lima, G.; Vitullo, D. & Ranalli, G. (2011) - Characterization of composted olive mil wastes to predict potential plant disease suppressiveness. Biological Control, vol. 58, n. 3, p. 199-207. https://doi.org/10.1016/j.biocontrol.2011.05.001 [ Links ]
Antil, R.S.; Raj, D.; Adballa, N. & Inubushi, K. (2015) - Physical, Chemical and Biological parameters for Compost Maturity Assessment: A Review. In: Mahesshwari, D.K. (Ed.) - Composting for Sustainable Agriculture. London, Springer, p. 283. [ Links ]
Baayen, R.P. & Van der Plas, C.H. (1992) - Localization ability, latent period and wilting rate in eleven carnation cultivars with partial resistance to Fusarium wilt. Euphytica, vol. 59, n. 2-3, p. 165–174. https://doi.org/10.1007/BF00041269 [ Links ]
Barker, A.V. (2001) - Compost utilization in sod production and turf management. In: Stoffella, P.J. & Kahn, B.A. (Eds.) - Compost utilization in horticultural cropping systems. Boca Raton, Lewis Publications, p. 201-225. [ Links ]
Batista, J.G.F. & Batista, E.R.B. (2007) - Compostagem - Utilização de compostos em Horticultura. Angra do Heroísmo, Universidade dos Açores - CITA-A, 252 p. [ Links ]
Benítez, T.; Rincón, A.M.; Limón, M.C. & Codón, A.C. (2004) - Biocontrol mechanisms of Trichoderma strains. International Microbiology, vol. 7, n. 4, p. 249-260. [ Links ]
Berjón, M.A.; Murray, P.N. & Benedito, C.C. (2004) - Los sustratos en los cultivos sin suelo. In: Gavilán, M.U. (Ed.) - Tratado de Cultivo Sin Suelo. Madrid, Ediciones Mundi-Prensa, p. 113-158. [ Links ]
Brinton, W. (2000) - Compost quality standards & guidelines - Final Report. Woods End Research Laboratory, Inc. Disponível em http://compost.css.cornell.edu/Brinton.pdf. Acedido em 8 de janeiro de 2019. [ Links ]
Chung, Y. R. & Hoitink, H.A.J. (1990) - Interactions Between Thermophilic Fungi and Trichoderma hamatum in Suprression of Rhizoctonia Damping-Off in a Bark Compost – Amended Container Medium. Phytopathology, vol. 80, n. 1, p. 73-77. https://doi.org/10.1094/Phyto-80-73 [ Links ]
Coelho, L.; Dionísio, L.; Bueno, F.; Reis, M.; Duarte, J. & Guerrero, C. (2016) -Trichoderma gamsii as a biological control agent of turfgrass diseases. In: Book of Abstracts of the 5th European Turfgrass Society Conference – Turfgrass – Towards Sustainability and Perfection for Aesthetic, recreational and Sports. Albufeira, Portugal, p. 145-146. [ Links ]
Cotxarrera, L.; Trillas-Gay, M. I.; Steinberg, C. & Alabouvette, C. (2002) - Use of sewage sludge compost and Trichoderma asperellum isolates to suppress Fusarium wilt of tomato. Soil Biology & Biochemistry, vol 34, p. 467–476. http://dx.doi.org/10.1016/S0038-0717(01)00205-X [ Links ]
Day, M. & Shaw, K. (2005) - Processos Biológicos, químicos, físicos del compostaje. In: Stollella, P. & Kahn, B. (Eds.) - Utilización de compost en sistemas de cultivo hortícola. Ediciones Mundi-Prensa. p. 17-50. [ Links ]
Ferreira, J.; Conceição, J.; Strecht, A.; Ribeiro, J.; Soeiro, A. & Cotrim, G. (2002) - Manual de agricultura biológica – Fertilização e protecção das plantas para uma agricultura sustentável. 3ª ed, Lisboa, Agrobio, 435 p. [ Links ]
Field, A. (2009) - Discovering Statistics using SPSS. 3rd ed, London, SAGE Publication. ISBN 978-1-84787-906-6 [ Links ]
Guerrero, C.; Vitoriano, J.; Neto, L. & Dionísio, L. (2008) - Control of fungi diseases on turfgrass using Trichoderma harzianum. WSEAS Transactions on Environment and Development, vol. 9, p.736-745. [ Links ]
Hoitink, H.A.J.; Stone, A.G. & Han, D.Y. (1997) - Suppression of plant disease by composts. HortScience, vol. 32, p. 184-187. [ Links ]
Kaur, R.; Kaur, J.& Singh, R. (2010) - Nonpathogenic Fusarium as a Biological Control Agent. Plant Pathology Journal, vol. 9, n. 3, p. 79-91. http://dx.doi.org/10.3923/ppj.2010.79.91 [ Links ]
López-Mondéjar, R.; Blaya, J.; Obiol, M.; Ros, M. & Pascual, J.A. (2012) - Evaluation of the effect of chitin-rich residues on the chitinolytic activity of Trichoderma harzianum: In vitro and greenhouse nursery experiments. Pesticide Biochemistry and Physiology, vol. 103, n. 1, p. 1-8. https://doi.org/10.1016/j.pestbp.2012.02.001 [ Links ]
Magan, N. & Lacey, J. (1984) - Effect of water activity, temperature and substrate on interaction between field and storage fungi. Transactions of the British Mycological Society, vol. 82, n. 1, p. 83-93. https://doi.org/10.1016/S0007-1536(84)80214-4 [ Links ]
Martinez, F.X. (1992) - Propuesta de metodología para la determinación de las propriedades fisicas de los substratos. In: Actas de las I Jornadas de Substratos de la SECH, p.55-65. [ Links ]
Mehta, C.M.; Palni, U.; Franke-Whittle, I.H. & Sharma, A.K. (2014) - Compost: Its role, mechanism and impact on reducing soil-borne plant diseases. Waste Management, vol. 34, n. 3, p. 607-622. https://doi.org/10.1016/j.wasman.2013.11.012 [ Links ]
Pane, C.; Spaccini,R.; Piccolo, A.; Scala, F.; & Bonanomi, G. (2011) - Compost amendments enhance peat suppressiveness to Pythium ultimum, Rhizoctonia solani and Sclerotinia minor. Biological Control, vol. 56, n. 2, p. 115-124. https://doi.org/10.1016/j.biocontrol.2010.10.002 [ Links ]
Pane, C. & Zaccardelli, M. (2014) - Principles of Compost-based Plant Diseases Control and innovative new developments. In: Maheshwari D.K. (Ed.) - Composting for sustainable agriculture. London, Springer, London, p.151-171. [ Links ]
Ramos, J.C.M.; Vilaseca, J.S.; Ramon, A.C. (1987) - Control analític de la qualitat del compost i estudi de la seva maduració. In: Experiències amb el compost. Estudis I monografies, nº 12, p. 31-69. Server del Medi Ambient, Diputació de Barcelona. [ Links ]
Reis, M. (2016) - Os compostos no controlo de doenças das plantas. Revista de Ciências Agrárias, vol. 39, n. 1, p. 25-35. http://dx.doi.org/10.19084/RCA15111 [ Links ]
Sant, D.; Casanova, E.; Segarra, G.; Avilés, M.; Reis, M. & Trillas, M. I. (2010) - Effect of Trichoderma asperellum strain T34 on Fusarium wilt and water usage in carnation grown on compost-based growth medium. Biological Control, vol. 53, n. 3, p. 291-296. https://doi.org/10.1016/j.biocontrol.2010.01.012 [ Links ]
Sharp, R.G. (2013) - A Review of the Applications of Chitin and Its Derivatives in Agriculture to Modify Plant-Microbial Interactions and Improve Crop Yields. Agronomy, vol. 3, n. 4, p. 757-793. http://dx.doi.org/10.3390/agronomy3040757 [ Links ]
Sullivan, D.M. & Miller, R.O. (2005) - Propiedades cualitativas, medición y varibilidad de los compost. In: Stollella, P. & Kahn, B. (Eds.) - Utilización de compost en sistemas de cultivo hortícola. Ediciones Mundi-Prensa, p. 95-119. [ Links ]
Steadman, J.R.; Marcinkowska, J. & Rutledge, S. (1994) - A Semi-Selective Medium for Isolation of Sclerotinia sclerotiorum. Canadian Journal of Plant Pathology, vol. 16, n. 1, p. 68-70. https://doi.org/10.1080/07060669409500791 [ Links ]
Trillas, M.I.; Casanova, E.; Cotxarrera, L.; Ordovás, J.; Borrero, C. & Avilés, M. (2006) - Composts from agricultural waste and Trichoderma asperellum strain T-34 suppress Rhizoctonia solani in cucumber seedlings. Biological Control, vol. 39, p. 32-38. https://doi.org/10.1016/j.biocontrol.2006.05.007 [ Links ]
Walsh, B.; Ikeda, S.S. & Boland, G. (1999) – Biology and Management of Dollar Spot (Sclerotinia homoeocarpa); an Important Disease of Turfgrass. HortScience, vol. 34, n. 1, p.13-21. [ Links ]
White, T.J.; Bruns, T.; Lee, S. & Taylor J. (1990) - Amplification and direct sequencing of fungal ribosomal RNA genes for phylogenetics. In: Sninsky, J.J. & White, T.J. (Eds.) -PCR protocols: A guide to methods and applications. New York, New York, Academic Press, p.315–322. [ Links ]
Zucconi, F.; Mónaco, A. & Forte, M. (1985) - Phytotoxins during the stabilization of organic matter, pp. 73-85. In: Gasser, J.K.R. (Ed.) - Composting of agricultural and other wastes. London, Elsevier Applied Science Publishers. [ Links ]
Agradecimentos
Trabalho apoiado pela Fundação para a Ciência e a Tecnologia através de uma bolsa de doutoramento para Luísa Coelho (SFRH/BD/109218/2015). Os autores agradecem à Universidade de Sevilha a cedência de S. homoeocarpa, particularmente ao Dr. Manuel Avilés.
Recebido/received: 2017.12.22
Aceite/accepted: 2018.12.27














