INTRODUÇÃO
A aceroleira (Malpighia emarginata D.C.), por se tratar de uma planta de clima tropical, adaptou-se bem ao semiárido brasileiro e, graças ao seu alto teor de vitamina C, tornou-se numa fruta altamente requisitada pelo mercado mundial para a produção de sumos, geleias, polpas, consumo in natura e extração de vitamina C para utilização em cosméticos. Além disso, a acerola é fonte de outros nutrientes, como a vitamina A, vitaminas do complexo B (tiamina, riboflavina e niacina), ferro, cálcio e carotenoides (Seeram, 2008; Bortolotti et al., 2013). O Brasil é o maior produtor, consumidor e exportador mundial, com uma área plantada de aproximadamente 7.200 ha e uma produção média de 150.000 toneladas/ano. O Submédio do Vale do Rio São Francisco possui cerca de 1.339 ha de aceroleira (≈18% da área total) (Calgaro e Braga, 2012).
Diversos fatores de ordem fitossanitária, com destaque para os nematoides-das-galhas radiculares (NGR), Meloidogyne spp., têm influenciado negativamente a produtividade e a qualidade dos frutos da aceroleira. As doenças causadas por NGR são consideradas as de maior importância econômica, comprometendo a produção da aceroleira em cerca de 10% (Costa e Ritzinger, 2003). Plantas infetadas por NGR exibem folhas amareladas, pequenas e que caem precocemente, além de nanismo e aspecto geral de deficiência nutricional. No entanto, o sintoma mais característico da infecção é a presença de galhas no sistema radicular, que podem conduzir ao declínio das plantas (Castellano et al., 2011; Cavichioli et al., 2014).
Ao longo do tempo têm vindo a ser realizados trabalhos de prospeção para o melhor conhecimento das espécies de Meloidogyne associadas à aceroleira, assim como os possíveis danos causados na cultura. A ocorrência de M. enterolobii em aceroleira, no município de Junqueirópolis-São Paulo, e na região de Garça-São Paulo, Brasil, e na Costa Rica, já foi referida por vários autores como um dos principais fatores limitantes para o desenvolvimento da cultura (Bueno et al., 2007; Garcia et al., 2011; Humphreys et al., 2012). As informações obtidas em trabalhos de prospecção auxiliam na identificação e determinação da distribuição dos nematoides, além de contribuírem para o estudo da biologia, ecologia, epidemiologia e implementação de medidas de controlo (Neves et al., 2009). Fornecem ainda informações sobre a importância relativa das doenças e flutuações da sua intensidade, e permitem verificar a eficiência das medidas de controlo recomendadas.
O presente trabalho teve como objetivo identificar as espécies de Meloidogyne associadas à aceroleira no perímetro irrigado do Submédio do Vale do Rio São Francisco, Brasil.
MATERIAIS E MÉTODOS
Amostragem e manutenção dos NGR
Setenta e cinco amostras de solo e raízes foram recolhidas de áreas irrigadas dos municípios de Petrolina-Pernambuco, Juazeiro-Bahia e Sobradinho-Bahia, principais produtores de acerola do Submédio do Vale do Rio São Francisco.
No momento da amostragem, levaram-se em consideração as principais áreas de aceroleira dos respectivos municípios. As amostras foram recolhidas na projeção da copa das plantas que apresentavam sintomas de infecção por NGR, a cerca de 15-20 cm de profundidade, seguindo o padrão de amostragem em zigue-zague. Em cada área de aceroleira, foram colhidas dez subamostras que foram, de seguida, misturadas para a obtenção de uma amostra composta de 500 g de solo e 200 g de raízes. As amostras foram acondicionadas em sacos de plástico devidamente identificados e mantidas em caixas térmicas. Simultaneamente, foram também recolhidas amostras de solo para análise física, no Laboratório de Solos da Embrapa Semiárido, que consistiu na determinação da densidade do solo (kg/dm3), porosidade (%) e granulometria. Os solos foram classificados com base no Triângulo Textural proposto pelo Departamento de Agricultura dos Estados Unidos (Soil Survey Staff, 1951). Em cada propriedade rural, foram registradas as coordenadas geográficas para localização das áreas de aceroleira amostradas (Quadro 1).
Quadro 1 Localização, cultivar e identificação das populações de Meloidogyne provenientes de áreas de aceroleira do Submédio do Vale do Rio São Francisco, Brasil
| Amostra | Perímetro irrigado | Coordenada geográfica | Cultivar | Espécie de Meloidogyne |
|---|---|---|---|---|
| 1 | Salitre a | S 09°31'45"; W 040°15'01" | Comum | M. enterolobii |
| 2 | Salitre | S 09°31'47"; W 040°15'12" | Comum | M. enterolobii |
| 3 | Salitre | S 09°31'55"; W 040°15'19" | Comum | M. enterolobii |
| 4 | Bebedouro b | S 09°08'21"; W 040°18'58" | BRS Sertaneja | M. arenaria + M. enterolobii |
| 5 | Bebedouro | S 09°08'18"; W 040°19'01" | Junko | M. enterolobii |
| 6 | Bebedouro | S 09°08'35"; W 040°18'24" | Junko | M. enterolobii |
| 7 | Bebedouro | S 09°06'44"; W 040°17'56" | Junko | M. enterolobii |
| 8 | Senador Nilo Coelho b | S 09º19'24"; W 040º37'27" | Flor Branca | M. enterolobii |
| 9 | Senador Nilo Coelho | S 09°18'09"; W 040°34'48" | BRS Sertaneja | M. enterolobii |
| 10 | Senador Nilo Coelho | S 09º18'12"; W 040º32'52" | BRS Sertaneja | M. enterolobii |
| 11 | Senador Nilo Coelho | S 09º16'41"; W 040º31'25" | Junko | M. enterolobii |
| 12 | Senador Nilo Coelho | S 09º17'47"; W 040º29'56" | Comum | M. enterolobii |
| 13 | Senador Nilo Coelho | S 09º17'56"; W 040º29'42" | Okinawa | M. enterolobii |
| 14 | Senador Nilo Coelho | S 09°19'17"; W 040°26'38" | Junko; BRS Sertaneja | M. enterolobii |
| 15 | Senador Nilo Coelho | S 09°18'28"; W 040°26'16" | Junko; BRS Sertaneja | M. enterolobii |
| 16 | Senador Nilo Coelho | S 09°18'38"; W 040°26'16" | BRS Sertaneja | M. enterolobii |
| 17 | Senador Nilo Coelho | S 09°17'58"; W 040°25'56" | Costa Rica | M. enterolobii |
| 18 | Senador Nilo Coelho | S 09°17'59"; W 040°25'53" | BRS Sertaneja | M. enterolobii |
| 19 | Senador Nilo Coelho | S 09°17'26"; W 040°26'09" | BRS Sertaneja | M. enterolobii |
| 20 | Maria Tereza b | S 09º06'26"; W 040º31'42" | BRS Sertaneja; Junko | M. enterolobii |
| 21 | Maria Tereza | S 09º06'26"; W 040º31'11" | Junko | M. enterolobii |
| 22 | Maria Tereza | S 09º06'18"; W 040º30'33" | Junko | M. enterolobii |
| 23 | Maria Tereza | S 09º06'15"; W 040º30'21" | Junko | M. enterolobii |
| 24 | Maria Tereza | S 09º06'29"; W 040º33'39" | Costa Rica | M. enterolobii |
| 25 | Maria Tereza | S 09º06'29"; W 040º33'39" | Junko | M. enterolobii |
| 26 | Maria Tereza | S 09º07'00"; W 040º33'40" | Junko; Costa Rica | M. enterolobii |
| 27 | Maria Tereza | S 09º08'04"; W 040º34'00" | Junko | M. enterolobii |
| 28 | Maria Tereza | S 09º09'35"; W 040º34'47" | Junko | M. enterolobii |
| 29 | Maria Tereza | S 09º09'44"; W 040º34'07" | Junko | M. enterolobii |
| 30 | Maria Tereza | S 09º11'22"; W 040º33'07" | Flor Branca | M. enterolobii |
| 31 | Senador Nilo Coelho | S 09º18'10"; W 040º35'07" | BRS Sertaneja | M. enterolobii |
| 32 | Senador Nilo Coelho | S 09º17'46"; W 040º35'30" | Flor Branca | M. arenaria + M. enterolobii |
| 33 | Senador Nilo Coelho | S 09º17'16"; W 040º35'29" | Flor Branca | M. enterolobii |
| 34 | Senador Nilo Coelho | S 09º19'10"; W 040º37'01" | BRS Sertaneja | M. enterolobii |
| 35 | Senador Nilo Coelho | S 09º20'05"; W 040º36'23" | Costa Rica | M. enterolobii |
| 36 | Senador Nilo Coelho | S 09º20'22"; W 040º36'48" | BRS Sertaneja | M. enterolobii |
| 37 | Senador Nilo Coelho | S 09º19'44"; W 040º37'36" | Junko | M. enterolobii |
| 38 | Senador Nilo Coelho | S 09º20'57"; W 040º37'16" | Junko | M. enterolobii |
| 39 | Senador Nilo Coelho | S 09º23'07"; W 040º37'34" | Junko | M. enterolobii |
| 40 | Senador Nilo Coelho | S 09º22'46"; W 040º36'54" | BRS Sertaneja | M. enterolobii |
| 41 | Associação Fonte da Vida c | S 09º30'51"; W 040º51'25" | Junko | M. enterolobii |
| 42 | Associação Fonte da Vida | S 09º30'12"; W 040º51'28" | Junko | M. enterolobii |
| 43 | Associação Fonte da Vida | S 09º30'51"; W 040º51'34" | Junko | M. enterolobii |
| 44 | Associação Fonte da Vida | S 09º30'74"; W 040º51'35" | Junko | M. enterolobii |
| 45 | Associação Fonte da Vida | S 09º30'56"; W 040º51'35" | Junko | M. enterolobii |
| 46 | Associação Fonte da Vida | S 09º30'42"; W 040º51'33" | Junko | M. enterolobii |
| 47 | Associação Fonte da Vida | S 09º30'32"; W 040º51'32" | Junko | M. enterolobii |
| 48 | Associação Fonte da Vida | S 09º30'73"; W 040º51'31" | Junko | M. enterolobii |
| 49 | Associação Asa Branca c | S 09º27'54"; W 040º55'47" | Junko; BRS Sertaneja | M. incognita |
| 50 | Associação Asa Branca | S 09º27'51"; W 040º55'46" | Junko; BRS Sertaneja | M. javanica |
| 51 | Associação Asa Branca | S 09º27'54"; W 040º55'44" | Junko; BRS Sertaneja | M. enterolobii + Meloidogyne sp. |
| 52 | Associação Asa Branca | S 09º27'54"; W 040º55'41" | Junko; BRS Sertaneja | M. incognita |
| 53 | Associação Asa Branca | S 09º27'56" W 040º55'39" | Junko; BRS Sertaneja | M. enterolobii |
| 54 | Associação Asa Branca | S 09º27'57"; W 040º55'31" | Junko; BRS Sertaneja | M. enterolobii |
| 55 | Associação Asa Branca | S 09º28'00"; W 040º55'29" | Junko; BRS Sertaneja | M.enterolobii |
| 56 | Associação Asa Branca | S 09º28'3"; W 040º55'22" | Junko; BRS Sertaneja | M. enterolobii |
| 57 | Associação Asa Branca | S 09º28'4"; W 040º55'17" | Junko; BRS Sertaneja | M. enterolobii |
| 58 | Maria Tereza | S 09°09'06"; W 040°33'02" | Junko | M.enterolobii |
| 59 | Maria Tereza | S 09°09'30"; W 040°32'41" | Junko | M. enterolobii |
| 60 | Maria Tereza | S 09°09'02"; W 040°31'05" | Okinawa | M. enterolobii |
| 61 | Senador Nilo Coelho | S 09°20'23"; W 040°40'49" | Flor Branca | M. enterolobii |
| 62 | Senador Nilo Coelho | S 09°21'27"; W 040°41'44" | Junko | M. enterolobii |
| 63 | Senador Nilo Coelho | S 09°21'40"; W 040°41'49" | Okinawa | M. enterolobii |
| 64 | Senador Nilo Coelho | S 09°20'50"; W 040°41'43" | Flor Branca | M. enterolobii |
| 65 | Senador Nilo Coelho | S 09°20'50"; W 040°41'43" | Junko | M. enterolobii |
| 66 | Senador Nilo Coelho | S 09°20'48"; W 040°42'06" | Okinawa | M. enterolobii |
| 67 | Senador Nilo Coelho | S 09°21'03"; W 040°42'07" | Flor Branca | M. enterolobii |
| 68 | Senador Nilo Coelho | S 09°20°35"; W 040°42'16" | BRS Sertaneja | M. enterolobii |
| 69 | Senador Nilo Coelho | S 09°21'15"; W 040°42'28" | Flor Branca | M. enterolobii |
| 70 | Senador Nilo Coelho | S 09°21'18"; W 040°42'25" | BRS Sertaneja | M. enterolobii |
| 71 | Senador Nilo Coelho | S 09°20'43"; W 040°42'23" | Okinawa | M. enterolobii |
| 72 | Senador Nilo Coelho | S 09°24'05"; W 040°31'30" | Junko | M. enterolobii |
| 73 | Mandacaru a | S 09°23'25"; W 040°25'13" | Junko | M. enterolobii |
| 74 | Mandacaru | S 09°23'42"; W 040°23'58" | BRS Sertaneja | M. enterolobii |
| 75 | Mandacaru | S 09°23'05"; W 040°25'08" | BRS Sertaneja | M. enterolobii |
a Município de Juazeiro-Bahia.
b Município de Petrolina-Pernambuco.
c Município de Sobradinho-Bahia.
As amostras de solo e raízes infetadas com Meloidogyne spp., com a presença de galhas nas raízes, foram encaminhadas para o Laboratório de Nematologia da Embrapa Semiárido. As raízes foram selecionadas, eliminando as regiões sem galhas e massas de ovos. Vasos de polietileno (3 L) foram cheios com 50% de solo argilo-arenoso esterilizado e 40% com solo e raízes de cada amostra. Um tomateiro cv. Santa Clara (suscetível aos NGR), com cerca de quatro semanas, foi transplantado para cada um dos vasos, para multiplicação dos NGR e posterior caracterização bioquímica. Os vasos foram mantidos em estufa com climatização controlada (temperatura: 23-32ºC, umidade relativa a 60%).
Caracterização bioquímica
A caracterização bioquímica das populações de Meloidogyne spp. foi realizada através da análise dos padrões enzimáticos de esterases obtidos por electroforese (Carneiro et al., 2000).
Quarenta dias após o transplante dos tomateiros, foram extraídas fêmeas, em início de postura e com coloração branco-leitosa, de raízes infetadas, com o auxílio de uma pinça de bicos finos, ao microscópio estereoscópico. As fêmeas foram colocadas em tubos do tipo eppendorf de 1,5 mL (seis fêmeas/tubo) aos quais tinham sido adicionados 6 µL de tampão de extração (20% peso/vol. de sacarose, 2% vol./vol. de Triton X-100, 0,01% peso/vol. de azul de bromofenol) (Esbenshade e Triantaphyllou, 1985). De cada uma das amostras recolhidas foram preparados oito tubos.
De seguida, as fêmeas foram maceradas com o auxílio de um pistão e o extrato proteico aplicado no gel de concentração. Em cada um dos géis foi utilizado um extrato proteico de seis fêmeas da população de referência - M. javanica. Os géis de separação (7,5%) e de concentração (4%) foram preparados de acordo com a metodologia descrita por Alfenas et al. (1991). A eletroforese decorreu em condições de baixa temperatura (≈4ºC) a 80 V, até a linha de azul de bromofenol atingir o gel de separação, e de seguida a 130 V. A eletroforese terminou quando a linha formada pelo corante se aproximou da extremidade inferior do gel de separação, aproximadamente 2 h depois.
Terminada a eletroforese, os géis foram cuidadosamente removidos e transferidos para gerbox (11x11x3,5 cm) com solução corante (tampão de fosfato de potássio 0,05 M, pH 6,0, contendo 0,05% vol./vol. de naftil acetato, 0,1% peso/vol. de Fast Blue RR Salt). A coloração decorreu a 37ºC, no escuro durante 20 minutos (Alfenas et al., 1991). Após a secagem à temperatura ambiente, os fenótipos de esterase foram caracterizados tendo sido calculada a mobilidade relativa (MR= distância percorrida pela banda/distância percorrida pelo corante de referência) das bandas polimórficas de cada população e as espécies de Meloidogyne identificadas por comparação com o fenótipo da população de referência, M. javanica (Esbenshade e Triantaphyllou, 1985, 1990).
Os fenótipos enzimáticos encontrados foram designados por uma letra e um número que correspondem, respectivamente, à inicial do restritivo específico da espécie de NGR identificada e ao número de bandas presentes no gel (Esbenshade e Triantaphyllou, 1985, 1990).
Uma vez identificadas as misturas de espécies de NGR, o que ocorreu em três amostras (Quadro 1), uma massa de ovos por fêmea foi recolhida, guardada individualmente em tubos do tipo eppendorf de 1,5 mL contendo NaCl a 0,1% (Esbenshade e Triantaphyllou, 1990; Carneiro e Almeida, 2001) e de seguida depositadas em solo contendo um tomateiro cv. Santa Clara. Quarenta dias após a inoculação repetiu-se o procedimento anteriormente descrito para confirmação das espécies de NGR presentes nas misturas.
RESULTADOS
A prevalência de NGR nas áreas de aceroleira amostradas, no Submédio do Vale do Rio São Francisco, foi de 100%. Em 75 amostras recolhidas, identificaram-se 75 populações de Meloidogyne (Figura 1). A cultivar Junko de aceroleira é a mais cultivada na região, pelo que 44% das amostras foram recolhidas em áreas com esta cultivar. Foram encontrados NGR também associados às cultivares BRS Sertaneja, Flor Branca, Costa Rica e Okinawa (Quadro 1).
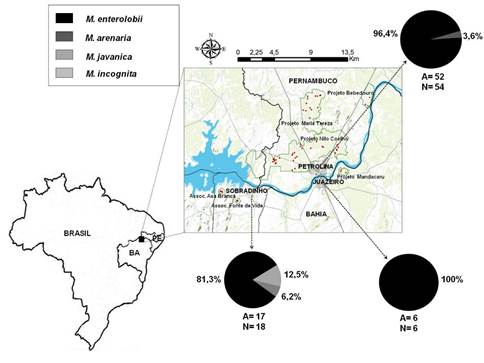
Figura 1 Locais de amostragem de Meloidogyne spp. em áreas de aceroleira, em três municípios do Submédio do Vale do Rio São Francisco (Petrolina-Pernambuco; Juazeiro-Bahia e Sobradinho-Bahia). Os círculos representam a frequência de cada espécie de Meloidogyne identificada em cada um dos municípios. A - áreas amostradas; N - populações identificadas em cada município.
A análise dos géis de poliacrilamida revelou a presença de cinco fenótipos de esterases distintos (Figura 2). O fenótipo En4 (Rm: 0,71; 0,77; 0,93; 0,97), típico de M. enterolobii, foi detectado em 72 amostras (96%). Esta espécie foi a mais frequente, estando presente em todas as áreas e associada a todas as cultivares de aceroleira (Quadro 1).
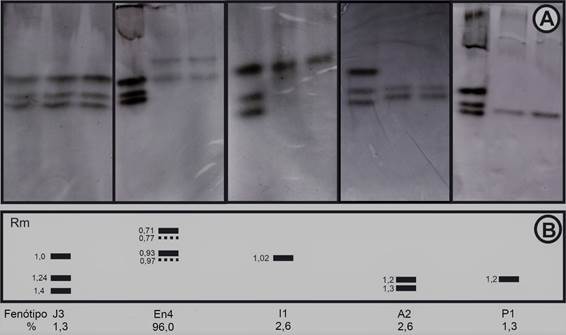
Figura 2 Fenótipos de esterase das populações de Meloidogyne spp. provenientes de áreas de aceroleira do Submédio do Vale do Rio São Francisco (A) e respectiva representação esquemática (B), com indicação da frequência de cada espécie (%). A - M. javanica (J3); B - M. enterolobii (En4/VS1-S1); C - M. incognita (I1); D - M. arenaria (A2); E - Meloidogyne sp. (P1); MR = mobilidade relativa.
O fenótipo I1 (Rm: 1,02), característico de M. incognita, foi observado em duas amostras (2,6%), ambas no município de Sobradinho-Bahia e em áreas com as cultivares Junko e BRS Sertaneja (Quadro 1). O fenótipo J3 (Rm: 1,0; 1,12; 1,2), típico de M. javanica, foi observado em apenas uma amostra proveniente de uma área cultivada com as cultivares Junko e BRS Sertaneja, em Sobradinho-Bahia (Quadro 1).
Meloidogyne arenaria, fenótipo A2 (Rm: 1,2; 1,3), foi detectada também somente em duas amostras, em mistura com M. enterolobii, em áreas com as cultivares Flor Branca e BRS Sertaneja, no município de Petrolina-Pernambuco (Quadro 1).
Foi detetada também uma população com um fenótipo de esterases atípico denominado P1 (Rm: 1,2), não sendo possível a sua identificação (Quadro 1). Esta espécie foi obtida numa área de aceroleira do município de Sobradinho-Bahia, juntamente com M. enterolobii. O fenótipo é semelhante ao de M. paranaensis. No entanto, ao utilizar o marcador SCAR (Região amplificada de sequência caracterizada) não houve amplificação de fragmentos da amostra, não sendo possível ainda identificar a espécie.
DISCUSSÃO
A presença de NGR em todas as áreas amostradas da região do Submédio do Vale do Rio São Francisco pode ser explicada pelas ótimas condições de sobrevivência e disseminação. As principais cultivares de aceroleira plantadas na região foram identificadas como hospedeiras do NGR e isso pode explicar a sua crescente disseminação entre os pomares (pers. com.). As condições ótimas de temperatura e humidade da região facilitam a ocorrência de várias gerações de NGR durante o ano e muitas infestantes existentes nos pomares são autênticos reservatórios de nematoides. Outro fato que tem vindo a favorecer a disseminação e instalação dos NGR é a comercialização irregular de plântulas de aceroleira infetadas (Sharma e Junqueira, 1993; Carneiro, 2003; Torres et al., 2007). No Submédio do Vale do Rio São Francisco, o uso de máquinas e alfaias agrícolas em solos infestados também tem promovido a disseminação destes nematoides para áreas onde ainda não existiam (Carneiro et al., 2006; EPPO, 2016).
Meloidogyne enterolobii foi a espécie mais frequente nas áreas de aceroleira amostradas. A maior parte destas áreas de aceroleira tinham sido, no passado, cultivadas com goiabeira que, em consequência da presença desta espécie de NGR, sofreram uma redução de área de mais de 70%, de 6000 ha em 2000 para 1668 ha em 2006 (Carneiro et al., 2007).
Ao realizar um levantamento das espécies de Meloidogyne, provenientes de diferentes estados produtores de acerola no Brasil, Costa et al. (1999) detetaram a presença de M. incognita, M. javanica e M. arenaria, sendo M. incognita a espécie predominante. De acordo com Ferraz e Brown (2016), fatores edafoclimáticos como temperatura, humidade, porosidade, textura e estrutura do solo, afetam o movimento dos nematoides no solo. A disseminação de M. enterolobii pelas áreas amostradas pode ter sido também favorecida por alguns destes fatores. A textura do solo das 75 amostras recolhidas foi determinada e 97% apresentaram textura média a arenosa. Solos desta natureza apresentam maior porosidade, o que favorece a movimentação dos nematoides e, consequentemente, o processo de infeção das plantas (Wallace, 1969). Nestas áreas, a irrigação também é feita de forma incorreta, sendo observados solos altamente encharcados e, em alguns casos, com escoamento superficial. De acordo com EPPO (2016), M. enterolobii apresenta movimento limitado a poucos centímetros no solo. No entanto, a disseminação pode ser favorecida pelas águas de irrigação ou de chuva.
Meloidogyne enterolobii é uma espécie com ampla distribuição geográfica, polífaga, com elevada taxa de reprodução, referida como muito agressiva e com capacidade para se reproduzir em plantas com genes de resistência para as principais espécies de Meloidogyne (Carneiro et al., 2001; Castagnone-Sereno, 2012). Esta capacidade para superar genes de resistência é uma característica intrínseca da espécie, a qual não é dependente da temperatura do solo, como ocorre para outras espécies, como M. javanica, M. arenaria e M. incognita (Ferris et al., 2013; Carvalho et al., 2015; Rashid et al., 2017). A temperatura de 22ºC, as plantas com genes de resistência utilizadas (tomateiro (Mi-1) e pimentão (N)) foram eficientes contra a infeção e reprodução de M. incognita, porém isso não aconteceu para M. enterolobii (Brito et al., 2007; Kiewnick et al., 2009).
Meloidogyne incognita foi encontrada em apenas duas amostras, contrariando os resultados de Costa et al. (1999), Castellano et al. (2004) e Silva et al. (2016). As duas populações apresentaram o fenótipo I1 de esterases. De acordo com Carneiro et al. (2000), a presença do fenótipo I2 depende do estádio de desenvolvimento do nematoide e do número de fêmeas usadas. As populações de M. incognita tiveram origem em pomares de aceroleira situados em Sobradinho-Bahia, onde a primeira cultura implantada foi a aceroleira. Nessa área, portanto, não houve influência da plantação anterior de goiabeiras que, frequentemente, deixa os solos infestados por M. enterolobii, mas, mesmo assim, esta espécie predominou.
Costa et al. (1999) citam as espécies M. incognita e M. javanica como as espécies de NGR com maior impacto na produção da aceroleira. No entanto, apenas foi detectada uma população de M. javanica nas áreas amostradas. Este facto é sustentado pela ampla gama de hospedeiros e elevada taxa de reprodução e virulência de M. enterolobii o que pode, ao longo dos anos, ter permitido o aumento da frequência desta espécie no campo, suprimindo a reprodução das outras espécies lá existentes (Carneiro et al., 2001).
Finalmente, apenas foram identificadas duas populações de M. arenaria associadas a raízes de aceroleira. As espécies apresentaram o fenótipo A2 e encontravam-se em mistura com populações de M. enterolobii. De acordo com Esbenshade e Triantaphyllou (1990), os fenótipos A1 e A3 de esterases também são descritos para esta espécie, mas não foram detetados nas populações identificadas neste trabalho. Este mesmo fenótipo foi encontrado por Somavilla et al. (2011) e Silva et al. (2016) nas populações de M. arenaria associadas a quivi, no Rio do Grande do Sul, e a diversos vegetais no Estado do Ceará, respetivamente.
Pelo exposto, podemos então concluir que no Submédio do Vale do São Francisco, as aceroleiras se encontravam infetadas por M. enterolobii, M. incognita, M. javanica e M. arenaria, sendo M. enterolobii a espécie mais frequente.
As informações obtidas poderão vir a ser utilizadas para o desenvolvimento de variedades de aceroleira resistentes aos NGR.














