INTRODUÇÃO
Em 2018, a amendoeira ocupava em Portugal uma superfície na ordem dos 35 000 ha, dos quais 19 800 ha na região de Trás-os-Montes, 7 500 ha na região do Alentejo e 7 300 ha na região do Algarve e uma produção da ordem das 20 000 t de amêndoa em casca (INE, 2019). Atualmente, a fileira mostra um dinamismo interessante, com aumento de área de amendoal, entre 2013 e 2018, de 7,0% em Trás-os-Montes e 81,0% no Alentejo. Em algumas regiões de Portugal (Terra Quente Transmontana e Algarve), a amendoeira tem uma enorme importância económica, social, cultural e ambiental, constituindo uma importante fonte de rendimento das populações rurais. No entanto, o amendoal pode sofrer ataques de doenças e pragas que levam à consequente redução da produção assim como da qualidade dos frutos (Benhadi-Marin et al., 2011; Sánchez-Ramos et al., 2014), como é o caso da monosteira, Monosteira unicostata (Mulsant & Rey, 1852) (Hemiptera: Tingidae) uma das principais pragas nos amendoais do Mediterrâneo (Russo et al., 1994; Marcotegui et al., 2015; Sánchez-Ramos et al., 2014, 2017b). No inverno, os adultos de monosteira procuram locais abrigados para hibernar, como a casca de árvores ou vegetação, entre outros. Na primavera, retomam a atividade, alimentam-se e realizam as primeiras posturas, preferencialmente na página inferior das folhas mais jovens. A monosteira pode desenvolver duas a quatro gerações anuais, dependendo das condições climáticas da região/ano/pomar (Pereira et al., 2008; Sánchez-Ramos et al., 2014). A terceira e quarta geração, quando existe, são responsáveis por estragos/prejuízos mais elevados, uma vez que são as gerações com maiores níveis populacionais. As diferentes gerações do inseto podem sobrepor-se ao longo do tempo, ou seja, ovos, ninfas e adultos coexistem em simultâneo, desde junho até ao final do verão (Marcotegui et al., 2015; Sánchez-Ramos et al., 2015, 2017b). Após a eclosão dos ovos, as ninfas, que possuem um comportamento sedentário e gregário, alimentam-se e vivem preferencialmente na página inferior das folhas, onde passam por cinco instares ninfais, antes de chegarem ao estado adulto (Sánchez-Ramos et al., 2015). Os estragos ocasionados podem ser diretos, quando resultam da picada nas folhas, provocando o esvaziamento celular e descoloração, e indiretos pela deposição de excreções na página inferior da folha. Qualquer dos estragos referidos reduz e dificulta a fotossíntese e as trocas gasosas, resultando num precoce envelhecimento das folhas, queda e consequentemente, a redução da produção (Russo et al., 1994; Marcotegui et al., 2015; Sánchez-Ramos et al., 2014, 2015, 2017a, b). Os estragos resultantes da alimentação deste hemíptero podem também comprometer a produção do ano seguinte (Pereira et.al., 2008; Marcotegui et al., 2015; Sánchez-Ramos et al., 2015). Os fatores de limitação natural e, muito em particular, a fauna auxiliar presente no ecossistema, exercem um papel importante no controlo de praga, limitando os seus níveis populacionais (Bolu, 2007; Eilers & Klein, 2009). De acordo com Eilers & Klein (2009), M. unicostata tem como possíveis inimigos os artrópodes pertencentes às seguintes ordens/famílias Araneae, Hymenoptera, Diptera, Forficulidae, Chrysopidae, Miridae, Anthocoridae, Coccinellidae e Carabidae. No entanto, entre estes apenas Araneae e Anthocoridae demonstraram uma atividade predadora comprovada em campo (Eilers & Klein, 2009). Neste sentido, o conhecimento da bioecologia da praga e a correta estimativa do risco são fundamentais para uma tomada de decisão fitossanitária consciente (Pereira et al., 2008; Santos et al., 2016). Neste contexto, o objetivo do presente trabalho consistiu em monitorizar os diferentes estados de desenvolvimento de M. unicostata na amendoeira, em Trás-os-Montes e avaliar os estragos produzidos.
MATERIAL E MÉTODOS
O presente trabalho decorreu em 2018 e 2019, num amendoal de sequeiro, em modo de produção integrada, localizado em Alfândega da Fé. A parcela em estudo possui uma área de 9,3 ha, constituída pelas cultivares Glorieta e Masbovera dispostas num compasso de plantação de 6 m na entrelinha 4 m na linha. O controlo das infestantes foi realizado com destroçador na entrelinha e com a aplicação de herbicida na linha. Com o objetivo de monitorizar as populações de M. unicostata, com periodicidade semanal, efetuou-se a colheita de 20 amostras (20 árvores selecionadas aleatoriamente). Cada amostra era constituída por 20 folhas, colhidas aleatoriamente numa árvore, na condição de amostrar o exterior, interior e diferentes alturas da copa, perfazendo 400 folhas por amostragem. As folhas recolhidas foram colocadas em sacos plásticos (um saco por amostra) e transportadas para laboratório numa mala térmica. As folhas foram observadas individualmente à lupa binocular e registou-se a presença de ovos, ninfas e adultos de M. unicostata, bem como o número de picadas de alimentação do inseto (estragos). Paralelamente, com periodicidade semanal ou quinzenal, entre maio e outubro, procedeu-se à realização da técnica das pancadas. Cada amostra era constituída por duas pancadas/ramo e dois ramos por árvore, recolhendo-se 25 amostras (árvores) selecionadas aleatoriamente. Os artrópodes capturados (M. unicostata e artrópodes auxiliares) foram identificados até ao mais baixo nível taxonómico possível, em laboratório, com auxílio de uma lupa binocular.
RESULTADOS E DISCUSSÃO
Nos dois anos de amostragem, verificou-se a presença de diferentes estados de desenvolvimento de M. unicostata, entre abril/maio e outubro, em qualquer dos métodos de amostragem (folhas e técnica das pancadas). Em 2018, 98% dos adultos e 99% das ninfas de M. unicostata encontravam-se na página inferior das folhas e os restantes 2% na página superior. Nesse ano, observou-se adultos e estados imaturos, nas folhas, durante todo o período de amostragem. O número máximo de adultos foi registado no início de agosto, com 0,1±0,4 adultos/amostra e o número máximo de ninfas registou-se em meados de agosto, com 0,6±1,4 exemplares/amostra (Figura 1). Na técnica das pancados, registou-se a captura de adultos durante todo o período de amostragem e com valores muito superiores aos observados nas folhas (Figura 2). O mesmo não foi verificado para os estados imaturos, uma vez que se observaram em número muito reduzido quando a técnica das pancadas foi utilizada. O número máximo de adultos registou-se em finais de julho e a meados de setembro, com aproximadamente 8 e 9 adultos/amostra (Figura 2).
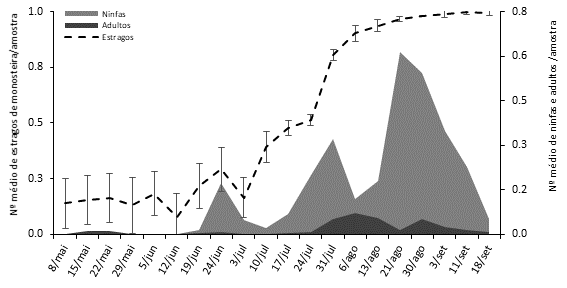
Figura 1 Número médio e respetivo erro padrão de ninfas, adultos de Monosteira unicostata (Mulsant & Rey) e seus estragos em folhas de amendoeira, em 2018.

Figura 2 Número médio e respetivo erro padrão de adultos de Monosteira unicostata (Mulsant & Rey, 1852), predadores e himenópteros parasitóides, capturados através da técnica das pancadas adaptada, 2018.
Em 2019, verificou-se uma distribuição mais uniforme dos adultos de M. unicostata entre a página superior e inferior das folhas, enquanto as ninfas estiveram predominantemente na página inferior. À semelhança de 2018, na amostragem de folhas, o maior número de adultos foi registado no início de agosto, com 0,1±0,2 adultos/amostra, enquanto para as ninfas o máximo de capturas foi observado a meados de julho com 0,4±1,5 ninfas/amostra (Figura 3). As capturas de adultos e ninfas de M. unicostata, obtidos na técnica das pancadas, foram bem superiores, mas com o mesmo padrão do observado nas folhas. O número máximo de adultos registou-se em finais de julho, com 8 adultos/amostra e um pico menor em meados de maio, com 5 adultos/amostra. Relativamente às ninfas, o número máximo de indivíduos recolhido verificou-se em finais de julho com aproximadamente 9 ninfas/amostra (Figura 4). Pereira et al. (2008) descreveram resultados similares num estudo realizado num amendoal transmontano, com o número máximo de adultos observados em meados de julho/início de agosto.
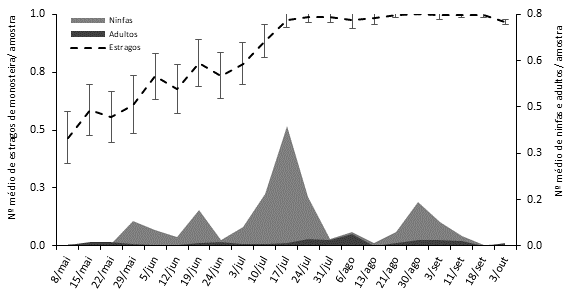
Figura 3 Número médio e respetivo erro padrão de ninfas e adultos e estragos provocados pela Monosteira unicostata (Mulsant & Rey, 1852) observados nas folhas de amendoeira, 2019.

Figura 4 Número médio e respetivo erro padrão de ninfas e adultos de Monosteira unicostata (Mulsant & Rey, 1852), himenópteros parasitoides e predadores capturados através da técnica das pancadas adaptada, 2019.
Em 2018, os estragos provocados pelos adultos e ninfas de M. unicostata mantiveram-se baixos até início de julho, tendo crescido exponencialmente a partir dessa data, observando-se em meados de agosto uma percentagem de folhas com estragos superior a 90% (Figura 1). As folhas observadas apresentavam manchas amarelas/esbranquiçadas na página superior e pontuações negras na página inferior resultantes das excreções do inseto. Observaram-se três períodos de forte aumento da percentagem de folhas atacadas (meados/final de junho, início/meados de julho e meados de julho/agosto), que correspondem precisamente ao aumento do número de ninfas de M. unicostata (Figura 1). Em 2019, os estragos provocados atingiram valores mais elevados logo em meados de maio, com cerca de 50% de folha atacadas. Após essa data, observou-se um aumento regular na intensidade de ataque, com estragos superiores a 90% em meados de julho (Figura 3). Este aumento da percentagem de folhas com estragos, também correspondeu ao aumento do número de ninfas de M. unicostata. A análise dos resultados obtidos nos dois anos de estudo (Figura 1 e 2) mostra a existência de uma relação direta entre o aumento do número de ninfas e o aumento dos estragos. Os resultados referidos anteriormente indicam que as ninfas exercem uma atividade fitófaga capaz de causar estragos relevantes nas folhas da amendoeira quando os níveis populacionais são elevados. Os adultos registados nas folhas foram em menor número e sem uma relação direta com o aumento dos estragos. Os adultos de M. unicostata possuem maior mobilidade (Sánchez-Ramos et al., 2017b), o que pode justificar o baixo número de indivíduos adultos observados nas folhas.
Em 2018, à semelhança das ninfas, foram detetados três períodos de maior ocorrência de adultos, o que pode indicar a existência de três gerações do inseto (Figuras 1 e 2). Em 2019, observamos igualmente três períodos de maior abundância de ninfas (fim de maio/meados de junho; meados-fins de julho e fim de agosto) e de adultos, embora no caso dos adultos, os três períodos de maior abundância sejam menores e menos evidentes (Figuras 3 e 4). Segundo Sánchez-Ramos et al. (2017b), este hemíptero desenvolve entre duas e quatro gerações anualmente, dependendo da área geográfica, uma vez que as diferenças na temperatura influenciam o desenvolvimento dos diferentes estados do inseto e, consequentemente, o número de gerações. Os resultados obtidos neste estudo são concordantes com os obtidos por Pereira et al. (2008) e Sánchez-Ramos et al. (2014), que referem a existência de três gerações anuais de M. unicostata, podendo em condições climáticas mais favoráveis ao desenvolvimento do inseto, completar uma quarta geração.
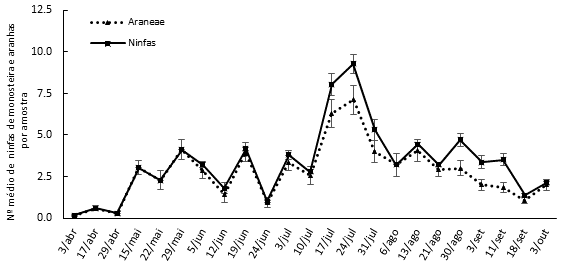
No que respeita à captura de artrópodes auxiliares, através da técnica das pancadas, em 2018, foram capturados exemplares de auxiliares predadores pertencentes às seguintes ordens: Araneae, Neuroptera, Thysanoptera, Coleoptera (família Coccinellidae) e Hymenoptera (família Formicidae), os quais podem exercer ação relevante sobre pragas da amendoeira. De acordo com Bolu (2007) e Eilers & Klein (2009), algumas espécies de artrópodes pertencentes às ordens/famílias Araneae, Hymenoptera, Diptera, Forficulidae, Chrysopidae, Miridae, Anthocoridae, Coccinellidae e Carabidae exercem uma ação importante na limitação das populações de M. unicostata. O maior número de predadores ocorreu entre meados de junho e meados de agosto, com o pico no início de agosto, sendo que este foi o período em que se observou maior número de adultos de M. unicostata. Os himenópteros parasitoides surgiram em maior número entre meados de maio a meados de julho. Nas restantes datas de amostragem, registou-se uma presença residual deste grupo, apesar do aumento do número de adultos presentes na copa (Figura 3). Em 2019, observa-se elevada presença de predadores entre meados de maio e o final de agosto, acompanhando a flutuação dos níveis populacionais de M. unicostata (Figura 4). Dentro do grupo de predadores, a comunidade Araneae apresentou um número máximo de indivíduos em meados de julho, com 7,1 ± 4,0 exemplares/amostra (Figura 5). No decorrer do período de amostragem, foi possível constatar que o grupo Araneae apresentou três períodos de maior ocorrência (meados de maio/meados de junho; meados de julho e finais de agosto), coincidentes com o período em que foram registadas as capturas mais elevadas de ninfas de monosteira (Figura 5). É de salientar que os auxiliares predadores identificados pertencem às seguintes ordens/famílias: Araneae, Dermaptera, Neuroptera, Formicidae, Coccinellidae, Carabidae e Staphylinidae.
CONCLUSÕES
Os resultados obtidos no presente estudo mostram que M. unicostata desenvolveu três gerações por ano, em Trás-os-Montes, a primeira entre meados de maio e meados de junho, a segunda geração entre meados de junho e o final de julho e a terceira geração entre finais de julho e outubro. Os maiores níveis populacionais da praga (ninfas e adultos), observam-se, normalmente, a partir de meados de julho, coincidente com a terceira geração da praga, a que maiores estragos provoca. A partir de meados/final de julho, mais de 90% das folhas encontra-se com estragos provocados por M. unicostata. A intensidade de ataque registada nos dois anos de amostragem comprova a importância deste hemíptero em Trás-os-Montes e a pertinência da sua monitorização para a implementação de medidas de luta contra a praga sempre que se considere necessário.