INTRODUÇÃO
A goiabeira (Psidium guajava) é uma fruteira de grande importância económica, distribuída mundialmente (Ashokkumar et al., 2021). Possui um elevado teor nutritivo, sendo composta por fibras, açúcares totais, vitaminas A, do complexo B e C, ß-caroteno e licopeno (Vitti et al., 2020). Além do seu consumo em fresco, é muito utilizada na produção de compostos industrializados como doces, sumos, geleia, polpa, entre outros (Vitti et al., 2020).
A produtividade dessa fruteira tem sofrido perdas significativas ao longo dos anos, devido à forte incidência dos nemátodes das galhas radiculares (NGR), Meloidogyne sp. Meloidogyne enterolobii é considerada a espécie mais agressiva em comparação com outras espécies tropicais devido à sua alta taxa de reprodução, grande número de hospedeiros e forte indução de galhas. A combinação desses fatores faz da espécie uma ameaça à produção de goiaba no mundo inteiro, resultando na destruição de vários pomares (Ashokkumar et al., 2019, 2021).
Alguns dos sintomas característicos das plantas infestadas por M. enterolobii são: aparecimento de galhas de dimensões variadas nas raízes, necrose e redução no número de radicelas, seguidos de amarelecimento e bronzeamento das margens de folhas e ramos, com intensa desfolha, floração tardia e redução do tamanho dos frutos, entre outros (Ashokkumar e Poornima, 2019; Ashokkumar et al., 2021).
Entre as práticas de controlo dos NGR, tem sido adotada a rotação de culturas, plantas resistentes, microrganismos antagónicos e nematodicidas sistémicos (Abdel-Rahman et al., 2013; Mwamba et al., 2021). No entanto, vários nematodicidas sintéticos têm vindo a ser banidos do mercado devido à sua alta toxidade e elevado custo (Abdel-Rahman et al., 2013; Kearn et al. 2014). O fato de os nematodicidas sintéticos serem produtos que não garantem a supressão dos nemátodes a longo prazo, além das preocupações ambientais e de saúde humana, tem restringido cada vez mais o seu uso. Em relação à rotação de culturas, o grande desafio diz respeito a encontrar plantas não hospedeiras. Quanto ao uso de plantas resistentes, ainda não são conhecidas para todas as espécies cultivadas. Por fim, o uso de microrganismos antagónicos também tem sido difícil de implementar devido à sua fraca adaptação ao ambiente, além da resistência dos produtores em utilizá-los.
Nos últimos anos, as medidas de controlo das doenças das plantas têm vindo a assentar numa intervenção preventiva, tendo como foco principal a redução dos custos e a segurança ambiental. A ação preventiva do extrato pirolenhoso deve-se à sua composição, pois possui elementos químicos que favorecem a absorção de nutrientes, melhorando, consequentemente, a resistência física das plantas. O extrato pirolenhoso, resultante da condensação da fumaça gerada pela queima da madeira durante o processo de carbonização, pode ser um meio alternativo de controlo devido à presença de compostos como aldeídos, fenóis, terpenos, ácidos orgânicos, entre outros (Santos et al., 2017; Farias et al., 2020). Santos et al. (2017) relataram a redução no parasitismo de M. incognita na cultura da alface após aplicação do extrato pirolenhoso. Farias et al. (2020) observaram que o fator de reprodução de Scutellonema bradys e Pratylenchus sp. foi reduzido em 43% após tratar tubérculos de inhame infectados com extrato pirolenhoso de Cocos nucifera.
Assim, o objectivo principal deste trabalho foi avaliar o potencial de diferentes concentrações de extrato pirolenhoso no controlo de M. enterolobii em plantas de goiabeira, cv. Paluma, cultivadas em estufa.
MATERIAL E MÉTODOS
Localização e caracterização da área experimental
O ensaio foi conduzido em estufa e no Laboratório de Fitopatologia, ambos localizados no Centro de Ciências e Tecnologia Agroalimentar da Universidade Federal de Campina Grande - CCTA/UFCG, Campus de Pombal-PB, com goiabeiras da cv. Paluma. O extrato pirolenhoso foi adquirido na empresa Ophicina Orgânica Fertilizantes Ltda, extraído da madeira de eucalipto. O seu pH é de 3,5, apresentando na sua composição compostos como água, ácidos orgânicos, álcoois, aldeídos, cetonas, furano, pirano e compostos fenólicos, de acordo com as informações do fabricante.
As plantas foram cultivadas num solo caracterizado como Luvissolo Crômico (EMBRAPA, 2006), colhido na camada de 0-30 cm em área pertencente ao Campus de Pombal (PB). Após seco ao ar, destorroado e passado em peneira de malha de 2,0 mm, o solo foi encaminhado para o laboratório de análises de solo e nutrição de plantas do CCTA/UFCG para a sua caracterização química e física conforme procedimentos descritos pela EMBRAPA (2011).
Em relação às características químicas do solo, foram descritos: pH (CaCl2) = 6,03; H+Al = 0,50; Al3+ = 0,50; P (mg kg-1) = 9,17; K+ (cmol dm-3) = 0,40; Na+ (cmol dm-3) = 1,04; Ca2+ (cmol dm-3) = 4,8; Mg2+ (cmol dm-3) = 3,30; MO (kg k-1) = 7,40; CTC+ (cmol dm-3) = 9,54. As características físicas observadas foram: areia (g kg-1) = 636,8; silte (g kg-1) = 97,2; argila (g kg-1) = 266,0; Ds (g cm-3) = 1,36; Dp (g cm-3) = 2,64; porosidade (m3 m3) = 0,48; sendo classificado com classe textural franco-arenoso.
Procedimentos experimentais
Adotou-se o delineamento inteiramente casualizado, com 11 tratamentos, correspondentes a diferentes concentrações do extrato pirolenhoso (0,0%-controlo; 0,5%; 10%; 15%; 20%; 25%; 30%; 35%; 40%; 50% e 100%) diluído em água, com cinco réplicas por tratamento. Cada unidade experimental consistiu de uma planta por vaso, contendo 5 dm3 de substrato.
O solo foi esterilizado previamente em autoclave a 120°C sob pressão de 1,05 Kgf cm-2, durante uma hora. A adubação com macro e micronutrientes foi realizada conforme recomendação em Novais et al. (1991), para ensaios em vasos com solo, com os devidos ajustes em função do resultado da análise de solo.
Foi utilizada a cv. Paluma, devido à sua importância económica e à sua aceitação nacional, além da alta suscetibilidade a M. enterolobii. Para isso, frutos da região do sertão da Paraíba foram colhidos para produção de plantas. As sementes foram retiradas através do despolpamento dos frutos, secas à sombra, e semeadas cerca de três sementes por copo, a uma profundidade de aproximadamente 3 cm e transplantadas apenas uma planta por vaso, sendo este procedimento realizado quando as plantas atingiram uma altura de 8-10 cm.
Obtenção e aplicação do inóculo
O inóculo de M. enterolobii constituído por ovos e jovens do segundo estádio (J2), foi obtido a partir de populações puras, colhidas de raízes de plantas de tomateiro (Solanum lycopersicum L.) cv. Santa Clara, mantidas em estufa. A espécie de nemátode utilizada foi identificada por eletroforese de esterases (Esbenshade e Triantaphyllou, 1990) pela Universidade Federal Rural de Pernambuco.
Quinze dias após o transplante das plantas de goiabeira para os vasos, os nemátodes foram extraídos das raízes de tomateiro, pela técnica de Hussey e Barker (1973), modificada por Bonetti e Ferraz (1981), e inoculados nas plantas de goiabeira na forma de suspensão, equivalente a 5000 ovos/J2, distribuídos em três orifícios abertos próximos do hipocótilo das plantas. Noventa e seis horas após a inoculação, foram aplicados os tratamentos, equivalente às concentrações do extrato pirolenhoso na superfície de cada vaso. Posteriormente, as plantas foram mantidas com irrigações diárias duas vezes ao dia. O solo dos vasos foi mantido em cobertura com palhada, permitindo a manutenção de uma temperatura média de 28 °C e a humidade acima de 60%.
Avaliação do parasitismo
As avaliações foram realizadas 90 dias após as aplicações do extrato pirolenhoso nas plantas de goiabeira inoculadas com M. enterolobii. Para isso, cada planta foi retirada cuidadosamente dos vasos e cortada na altura do colo para separar a parte aérea das raízes. O sistema radicular foi lavado em água corrente e mergulhado numa solução de floxina B por 10 minutos, para melhor visualização de massas de ovos (Silva et al., 1988).
O número de galhas (NG) e de massas de ovos (MO) foram quantificados com o auxílio de lupa de Hansoros (Silva et al., 1988). A estimativa do número de J2 e ovos (OR) das raízes foi realizada utilizando a metodologia de Coolen e D’ Herde (1972); as raízes foram lavadas em água corrente para a eliminação das partículas de solo e colocadas em 300 mL de água, tendo sido trituradas com um liquidificador por 20 segundos, a baixa rotação, seguida de centrifugação em solução de sacarose. O número total de ovos e J2 foi contado com auxílio do microscópio óptico e câmara de Peters; posteriormente, esse número foi dividido pela massa da raiz, obtendo-se o número de J2 por grama de raiz.
A estimativa do número de J2 no solo foi realizada a partir de uma amostra de 100 cm3 de solo de cada tratamento. Foi utilizada a técnica de centrifugação em solução de sacarose (Jenkins, 1964).
A quantificação da redução do fator de reprodução (RFR) foi realizada de acordo com a metodologia de Moura e Regis (1987), que consideram as seguintes categorias relativamente à resposta aos tratamentos: com RFR do nemátode de 100%, as plantas são classificadas como altamente resistentes ou imunes (AR ou I), de 96 a 99% resistentes (R), de 76 a 95% moderadamente resistentes (MR), de 51 a 75% pouco resistentes (PR), de 26 a 50% como suscetíveis (S) e 25% como altamente suscetíveis (AS). Para o cálculo da RFR, tomou-se o maior valor de FR como padrão de suscetibilidade, considerado como 0 % de redução.
O índice de reprodução (IR) foi determinado utilizando a reprodução dos nemátodes no tomateiro cv. Santa Clara, controlo (100%), em comparação com as plantas de goiabeira tratadas com as diferentes concentrações de extrato pirolenhoso, conforme metodologia de Taylor & Sasser (1978). Assim, a população final (Pf) encontrada nas plantas de goiabeira foi dividida pela encontrada no tomateiro, definindo assim, os índices de reprodução. A classificação quanto aos níveis de proteção para as plantas de goiabeira, após tratadas, foi obtida pelo critério de reprodução estabelecido por Taylor (1967), em que: S - plantas suscetíveis, reprodução normal, IR acima de 51%; LR - plantas levemente resistentes, IR de 26 a 50%; MoR - plantas moderadamente resistentes, com IR de 11 a 25%; MR - plantas muito resistentes, IR de 1 a 10%; AR/I - plantas altamente resistentes/imunes, IR abaixo de 1%. No presente estudo, a a resistência foi considerada em função do efeito do extrato pirolenhoso no controlo dos nemátodes.
O fator de reprodução (FR) foi calculado utilizando a seguinte fórmula: FR = população final (número de ovos/planta + número de J2/vaso)/população inicial inoculada (5 000 ovos/J2), para definir resistência (FR<1) e suscetibilidade (FR≥1), conforme recomendado por Oostenbrink (1966).
Análise estatística
Os dados foram submetidos a análise de variância, pelo teste F (p<0,05) e quando significativos, as médias foram ajustadas em equações de regressão, com auxílio do software Sigma Plot 11.0. Após o ajuste das equações de regressão, foram estimadas as concentrações do extrato pirolenhoso (x) para reduzir em 50% as médias das variáveis de parasitismo dos nemátodes (CE50) (1/2*Y).
RESULTADOS E DISCUSSÃO
foram observadas diferenças significativas entre as concentrações do extrato pirolenhoso para todas os parâmetros analisados (número de galhas, massa de ovos, ovos na raiz, J2 no solo, J2 na raiz, nemátodes por grama de raiz, RFR, IR e FR) (Quadro 1).
Quadro 1 Análise de variância para o número de galhas (NG), massa de ovos (MO), ovos na raiz (OR), jovens do segundo estádio juvenil (J2) no solo (JS), jovens do segundo estádio juvenil (J2) na raiz (JR), nemátodes por grama de raiz (Ng/R), redução do fator de reprodução (RFR), índice de redução (IR) e fator de reprodução (FR) de Meloidogyne enterolobii em goiabeira, submetidos a diferentes concentrações de extrato pirolenhoso. Pombal-PB, 2020
| Fonte de Variação | Quadrado Médio | ||||||||
| NG (Und) | MO (Und) | OR (Und) | JS (Und) | JR (Und) | Ng/R (Und) | RFR (%) | IR (%) | FR - | |
| Tratamento | 183,81** | 16820,4** | 490,4** | 549,64** | 229,2** | 287,4** | 3764,7** | 0,37** | 0,45** |
| Desvio Padrão | 12,67 | 609,1 | 2,39 | 1,33 | 12,46 | 2,77 | 5,6 | 0,0005 | 0,0009 |
| CV (%) | 16,46 | 23,21 | 15,64 | 17,20 | 22,56 | 30,88 | 2,77 | 16,52 | 20,04 |
**significativo a 1%; CV: coeficiente de variação
O extrato pirolenhoso teve efeito positivo no controlo de M. enterolobii em plantas de goiabeira. As médias referentes ao número de galhas (Figura 1A), massa de ovos (Figura 1B), ovos na raiz (Figura 1C) e J2 no solo (Figura 1D) ajustaram-se ao modelo de regressão exponencial decrescente, em função das concentrações do extrato pirolenhoso adicionado ao solo. A concentração do extrato pirolenhoso para reduzir em 50% (CE50) o número de galhas, massa de ovos, ovos na raiz e J2 no solo foi de 14,38%, 0,53%, 0,09% e 0,11%, respectivamente. Reduções mais acentuadas do número de galhas foram obtidas a partir da aplicação da concentração de 20% do extrato pirolenhoso.
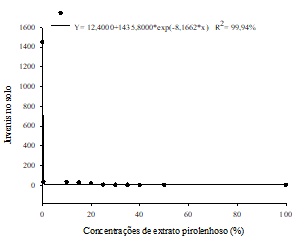



Figura 1 Número médio de galhas (A), massa de ovos (B), ovos na raiz (C) e jovens do segundo estádio juvenil (J2) no solo (D), após aplicação de diferentes concentrações de extrato pirolenhoso, em plantas de goiabeira inoculadas com 5000 ovos/J2 de Meloidogyne enterolobii.
A eficácia do extrato pirolenhoso na redução dessas variáveis, deve-se, possivelmente, à presença de compostos químicos como: cetonas, ésteres, aldeídos, ácidos orgânicos, metanol, alcatrão solúvel, cadeias fenólicas, entre outros, que ao serem absorvidos pelas plantas, podem ter ação nematodicida (Nakai et al., 2007). Resultados semelhantes foram observados por Santos et al. (2017), onde foi obtida uma redução superior a 68% para o número de galhas, utilizando uma dose a partir de 0,5% do extrato pirolenhoso na cultura da alface.
Para as massas de ovos (Figura 1B), ovos na raiz (Figura 1C) e J2 no solo (Figura 1D), observou-se uma redução acentuada e constante com concentrações abaixo de 10% do extrato pirolenhoso, o que demonstra a eficácia na neutralização da ação parasitária do nemátode nas plantas de goiabeira. Estudos baseados em extratos pirolenhosos já demonstraram uma importante bioatividade para outros nemátodes fitoparasitas, tais como, M. incognita, Scutellonema bradys e Pratylenchus spp. (Santos et al., 2017; Farias et al., 2020).
A redução dos nemátodes não está associada somente ao contato direto dos compostos presentes no extrato pirolenhoso, mas também à disponibilidade desses que viabilizam as propriedades físicas, químicas e biológicas do solo, potencializando a absorção dos nutrientes pelas plantas e, assim, promovendo uma maior capacidade de resistência ao ataque dos nemátodes (Zanetti, 2004; Michereff-Filho et al., 2008).
O número de J2 na raiz (Figura 2A) e nemátodes por grama de raiz (Figura 2B), permitiu um ajustamento ao modelo de regressão exponencial decrescente em função das concentrações do extrato. Para essas variáveis, observou-se uma redução efetiva a partir da menor concentração de extrato (0,5%), suficiente para ocasionar uma redução superior a 50% da população de M. enterolobii.
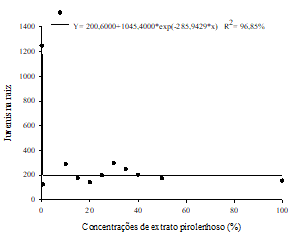

Figura 2 Número médio de jovens do segundo estádio juvenil (J2) na raiz (A), nemátodes por grama de raiz (B), após aplicação de diferentes concentrações de extrato pirolenhoso, em plantas de goiabeira inoculadas com 5000 ovos/J2 de Meloidogyne enterolobii.
Para o Índice de reprodução, todas as concentrações aplicadas do extrato pirolenhoso, promoveram uma redução da infecção de M. enterolobii nas plantas de goiabeira, com valores de infecção abaixo de 1% (Tabela 2). Quanto ao fator de reprodução, todos os tratamentos com as concentrações entre 0,5 e 100% do extrato ficaram com valores abaixo de 1, o que significa que as plantas de goiabeira tratadas com extrato pirolenhoso não sofreram danos causados por M. enterolobii (Quadro 2).
Quadro 2 Índice de redução (IR), fator de reprodução (FR) e redução do fator de reprodução (RFR) de Meloidogyne enterolobii, em solo tratado com diferentes concentrações de extratos pirolenhoso. Pombal, PB. 2020. Média de 5 réplicas/tratamento
| Concentrações | Índice de Redução1 | Fator de Reprodução2 | Redução do Fator de Reprodução3 | ||||
|---|---|---|---|---|---|---|---|
| IR (%)** | Classe | FR** | Classe | RFR (%) | Classe | ||
| 0 | - | - | 1,06 | S | - | - | |
| 0,5 | 0,05 | AR | 0,06 | R | 94,07 | R | |
| 10 | 0,08 | AR | 0,09 | R | 91,09 | R | |
| 15 | 0,06 | AR | 0,06 | R | 94,06 | R | |
| 20 | 0,05 | AR | 0,05 | R | 94,81 | R | |
| 25 | 0,05 | AR | 0,06 | R | 94,12 | R | |
| 30 | 0,08 | AR | 0,08 | R | 91,95 | R | |
| 35 | 0,06 | AR | 0,07 | R | 93,46 | R | |
| 40 | 0,05 | AR | 0,05 | R | 94,81 | R | |
| 50 | 0,04 | AR | 0,05 | R | 95,24 | AR | |
| 100 | 0,04 | AR | 0,04 | R | 95,59 | AR | |
| Tomateiro | 100,00 | S | 1,09 | S | Padrão | Padrão | |
| CV (%) | 16,52 | - | 20,04 | - | 2,77 | - | |
1Cultura suscetível (acima de 50% em relação ao tomateiro); LR: levemente resistente (26% a 50%); MoR: moderadamente resistente (11% a 25%); MR: muito resistente (1% a 10%); AR: altamente resistente (menos de 1%) e I: imune (quando não houve reprodução). 2FR = resistente (FR < 1); S = suscetível (FR ≥ 1). 3AR =Altamente Resistente (95,0 - 99,9); R = resistente (90,0 - 94,9); MR = Moderadamente Resistente (75,0 - 89,9); e S = suscetível (menor que 75,0), adaptado de Moura (1997).
Os resultados do fator de reprodução e índice de reprodução permitiram constatar que as plantas tratadas com as concentrações de 0,5 a 40% do extrato pirolenhoso se mostraram mais protegidas relativamente ao parasitismo de M. enterolobii, e ainda mais nas concentrações de 50 e 100% (Quadro 2).
De acordo com as informações do vendedor, o extrato pirolenhoso possui na sua composição ácidos orgânicos, álcoois, aldeídos, cetonas, furanos, piranos e compostos fenólicos. Os aldeídos, fenóis, terpenos e ácidos orgânicos têm demonstrado efeito nematodicida contra M. incognita (Seo e Kim, 2014; Santos et al., 2017), Heterodera zeae (Faizi et al., 2011), Panagrellus redivivus e Caenorhabditis elegans (Li et al., 2009; Abdel-Rahman et al., 2013).
Puja e Pannu (2009) descreveram que vários terpenóides e seus derivados possuem atividade nematodicida. Os J2 de M. incognita foram inibidos por compostos como, por exemplo, dimetoxigossipol, gossipol, metoxigossipol e hemigossipol. Da mesma forma, timol, linalol, geraniol e cânfora foram eficazes no controlo de J2 de M. incognita e de M. javanica (Puja e Pannu, 2009).














