INTRODUÇÃO
O bagaço de azeitona (BA) oriundo do processo de extração de azeite por centrifugação contínua em duas fases é um subproduto de difícil degradação. A elevada humidade e fitotoxicidade do BA limitam a sua utilização, sendo necessário encontrar formas alternativas para a sua valorização. Portugal representa 5% da produção de azeite da União Europeia, produzindo cerca de 100 mil toneladas de azeite e 547 mil toneladas de BA anualmente (GPP, 2020; Hernández et al., 2021).
O processo de compostagem de BA poderá ser uma alternativa de valorização, tendo em vista a obtenção de compostos que podem ser reintroduzidos no ciclo de nutrientes, contribuindo para a economia circular. Os microrganismos são os grandes agentes que promovem a degradação aeróbica dos resíduos, e podem diferenciar-se de acordo com as condições térmicas da pilha de compostagem (Panaliveloo et al., 2020), comumente dividas em fase mesófila ou de ativação, fase termófila e fase de maturação ou arrefecimento. Os grupos mais abundantes de microrganismos nos processos de compostagem compreendem bactérias e fungos, e sabe-se que a atividade da população bacteriana é mais intensiva durante as fases mesófila e termófila devido ao rápido metabolismo das bactérias e a sua rápida adaptação as mudanças e condições do substrato durante a compostagem, enquanto as populações fúngicas atuam especialmente quando ocorre a humificação, durante a fase de maturação (Tortosa et al., 2020).
Tanto quanto se sabe, existem poucos estudos que tenham avaliado a comunidade microbiana durante o processo de compostagem de bagaço de azeitona (Filippi et al., 2002). Face ao exposto o presente trabalho tem por objetivos: (I) estudar a evolução da comunidade bacteriana ao longo do processo de compostagem de BA; (II) Isolar e identificar bactérias com a finalidade de explorá-las no futuro em processos de compostagem de BA.
MATERIAL E MÉTODOS
Compostagem
A compostagem foi realizada na empresa ACUSHLA S.A. azeites biológicos em pilhas trapezoidais (Figura 1) com proporções de BA: fonte de azoto: agente estruturante iguais a 4,1:1:8,2 (pilha A), 4,1:1:4,1 (pilha B), 1:2:1 (pilha C) e 4,1:1:8,2 (pilha D). As pilhas foram reviradas manualmente, com exceção da pilha D, que permaneceu estática ao longo do processo. Foram recolhidas 5 amostras compósitas de cada pilha em três fases distintas da compostagem: T0, correspondente ao tempo inicial; T1, correspondente a fase mesófila, de ativação; e T2, fase termófila, com exceção da pilha C, onde a amostragem do T1 não foi possível.
Isolamento de bactérias
Para o isolamento de bactérias utilizou-se o método da diluição seriada, utilizando uma solução tampão fosfato salino (PBS). Diluições de 10-5 e 10-6 foram utilizadas para inocular placas de petri contendo meio de cultura PCA (Plate Count Agar), em duplicata. As placas foram incubadas no escuro, a 25 ºC (T0), 30ºC (T1) e 45ºC (T2), para mimetizar as condições térmicas de cada uma das fases de compostagem, durante 48h. Ao fim deste tempo procedeu-se à contagem do número de colónias de cada morfotipo, e à obtenção de culturas puras.
Identificação das bactérias
A identificação das bactérias obtidas foi feita pela sequenciação de uma porção do gene 16S do rRNA. Para tal, procedeu-se à extração de DNA dos isolados bacterianos utilizando o kit REDExtract-N-AmpTM Plant PCR (Sigma-Aldrich), seguindo as instruções do fornecedor. A amplicação do DNA foi realizada utilizando o mesmo Kit, no termociclador MyCycler da BioRad, com 20 µl de mistura final, que possuía a Taq polimerase (1,25 U), os primers 27F (0,2 µM) e 534R (0,2 µM), dNTP’s (200 µM), tampão contendo MgCl2 (2,5 mM), água ultrapura estéril e 2 µL de DNA bacteriano. Os produtos amplificados foram purificados e sequenciados usando os serviços da Macrogen Inc. (Madrid, Espanha). As sequências de DNA obtidas foram analisadas utilizando o software informático BioEdit. Recorrendo ao servidor NCBI (http://www.ncbi.nlm.nih.gov) e utilizando o algoritmo BLAST, foi analisada a homologia das sequências obtidas com outras sequências presentes na base de dados GenBank.
Análise estatística
A diversidade da comunidade bacteriana entre as pilhas e fases da compostagem foi avaliada pela riqueza de espécies (nº de espécies) e abundância (nº de isolados). As diferenças entre médias foram determinadas por análise de variância ANOVA e Tukey, no software PAST 4.10. Para avaliar a similaridade da comunidade microbiana entre pilhas e fases de compostagem, procedeu-se à elaboração de uma ordenação não métrica multidimensional (NMMS) utilizando o coeficiente de similaridade de Bray-Curtis. Para detetar as diferenças significativas, aplicou-se o ANOSIM. Estas duas análises foram efetuadas recorrendo ao software Community Analysis Package v. 5.0.
RESULTADOS E DISCUSSÃO
Em termos de composição, a ordenação não métrica multidimensional (Figura 2) e ANOSIM, mostram que a comunidade bacteriana varia significativamente (p=0,001) entre as diferentes fases da compostagem (T0, T1 e T2). Por sua vez, as diferenças de composição bacteriana entre pilhas foram significativas (p<0,05) apenas na fase inicial T0 (A vs C, A vs D, B vs C e C vs D) e termófila T2 (A vs C, B vs D e C vs D).
As espécies bactérias que mais contribuíram para a diferenciação entre tempos foram Acetobacter cf. tropicalis, Klebsiella pneumoniae, Bacillus siamensis, Bacillus subtillis, Leuconostoc mesenteroides, Mycoplasma wenyonii, Enterococcus saccharolyticus e Gluconacetobacter cf. aggeris.

Figura 2 Ordenação não métrica multidimensional (NMMS) da comunidade bacteriana agrupada por matriz biológica (i.e., fases da compostagem - T0, T1, T2; e pilha - A, B, C e D), usando o coeficiente de Bray-Curtis.
É importante ressaltar que a espécie Salmonella enterica foi detetada somente na fase de ativação (T1), provavelmente devido à presença de estrume de animais (fonte de azoto), mas que desapareceu na fase termófila. Isso demonstra o importante papel da compostagem no processo de sanitização do composto, eliminando os organismos patogénicos (Palaniveloo et al., 2020).
Na fase termófila T2, observou-se uma abundância das bactérias Pseudomonas thermotolerans e dos géneros Pseudomonas e Bacillus, que são considerados eficientes na decomposição de matéria orgânica e sua transformação em húmus, e benéficas à melhoria das propriedades do solo aquando da aplicação do composto (Pant et al., 2012).
Em termos de diversidade, verificaram-se diferenças significativas (p<0.05) entre fases de compostagem. Quer a riqueza (Figura 3) como a abundância (Figura 4) de espécies bacterianas foi significativamente superior durante a fase de ativação (mesófila), quando comparado com a fase inicial (T0) ou mesmo a fase termófila, onde se registou o valor mais baixo. A comparação entre pilhas mostra diferenças significativas (p<0,05) ao nível da riqueza e da abundância de espécies no tempo inicial, com a pilha C revelando valores maiores e a pilha D valores menores. De igual modo, durante a fase termófila (T2), observaram-se diferenças significativas na riqueza de espécies entre as pilhas C e D, apresentando a pilha D um valor superior, também observado na abundância.
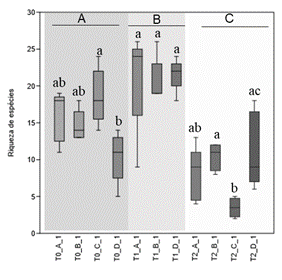
Figura 3 Gráfico Boxplot da riqueza de espécies para as diferentes pilhas (A, B, C e D) e fases da compostagem (T0, T1, T2). As barras com letras diferentes são estatisticamente diferentes, p<0,05, entre tempos (maiúscula) e entre pilhas (minúscula).
Conclusões
Os resultados observados neste estudo evidenciam que a comunidade bacteriana evolui de forma diferente ao longo das diferentes fases do processo de compostagem do bagaço de azeitona. Esta variação da comunidade parece ter importância na transformação dos resíduos orgânicos em compostos livres de microrganismos patogénicos e de fitotoxicidade. Foram igualmente detetadas diferenças na composição bacteriana entre as quatro pilhas estudadas. Esforços futuros serão direcionados à exploração do potencial uso de microrganismos como bioprodutos, acelerando o processo de compostagem e melhorando as características do composto final.
















