INTRODUÇÃO
As substâncias psicoativas (SPAs) são bastante consumidas em todo mundo sendo consideradas contaminantes de preocupação emergente (Ramírez-Malule et al., 2020). As SPAs e seus metabólitos têm sido detetados nos ecossistemas aquáticos e terrestres devido principalmente ao consumo humano e posterior excreção via urina (entrada nas estações de tratamento de águas residuais), mas também devido ao descarte inadequado pelos fabricantes/produtores ilegais (Cunha et al., 2019; Santana-Viera et al., 2023). Apesar das concentrações de SPAs no solo serem baixas, as suas propriedades biológicas e a mistura com outros compostos podem representar um risco relevante para os organismos que vivem no solo. Por outro lado, também podem ter impacto na saúde humana visto que as SPAs e fármacos apresentam efeitos biológicos mesmo em concentrações muito baixas e podem ser encontradas nos produtos alimentares provenientes de solos contaminados (Gworek et al., 2021).
A metafedrona (3-MMC) e a cetamina são SPAs utilizadas para fins recreativos devido aos seus efeitos psicoestimulantes. Estes contaminantes são introduzidos nos solos agrícolas através da irrigação com águas contaminadas ou a aplicação de lamas provenientes das estações de tratamento de águas residuais, entre outros (Subedi & Kannan, 2015), podendo causar efeitos nos organismos edáficos (Yücel, 2022). Estas duas SPAs têm sido quantificadas nas águas residuais em concentrações que podem chegar às 972 µg/L (Mwenesongole et al., 2013; Lin et al., 2014).
Apesar da grande preocupação com os efeitos das SPAs na saúde humana, pouca atenção tem sido dada aos seus efeitos toxicológicos nos organismos terrestres e cadeias alimentares. Neste estudo, a minhoca da espécie Eisenia fetida foi utilizada como organismo modelo uma vez que é considerada um bioindicador fundamental na avaliação dos processos e efeitos de contaminação dos solos (OECD, 1984). Assim, este trabalho teve como principal objetivo a avaliação dos efeitos genotóxicos da metafedrona e cetamina em E. fetida.
MATERIAIS E MÉTODOS
Ensaio de exposição
Para a realização do ensaio foi inicialmente preparado o solo artificial de acordo com as recomendações da norma ISO (2012), constituído por areia (0,7 mm, Axton), caulino (MIBAL, Portugal) e turfa (SIRO 100), na proporção de 70, 20 e 10%, respetivamente, com base no peso seco (ps). Foi determinada a capacidade máxima de retenção de água (CMRA) e posteriormente ajustado o valor de humidade para 40% da CMRA. Adicionalmente, o valor de pH inicial do solo artificial foi corrigido para 6,0±0,5 através da adição de CaCO3 (Labsolve, Portugal).
Para a realização do ensaio de exposição foram pesadas e selecionadas 300 minhocas adultas, com clitelo bem desenvolvido e com biomassa entre 300 e 600 mg. Antes do ensaio de exposição, as minhocas foram colocadas a aclimatizar em solo artificial durante 24 a 48 horas e posteriormente ficaram a depurar.
A metafedrona foi adquirida na LGC Standards GmbH (Wesel, Alemanha), enquanto a cetamina foi adquirida na forma comercial do medicamento NIMATEK®, para uso veterinário.
Os organismos foram expostos a três concentrações de metafedrona e cetamina, nomeadamente: 25, 250 e 2500 µg/kg e um controlo (sem adição de composto) sendo realizadas três réplicas por concentração.
Para o ensaio de exposição, em cada recipiente-teste foram colocadas 500 g de solo (equivalente a ps) com a respetiva concentração do composto. Posteriormente, foram colocadas 10 minhocas adultas em cada recipiente e 1g de aveia biológica moída (previamente esterilizada em câmara de luz UV). No fim, os recipientes-teste foram fechados com tampas furadas para permitir as trocas gasosas, mas impedir a saída das minhocas. O ensaio decorreu sob condições laboratoriais constantes de temperatura (20±2 ºC), fotoperíodo (16-h luz e 8-h escuro), intensidade de luz (entre 400 e 800 lux) e arejamento.
A cada 7 dias foi realizado o controlo gravimétrico do teor de humidade do solo bem como a alimentação das minhocas. Ao fim de 28 dias de exposição as minhocas foram retiradas dos recipientes-teste para posterior realização da técnica do ensaio cometa para avaliação do dano genético.
Colheita de células
Para avaliação dos efeitos da metafedrona e cetamina no dano genético das minhocas, foram retirados 3 animais de cada recipiente-teste e submetidos a uma extração de celomócitos com um tampão de extrusão (PBS 95%, EtOH 5%, EDTA 2,5 mg/mL e éter glicerol guaiacol 10 mg/mL) durante 3 minutos. O conteúdo celómico extrudado foi centrifugado (1100 rpm, 3 minutos), o sobrenadante removido e as células foram homogeneizadas em PBS frio (estes passos foram repetidos 3 vezes).
Ensaio cometa
O ensaio cometa foi realizado seguindo o protocolo de Collins et al. (2023). Resumidamente, 30 μL da extração celular foram suspensos em 300 μL de agarose com baixo ponto de fusão e, de seguida foram colocadas 2 gotas (de 70 μL cada) numa lâmina pré-revestida com agarose com ponto de fusão normal. Depois foi colocada uma lamela de vidro (18 x 18 mm) sobre cada gota para espalhar a mistura. Para cada organismo foram preparadas 2 lâminas. Após estarem 5 minutos a 4 ºC, as lamelas foram removidas e as lâminas colocadas em tampão de lise (2,5 M NaCl, 0,1 M EDTA, 10 mM Tris-base, 1% Triton X-100, pH 10, a 4 °C) durante 1 hora. Posteriormente as lâminas foram incubadas durante 20 minutos em tampão de eletroforese (0,3 M NaOH, 1 mM EDTA, pH < 13, 4 °C) e 20 minutos em eletroforese a 25 V (0,8 V/cm) e 300 mA. Por fim, foi realizada a neutralização das células em PBS e em água destilada (10 minutos cada) a 4 ºC.
Para a visualização dos cometas, cada gel nas laminas foi corado com 30 μL de DAPI, coberto com uma lamela de vidro (22 x 22 mm) e depois observado no microscópio de fluorescência, Olympus BX41 (Olympus, Inc., Hauppauge, NY, EUA). Para cada lâmina, foram visualizados aleatoriamente 100 cometas e classificados em cinco classes com base na integridade da cabeça e comprimento da cauda (Collins et al., 2008), ou seja, a classe 0 (sem cauda) até a classe 4 (quase todo o ADN presente na cauda). A seguir foi calculado o Índice do Dano Genético (IDG) expresso em Unidades Arbitrárias (UA) usando a seguinte equação:
onde n corresponde ao número de cometas em cada uma das 4 classes. Como resultado, o IDG pode variar entre 0 (todas as células sem dano) e 400 (todas as células com classe de dano 4) UA.
Os resultados foram sujeitos a uma análise de normalidade na distribuição e homogeneidade de variâncias, pelos testes de Shapiro-Wilk e Bartlett, respetivamente. Posteriormente, os dados foram sujeitos a uma ANOVA de 1 fator, seguida do teste de comparação de Tukey para um grau de probabilidade de p ≤ 0,05. Os dados foram expressos como média ± desvio padrão.
RESULTADOS E DISCUSSÃO
O ADN dos organismos é afetado pelo stresse ambiental, em particular o stresse químico, uma vez que os compostos tóxicos conseguem induzir quebras nas cadeias de ADN. Desta forma, a intensidade das quebras foi proposta como um indicador sensível de genotoxicidade e um biomarcador eficaz na biomonitorização ambiental (Frenzilli et al., 2001; Cant et al., 2022). Nas minhocas os celomócitos são leucócitos circulantes presentes na cavidade celomática os quais desempenham um papel muito importante na defesa imunológica (Khalil, 2016) e são utilizados para avaliar o dano genético.
Os resultados obtidos após exposição das minhocas adultas à metafedrona podem ser observados na Figura 1. Verificou-se que a presença de metafedrona no solo artificial na concentração de 2500 µg/kg induziu um aumento do dano genético nos celomócitos de E. fetida quando comparado com o grupo controlo (p = 0.0134).
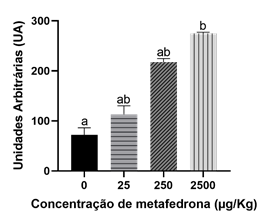
Figura 1 Efeitos da metafedrona nas células celomócitas de E. fetida após uma exposição de 28 dias. Letras diferentes representam diferenças entre as concentrações (p < 0,05).
A exposição de minhocas adultas à cetamina também induziu dano genético nos celomócitos (Figura 2). A exposição a 250 e 2500 µg/kg levou a um aumento estatisticamente significativo em relação ao grupo controlo (p = 0,0176 e 0,0062, respetivamente).
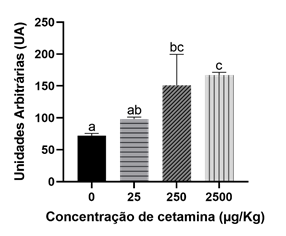
Figura 2 Efeitos da cetamina em células celomócitas de E. fetida após uma exposição de 28 dias. Letras diferentes representam diferenças entre as concentrações (p < 0,05).
Os resultados obtidos neste ensaio com minhocas mostram que a cetamina e a metafedrona causam genotoxicidade em concentrações elevadas, sendo que a cetamina começa a induzir efeitos na concentração de 250 µg/kg enquanto que a metafedrona induz efeitos em concentrações mais elevada, 2500 µg/kg. No entanto, para a concentração mais elevada, a metafedrona induziu mais danos no ADN em comparação com a cetamina (270 para 167 UA, respetivamente).
A diferença entre as duas SPAs pode estar relacionada com as suas estruturas químicas distintas que podem afetar a absorção dos compostos (toxicocinética) através da epiderme da minhoca e/ou a toxicidade do composto (toxicodinâmica).
Os nossos resultados vão ao encontro dos resultados obtidos por Govindarasu (2016), que observou que a exposição de minhocas a metanfetamina (uma SPA) durante 28 dias, levou ao aumento do dano genético nas células celomócitas. Adicionalmente, os antibióticos tetraciclina e clortetraciclina induziram genotoxicidade significativa em minhocas da espécie E. fetida, em particular a clortetraciclina (Dong et al., 2012).
Os danos genéticos podem estar diretamente relacionados com o aumento das espécies reativas de oxigénio (ROS) (Reinecke & Reinecke, 2004). De facto, a exposição de metafedrona e cetamina levou ao aumento dos ROS em organismos vertebrados, como o rato, Rattus norvegicus (Réus et al., 2015; Dias da Silva et al., 2019) e peixe-zebra, Danio rerio (Félix et al., 2018). No entanto, não foram encontrados estudos que avaliem os efeitos da metafedrona e cetamina ao nível do stresse oxidativo de minhocas. Assim, torna-se importante avaliar os efeitos que estas SPAs podem vir a induzir nos organismos terrestres de forma a fazer uma avaliação mais precisa do seu potencial risco ambiental.
CONCLUSÕES
Os dados obtidos mostram que a cetamina induz efeitos a concentrações mais baixas que a metafedrona, no entanto, à mesma concentração de 2500 µg/kg a metafedrona causou mais danos no ADN que a cetamina. Os resultados mostraram que as duas SPAs estudadas, metafedrona e cetamina, podem causar quebras nas cadeias de ADN e desta forma induzir genotoxicidade em minhocas, mas só para as concentrações mais altas estudadas (e que estão muito acima das concentrações ambientalmente relevantes). Assim, podemos deduzir que estes compostos não vão provocar efeitos negativos nas populações de anelídeos, no entanto temos de considerar a presença simultânea de outros compostos tóxicos (que pode levar a interações diversas como aditividade, sinergismo, antagonismo, potenciação, etc.) e as exposições prolongadas aos tóxicos.
Devido à ausência de estudos sobre os efeitos de SPAs nos organismos terrestres, estes estudos são importantes para uma avaliação do risco ambiental mais rigorosa, em particular de tóxicos mais prevalentes e para exposições mais prolongadas, e perceber melhor o impacto na ecologia e biodiversidade do solo.














