INTRODUÇÃO
As concentrações de gases do efeito de estufa (GEE) vêm aumentando significativamente ao longo das últimas décadas, com concentrações atuais 40% maiores que as observadas em 1750, no período pré-Revolução Industrial (IPCC, 2013). Esse fenômeno é desencadeado principalmente pela ação antropogênica e tem como consequência diversas questões ambientais como o derretimento de geleiras, elevação do nível do mar, desertificação de áreas tropicais, aumento da ocorrência de eventos climáticos extremos, extinção de espécies que podem desestruturar toda a vida no nosso planeta (Rahmstorf, 2010). Dessa forma, medidas de mitigação das concentrações de GEE são cada vez mais urgentes, sendo o sequestro de carbono (C) por reservatórios terrestres, como nos solos e florestas, uma das maneiras mais eficientes já encontradas para implementá-las (IPPC, 2018).
Os solos de manguezais apresentam alta produtividade primária de sua vegetação, grande depósito de matéria orgânica de diversas fontes e solos com condições anaeróbias que o tornam o maior reservatório terrestre de C (Duarte e Cebrián, 1996; Duarte et al., 2005; Bouillon et al., 2008; Kristensen et al., 2008). Apesar disso, estima-se que a taxa de degradação desses ambientes por ação antrópica seja uma das maiores entre todos os ecossistemas do planeta (Alongi, 2002; Gilman et al., 2008; Giri et al., 2011).
Com o propósito de recuperar manguezais e os demais ecossistemas degradados para mitigação das mudanças climáticas, a Assembleia Geral das Nações Unidas (ONU) declarou o período entre os anos de 2021-2030 como a década da restauração de ecossistemas, com objetivo de remover até 26 Gt de GEE da atmosfera. Dessa forma, iniciativas para o replantio de manguezais são cada vez mais necessárias, pois promovem o restabelecimento desses ecossistemas (Euliss et al., 2006; Badiou et al., 2011; Kolka et al., 2018). Um exemplo é através da definição e manutenção de Áreas de Preservação Ambiental, que são previstas pela legislação brasileira e têm o objetivo de proteger e conservar atributos bióticos, abióticos, estéticos e culturais dos ecossistemas.
Sendo assim, o objetivo desse trabalho é avaliar o efeito temporal do reflorestamento em manguezais degradados sobre o restabelecimento e acúmulo dos conteúdos de carbono do solo e sobre as condições físico-químicas que guiam este processo.
MATERIAIS E MÉTODOS
Área de estudo
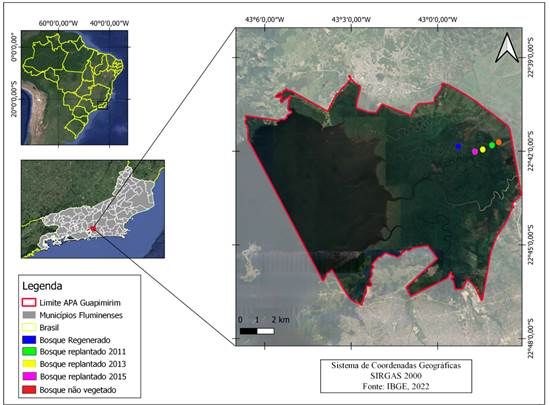
O estudo foi realizado na Área de Preservação Ambiental (APA) de Guapi-mirim, Rio de Janeiro, Brasil (Figura 1). A APA de Guapi-mirim, localizada no recôncavo da Baía de Guanabara, cobre 13 950 há e foi criada em 1984 com o objetivo de proteger os remanescentes de manguezais da região (Pellens et al., 2001). Segundo a classificação de Köppen, o clima da região é Aw, quente e úmido, com estação chuvosa na primavera-verão. Os solos predominantes na APA de Guapi-Mirim são do tipo Hidromórfico Orgânico Tiomórfico, com características de salinidade e presença de enxofre (Araújo e Maciel, 1979). Por ocasião da implantação da APA, antigas áreas de manguezal que foram removidas por atividade antrópica (uso da terra e retirada de madeira) passaram a ser recuperadas seguindo um protocolo de reflorestamento.
Na APA, foram identificados cinco bosques (setores) com diferentes idades de recuperação para coleta das amostras de solos, sendo três deles reflorestados nos anos de 2011, 2013 e 2015; um bosque recuperado naturalmente há 30 anos e um completamente degradado e sem vegetação (identificados como 2011, 2013, 2015, R e NV, respectivamente). Todos os bosques pertencem à mesma posição fisiográfica e estão sob influência do rio Carceribu.
Coleta de amostras
Em cada um dos cinco bosques, durante a maré baixa, foram demarcados 3 pontos a cada 20 m a partir de um transecto perpendicular ao leito do rio. Em cada ponto foi coletada uma amostra indeformada de solo (testemunho) com auxílio de tubos de policloreto de vinila (PVC; 0,05 m de diâmetro e 0,6 m de comprimento). Para evitar a oxidação das amostras de solo, todos os tubos foram hermeticamente fechados, mantidos em aproximadamente 4 ° C e transportado na posição vertical até que as amostras fossem seccionadas em intervalos de 0-10, 10-20, 20-30, 30-50 cm. Essas sub-amostras foram identificadas e congeladas para que fossem realizadas as análises laboratoriais.
Análises do solo
Foram realizadas análises de pH e potencial redox (Eh), ainda em campo, através de um medidor portátil de pH/mV com eletrodo de vidro e calibração automática. A análise granulométrica foi realizada de acordo com o método do Densímetro (Gee e Bauder, 1986) com prévio tratamento das amostras com peróxido de hidrogênio (30%) para a eliminação da matéria orgânica e álcool etílico 60% para a eliminação dos sais (Pansu e Gautheyrou, 2006).
Para as análises de carbono orgânico total (COT) foi utilizado um analisador elementar acoplado a um espectrômetro de massas. As amostras foram previamente tratadas com HCl 1N (Howard et al., 2014) para a dissolução dos carbonatos.
RESULTADOS E DISCUSSÃO
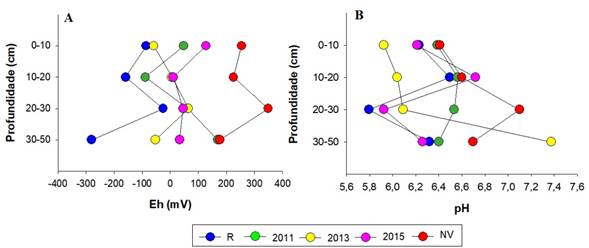
O pH e o Eh são indicadores da ocorrência de processos pedogenéticos em situação de inundação (gleização, sulfidização e paludização), que respondem pelo sequestro de C (Ponnamperuma, 1972; Ferreira et al., 2010; Nóbrega et al., 2016) e emissão de GEE (e.g., CO2, CH4 e N2O; Queiroz et al., 2019; Otero et al., 2020).
Os bosques avaliados apresentaram condição que variaram de anóxicas (Eh<+100 mV) a óxicas (Eh> +350 mV), com valores de Eh variando entre -346 e +382 mV (Figura 2A). Os maiores valores de Eh foram encontrados no bosque NV (336 mV), enquanto que R e os bosques reflorestados apresentaram valores consideravelmente menores, sendo o menor encontrado em R (-345 mV), indicando que a presença e o desenvolvimento da vegetação conduzem a uma redução do Eh em consequência da excreção de substâncias orgânicas lábeis como açúcares e ácidos orgânicos que reativam a atividade microbiana nestes ambientes (Otero e Macias, 2002). Comparando os bosques R e NV, são especialmente notadas as diferenças significativas para todas as profundidades, com médias de -97,42 e 121,49 mV, para R e N, respectivamente (Figura 2-A).
Quanto aos valores de pH, houve variação entre 5,2 e 7,8, havendo de uma forma geral aumento dos valores em profundidade (Figura 2B). Os menores valores de pH foram observados em superfície (0-20 cm), podem ser explicados por uma menor intensidade de inundação no solo e em consequência da ocorrência de oxidação dos sulfetos, gerando acidez (Nóbrega et al., 2016). Comparando os bosques, o maior valor médio de pH foi observado na área não vegetada (6,76), enquanto o menor valor médio foi observado no bosque recuperado (6,15). Apesar disso, os resultados não mostram clareza quanto a qualquer padrão de pH entre o gradiente das idades de reflorestamento e das profundidades dos bosques estudados.
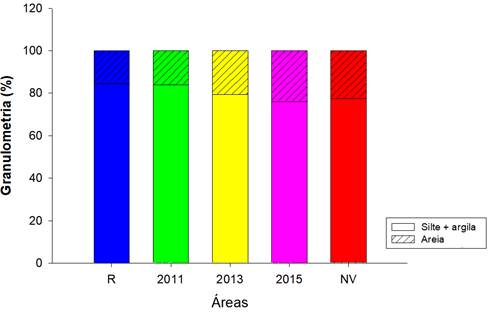
Os valores médios obtidos por bosque para a fração areia e fração fina (silte + argila) podem ser observados na Figura 3. Os maiores valores da fração fina foram encontrados no bosque R e 2011 (90,80 e 86,98%, respectivamente). Os bosques R e 2015 apresentaram mais concentração de areia em profundidade (30,16 e 33,59%) e 2011 e NV, por outro lado, apresentaram menores valores desse atributo em superfície (11,58 e 20,06%). O bosque 2013 apresentou comportamento homogêneo de areia ao longo do perfil do solo. De uma forma geral, foram observados valores baixos de argila, com pouca variação entre profundidades e bosques, com máximo de 1,70% no bosque NV e mínimo de 0,98% no bosque 2013.
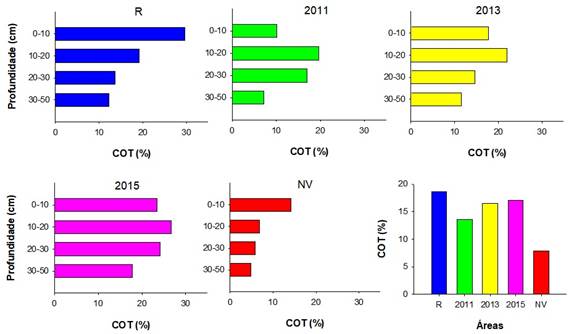
Os resultados dos conteúdos de COT confirmam os elevados conteúdos desse elemento presente em solos de manguezais, com valores obtidos que oscilam entre 44,42 e 3,53%, nos bosques R e NV, respectivamente (Figura 4). De uma forma geral, o comportamento observado em profundidade foi parecido nos bosques replantados, com maiores teores de C entre 10-20 cm com decréscimo em profundidade. Os resultados indicam que parece não haver resposta direta da idade do desenvolvimento vegetal no acúmulo deste elemento para os bosques estudados, possivelmente pela grande heterogeneidade no material sedimentário destes ambientes. Porém, comparando áreas vegetadas (R, 2011, 2013 e 2015) com NV, é possível observar diferenças relevantes no conteúdo de COT, variando, por exemplo, de 7,87 a 18,63% entre NV e R, respectivamente com a média de 17,66% para os bosques replantados (2011, 2013, 2015).
CONCLUSÕES
A variação temporal do estágio de reflorestamento não apresentou relação com as propriedades dos solos, bem como para o acúmulo de carbono, para os bosques e idades estudados. Porém, os resultados indicam que as amostras de solo nas quais havia vegetação adjacente obtiveram melhores condições físico-químicas para proporcionar o acúmulo de carbono, proveniente da floresta de mangue, nesses ambientes em comparação com as amostras da área degradada. Isso indica que o reflorestamento pode ser uma solução para reverter o processo de degradação do solo e emissão de GEE, tendo como consequência o acúmulo de carbono.