INTRODUCCIÓN
Amaranthus palmeri S. Watson es una mala hierba de amplia distribución e impacto y una especie potencialmente invasora. Además, es muy propensa a desarrollar biotipos resistentes a herbicidas. De hecho, ya existen poblaciones con resistencias conocidas a herbicidas de 10 mecanismos de acción diferentes (Heap, 2024), entre ellos los inhibidores de la actividad de la enzima acetolactato sintasa (ALS). La mayor parte de las resistencias a inhibidores de la ALS en A. palmeri y en otras especies son por mecanismos relacionados con la diana (target-site o TS) (Eceiza et al., 2023), pero los mecanismos no relacionados con la diana (non-target site o NTS) cada vez están cobrando mayor importancia.
ALS es la primera enzima común en la ruta de biosíntesis de los aminoácidos ramificados leucina, isoleucina y valina (Zhou et al., 2007). La inhibición de esta enzima por los herbicidas (mecanismo de acción) está ampliamente estudiada, sin embargo, los efectos fisiológicos de esta inhibición que eventualmente llevan a la muerte de la planta (modo de acción) no son tan conocidos. Uno de estos efectos, solo parcialmente estudiado, es el estrés oxidativo. El estrés oxidativo se desarrolla como un resultado del desequilibrio entre la generación de Especies Reactivas de Oxígeno (EROs) y las actividades antioxidantes de la planta, que se puede manifestar, en unas primeras fases, en una inducción antioxidante y, si es suficientemente severo, en daño oxidativo a biomoléculas, por ejemplo, en peroxidación lipídica (Demidchik, 2015).
Recientemente, un estudio del presente grupo de investigación concluyó que el estrés oxidativo causado por uninhibidor de la ALS, la sulfonilurea nicosulfurón, en una población sensible de A. palmeri no se observaba en una resistente TS (Eceiza et al., 2023). Sin embargo, quedaba por abordar la respuesta oxidativa de una población resistente NTS.
El objetivo de este estudio has sido ampliar el conocimiento fisiológico de los mecanismos de resistencia NTS, concretamente, del impacto que tienen en el estrés oxidativo inducido por herbicidas inhibidores de la ALS. Para ello, se ha empleado nicosulfurón, sobre una población sensible (S) y otra resistente (R), en la cual se había descrito resistencia de NTS a sulfonilureas por metabolización por citocromos P450 (Nakka et al., 2017).
MATERIALES Y MÉTODOS
Material vegetal y tratamientos
La población sensible, originaria de Carolina del Norte, EEUU, fue cedida por el Dr. Gaines (Universidad Estatal de Colorado, CO, EEUU). La población resistente, originaria de Kansas, EEUU, fue cedida por la Dra. Jugulam (Kansas State University, EEUU). En esa población se detectó un mecanismo de resistencia TS, en concreto, una mutación en la posición Pro-197 del gen ALS, en el 30% de los individuos, mientras que el 70% presentaron resistencia de tipo NTS debido a metabolización mediada por P450 (Nakka et al., 2017). Las plantas de las dos poblaciones fueron crecidas en cultivo hidropónico puro con aireación forzada (Fernández-Escalada et al., 2016).
A los 19-22 días de edad (BBCH 14), sobre las poblaciones S y R, se aplicó el herbicida nicosulfurón (SAMSON®) en dos dosis: dosis recomendada equivalente a 0,06 kg i.a ha-1 y 3 veces la dosis recomendada. Se dejaron algunas plantas sin tratar (controles) en ambas poblaciones. Todas las plantas permanecieron en estado vegetativo hasta el muestreo, que se realizó a los siete días. Se muestrearon las hojas en viales que fueron inmediatamente congelados y almacenados a -80 ºC. y el tejido foliar fue triturado antes de las determinaciones analíticas listadas a continuación.
Determinaciones analíticas
En las plantas de la población R, se extrajo el ADN genómico y se amplificaron, mediante PCR, los fragmentos CAD y BE del gen que codifica la enzima ALS, ya que son los fragmentos en los que aparecen mutaciones que confieren resistencia a los herbicidas inhibidores de la ALS. En el caso del fragmento CAD, el primer forward contenía la siguiente secuencia: 5’-CGCCCTCTTCAAATCTCATC-3’, y el reverse, la secuencia: 5’-CAATCAAAACAGGTCCAGGTC-3’ (Torra et al., 2020). En el caso del fragmento BE, el primer forward contenía la secuencia: 5’-TGCTATTGGAGCTGCTGTTG-3’, y el reverse, la secuencia: 5’-CCTTCTTCCATCACCCTCTG-3’ (Torra et al., 2020). Las muestras fueron secuenciadas en el laboratorio de STAB VIDA (Caparica, Portugal).
Se midió la concentración de H2O2 fluorométricamente, como indicador de EROs, tal y como se había descrito anteriormente (Eceiza et al., 2023). Como indicador de la peroxidación lipídica, un signo inequívoco de estrés oxidativo, se midió el contenido de malondialdehído (MDA) espectrofotométricamente (Eceiza et al., 2023).
La actividad de las enzimas antioxidantes glutatión reductasa (GR) y peroxidasas (POX) se midió espectrofotométricamente (Eceiza et al., 2023). El contenido de ácido ascórbico y su forma oxidada, dehidroascorbato, fueron determinados mediante cromatografía líquida de alto rendimiento (Herrero-Martínez et al., 2000).
Análisis estadístico
Para los análisis estadísticos, las plantas se separaron por poblaciones: S y R. Las posibles diferencias entre los controles S y R se evaluaron mediante la prueba t de Student (p < 0,05). Las posibles diferencias entre tratamientos dentro de una misma población se evaluaron mediante ANOVA de una vía seguida de la prueba posthoc HSD de Tukey (p < 0,05).
RESULTADOS Y DISCUSIÓN
Se secuenció el gen ALS de todas las plantas R utilizadas en este estudio y se comprobó que ninguna presentaba mutaciones en los fragmentos CAD o BE. Así, todas las determinaciones analíticas se llevaron a cabo en individuos de la población R que no presentaban mutaciones genéticas en la enzima ALS y con resistencia al herbicida nicosulfurón, una resistencia NTS.
En cuanto al daño oxidativo, en ambas poblaciones tiende a incrementarse la peroxidación lipídica (estimada por la producción de MDA, Figura 1B) de forma proporcional a la dosis de herbicida, especialmente en la población S. Este incremento está probablemente relacionado con la sobreproducción de EROs (Figura 1A) en las plantas sensibles tratadas con nicosulfurón. Sin embargo, no hay cambios significativos. Se descarta que el daño oxidativo sea una de las causas de muerte de la planta.
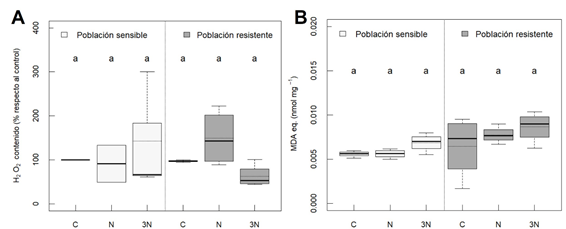
Figura 1 Contenido de H2O2 (A) y equivalentes de malondialdehído o MDA (B), en poblaciones de Amaranthus palmeri sensible y resistente a inhibidores de ALS. Tratamientos: sin tratar (control, C), dosis recomendada de nicosulfurón (N), y 3 veces la dosis recomendada de nicosulfurón (3N). No se observaron diferencias significativas entre tratamientos de cada población (ANOVA, HSD Tukey, p < 0,05).
La Figura 1A, muestra que no hay cambios significativos en los niveles de H2O2 entre los diferentes tratamientos de la misma población, aunque se observa un incremento no significativo en la población S con 3 veces la dosis recomendada, probablemente achacable a la acción herbicida. Este incremento de EROs con el herbicida nicosulfurón se ha observado anteriormente, tanto en A. palmeri (Eceiza et al., 2023) como en otras especies, como el maíz (Wang et al., 2018; Liu et al., 2019). Los mecanismos de producción de EROs inducidos por herbicidas inhibidores de la ALS son desconocidos, pero hay varias hipótesis al respecto. Una de ellas es la activación del metabolismo hipóxico o fermentación en respuesta al herbicida debido a un menor uso de carbohidratos por parte de las raíces, lo que lleva a una disminución brusca de las reacciones rédox, con una posterior producción de H2O2 (Gaston et al., 2002; Zabalza et al., 2005). En cambio, no se observa este incremento de H2O2 en la población R (Figura 1A), abriendo la puerta a que haya mecanismos de resistencia NTS que estén evitando la producción de EROs.
Se midieron las actividades GR y POX como dos de los principales sistemas antioxidantes enzimáticos (Elavarthi & Martin, 2010). No hubo cambios significativos en la actividad GR en la población S e incluso disminuyó con la dosis de herbicida en la población R (Figura 2A). Sin embargo, la actividad POX sí se vio claramente inducida por el tratamiento de 3 veces la dosis recomendada, de forma muy evidente en la población S (Figura 2B). En cuanto al metabolismo del ascorbato, medido como indicador de la actividad antioxidante no enzimática, no se observaron tendencias destacables (Figura 2C).
Las peroxidasas son una clase muy amplia de enzimas que, en función de las circunstancias, pueden actuar como productoras o como consumidoras de EROs. En un ciclo peroxidativo normal, el estado basal de las POX consiste en reducir el H2O2 a agua, y entonces parte de la enzima se oxida. Sin embargo, cuando el sustrato es un productor de EROs, el radical derivado interactúa con una molécula de oxígeno, liberando una molécula de superóxido (O2 -), precursor del H2O2 en la reacción de Fenton (Shigeto & Tsutsumi, 2016). Teniendo en cuenta la similitud entre los resultados de EROs y de actividad POX, y de la nula activación de los demás antioxidantes en la población S, es factible la hipótesis de que las peroxidasas estén provocando esa sobreproducción de H2O2 en las plantas sensibles tratadas con nicosulfurón.
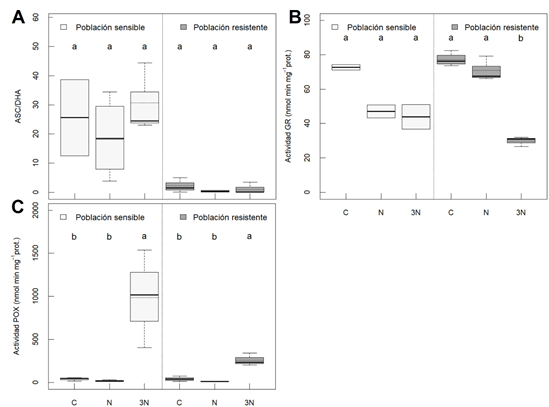
Figura 2 Actividad glutatión reductasa o GR (A); actividad de las peroxidasas o POX (B); y cociente entre contenido de ascorbato o ASC y dehidroascorbato o DHA (C), en poblaciones de Amaranthus palmeri sensible y resistente a inhibidores de ALS. Tratamientos: sin tratar (control, C), dosis recomendada de nicosulfurón (N), y 3 veces la dosis recomendada de nicosulfurón (3N). Letras diferentes indican diferencias significativas entre tratamientos en cada población (ANOVA, HSD Tukey, p < 0,05).
En la población resistente, en cambio, el incremento en la actividad POX (Figura 2B) y la oxidación del ascorbato (Figura 2C) pueden estar controlando los niveles de EROs y, por tanto, el estrés oxidativo causado por el herbicida. Esto podría ser considerado como un mecanismo de resistencia NTS complementario, pero en ningún caso el único, ya que, como se ha sugerido antes, el estrés oxidativo no es un efecto letal de la inhibición de la ALS.
CONCLUSIONES
Los resultados indican cierto estrés oxidativo en plantas sensibles de A. palmeri tratadas con la dosis más alta de nicosulfurón, aunque este estrés oxidativo no es suficientemente severo como para ser causa de muerte de la planta. En las plantas resistentes, en cambio, no se observa estrés oxidativo, sugiriendo que la producción de H2O2 puede estar controlada por la implicación de ciertos sistemas antioxidantes (actividad POX y ascorbato). Esto podría indicar que la población resistente presenta una fisiología complementaria a los mecanismos NTS para paliar el estrés oxidativo inducido por los inhibidores de la ALS.














