Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Acessos
Acessos
Links relacionados
-
 Similares em
SciELO
Similares em
SciELO
Compartilhar
Revista Portuguesa de Imunoalergologia
versão impressa ISSN 0871-9721
Rev Port Imunoalergologia vol.20 no.4 Lisboa out. 2012
Omalizumab no tratamento da asma brônquica alérgica: Experiência num Serviço de Imunoalergologia
Omalizumab in the treatment of allergic asthma: Experience in our Immunoallergology Department
José Geraldo Dias, Pedro Silva, Ana Mendes, Célia Costa, Elisa Pedro, Manuel Pereira Barbosa
Serviço de Imunoalergologia, Hospital de Santa Maria, Centro Hospitalar Lisboa Norte
RESUMO
Introdução: O omalizumab é um anticorpo monoclonal aprovado como terapêutica adicional na asma alérgica grave. Avaliámos a resposta na prática clínica ao omalizumab em doentes com asma alérgica grave não controlada. Métodos: Análise retrospectiva dos processos clínicos dos doentes com asma tratados há pelo menos 16 semanas com omalizumab, desde Abril de 2008 até Dezembro de 2011 no Serviço de Imunoalergologia. Incluídos doentes com asma alérgica grave não controlada com alta dose de corticóide inalado (CI) e beta 2 agonista de longa acção (LABA), que iniciaram omalizumab como terapêutica adicional. Analisaram-se os seguintes parâmetros antes, 16 semanas e 6 meses após o início de omalizumab: frequência e gravidade das exacerbações, frequência de medicação de alívio, terapêutica diária de base, dose diária de corticosteróides orais (CO), controlo da asma através do Asthma Control Test (ACT) e valor do volume expiratório máximo no primeiro segundo (FEV1) previsto. Resultados: Incluídos 23 doentes (8 -72 anos; 17 do sexo feminino), com FEV1 <80% do valor normal previsto, sintomas diários ou despertares nocturnos frequentes e pelo menos uma exacerbação de asma com necessidade de CO nas 16 semanas anteriores ao início do omalizumab. Todos os doentes suspenderam os CO (de base ou SOS) após 2 meses de tratamento. Às 16 semanas de tratamento, todos os doentes reportaram um melhor controlo da asma (valor médio de ACT antes / após omalizumab: 15/22), redução da medicação de base (diminuição da dose média diária de budesonido ou equivalente de 1057μg para 669μg) e da necessidade de medicação de alívio, diminuição da frequência e gravidade das exacerbações, não se verificando exacerbações graves. Verificou -se aumento do FEV1 em 18/23 doentes (78%). Aos 6 meses de tratamento, a melhoria clínica dos doentes manteve-se. Discussão: O omalizumab parece ser eficaz como terapêutica adicional em doentes com asma alérgica grave não controlada, apesar da medicação com alta dose de CI e LABA. Além da melhoria clínica, permitiu a suspensão dos CO num curto período de tempo.
Palavras-chave: Anti-imunoglobulina E, asma alérgica grave, omalizumab.
ABSTRACT
Background: Omalizumab is a monoclonal antibody approved as add -on therapy for treatment of severe allergic asthma. We evaluated the clinical response to omalizumab in real -life patients with uncontrolled severe allergic asthma. Methods: Retrospective analysis of clinical processes of patients with asthma treated with omalizumab for at least 16 weeks, in our Immunoallergology Department from April 2008 to December 2011. Included patients with severe allergic asthma, not controlled with high dose inhaled corticosteroids (IC) and long acting beta 2 agonists (LABA), which received omalizumab as add -on therapy. The following parameters were analyzed before, 16 weeks and 6 months after initiation of omalizumab: frequency and severity of exacerbations, frequency of rescue medication use, daily medication, daily dose of oral corticosteroids (OC), asthma control by Asthma Control Test(ACT) and value of predicted forced expiratory volume in one second (FEV1). Results: Included 23 patients (8 -72 years, 17 female) with FEV1 <80% of normal predicted, daily symptoms or frequent awakenings and at least one asthma exacerbation requiring OC 16 weeks before the treatment of omalizumab was initiated. All patients discontinued OC (as daily or rescue medication) after 2 months of treatment. At 16 weeks of treatment, all patients reported better control of asthma (average ACT before / after omalizumab: 15/22), reduction of daily medication (decrease in average daily dose of budesonide or equivalent of 1057 μg to 669 μg) and of rescue medication, decrease in number and severity of exacerbations, without severe exacerbations. There was an increase in FEV1 in 18/23 patients (78%). At 6 months of therapy, clinical improvement of the patients remained stable. Discussion: Omalizumab seems to be effective as add -on therapy, in patients with uncontrolled severe allergic asthma despite high dose of IC and LABA. Besides clinical improvement, omalizumab allowed suspension of OC in a short period of time.
Keywords: Anti-immunoglobulin E, omalizumab, severe allergic asthma.
INTRODUÇÃO
Aproximadamente 5% dos doentes com asma têm asma grave, que frequentemente não está controlada, apesar da terapêutica optimizada com corticosteróides inalados (CI) e beta 2 agonistas de longa acção (LABA)1,2. Estes doentes têm um risco aumentado de exacerbações graves e de morte3,4 e têm poucas opções terapêuticas disponíveis.
Os corticosteróides orais (CO) são eficazes em alguns doentes, mas estão associados a efeitos adversos significativos5.
De acordo com as guidelines do Global Initiative for Asthma (GINA) 20112, o omalizumab está indicado para doentes com asma alérgica grave a partir dos 6 anos de idade, no último degrau de terapêutica, como alternativa aos CO, como terapêutica adicional em doentes tratados com alta dose de CI e LABA.
O omalizumab é um anticorpo monoclonal IgG humanizado que se liga ao domínio Cε3 da IgE livre, impedindo a sua ligação aos receptores específicos de alta e baixa afinidade (FcεRI e FcεRII) presentes nas membranas celulares de vários tipos de células (mastócitos, basófilos, eosinófilos, linfócitos B), reduzindo a libertação de mediadores inflamatórios, como leucotrienos, citocinas e histamina6-11. Paralelamente, reduz a expressão do número de receptores à superfície dos basófilos9 e previne o aumento dos níveis de FcεRI induzidos pela IgE nos mastócitos cutâneos12,13 e nas células da mucosa das vias aéreas (provavelmente mastócitos)14. Administra -se por via subcutânea, com intervalos de duas a quatro semanas, sendo a dose individualizada em função da IgE total sérica e do peso do doente15.
A eficácia do omalizumab tem sido demonstrada em vários estudos através da redução da gravidade e frequência das exacerbações, dos scores de sintomas, do uso de corticoterapia (inalada e/ou oral) e de medicação de alívio, verificando-se ainda uma melhoria da função respiratória16-19 e da qualidade de vida dos doentes20,21.
Actualmente, recomenda-se que a primeira avaliação da resposta à terapêutica seja feita após 16 semanas de tratamento, tendo em conta que uma avaliação mais precoce poderá não identificar alguns respondedores mais tardios. A avaliação é essencialmente clínica, baseando-se no nível de controlo da asma. De acordo com a avaliação médica, os doentes que alcançam uma melhoria significativa ou um controlo total da asma têm indicação para manter a terapêutica22.
O omalizumab tem um bom perfil de tolerância, estando descritos efeitos adversos, na sua maioria ligeiros e em frequência semelhante à dos grupos placebo16,17.
Neste trabalho, os autores avaliam a resposta clínica ao omalizumab como terapêutica adicional em doentes com asma brônquica alérgica grave não controlada, num Serviço de Imunoalergologia. Trata -se de um estudo observacional retrospectivo com doentes da vida real,sem grupo-controlo, mas que permite avaliar a eficácia do omalizumab em doentes da prática clínica.
MÉTODOS
Procedeu-se a uma análise retrospectiva dos processos clínicos de todos os doentes com asma brônquica tratados há pelo menos 16 semanas com omalizumab, desde Abril de 2008 até Dezembro de 2011, no Serviço de Imunoalergologia.
Foram incluídos os doentes seguidos em consulta mensalmente ou de 2 em 2 meses, com asma brônquica alérgica grave não controlada, apesar de cumprirem a terapêutica recomendada no degrau IV do GINA 2011 (dose alta de CI, LABA e medicação de alívio de acordo com a necessidade), que iniciaram omalizumab como terapêutica adicional.
Para se avaliar a resposta clínica ao omalizumab, analisaram -se os seguintes parâmetros antes, 16 semanas e 6 meses após o início da terapêutica: frequência e gravidade das exacerbações, frequência de medicação de alívio, terapêutica diária de base, dose diária de CO, controlo da asma através do questionário Asthma Control Test ACT) e valor do volume expiratório máximo no primeiro segundo (FEV1) previsto. Foram também analisados os efeitos adversos do omalizumab.
Uma exacerbação foi definida como um agravamento dos sintomas de asma, com necessidade de medicação de alívio. Denominou-se ligeira a moderada quando houve necessidade de aumentar os broncodilatadores inalados (de curta ou longa acção) e grave quando houve necessidade de tratamento com CO, recorrência ao serviço de urgência ou internamento.
Para avaliação do controlo da asma optou-se por utilizar o ACT. O ACT é composto por cinco questões que abordam os seguintes cinco domínios: limitação das actividades diárias, dispneia, sintomas nocturnos, necessidade de medicação para alívio rápido dos sintomas e nível de controlo da asma. Os doentes reportam as suas experiências durante as últimas 4 semanas, sendo atribuída uma pontuação de 1 (limitação máxima) a 5 (sem limitação) para cada questão, podendo a pontuação total variar de 5 a 25. Considera -se que a asma está controlada quando a pontuação é ≥ 20.
De acordo com o protocolo do serviço, os doentes foram observados pelo médico presente no Hospital de Dia (não necessariamente o mesmo) quinzenal ou mensalmente, no dia da administração de omalizumab, sendo registada no diário clínico dos doentes toda a informação (frequência e gravidade das exacerbações e quantificação da medicação de base e de alívio). Realizaram espirometria e ACT antes do início do tratamento, às 16 semanas, aos 6, 9 e 12 meses. Para uniformização de valores, foram consideradas as informações antes, às 16 semanas e aos 6 meses de tratamento.
Nas primeiras quatro administrações, os doentes ficaram sob vigilância clínica durante dois horas e efectuaram o tratamento com veia canalizada. Dispensou-se este procedimento a partir da 5.ª administração e reduziu-se o tempo de vigilância para uma hora até à 8.ª administração e para trinta minutos a partir da 9.ª administração.
Todos os doentes tinham o consentimento informado assinado e a autorização para o tratamento pela comissão de farmácia do hospital.
RESULTADOS
As características clínicas e demográficas da população estudada estão descritas no Quadro 1. Foram incluídos 23 doentes, 17 do sexo feminino e 6 do sexo masculino, com média de idades de 42 anos (mínimo 8 e máximo 72). Vinte e dois doentes tinham rinite associada, 4 eczema atópico, 2 alergia alimentar (um a peixes, marisco e frutos secos; outro a leite, ovo e frutos frescos; ambos com anafilaxia). Todos os doentes tinham sensibilização a ácaros, evidenciada por IgE específicas séricas e testes cutâneos por picada (TCP) positivos, FEV1 <80% do valor normal previsto, sintomas diários ou despertares nocturnos frequentes e pelo menos uma exacerbação de asma com necessidade de CO nas 16 semanas anteriores ao início do omalizumab. Antes do início do tratamento, adicionalmente aos CI e aos LABA, uma proporção de doentes fazia medicação diária com antagonista dos receptores dos leucotrienos (montelucaste) (96%), teofilina ou aminofilina (43%), ou CO (30%). Em 10 dos 23 doentes (43%) tinha sido iniciada imunoterapia específica a ácaros no passado, tendo-se suspendido em todos eles por agravamento clínico da asma.
Quadro 1. Características clínicas e demográficas da população
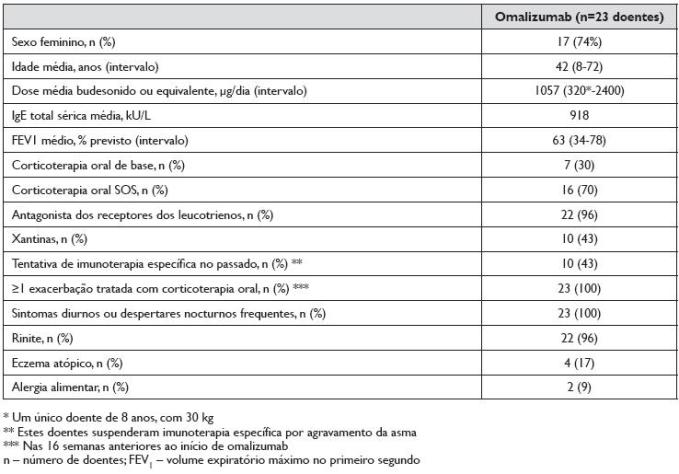
O valor médio/mediana de IgE total sérica antes do início do tratamento com omalizumab foi de 918/458 kU/L. A dose de omalizumab, calculada através de tabelas com base no valor de IgE total sérica e no peso do doente, foi em média de 509 mg/mês (variando de 150-750 mg/mês). Em 6 doentes (26%), a administração de omalizumab foi de 2/2 semanas e em 17 (74%) de 4/4 semanas.
Durante o período do estudo, o tempo médio de tratamento com omalizumab foi de 19 meses, variando de 6 a 45 meses.
A evolução dos doentes após 16 semanas de terapêutica com omalizumab está sumarizada no Quadro 2.
Quadro 2. Evolução dos doentes após 16 semanas de terapêutica com omalizumab
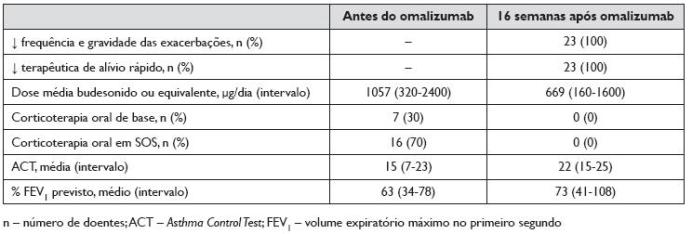
Com o início da terapêutica com omalizumab, todos os doentes suspenderam a corticoterapia oral (de base ou SOS). A suspensão dos CO foi possível após um período inferior a dois meses em todos os doentes.
No que diz respeito à terapêutica de base, às 16 semanas de tratamento verificou -se uma redução em todos eles. Relativamente aos CI, comparando com a dosagem antes do início do omalizumab, houve uma diminuição da dose média de 1057 μg/dia para 669 μg/dia de budesonido ou equivalente, ou seja, em média os doentes passaram a fazer 63% da dose de CI que faziam antes de iniciar o omalizumab. Dezanove dos 23 doentes (83%) reduziram a dose diária de CI, sendo que os restantes 4 mantiveram a mesma dose que faziam antes do início da terapêutica com omalizumab. Nestes doentes, além da suspensão dos CO, verificou-se a suspensão de montelucaste e/ou teofilina em todos eles. Verificou-se a suspensão de montelucaste em 3 dos 22 doentes que o tomavam diariamente. Dos 10 doentes medicados diariamente com teofilina ou aminofilina, 3 suspenderam e outros 3 reduziram a dose destes fármacos.
Com base nos registos clínicos efectuados a cada administração, constatou -se que todos os doentes reportaram uma diminuição da medicação de alívio rápido 16 semanas após o início da terapêutica com omalizumab. A frequência das exacerbações também diminuiu em frequência e em gravidade em todos os doentes, não se verificando exacerbações graves (com necessidade de CO, recorrência ao serviço de urgência ou internamento) em nenhum doente.
Todos os doentes referiram uma melhoria do controlo da asma, com valores médios do ACT antes e 16 semanas após o início de omalizumab de 15 e 22, respectivamente.
O valor médio do FEV1 antes do início do omalizumab foi de 63% do previsto (variando de 34% a 78%); após 16 semanas de tratamento, o valor médio do FEV1 foi de 73% do previsto (variando de 41% a 108%). Em 18 dos 23 doentes (78%) verificou-se um aumento do FEV1, evidenciado por um aumento do FEV1 previsto superior a 10% relativamente ao valor inicial. Os restantes 5 doentes mantiveram valores de FEV1 sobreponíveis aos iniciais, não se verificando agravamento em nenhum doente.
Aos 6 meses de tratamento, a melhoria clínica dos doentes manteve -se. Estes doentes não voltaram a ter exacerbações graves, necessidade de CO, mantiveram a terapêutica diária e de alívio que tinham às 16 semanas e mantiveram valores de ACT e de FEV1 sobreponíveis aos que tinham após 16 semanas de tratamento.
Os doentes com tempo de tratamento superior a 6 meses (21 dos 23) mantiveram evolução clínica favorável. De acordo com os registos clínicos, verificou-se ainda uma melhoria clínica das comorbilidades de etiologia alérgica associadas. Os 2 doentes com alergia alimentar passaram a tolerar alimentos até então responsáveis por reacções anafilácticas; após ter sido demonstrada diminuição da reactividade cutânea por TCP para os alimentos em causa, foram realizadas provas de provocação oral, que foram negativas.
Todos os doentes com rinite (22) reportaram melhoria da sintomatologia nasal e redução do uso de corticóides nasais e/ou anti -histamínicos orais. Os 4 doentes com eczema atópico referiram melhoria das lesões cutâneas e diminuição da necessidade de corticóides tópicos, verificando-se diminuição do valor do Scoring Atopic Dermatitis (SCORAD), realizado de 3 em 3 meses nestes doentes.
No que diz respeito ao perfil de segurança do fármaco na nossa população apenas se registaram efeitos adversos ligeiros em três doentes: cefaleias ligeiras (1), mialgias (1) e eritema pruriginoso do tronco (1), todos apenas na primeira administração e com resolução em menos de 24 horas. Quatro doentes tiveram reacções adversas locais ligeiras, que se manifestaram por eritema não pruriginoso e/ou dor no local da administração do fármaco. Ocorreram ocasionalmente, não se repetindo em todas as administrações e tiveram resolução espontânea em menos de 24 horas.
Apesar de evolução favorável, 2 doentes suspenderam o omalizumab devido à impossibilidade de manter tratamento por mudança de residência para outro país; um após 10 meses e outro após 5 meses de terapêutica. Ambos, àsemelhança dos restantes, tinham suspendido os CO, diminuído a terapêutica de base e a necessidade de medicação de alívio, diminuído a frequência e a gravidade das exacerbações, reportando um melhor controlo da asma.
DISCUSSÃO
De acordo com estudos já publicados, a asma grave está associada a um maior risco de hospitalização por asma23,24, sendo os doentes com asma grave responsáveispela maioria dos internamentos25. O controlo inadequado da asma grave leva ao aumento do risco de internamento e de morte por asma3,4. Sabe -se que qualquer doente com asma pode ter uma exacerbação grave, mas os doentescom asma grave têm um risco aumentado de exacerbações que podem ser fatais26,27.
O omalizumab está indicado nos doentes com asma grave de etiologia alérgica (IgE específicas séricas ou TCP positivos para alergénios perenes), com FEV1 inferior a 80% do valor normal previsto, sintomas diários ou despertares nocturnos frequentes e exacerbações com necessidade de CO22. De acordo com o GINA 2011, está recomendado a partir dos 6 anos de idade, no último degrau de terapêutica, como alternativa aos CO, como terapêutica adicional em doentes tratados com alta dose de CI eLABA.
A dose a administrar é calculada em função do valor de IgE total e peso do doente, tendo sido sugerida a possibilidade de a reduzir progressivamente em doentes que atingem um nível de controlo da asma adequado, mas a redução da dose não está, para já, recomendada. A duração do tratamento é indeterminada. Após a suspensão do tratamento, as concentrações de IgE livre e de omalizumab retornam aos valores basais e os sintomas de asma reaparecem28.
Em relação ao custo-benefício nos doentes tratados com omalizumab, as informações são contraditórias. Existem estudos que concluem que, genericamente, o omalizumab não tem uma boa relação custo-benefício29. No entanto, outros têm demonstrado que o omalizumab é compensador quando utilizado no tratamento de doentes devidamente seleccionados, na medida em que vai permitir uma melhor qualidade de vida, um melhor controlo da asma, a redução da terapêutica diária e de alívio, de visitas médicas não programadas e de internamentos e a diminuição do absentismo escolar e laboral30,31.
Na nossa avaliação, após 16 semanas de tratamento, todos os doentes reportaram um melhor controlo da asma, redução da medicação de base e da necessidade de medicação de alívio, diminuição da frequência e gravidade das exacerbações, não se tendo verificado exacerbações graves em nenhum doente (necessidade de CO, visita médica não programada ou internamento).
Nos doentes com asma grave incluídos neste estudo, o omalizumab como terapêutica adicional, ao permitir um melhor controlo da asma, com diminuição da frequência e da gravidade das exacerbações, contribuiu de forma importante para a diminuição do risco de hospitalização e de morte por asma.
De uma forma geral, o omalizumab foi bem tolerado pelos doentes, com efeitos adversos mínimos e coerentes com o que tem sido descrito na literatura16,17. Verificaram-se apenas reacções ligeiras, sem necessidade de medicação, com resolução em menos de 24 horas. Desta forma, a terapêutica com omalizumab possibilitou uma melhoria clínica sem efeitos adversos relevantes que poderiam, neste degrau de terapêutica, ser responsáveis por uma má adesão ao tratamento.
De salientar que todos os doentes avaliados às 16 semanas de tratamento tiveram uma evolução favorável, permitindo a manutenção da terapêutica. Este facto deve-se, não só à eficácia clínica do omalizumab, mas também à adequada selecção dos doentes, que cumpriram os critérios exigidos.
Assim sendo, os doentes mantiveram a administração quinzenal ou mensal de omalizumab. De acordo com os registos clínicos nos processos dos doentes, dos valores de FEV1 e do ACT, todos mantiveram a melhoria clínica evidenciada às 16 semanas de tratamento nos meses subsequentes, sugerindo a eficácia do omalizumab enquanto está a ser administrado. No período ao qual se reporta o estudo, nenhum dos doentes suspendeu o tratamento por indicação médica. Serão necessários mais ensaios para se poder determinar uma duração óptima de tratamento com omalizumab, com a qual o seu efeito se mantenha a longo prazo após a sua suspensão.
Tal como esperado, outras patologias alérgicas coexistentes nos doentes também evoluíram favoravelmente. Em particular e como já salientado, nos dois doentes com alergia alimentar, verificou-se, para além da evolução clínica favorável da asma, uma melhoria do quadro de alergia alimentar. Os doentes passaram a tolerar alimentos até então responsáveis por reacções anafilácticas, contribuindo também para a melhoria da qualidade de vida, na medida em que passaram a poder ter uma dieta sem as restrições alimentares obrigatórias até então. Os bons resultados do efeito do omalizumab na história da alergia alimentar têm sido documentados em vários estudos32,33, sugerindo uma possível indicação futura em casos seleccionados de alergia alimentar. No entanto, serão necessários mais estudos, controlados e em dupla ocultação, para que o omalizumab possa ser eventualmente recomendado para o tratamento da alergia alimentar.
Os resultados obtidos neste trabalho reflectem os de estudos controlados e em dupla ocultação34, o que, tratando -se de um estudo real life, com uma população de doentes com perfis diferentes, como sucede na prática clínica diária, demonstra a eficácia clínica do omalizumab.
Neste estudo não podemos avaliar, contudo, o efeito placebo (uma vez que não há grupo controlo) que pode também ter contribuído para os resultados favoráveis obtidos.
Em conclusão, de acordo com este estudo real life e como previamente descrito na literatura, o omalizumab parece ser uma opção terapêutica segura e eficaz, quando utilizado como terapêutica adicional em doentes com asma alérgica grave, não controlada apesar da medicação comalta dose de CI e LABA. A selecção adequada dos doentes é de extrema importância, na medida em que o omalizumab tem um custo elevado e está reservado apenas para o último degrau de terapêutica (de acordo com GINA 2011).
Além da melhoria clínica, permite a suspensão da corticoterapia sistémica num curto período de tempo, com todos os benefícios para o doente.
REFERÊNCIAS
1. American Thoracic Society. Proceedings of the ATS workshop on refractory asthma. Current understanding, recommendations, and unanswered questions. Am J Respir Crit Care Med 2000;162:2341-51. [ Links ]
2. Global Initiative for Asthma (GINA). Global strategy for asthma management and prevention. NIH Publication 02-3659 issued January1995 (updated 2011). At: http://www.ginasthma.com. [ Links ]
3. Tough SC, Hessel PA, Ruff M, Green FH, Mitchell I, Butt JC. Features that distinguish those who die from asthma from community controls with asthma. J Asthma 1998;35:657-65. [ Links ]
4. Turner MO, Noertjojo K, Vedal S, Bai T, Crump S, Fitzgerald JM. Risk factors for near -fatal asthma. A case-control study in hospitalized patients with asthma. Am J Respir Crit Care Med 1998;157:1804-9. [ Links ]
5. European Network for Understanding Mechanisms of Severe Asthma (ENFUMOSA). The ENFUMOSA cross-sectional European multicentre study of the clinical phenotype of chronic severe asthma. Eur Respir J 2003;22:470-7. [ Links ]
6. Saine SS, MacGlashan DW, Sterbinsky SA, Tugias A, Adelman BC, Lichtenstein LM, et al. Down-regulation of human basophil IgE and FcεRIα surface densities and mediator release by anti -IgE infusions is reversible in vitro and in vivo. J Immunol 1999;162:5624 -30. [ Links ]
7. Presta LG, Lahr SJ, Shields RL, Porter JP, Gorman CM, Fendly BM, et al. Humanization of an antibody directed against IgE. J Immunol 1993;151:2623-32. [ Links ]
8. European Medicines Agency. Xolair: summary of product characteristics [online]. Available from URL: http://www.ema.europa.eu [Accessed 2007 Dec 19]. [ Links ]
9. XolairR (omalizumab): US prescribing information. San Francisco(CA): Genentech, Inc. 2007 Jul. [ Links ]
10. Bang LM, Plosker GL. Omalizumab: a review of its use in the management of allergic asthma. Treat Respir Med 2004;3:183-99. [ Links ]
11. Soresi S, Togias A. Mechanisms of action of anti-immunoglobulin E therapy. Allergy Asthma Proc 2006;27(2 Suppl. 1):S15-23. [ Links ]
12. Gomez G, Jogie -Brahim S, Shima M, Schwartz LB. Omalizumab reverses the phenotypic and functional effects of IgE-enhanced Fc epsilonRI on human skin mast cells. J Immunol 2007;179:1353-61. [ Links ]
13. Beck LA, Marcotte GV, MacGlashan D, Togias A, Saini S. Omalizumab-induced reductions in mast cell Fc epsilonRI expression and function. J Allergy Clin Immunol 2004;114:527-30. [ Links ]
14. Djukanovic R, Wilson SJ, Kraft M, Jarjour NN, Steel M, Chung KF, et al. Effects of treatment with anti-immunoglobulin E antibody omalizumab on airway inflammation in allergic asthma. Am J Respir Crit Care Med 2004;170:583-93. [ Links ]
15. Hochhaus G, Brookman L, Fox H, Johnson C, Matthews J, Ren S, et al. Pharmacodynamics of omalizumab: implications for optimized dosing strategies and clinical efficacy in the treatment of allergic asthma. Curr Med Res Opin 2003;19:491-8. [ Links ]
16. Solèr M, Matz J, Townley R, Buhl R, OBrien J, Fox H, et al. The anti-IgE antibody omalizumab reduces exacerbations and steroid requirement in allergic asthmatics. Eur Respir J 2001;18:254-61. [ Links ]
17. Busse W, Corren J, Lanier BQ, McAlary M, Fowler -Taylor A, Cioppa GD, et al. Omalizumab, anti -IgE recombinant humanized monoclonal antibody, for the treatment of severe allergic asthma. J Allergy Clin Immunol 2001;108:184-90. [ Links ]
18. Holgate ST, Chuchalin AG, Hébert J, Lötvall J, Persson GB, Chung KF, et al. Efficacy and safety of a recombinant anti -immunoglobulin E antibody (omalizumab) in severe allergic asthma. Clin Exp Allergy 2004;34:632-8. [ Links ]
19. Ayres JG, Higgins B, Chilvers ER, Ayre G, Blogg M, Fox H. Efficacy and tolerability of anti -immunoglobulin E therapy with omalizumab in patients with poorly controlled (moderate-to-severe) allergic asthma. Allergy 2004;59:701-8. [ Links ]
20. Finn A, Gross G, van Bavel J, Lee T, Windom H, Everhard F, et al. Omalizumab improves asthma-related quality of life in patients with severe allergic asthma. J Allergy Clin Immunol 2003;111:278-84. [ Links ]
21.Buhl R, Hanf G, Solèr M, Bensch G, Wolfe J, Everhard F, et al. The anti-IgE antibody omalizumab improves asthma-related quality of life in patients with allergic asthma. Eur Respir J 2002;20:1088-94. [ Links ]
22. Holgate S, Buhl R, Bousquet J, Smith N, Panahloo Z, Jimenez P. The use of omalizumab in the treatment of severe allergic asthma: A clinical experience update. Respir Med 2009;103:1098-113. [ Links ]
23. Weber EJ, Silverman RA, Callaham ML, Pollack CV, Woodruff PG, Clark S, et al. A prospective multicenter study of factors associated with hospital admission among adults with acute asthma. Am J Med 2002;113:371-8. [ Links ]
24. Hartert TV, Speroff T, Togias A, Mitchel EF Jr, Snowden MS, Dittus RS, et al. Risk factors for recurrent asthma hospital visits and death among a population of indigent older adults with asthma. Ann Allergy Asthma Immunol 2002;89:467-73. [ Links ]
25. Taylor WR, Newacheck PW. Impact of childhood asthma on health. Pediatrics 1992;90:657-62. [ Links ]
26. Burr ML, Davies BH, Hoare A, Jones A, Williamson IJ, Holgate SK, et al. A confidential inquiry into asthma deaths in Wales. Thorax 1999;54:985-9. [ Links ]
27. Jalaludin BB, Smith MA, Chey T, Orr NJ, Smith WT, Leeder SR. Risk factors for asthma deaths: a population -based, case-control study. Aust N Z J Public Health 1999;23:595-600. [ Links ]
28. Slavin R, Ferioli C, Tannenbaum SJ, Martin C, Blogg M, Lowe PJ. Asthma symptom re -emergence after omalizumab withdrawal correlates well with increasing immunoglobulin-E and decreasing pharmacokinetic concentrations. J Allergy Clin Immunol 2009;123:107-13. [ Links ]
29. Wu AC, Paltiel AD, Kuntz KM, Weiss ST, Fuhlbrigge AL. Cost-effectiveness of omalizumab in adults with severe asthma: results from the Asthma Policy Model. J Allergy Clin Immunol 2007;120:1146-52. [ Links ]
30. Sullivan SD, Turk F. An evaluation of the cost-effectiveness of omalizumab for the treatment of severe allergic asthma. Allergy 2008:63:670-84. [ Links ]
31. Menzella F, Facciolongo N, Piro R, Formisano D, Roggeri A, Simonazzi A, et al. Clinical and pharmacoeconomic aspects of omalizumab: a 4-year follow-up. Ther Adv Respir Dis 2012;6:87-95. [ Links ]
32. Rafi A, Do LT, Katz R, Sheinkopf LE, Simons CW, Klaustermeyer W. Effects of omalizumab in patients with food allergy. Allergy Asthma Proc 2010:31:76-83. [ Links ]
33. Incorvaia C, Mauro M, Riario -Sforza GG, Frati F, Tarantini F, Caserini M. Current and future applications of the anti-IgE antibody omalizumab. Biologics 2008;2:67-73. [ Links ]
34. Humbert M, Beasley R, Ayres J, Slavin R, Hébert J, Bousquet J, et al. Benefits of omalizumab as add-on therapy in patients with severe persistent asthma who are inadequately controlled despite best available therapy (GINA 2002 step 4 treatment): INNOVATE. Allergy 2005;60:309-16. [ Links ]
José Geraldo Dias
Serviço de Imunoalergologia, Hospital de Santa Maria,
Centro Hospitalar Lisboa Norte
Av. Prof. Egas Moniz, 1649 -035 Lisboa
E-mail: ze.geraldodias@gmail.com
Financiamento: Nenhum.
Declaração de conflitos de interesse: Nenhum.
Data de recepção / Received in: 08/07/2012
Data de aceitação / Accepted for publication in: 22/07/2012














