Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Acessos
Acessos
Links relacionados
-
 Similares em
SciELO
Similares em
SciELO
Compartilhar
Revista Portuguesa de Imunoalergologia
versão impressa ISSN 0871-9721
Rev Port Imunoalergologia vol.21 no.4 Lisboa dez. 2013
ARTIGO ORIGINAL
Doença do soro-like associada à administração de fármacos em idade pediátrica
Serum sickness-like reaction associated with drugs intake in pediatric age
Patrícia Barreira1, Eva Gomes2
1 Serviço de Imunoalergologia, Centro Hospitalar de Vila Nova de Gaia / Espinho
2 Serviço de Imunoalergologia, Hospital Maria Pia, Centro Hospitalar do Porto
RESUMO
Introdução: A doença do soro-like (DSL) é uma entidade rara, habitualmente auto -limitada, com prognóstico favorável, que se pode associar à administração de fármacos. Objectivo: Caracterizar os casos de DSL avaliados numa consulta de alergia a fármacos dum hospital pediátrico. Métodos: Estudo retrospectivo dos casos de DSL avaliados na consulta de alergia a fármacos do Serviço de Imunoalergologia do Hospital Maria Pia entre 2006 e 2012. Resultados: Incluíram -se 23 doentes, 13 do sexo feminino. A idade na altura da reacção variou entre 1 e 7 anos (mediana 3 anos). Os antibióticos beta-lactâmicos foram os fármacos suspeitos em todos os casos. Todas as reacções foram tardias e surgiram, em média, ao 8.º dia de tratamento (± 3 dias). As lesões cutâneas e o atingimento articular verificaram-se em todos os doentes. O estudo analítico durante a reacção foi realizado em 91% dos doentes (hemograma, velocidade de sedimentação, doseamento de fracções do complemento e serologias víricas e para bactérias atípicas). A maioria das reacções foi tratada no serviço de urgência, tendo sido internados 11 doentes. Todos apresentaram evolução favorável, com mediana de 8 dias para a resolução completa (1 – 45 dias). Investigação na consulta de alergia a fármacos: doseamento de IgE específicas para antibióticos beta-lactâmicos pedido em todos os doentes (positivo em dois casos). Testes cutâneos por picada e intradérmicos realizados num doente, com resultados positivos na leitura tardia. Prova de provocação negativa nos 4 doentes em que foi efectuada. Conclusões: Não existem estudos sobre a prevalência de DSL associada à ingestão de fármacos. As manifestações clínicas podem simular outras patologias e surgir após o fim do tratamento com o fármaco. É necessário um elevado índice de suspeição para fazer o diagnóstico da doença, o qual é determinado pela relação temporal entre a ingestão do fármaco e o aparecimento do quadro clínico, sendo de menor importância o contributo dos meios auxiliares de diagnóstico.
Palavras-chave: Criança, doença do soro -like, hipersensibilidade a fármacos.
ABSTRACT
Background: Serum sickness-like reaction (SSLR) is a rare disease, usually self -limited and with favorable prognosis, that may be associated with the administration of drugs. Objective: To describe cases of SSLR observed on a drug allergy unit of a pediatric hospital. Methods: Retrospective analysis of SSLR cases observed on the drug allergy unit of the Immunoalergo logy Department of Hospital Maria Pia between 2006 and 2012. Results: 23 patients were included, 13 female. The age at the time of the reaction ranged from 1 to 7 years (median 3 years). Beta -lactam antibiotics were the suspected drug in all cases. All reactions were delayed, appearing on average at day 8 of treatment (± 3 days). Skin lesions and arthralgias/arthritis occurred in all patients. Laboratory evaluation during the reaction was conducted in 91% of patients, including complete blood count, sedimentation rate, determination of complement fractions and serologic tests. Most reactions were treated in the emergency department and 11 patients were admitted. All patients had a favorable outcome, with a median of 8 days for complete resolution(1 -45 days). Results of the allergological work-up: specific IgE for beta -lactam was performed in all patients (positive in two cases). Skin prick tests and intradermal tests were performed in one patient, with a positive late reading. The challenge test was performed in four patients (negative in all cases). Conclusions: There are no studies on the prevalence of SSLR associated with drugs intake. Clinical manifestations can mimic other disorders and can arise just after the drug treatment. A high degree of suspicion is required to the diagnosis, which is determined by the temporal relationship between drug intake and the onset of clinical signs. The diagnostic procedures play a secondary role in this disease.
Keywords: Children, drug hypersensitivity, serum sickness -like reaction.
INTRODUÇÃO
A doença do soro, descrita pela primeira vez em humanos em 1905 por Pirquet e Schick, é uma reacção sistémica que ocorre após a administração de soro heterólogo, habitualmente de origem animal1.
Consiste numa reacção de hipersensibilidade (HS) do tipo III, mediada por imunocomplexos (IC) que se depositam na parede de pequenos vasos, levando à activação do sistema do complemento, com a consequente libertação de mediadores inflamatórios e lesão tecidular2. Clinicamente caracteriza-se por febre, lesões cutâneas, artralgias/artrite, linfadenopatia, nefrite com albuminúria e hematúria e, mais raramente, hepatoesplenomegalia. O prognóstico é favorável, com evolução para a cura, sem sequelas, em dias a semanas3. A incidência da doença do soro tem vindo a diminuir em consequência do menor uso de soro heterólogo de origem animal, sendo actualmente rara4. No entanto, existe uma outra entidade, clinicamente semelhante, que se designa por doença do soro -like (DSL). Esta é mais frequente em idade pediátrica e surge, muitas vezes, associada à administração de fármacos. O mecanismo patofisiológico subjacente ainda não está esclarecido, mas, na maioria dos casos, não é possível detectar IC. Assim, a DSL não cursa, habitualmente, com hipocomplementemia, vasculite ou nefrite5.
As manifestações clínicas mais comuns são febre, artralgias e lesões cutâneas (urticária, angioedema)6. O fármaco mais vezes implicado é o cefaclor7, mas muitos outros têm sido descritos: penicilina8, amoxicilina9, cefazolina10, cefuroxima11,12, ceftriaxona12, meropenem13, sulfonamidas14, macrólidos15, ciprofl oxacina16, tetraciclinas17,18, rifampicina19, griseofulvina20, itraconazol21, bupropiom22,fluoxetina23, omalizumab24, rituximab25, fenilbutazona26, clopidogrel27, entre outros.
Não existem alterações laboratoriais características da doença4. O hemograma é frequentemente normal, ou, por vezes, revela leucocitose ou leucopenia transitórias.
A velocidade de sedimentação pode estar normal, elevada ou diminuída. Dado que não ocorre formação de IC, estes não são detectados e o doseamento das fracções do complemento é, habitualmente, normal. O exame sumário de urina não revela albuminúria, hematúria ou outras alterações. As enzimas de citólise hepática (aspartato aminotransferase – AST – e alanina aminotransferase – ALT) estão, habitualmente, dentro dos valores de referência, assim como os índices de função renal. O diagnóstico é essencialmente clínico, sendo determinado pela relação temporal entre a ingestão do fármaco e o aparecimento da sintomatologia (1 -3 semanas)5. O diagnóstico diferencial em crianças faz -se com patologias que cursem com febre, lesões cutâneas e atingimento articular: infecções víricas (tais como, por parvovírus B19, rubéola ou mononucleose infecciosa) e bacterianas (por exemplo, doença de Lyme ou endocardite bacteriana), doença de Kawasaky, púrpura de Henoch-Schönlein, artrite idiopática juvenil, vasculite urticariforme, lúpus eritematoso sistémico e, embora mais rara, doença neoplásica28.
O tratamento consiste na suspensão do fármaco suspeito e, se necessário, corticoterapia, anti-inflamatórios não esteróides, anti -histamínicos ou gamaglobulina endovenosa.
A necessidade de hospitalização está, frequentemente associada a sintomatologia incapacitante, nomeadamente, pelo atingimento articular, com consequente dificuldade da marcha. Apesar disso, o prognóstico é habitualmente favorável, tratando-se de uma patologia auto-limitada, com resolução completa em 7 a 21 dias20.
A DSL é uma patologia rara e pouco estudada. Este trabalho pretendeu descrever uma série de casos de DSL em crianças observadas na consulta específica de Alergia a Fármacos do Serviço de Imunoalergologia dum Hospital Pediátrico, nomeadamente, os seus aspectos clínicos e resultados do estudo efectuado.
MATERIAL E MÉTODOS
Estudo retrospectivo dos processos clínicos dos casos pediátricos de DSL avaliados numa consulta especializada de Alergia a Fármacos no Serviço de Imunoalergologia do Hospital Maria Pia entre 2006 e 2012.
Os parâmetros avaliados foram os seguintes: género, idade do doente à data da reacção, antecedentes pessoais e familiares de atopia, motivo de referenciação, fármaco(s) suspeito(s) e motivo da sua prescrição, manifestações clínicas, timing da reacção, meios complementares de diagnóstico realizados durante e/ou após a reacção, tempo para resolução total do quadro clínico, necessidade de recorrer ao serviço de urgência (SU) ou equivalente, tratamento da reacção (suspensão do fármaco suspeito e/ou outras terapêuticas), resultado do estudo na consulta de Alergia a Fármacos e orientação do doente.
Não havendo na literatura consenso sobre a orientação a dar a doentes com suspeita de DSL associada à administração de fármacos, optou–se por fazer um estudo com base nos meios auxiliares de diagnóstico disponíveis para a suspeita de hipersensibilidade a beta-lactâmicos. O doseamento de imunoglobulinas (Ig) E específicas para beta -lactâmicos foi proposto e aceite por todos os doentes. Uma vez que todas as reacções foram tardias, não seria de esperar encontrar valores de IgE específicas positivas e, assim, nos doentes em que tal aconteceu, foram propostos testes cutâneos (TC). Aos restantes doentes foi proposta prova de provocação oral (PPO) com o fármaco suspeito ou com alternativo dentro do grupo dos beta -lactâmicos. As PPO realizadas foram abertas, não controladas por placebo, e contemplaram um dia de administração em regime de Hospital de Dia (doses crescentes do fármaco até atingir dose cumulativa indicada para a idade e peso do doente). Dado que todas as reacções foram não imediatas e surgiram, em média, ao 8.º dia de tratamento, os doentes fizeram ainda administração continuada no domicílio, até perfazer ciclo de 8 dias nas doses e frequência habitual para cada fármaco testado.
O doseamento de IgE específicas para beta–lactâmicos (penicilina G, penicilina V, amoxicilina, ampicilina e cefaclor) foi realizado através do sistema ImmunoCAP®, Phadia – Thermo Fisher Scientific, Uppsala, Suécia, sendo o resultado apresentado em kU/L. O valor de cut-off considerado como resultado positivo foi de 0,35 kU/L. Os TC (por picada e intradémicos) foram efectuados respeitando os períodos de evicção estipulados para os medicamentos relevantes e utilizando a metodologia recomendada pelo grupo de interesse de Alergia a Fármacos da Academia Europeia de Alergologia e Imunologia Clínica (European Network for Drug Allergy –ENDA) para o diagnóstico das reacções não imediatas a beta- actâmicos29,30. As PPO foram realizadas seguindo as recomendações do mesmo grupo31.
RESULTADOS
Foram incluídos 23 doentes, 13 do sexo feminino. A maioria não apresentava antecedentes de atopia (87,5%) e nenhum tinha história pessoal ou familiar de alergia medicamentosa prévia.
A idade na altura da reacção variou entre 1 e 7 anos (mediana de 3 anos).
O motivo de referenciação à consulta de Imunoalergologia foi, para todos os doentes, suspeita de HS a fármacos. Os antibióticos beta -lactâmicos foram os fármacos suspeitos em todos os casos: a amoxicilina/ácido clavulânico em 55%, a amoxicilina em 32% e as cefalosporinas em 3 doentes (de 1.ª, 2.ª e 3.ª gerações: cefatrizina, cefaclor, cefixima, respectivamente). Um doente apresentava, após rever a história medicamentosa completa do episódio, mais do que um fármaco suspeito: amoxicilina/ácido clavulânico, paracetamol e ibuprofeno.
Os principais motivos de prescrição do antibiótico foram a amigdalite (41%) e a otite média aguda (32%).
Todas as reacções foram não imediatas e surgiram, em média, ao 8.º dia de tratamento (± 3 dias).
As lesões cutâneas e o atingimento articular (artralgias/artrite) verificaram -se em todos os doentes, estando a febre presente em dois deles. De referir que a febre foi considerada como manifestação da DSL nos casos em que os doentes já estariam apiréticos e reiniciaram hipertermia.
Nos restantes casos, a febre foi integrada no contexto do quadro infeccioso subjacente. Em nenhum dos casos havia referência a linfadenopatia ou hepatoesplenomegalia na altura da reacção. As manifestações cutâneas mais frequentemente descritas foram a urticária (55%) e o exantema maculopapular (35%). Apenas um doente apresentou angioedema (labial e periorbitário).
A maioria dos doentes (n=21) realizou estudo analítico durante a fase aguda, que incluía hemograma, velocidade de sedimentação, doseamento de fracções do complemento e serologias víricas e para bactérias atípicas.
As principais alterações encontradas no hemograma foram a leucocitose com neutrofilia, não se tendo verificado alterações no estudo do complemento. Apenas um doente efectuou doseamento de IC circulantes, que foi negativo. O exame sumário de urina foi pedido a 8 doentes, sendo normal em todos (nomeadamente, sem hematúria ou albuminúria). A biópsia cutânea foi realizada a um doente, tendo revelado alterações inflamatórias inespecíficas, enquadradas no contexto de toxicodermia.
Um doente mostrou evidência de infecção activa por parvovírus B19 (IgM+/IgG -).
A maioria das reacções foi tratada no serviço de urgência com anti -histamínicos, corticosteróides ou anti-inflamatórios não esteróides. Houve necessidade de internamento em 11 doentes (48%): em 4 deles para vigilância clínica, com alta ao fim de 24 horas. Nos restantes, o internamento deveu-se a quadros mais exuberantes, com atingimento articular a condicionar incapacidade para a marcha.
Apesar disso, todos os doentes apresentaram evolução favorável, com uma mediana de 8 dias para a resolução completa (1 -45 dias). O doente que apresentou quadro clínico mais longo teve uma evolução da doença caracterizada por surtos e remissões, durante 45 dias até à cura completa.
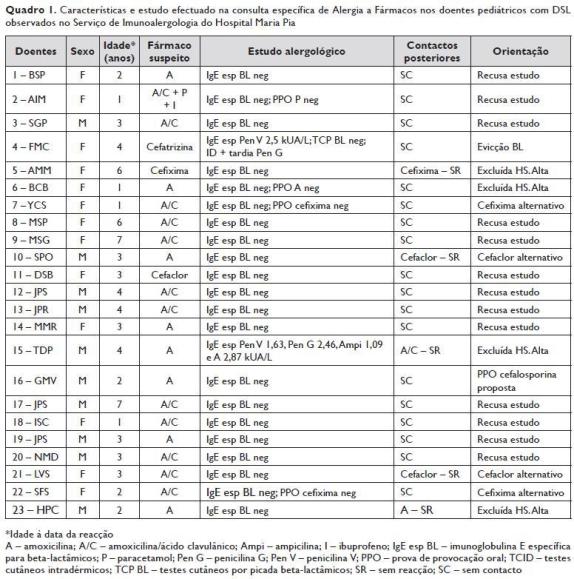
No que diz respeito ao estudo efectuado na consulta específica de Alergia a Fármacos, o doseamento de IgE específicas para beta-lactâmicos foi pedido em todos os doentes, sendo positivo em dois casos: num dos doentes [doente 4] (cujo fármaco suspeito era a cefatrizina) verificou-se positividade para penicilina V (2,5 kU/L); no outro doente [doente 15], encontrou-se positividade para todos os alergénios testados, à excepção do cefaclor (penicilina V [1,63 kU/L], penicilina G [2,46 kU/L], ampicilina [1,09 kU/L] e amoxicilina [2,87 kU/L]).
Os TC por picada (TCP) e intradérmicos (ID) foram realizados apenas num doente [doente 4] com positividade na leitura tardia dos ID para penicilina G. Este doente foi aconselhado a manter evicção de beta-lactâmicos. No doente 15 o fármaco envolvido na reacção era a amoxicilina.
O doente efectuou ciclo posterior de antibioterapia com amoxicilina/ácido clavulânico sem intercorrências, não se tendo confirmado a suspeita de HS a beta -lactâmicos, pelo que não foi aconselhada a sua evicção.
A PPO foi efectuada em quatro doentes, tendo sido negativa em todos eles. Nos doentes 2 e 6, os fármacos testados foram os suspeitos (paracetamol e amoxicilina, respectivamente), não se tendo confirmado a suspeita de HS, pelo que não foi aconselhada a sua evicção. Os doentes 7 e 22 realizaram PPO com um fármaco alternativo (cefixima, em doentes cujo fármaco suspeito era a amoxicilina/ácido clavulânico), pelo que tiveram alta com cefixima como antibiótico alternativo.
Em 4 doentes ocorreu contacto posterior com antibióticos beta -lactâmicos, sem qualquer intercorrência.
Os doentes 5 e 23 contactaram posteriormente os fármacos envolvidos – cefixima e amoxicilina, respectivamente – pelo que se excluiu a suspeita de HS a estes fármacos. Nos outros dois casos, o contacto posterior foi com o cefaclor (em doentes cujos fármacos suspeitos eram, respectivamente, a amoxicilina [doente 10] e a amoxicilina/ácido clavulânico [doente 21]). Nestes doentes não foi possível excluir HS aos fármacos implicados, mas tiveram alta com antibiótico alternativo.
Verificou-se que 13 doentes recusaram prosseguir o estudo, pelo que tiveram alta da consulta, com indicação para manter evicção de beta-lactâmicos, dado não ter sido possível confirmar ou excluir a suspeita de HS a estes fármacos.
No doente 16, cujo fármaco suspeito era a amoxicilina, foi proposta PPO com cefalosporina, aceite mas ainda não realizada.
De seguida, apresenta-se um quadro-resumo com as características e o resultado do estudo efectuado na consulta específica de Alergia a Fármacos nos doentes pediátricos com DSL, observados no Serviço de Imunoalergologia do Hospital Maria Pia.
DISCUSSÃO
No presente estudo, verificou -se que, tal como descrito na literatura, as manifestações clínicas mais frequentes da DSL são febre, artralgias e lesões cutâneas, nomeadamente, urticária6. A ausência de alterações laboratoriais específicas da doença descrita noutros estudos4 foi também constatada neste trabalho. Assim, nenhum dos doentes apresentava hipocomplementemia, vasculite ou nefrite5. À semelhança do habitualmente documentado, o prognóstico da doença é favorável, com resolução do quadro em 7-21 dias, sem sequelas3,20. No entanto, salienta -se a presença de atingimento articular, frequentemente incapacitante, que pode levar ao internamento destas crianças, o que aconteceu em 48% dos casos estudados. Esta percentagem elevada foi também já referida por outros autores32.
A mediana de idades das crianças avaliadas foi de 3 anos, o que está de acordo com outros trabalhos, que apontam para maior prevalência abaixo dos 5 anos32.
O cefaclor, fármaco mais frequentemente implicado na DSL7, surge, no presente estudo, como fármaco suspeito em apenas um doente. Os autores consideram que esta diferença nos fármacos mais frequentemente envolvidos poderá ser justificada pelas alterações no padrão de prescrição, dado que o desenvolvimento de resistências tem tornado o cefaclor num antibiótico cada fez menos utilizado nas infecções em idade pediátrica33.
A DSL é uma patologia rara e pouco estudada, desconhecendo -se a sua incidência, prevalência, mecanismos patofisiológicos e abordagem diagnóstica adequada. Na literatura, verifica-se inexistência de directrizes acerca do estudo mais adequado deste tipo de reacção (sobretudo numa fase posterior à resolução). Assim, a DSL não consta nas indicações para proceder a TC (seja por picada, intradérmicos ou epicutâneos) ou provas de provocação, mas também não é apontada como contra -indicação29 -31. As opções sobre os procedimentos diagnósticos são limitadas, pelo que restam ao clínico poucas alternativas na abordagem e orientação destes doentes. Por um lado, poderão aconselhar a evicção dos fármacos suspeitos, propondo alternativos.
Outra abordagem possível será utilizar os meios diagnósticos disponíveis, tal como foi feito neste trabalho, em que os autores fizeram pedido de IgE específicas para beta-lactâmicos a todos os doentes, visto este ser um estudo facilmente acessível e não acarretar riscos para o doente.
No entanto, dado esta não ser, reconhecidamente, uma reacção mediada pela IgE, a relevância dos resultados obtidos é muito discutível. Assim, a única forma de confirmar//excluir o diagnóstico de DSL é através de uma prova de provocação com o fármaco suspeito. Foi o que fizeram os autores de um estudo espanhol de 200934, que analisaram 39 crianças com reacções não imediatas às aminopenicilinas, 14 delas com DSL. Do estudo efectuado nos doentes com DSL, verificou -se que todos apresentavam IgE específicas e TC para beta -lactâmicos (por picada, intradérmicos e epicutâneos) negativos. Todos os doentes realizaram PPO com o fármaco suspeito, tendo sido positiva em 7 (50%), nos quais foi possível confirmar a presença de HS a beta-lactâmicos. Os autores concluem que a PPO parece ser um procedimento seguro e adequado para o diagnóstico das reacções não imediatas às aminopenicilinas, sendo o valor dos TC limitado nestas formas de apresentação.
O facto de não existirem alternativas para estudar estes doentes, para além da PPO, a idade precoce dos doentes e a existência de sintomas incapacitantes que, muitas vezes, justificam o internamento, poderá, no entender dos autores, explicar a elevada percentagem de doentes (57%) que recusou prosseguir investigação na consulta especializada de Alergia a Fármacos.
CONCLUSÕES
Uma vez que as manifestações clínicas podem simular outra patologia, nomeadamente infecciosa, e surgir após o fim do tratamento com o fármaco, os autores pretendem chamar a atenção para o elevado índice de suspeição necessário para fazer o diagnóstico de DSL, determinado pela relação temporal entre a ingestão do fármaco e o aparecimento do quadro clínico.
Não existem estudos sobre a prevalência de DSL associada à ingestão da maioria dos fármacos. Para o cefaclor, os resultados têm sido divergentes de acordo com os estudos: a incidência varia entre 0,024% (2 casos em 8346) e 0,5% (1 caso em 200), com uma incidência global de 0,055%35.
Uma vez que não se conhece o mecanismo patofisiológico subjacente a este tipo de reacção, algumas questões permanecem em aberto, nomeadamente como deverá ser feita a investigação e qual a orientação que deverá ser dada aos doentes.
Mais estudos são necessários para responder a estas e outras interrogações e avançar um pouco mais no conhecimento sobre esta entidade que, sendo rara, causa importante desconforto nas crianças e significativa ansiedade familiar.
REFERÊNCIAS
1. von Pirquet CE. Allergy. Arch Intern Med 1911;7:259 -288;383-436. [ Links ]
2. Lawley TJ, Bielory L, Gascon P, Yancey KB, Young NS, Frank MM. A prospective clinical and immunologic analysis of patients with serum sickness. N Eng J Med 1984;311:1407-13. [ Links ]
3. Chao YK, Shyur SD, Wu CY, Wang CY. Childhood serum sickness: a case report. J Microbiol Immunol Infect 2001;34:220-3. [ Links ]
4. Tatum AJ, Ditto AM, Patterson R. Severe serum sickness–like reaction to oral penicillin drugs: three case reports. Ann Allergy Asthma Immunol 2001;86:330-4. [ Links ]
5. Segal AR, Doherty KM, Leggott J, Zlotoff B. Cutaneous reactions to drugs in children. Pediatrics 2007;120:e1082-96. [ Links ]
6. Yerushalmi J, Zvulunov A, Halevy S. Serum sickness-like reactions. Cutis 2002;69:395-7. [ Links ]
7. Hebert AA, Sigman ES, Levy ML. Serum sickness-like reactions from cefaclor in children. J Am Acad Dermatol 1991;25:805-8. [ Links ]
8. Clark BM, Kotti GH, Shah AD, Conger NG. Severe serum sickness reaction to oral and intramuscular penicillin. Pharmacotherapy 2006;26:705-8. [ Links ]
9. Levine LR. Quantitative comparison of adverse reactions to cefaclor vs. amoxicillin in a surveillance study. Pediatr Infect Dis 1985;4:358-61. [ Links ]
10. Brucculeri M, Charlton M, Serur D. Serum sickness-like reaction associated with cefazolin. BMC Clinical Pharmacol 2006;6:1-3. [ Links ]
11. Katta R, Anusuri V. Serum sickness -like reaction to cefuroxime: a case report and review of the literature. J Drugs Dermatol 2007;6:747-8. [ Links ]
12. Baniasadi S, Fahimi F, Mansouri D. Serum sickness-like reaction associated with cefuroxime and ceftriaxone. Ann Pharmacother 2007;41:1318-9. [ Links ]
13. Ralph ED, John M, Rieder MJ, Bombassaro AM. Serum sickness-like reaction possibly associated with meropenem use. CID 2003;36:e149-51. [ Links ]
14. Platt R, Dreis MW, Kennedy DL, Kuritsky JN. Serum sickness like reactions to amoxicillin, cefaclor, cephalexin, and trimethoprim-sulfamethoxazole. J Infect Dis 1988;158:474-77. [ Links ]
15. Sohail MA Nasir J, Ikram U, Genese T. Serum sickness -like reaction with clarithromycin. J Hosp Med 2011;6:231-2. [ Links ]
16. Slama TG. Serum sickness -like illness associated with ciprofloxacin. Antimicrob Agents Chemother 1990;34:904-5. [ Links ]
17. Shapiro LE, Knowles SR, Shear NH. Comparative safety of tetracycline, minocycline, and doxycycline. Arch Dermatol 1997;133:1224-30. [ Links ]
18. Harel L, Amir J, Livni E, Straussberg R, Varsano I. Serum sickness-like reaction associated with minocycline therapy in adolescents. Ann Pharmacother 1996;30:481-3. [ Links ]
19. Parra FM, Pérez MJE, Cuevas M, Ferreira A. Serum sickness –like illness associated with rifampicin. Ann Allergy 1994;73:123-5. [ Links ]
20. Colton RL, Amir J, Mimouni M, Zeharia A. Serum sickness like reaction associated with griseofulvin. Ann Pharmacother 2004;38:609-11. [ Links ]
21. Park H, Knowles S, Shear NH. Serum sickness-like reaction to itraconazole. Ann Pharmacother 1998;32:1249. [ Links ]
22. McCollom RA, Elbe DH, Ritchie AH. Bupropion-induced serum sickness -like reaction. Ann Pharmacother 2000;34:471-3. [ Links ]
23. Shapiro LE, Knowles SR, Shear NH. Fluoxetine -induced serum sickness -like reaction. Ann Pharmacother 1997;31:927. [ Links ]
24. Pilette C, Coppens N, Houssiau FA, Rodenstein DO. Severe serum sickness -like syndrome after omalizumab therapy for asthma. J Allergy Clin Immunol 2007;120:972-3. [ Links ]
25. Finger E, Scheinberg M. Development of serum sickness-like symptoms after rituximab infusion in two patients with severe hypergammaglobulinemia. J Clin Rheumatol 2007;13:94-5. [ Links ]
26. Sánchez G, Vila L, Pajarón M, Diéguez I. Skin manifestations of a case of phenylbutazone -induced serum sickness -like reactions. J Investig Allergol Clin Immunol 2000;10:170-2. [ Links ]
27. Phillips EJ, Knowles SR, Shear N. Serum sickness -like reaction associated with clopidogrel. Br J Clin Pharmacol 2003;56:583. [ Links ]
28. Mathes EF, Gilliam AE. A four-year-old boy with fever, rash and arthritis. Semin Cutan Med Surg 2007;26:179 -87. [ Links ]
29. Brockow K, Romano A, Blanca M, Ring J, Pichler W, Demoly P. General considerations for skin test procedures in the diagnosis of drug hypersensitivity. Allergy 2002;57:45-51. [ Links ]
30. Romano A, Blanca M, Torres MJ, Bircher A, Aberer W, Brockow K, et al. Diagnosis of nonimmediate reactions to β-lactam antibiotics. Allergy 2004;59:1153-60. [ Links ]
31. Aberer W, Bircher A, Romano A, Blanca M, Campi P, Fernandez J, et al. Drug provocation testing in the diagnosis of drug hypersensitivity reactions: general considerations. Allergy 2003;58:854-63. [ Links ]
32. Vial T, Pont J, Pham E, Rabilloud M, Descotes J. Cefaclor –associated serum sickness -like disease: eight cases and review of the literature. Ann Pharmacother 1992;26:910-4. [ Links ]
33. Rosenfeld RM, Culpepper L, Doyle KJ, Grundfast KM, Hoberman A, Kenna MA, et al. Clinical practice guideline: otitis media with ef fusion. Otolaryngol Head Neck Surg 2004;103(5 Suppl):S95-118. [ Links ]
34. Blanca -López N, Zapatero L, Alonso E, Torres MJ, Fuentes V, Martínez -Molero MI, et al. Skin testing and drug provocation in the diagnosis of nonimmediate reactions to aminopenicillins in children. Allergy 2009;64:229-33. [ Links ]
35. CECLOR – Marketed Product Information. 2009 October [cited 2012 Nov 10]; Available from: http://www.pubs.gov.au/meds%2Fpi%2Faspceclo11109.pdf.
Patrícia Barreira
Serviço de Imunoalergologia, Centro Hospitalar de Vila Nova Gaia / Espinho
Rua Conceição Fernandes
4434 – 502 Vila Nova de Gaia
E-mail: pccb23@gmail.com
Financiamento: Nenhum.
Declaração de conflito de interesses: Nenhum.
Data de recepção / Received in: 17/12/2012
Data de aceitação / Accepted for publication in: 04/02/2013














