Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Acessos
Acessos
Links relacionados
-
 Similares em
SciELO
Similares em
SciELO
Compartilhar
Revista Portuguesa de Imunoalergologia
versão impressa ISSN 0871-9721
Rev Port Imunoalergologia vol.28 no.4 Lisboa dez. 2020
https://doi.org/10.32932/rpia.2020.12.047
CASO CLÍNICO
Anafilaxia periparto recorrente como manifestação de mastocitose sistémica
Recurrent peripartum anaphylaxis as a manifestation of systemic mastocytosis
Ana Luísa Moura1, Frederico Regateiro1,2,3, Iolanda Alen Coutinho1, Diana Santos Mota4, Artur Paiva5, Ana Todo Bom1,6, Emília Faria1
1 Serviço de Imunoalergologia, Centro Hospitalar e Universitário de Coimbra
2 Instituto de Imunologia, Faculdade de Medicina, Universidade de Coimbra, Coimbra
3 Instituto de Investigação Clínica e Biomédica de Coimbra (iCBR), Faculdade de Medicina, Universidade de Coimbra
4 Serviço de Hematologia, Centro Hospitalar e Universitário de Coimbra
5 Unidade de Gestão Operacional em Citometria, Serviço de Patologia Clínica, Centro Hospitalar e Universitário de Coimbra
6 Faculdade de Medicina, Universidade de Coimbra
RESUMO
A mastocitose é uma doença rara com elevado risco para reações anafiláticas graves. Descrição do caso: Mulher que, aos 27 anos, desenvolveu choque anafilático durante um parto por cesariana. No perioperatório foram administrados lidocaína, ropivacaína, ocitocina, cefazolina e fentanilo. Os testes cutâneos foram positivos apenas à ocitocina (leitura imediata). Um ano mais tarde surgiram lesões cutâneas maculopapulares, vermelho‑acastanhadas, pruriginosas, no tronco e membros inferiores, com sinal de Darier. A biópsia cutânea foi sugestiva de mastocitose. Em cesariana subsequente, ocorreu novo episódio de anafilaxia com paragem cardiorrespiratória e convulsões tonico‑clonicas generalizadas. A presença de 3 critérios minor> (OMS 2016) permitiu o diagnóstico de mastocitose sistémica: (1) triptase basal 40,1 mg/L; (2) mastócitos com morfologia atípica na medula óssea; e (3) expressão aberrante de CD25 nos mastócitos. Conclusão: O diagnóstico de mastocitose exige frequentemente um alto índice de suspeição clínica, nomeadamente em casos de anafilaxia no perioperatório.
Palavras‑chave: Anafilaxia perioperatória, choque anafilático, mastocitose sistémica, síndrome de activação mastocitária.
ABSTRACT
Mastocytosis is a rare disease associated with high risk for severe anaphylactic reactions. Case description: Female patient that developed severe anaphylactic shock during a caesarian delivery at 27 years‑old.
The drugs administered in the perioperative period were lidocaine, ropivacaine, oxytocin, cefazolin and fentanyl. Skin tests were positive only to oxytocin (immediate reaction). One year later, a red‑brown, pruriginous, maculopapular rash with Dariers sign was noted in the torso and legs. The skin biopsy showed mast cells in the dermis, consistent with mastocytosis. On a second caesarian section, she had another episode of anaphylaxis with cardiorespiratory failure and generalized convulsions. The diagnosis of systemic mastocytosis was based on following criteria (WHO 2016): (1) basal serum tryptase levels 40,1 mg/L; (2) abnormal morphology of mast cells in bone marrow; and, (3) expression of CD25 on mast cells. Conclusion: The diagnosis of mastocytosis requires high clinical suspicion, particularly in cases of perioperative anaphylaxis.
Keywords: Anaphylactic shock, mast cell activation syndrome, perioperative anaphylaxis, systemic mastocytosis.
INTRODUÇÃO
A anafilaxia perioperatória é uma reação sistémica grave ocorrida no período perianestésico e uma das causas mais frequentes de anafilaxia na idade adulta1‑4.
Os fármacos e materiais utilizados nos procedimentos anestésicos e cirúrgicos são potenciais desencadeantes de reações de hipersensibilidade, e a presença de outras variáveis, como comorbilidades associadas, medicação crónica e complicações cirúrgicas podem agravar a reação ou dificultar o seu tratamento3.
A mastocitose sistémica (MS) e outras síndromes de ativação mastocitária são fatores de risco para reacções de anafilaxia grave no perioperatório5,6. A MS é uma doença rara e heterogénea, com uma incidência estimada de 1:150 000, que resulta da proliferação de mastócitos clonais e envolve, frequentemente, a pele e outros órgãos, como medula óssea (MO), fígado, baço e gânglios linfáticos7.
De acordo com a Organização Mundial de Saúde (OMS), o diagnóstico de MS baseia‑se em 5 critérios fundamentais: um critério major – presença de 15 ou mais agregados de mastócitos detetados em secções de MO ou outros tecidos extracutâneos – e quatro critérios minor – (1) presença de mais de 25% de mastócitos fusiformes/com morfologia atípica em secções de MO ou outros órgãos extracutâneos, ou imaturidade/atipia em mais de 25% dos mastócitos no aspirado medular, (2) mutação pontual ativadora no codão 816 do gene KIT na MO, sangue ou outro órgão extracutâneo, (3) fenótipo aberrante dos mastócitos (CD25+, com ou sem expressão de CD2), e, (4) nível basal de triptase sérica superior a 20 ng/mL8,9.
O diagnóstico de MS é estabelecido pela presença de, pelo menos, um critério major e um minor ou 3 critérios minor8,9.
O espetro clínico de MS varia entre quadros assintomáticos e episódios frequentes de sintomas causados pela libertação de mediadores mastocitários, que podem incluir reações anafiláticas fatais9. Entre os adultos diagnosticados com diversas formas de mastocitose, a prevalência de anafilaxia situa‑se entre 20% a 56%, o que representa um risco 100 a 1000 vezes superior ao da população em geral3,6. Nestes doentes, a hipersensibilidade imediata resulta, habitualmente, da desgranulação de mastócitos desencadeada por fatores inespecíficos (i.e., psicológicos, farmacológicos, mecânicos e alterações da temperatura)6. No entanto, reações IgE‑mediadas podem também ocorrer3. Os fatores desencadeantes mais frequentemente envolvidos nos episódios de anafilaxia associados à MS são as picadas de himenópteros (53% dos casos), seguidos de reações sem desencadeante identificado (39%) e, mais raramente, fármacos e alimentos3.
As reações anafiláticas nos doentes com MS são potencialmente graves e, na maior parte dos casos, apresentam‑se com manifestações cardiovasculares que incluem síncope com hipotensão arterial3.
DESCRIÇÃO DO CASO
Doente do sexo feminino, atualmente com 39 anos, que, durante um parto por cesariana aos 27 anos num hospital distrital (primeira gravidez), teve um episódio grave de choque anafilático com paragem cardiorrespiratória e necessidade de manobras de reanimação. No período perioperatório foram administrados os seguintes fármacos: lidocaína, ropivacaína, ocitocina, cefazolina e fentanilo.
Foi encaminhada para a consulta de Imunoalergologia tendo sido realizado o seguinte estudo: (1) testes cutâneos de alergia (TCA) com bateria standard> de aeroalergénios que foram positivos apenas para D. pteronissinus e farinae e negativos para o látex; (2) TCA com cefazolina, ropivacaína, lidocaína e fentanilo, que foram todos negativos nas leituras imediata e tardia; (3) TCA com ocitocina positivos no intradérmico na concentração 0,05 UI/mL (foram efetuados testes controlo em cinco doentes atópicos com resultado negativo); (4) provas de provocação (PP) com mepivacaína e ropivacaína negativas; (5) IgE total de 47 UI/mL e IgE específicas para látex e ocitocina (Phadia, Suécia) negativas. Não foi medida a triptase sérica.
Os TCA e PP foram realizados com base nos protocolos definidos pelos grupos Global Allergy and Asthma European> Network (GA2LEN©) e European> Network on Drug> Allergy (ENDA/EAACI), respetivamente para aeroalergénios (+ L. destructor) e fármacos.
Foi assumido o diagnóstico de hipersensibilidade à ocitocina como causa da anafilaxia. A PP com o fármaco alternativo (misoprostol) foi negativa. Foi ainda diagnosticada rinite alérgica intermitente ligeira. Teve alta da consulta após ter sido fornecido um relatório com as indicações de evicções necessárias nos procedimentos futuros.
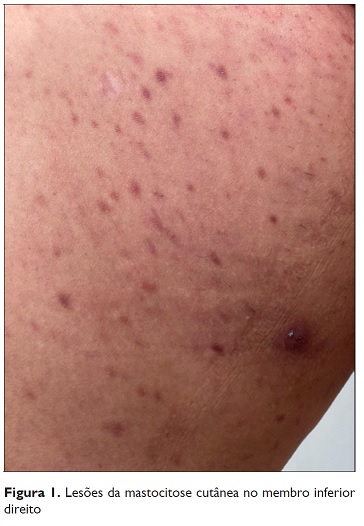
Cerca de um ano após este episódio de anafilaxia, a doente recorreu a uma consulta de Dermatologia por um exantema maculopapular no tronco e membros inferiores, pruriginoso, com pigmentação vermelho‑acastanhado (Figure 1), e com positividade na pesquisa do sinal de Darier. Na biópsia cutânea observou‑se um infiltrado de mastócitos na derme em número superior a 20 por campo de grande ampliação e de pigmentação basal, sugestiva de mastocitose cutânea maculopapular na variante monomórfica. Foi medicada com anti‑histaminico diário.
Quatro anos mais tarde, durante um segundo parto por cesariana, apesar da evicção de ocitocina, a doente desenvolveu novo episódio de choque anafilático grave, com convulsões generalizadas tonico‑clonicas e necessidade de medidas de suporte avançado de vida.
Colocada a hipótese diagnóstica de MS, foi enviada às consultas de Imunoalergologia e Hematologia. Do estudo realizado, a destacar: (1) doseamento da triptase sérica basal 40,1 e 39,2 mg/L, em dois momentos distintos; (2) citometria de fluxo do aspirado da MO mostrou 0,09% de mastócitos, 100% com fenótipo aberrante‑CD25+; (3) medulograma detetou um número aumentado de mastócitos (1%), sem outras alterações; (4) biópsia medular óssea mostrou presença de células alongadas de citoplasma amplo, evidenciando grânulos metacromáticos, compatível com envolvimento focal da MO por MS; (5) pesquisa da mutação do gene c‑KIT D816V em linfócitos e neutrófilos na MO foi negativa, não tendo sido possível a pesquisa nos mastócitos devido ao número diminuído destas células; (6) beta‑2‑microglobulina sérica normal.
A doença foi classificada como MS indolente, tendo em conta os seguintes aspetos: (1) presença de 3 critérios minor da OMS, (2) ausência de critérios C, (3) ausência de outra neoplasia hematológica associada e (4) ausência de critérios B9 (Quadro 1).
Mantém vigilância periódica desde essa altura em consultas de Imunoalergologia, Hematologia e Dermatologia.
Foram fornecidos planos escritos de emergência e com recomendações para minimizar os riscos em procedimentos futuros (Quadro 2), realizados os ensinos para utilização de dispositivo de adrenalina auto‑injetavel e emitido o Cartão de Pessoa com Doença Rara, da Direcao‑Geral da Saúde.

DISCUSSÃO
Descrevemos um caso raro de uma doente com dois episódios graves de choque anafilático no perioperatório de cesarianas, cuja evolução e investigação etiológica culminaram no diagnóstico de MS, cumprindo três critérios minor da classificação da OMS9.
Realçamos, por um lado, a primeira manifestação da doença ter sido um episódio de anafilaxia que ocorreu previamente ao aparecimento das lesões cutâneas e, por outro, à gravidez e/ou cesariana como fatores de stress acrescido nestes doentes.
A evolução silenciosa da doença até a anafilaxia, associada ao diagnóstico de hipersensibilidade IgE‑mediada a um dos fármacos administrados no primeiro episódio de anafilaxia, gerou dificuldades no diagnóstico diferencial.
Este facto sugere a possibilidade de uma sobreposição de dois mecanismos de reações de hipersensibilidade imediata, alérgico e não alérgico, tendo dificultado a marcha diagnóstica. Para além disso, nesta altura, a medição da triptase sérica ainda não estava disponível neste centro hospitalar.
A erupção cutânea típica, designada por urticária pigmentosa, é a manifestação cutânea mais frequente neste tipo de patologia, ocorrendo em mais de 90% dos doentes com a forma indolente da doença8.
O tratamento da MS é tão heterogéneo quanto as suas diversas apresentações. Nas formas mais ligeiras pode estar indicada apenas vigilância clínica, enquanto nas formas mais graves pode ser necessário transplante alogénico de progenitores hematopoiéticos10. No entanto, o tratamento dirigido aos sintomas deve ser considerado em todos os doentes com MS10. Assim, a maior parte dos algoritmos de tratamento abordam (1) a evicção dos desencadeantes das reações, (2) o controlo sintomático com anti‑histaminicos, estabilizadores dos mastócitos e modificadores dos leucotrienos e (3) o tratamento emergente das crises, sendo fundamental serem portadores de adrenalina autoinjetável10.
A MS indolente, a forma apresentada pela doente que aqui descrevemos, é a forma mais frequente e com prognóstico mais favorável. Existe, no entanto, um risco de reações futuras fatais/perifatais.
O tratamento com omalizumab parece diminuir os episódios em doentes com anafilaxias recorrentes, como evidenciado em estudo recente, onde se verificou que o tratamento com omalizumab reduziu o número e gravidade dos episódios de anafilaxia em 4 de 6 doentes com o diagnóstico de MS indolente10.
Tendo em conta o risco de anafilaxia grave devem ser mantidos cuidados durante a anestesia/cirurgia, nomeadamente uma escolha apropriada dos fármacos a serem utilizados no peri‑operatório (Quadro 2), a realização de pré‑medicação e cuidados gerais de evicção dos possíveis desencadeantes inespecíficos de ativação mastocitária, como controlo da ansiedade e stress emocional, mudanças de temperatura (hipo ou hipertermia), fatores mecânicos (pressão do torniquete e do cuff> do medidor de tensão arterial, fricção dos adesivos).
Salientamos a obrigatoriedade da medição da triptase sérica basal perante uma anafilaxia que, aliado ao despiste de envolvimento sistémico aquando do diagnóstico de mastocitose cutânea, poderia ter evitado/minimizado o segundo episódio de anafilaxia nesta doente.
Este caso clínico ilustra a necessidade de haver um alto índice de suspeição clínica de MS nos casos de reacções anafiláticas graves e a necessidade de acompanhamento precoce por equipas multidisciplinares.
REFERÊNCIAS
1. Faria E. Anafilaxia a agentes anestésicos. Rev Port Imunoalergologia 2018;26(4):239‑54. [ Links ]
2. Faria E, Rodrigues‑Cernadas J, Gaspar A, et al Drug‑induced anaphylaxis survey in Portuguese Allergy Departments. J Investig Allergol Clin Immunol 2014;24:40‑8. [ Links ]
3. Aun MV, Garro LS, Ribeiro MR, Motta AA, Kalil J, Giavina‑Bianchi P. Anafilaxia perioperatória: a experiência brasileira. Rev Port Imunoalergologia 2016;24:99‑106. [ Links ]
4. Garvey LH, Ebo DG, Mertes PM, Dewachter P, Garcez T, Kopac P, Laguna JJ, et al. An EAACI position paper on the investigation of perioperative immediate hypersensitivity reactions. Allergy 2019;74(10):1872‑84. [ Links ]
5. Valent P, Akin C, Bonadonna P, Hartmann K, Brockow K, Niedoszytko M, et al. Proposed diagnostic algorithm for patients with suspected mast cell activation syndrome. J Allergy Clin Immunol Pract 2019;7(4):1125‑33.e1. [ Links ]
6. Gülen T, Ljung C, Nilsson G, Akin C. Risk factor analysis of anaphylactic reactions in patients with systemic mastocytosis. J Allergy Clin Immunol Pract 2017;5(5):1248‑55. [ Links ]
7. Valent P, Akin C, Arock M, Brockow K, Butterfield JH, Carter MC, et al. Definitions, criteria and global classification of mast cell disorders with special reference to mast cell activation syndromes: a consensus proposal. Int Arch Allergy Immunol 2012;157:215‑25. [ Links ]
8. Hartmann K, Escribano L, Grattan C, Brockow K, Carter MC, Alvarez‑Twose I, et al. Cutaneous manifestations in patients with mastocytosis: Consensus report of the European Competence Network on Mastocytosis; the American Academy of Allergy, Asthma & Immunology; and the European Academy of Allergology and Clinical Immunology. J Allergy Clin Immunol 2016;137(1):35‑45. [ Links ]
9. Valent P, Akin C, Metcalfe D. Mastocytosis: 2016 updated WHO classification and novel emerging treatment concepts. Blood 2017; 129(11): 1420-7. [ Links ]
10. Slapnicar C, Trinkaus M, Hicks L and Vadas P. Efficacy of omalizumab in indolent systemic mastocytosis. Case Rep Hematol 2019;2019:3787586. [ Links ]
Ana Luísa Moura
Serviço de Imunoalergologia
Centro Hospitalar e Universitário de Coimbra
E-mail: al-moura@hotmail.com
Conflito de interesses
Os autores declaram que não existem conflitos de interesses.
Data de receção / Received in: 20/11/2019
Data de aceitação / Accepted for publication in: 31/01/2020














