INTRODUÇÃO
A asma é a doença inflamatória crónica mais comum na idade pediátrica1. Clinicamente é caracterizada por episódios recorrentes de sibilância, tosse de predomínio noturno, dispneia e opressão torácica2,3.
A maioria das crianças com sibilância recorrente em idade pre‑escolar apresenta resolução do quadro clínico antes da adolescência, sendo o risco de evolução para asma persistente dependente do fenótipo de sibilância.
Classicamente, os fenótipos de sibilância recorrente dividem‑se em sibilância transitória, sibilância persistente e sibilância de início tardio4-7. Um estudo nacional, publicado em 2014 por Pité et al., identificou três fenótipos de sibilância em crianças: sibilância persistente atópica, sibilância persistente não atópica e sibilância transitória não atópica8. No seguimento a 13 anos, verificou‑se que as crianças com sibilância persistente atópica, caracterizada pela presença de atopia e história pessoal de rinite em idade pré‑escolar, têm significativamente maior risco de persistência clínica e evolução para asma8.
A classificação da asma em fenótipos, endótipos, graus de gravidade e de controlo permite uma abordagem terapêutica mais dirigida e eficaz. Os fenótipos de asma são baseados em dados clínicos (e.g., idade de apresentação, fatores de agravamento, comorbilidades, resposta à terapêutica, etc). Porém, estas características clínicas relacionam‑se apenas parcialmente com o tipo de inflamação presente nas vias aéreas das crianças asmáticas.
Por outro lado, a classificação em endótipos é baseada nos mecanismos fisiopatológicos subjacentes, sendo definidos por padrões celulares e/ou moleculares, e poderá explicar as características fenotípicas9. Pelo menos em teoria, a classificação em endótipos permitirá uma melhor escolha terapêutica10. Atualmente, os dois endótipos mais consensuais são baseados na presença de inflamação Th2 (Th2‑high vs Th2‑low).
Na inflamação Th2, as alarminas epiteliais TSLP, IL‑25 e IL‑33 estimulam a produção de citocinas IL‑4, IL‑5 e IL‑13 pelas células dendríticas e células linfoides inatas tipo 2 (ILC‑2).
Estas citocinas vão induzir a diferenciação de linfócitos Th2 e a proliferação, ativação e acumulação de eosinófilos no epitélio brônquico e, em alguns doentes, a produção de IgE específica11.
A definição de fenótipos de asma grave na idade pediátrica é um processo complexo e pouco consensual, em parte devido às limitações para investigação clínica neste grupo etário e ao reduzido número de estudos. Um dos trabalhos mais reconhecidos nesse campo identificou quatro clusters, de gravidade crescente, num grupo de 161 crianças seguidas no Severe Asthma Research Program (SARP): 1 - asma sintomática de início tardio, que apresentou menor gravidade, presente em 48 (29,8%) doentes; 2 - asma atópica de início precoce com função pulmonar normal, em 52 (32,3%); 3 - asma atópica de início precoce com limitação moderada do fluxo aéreo, em 32 (19,9%); 4 - asma atópica de início precoce com limitação significativa do fluxo aéreo, em 29 (18%). Os clusters 3 e 4 - mais graves - apresentaram níveis superiores de FeNO, bem como mais comorbilidades e maior necessidade de tratamento com corticoterapia oral12.
Uma limitação importante desde trabalho foi o facto de nenhum dos clusters corresponder devidamente às definições de asma grave da ATS ou do GINA, que foram extrapoladas a partir da idade adulta. Estes dados reforçam a heterogeneidade marcada da asma grave em crianças, também verificada nos adultos. Contudo, ao contrário dos adultos com asma de início tardio, a asma grave com início em idade pediátrica parece predominantemente associada a um endótipo Th2‑high e a mecanismos alérgicos - eosinofilia periférica, maior sensibilidade a aeroalergénios, concentrações elevadas de IgE e elevações persistentes de FeNO13.
A investigação em transcriptómica, proteómica e metabolómica de doentes com asma tem procurado identificar outros endótipos e genes relacionados, assim como estabelecer associações entre endótipos e fenótipos clínicos de asma10. A caracterização endotípica da asma assume particular relevância no contexto da asma grave. O conceito de asma grave, de acordo com definição da Global Initiative for Asthma (GINA) 2019, está intimamente relacionado com a resposta à terapêutica e compreende um dos dois seguintes critérios: 1 - asma não controlada com terapêutica máxima otimizada nos steps 4 ou 5 (ou step 4 em crianças com idade inferior a 6 anos); 2 - asma que agrava com a redução destes steps terapêuticos14. Também a definição da European Respiratory Society (ERS) e da American Thoracic Society (ATS) reforça a necessidade de terapêutica inalatória em alta dose e, possivelmente, de corticoterapia sistémica. Estima‑se que cerca de 4,5% das crianças asmáticas têm asma grave15,16.
Na asma grave, é frequente o recurso à corticoterapia oral e/ou inalada (ICS) em alta dose, o que pode ter efeitos indesejados, devido à potencial supressão do eixohipotalamo‑hipofise (embora a insuficiência adrenal seja rara), alteração comportamental (esquemas de corticoterapia oral em exacerbações de asma podem causar ansiedade, mania, irritabilidade ou comportamentos agressivos) ou interferência no metabolismo ósseo (possível redução da densidade mineral óssea com doses de ICS elevadas e a longo prazo), entre outros efeitos17. Em particular, o uso de corticosteroides orais tem um efeito dose-dependente no atraso do crescimento das crianças, com possível impacto negativo na altura final. Com os ICS em alta dose, os dados são menos conclusivos. O efeito dos ICS no crescimento de crianças em idade pre‑pubertaria é mais pronunciado com maiores doses de fármaco (superiores a dose‑equivalente de 400μg de beclometasona), mas ocorre principalmente durante o primeiro ano de tratamento, sendo incerto que este atraso tenha impacto na estatura da idade adulta. Deste modo, é importante encontrar alternativas terapêuticas que reduzam o uso destes fármacos e os seus potenciais efeitos adversos17,18. A asma grave na idade pediátrica pode também causar inflamação e remodeling das vias aéreas, o que potencialmente leva a obstrução persistente do fluxo aéreo e a um declínio marcado do FEV1 na idade adulta19.
Vários medicamentos biológicos dirigidos a moléculas da inflamação Th2 foram aprovados para o tratamento da asma moderada a grave em adultos20. Os ensaios clínicos e guidelines terapêuticas14 distinguem entre adultos (geralmente, acima dos 18 anos), adolescentes (entre os 12 e os 18 anos) e crianças (abaixo dos 12 anos). O GINA considera ainda a idade pré‑escolar (abaixo dos 6 anos), que apresenta especificidades no diagnóstico e tratamento. Na ausência de ensaios clínicos dirigidos apenas a faixas etárias pediátricas, os resultados dos estudos clínicos em adultos para asma grave têm sido, frequentemente, extrapolados para adolescentes, dada a putativa semelhança fisiopatológica. Em idades mais precoces, as diferenças são mais significativas, quer na fisiologia das crianças, quer na fisiopatologia da doença, estando disponível menor evidência científica nestes grupos etários21. Atualmente não existem biológicos aprovados para o tratamento da asma grave em crianças com menos de 6 anos.
Este artigo tem como objetivo rever a informação existente sobre as terapêuticas biológicas actualmente disponíveis ou em desenvolvimento para o tratamento da asma grave em crianças e adolescentes (Quadro 1 e
Figura 1).
Quadro 1 Resumo dos principais estudos concluídos sobre as terapêuticas biológicas em comercialização/investigação para a asma grave em idade pediátrica. Foram excluídos estudos ainda a decorrer ou suspensos
| Estudo | Anticorpo | Doentes (n.º) | Idades (anos) | Resultados publicados |
|---|---|---|---|---|
| Lanier et al. 27 | Omalizumab | 627 | 6-11 | Taxa anualizada de exacerbações - redução de 43% vs. placebo N.º exacerbações com hospitalização - redução de 50% vs. placebo |
| ICATA26 | Omalizumab | 419 | 6-20 | N.º dias com sintomas - redução de 24,5% vs. placebo Taxa de exacerbações - redução de 18% vs. placebo Redução da dose de corticosteroides inalados |
| PROSE29 | Omalizumab | 478 | 6-17 | Taxa de exacerbações - 11,3% vs. 21,0% placebo; diferença não significativa vs. aumento de corticosteroides inalados Maior benefício no período run-in |
| STELLAIR32 | Omalizumab | 872 | ≥6 | 78,5% de crianças tiveram redução >40% da taxa de exacerbações Eficácia semelhante em subgrupos com elevado ou reduzido número de eosinófilos periféricos |
| DREAM36 | Mepolizumab | 621 | 12-74 | Taxa de exacerbações - redução de 39-52% vs. placebo Redução maior em doentes com maior eosinofilia periférica |
| MENSA37 | Mepolizumab | 576 | 12-82 | Taxa de exacerbações - redução de 47-53% vs. placebo FEV1 médio - aumento de 98-100ml vs. placebo Melhoria nos scores de qualidade de vida e controlo da asma |
| SIRIUS38 | Mepolizumab | 135 | 16-74 | Dose de corticosteroides sistémicos - redução de 50% vs. placebo Taxa anualizada de exacerbações - redução de 32% vs. placebo Melhoria no score ACQ-5 de controlo da asma |
| COSMOS39 (extensão MENSA/ SIRIUS) | Mepolizumab | 651 | 12-82 | Reações adversas: sistémicas - 2%; local de injeção - 4% Manutenção da redução da taxa de exacerbações e dose de cor- ticosteroide sistémico em 52 semanas de tratamento |
| COLUMBA40 (extensão DREAM) | Mepolizumab | 347 | 12-74 | Efeitos adversos atribuídos ao tratamento - 28% (cefaleias - 4%; reações no local de injeção - 12%) Manutenção da redução da taxa de exacerbações e score ACQ-5 em mais de 155 semanas de tratamento |
| Gupta et al 41 | Mepolizumab | 30 | 6-11 | Redução do número de eosinófilos circulantes, taxa de exacerbações e controlo sintomático Eventos adversos: em geral - 90%; graves - 23% (0% atribuídos ao tratamento) |
| BREATH*43 | Reslizumab | 39 | 12-17 | Taxa de exacerbações em adolescentes - não redução (razão [reslizumab/placebo] de 2,09) |
| SIROCCO/ CALIMA¥,44 | Benralizumab | 108 | 12-17 | Taxa de exacerbações em adolescentes - não redução (70% vs. 41% placebo |
| QUEST47 | Dupilumab | 1902 | ≥12 | Taxa anualizada de exacerbações - redução de 65,8% vs. placebo |
| VENTURE50 | Dupilumab | 210 | ≥12 | Dose de corticosteroides sistémicos - redução de 70,1% vs. 41,9% placebo |
* Programa de 4 estudos - representado na tabela subgrupo pediátrico de um total de 1759 doentes; ¥ Representado na tabela subgrupo pediátrico de um total de 2295 doentes.
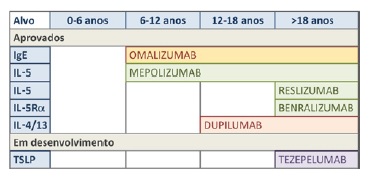
Figura 1 Anticorpos monoclonais aprovados ou em fases de desenvolvimento avançado para o tratamento da asma grave. Para cada biológico é apresentado o seu alvo terapêutico (coluna da esquerda) e as faixas etárias para as quais estão aprovados ou em desenvolvimento
TERAPÊUTICA ANTI‑IgE
Omalizumab
O omalizumab é um anticorpo monoclonal IgG1 de administração subcutânea com atividade anti‑IgE que se fixa à porção Cε3 da IgE livre, impedindo, deste modo, a ligação da IgE aos recetores FcεRI na superfície de mastócitos, basófilos e outras células do sistema imunitário22.
O omalizumab foi aprovado pela FDA em 2003 para o tratamento da asma moderada a grave em doentes com 12 ou mais anos e em 2005 pela EMA para o tratamento de doentes com asma alérgica não controlada com múltiplas exacerbações apesar do tratamento com doses altas de corticoides inalados/β2‑agonistas de longa ação e com FEV1 < 80% do previsto. A utilização em doentes com idades a partir dos 6 anos foi aprovada pela EMA em 2009 e pela FDA em 201623,24. O omalizumab apresenta um elevado perfil de segurança em crianças, adolescentes e adultos, com cefaleias e reações no local de injeção a serem os efeitos indesejáveis mais observados24,25.
As doses de administração do fármaco variam entre 75 e 375mg (para idades entre os 6 e os 11 anos) e 150 a 375mg (para idades iguais ou superiores a 12 anos) a cada 2 ou 4 semanas. A determinação da posologia e da frequência recomendadas depende dos níveis de IgE sérica total medidos antes do início do tratamento e do peso corporal do doente. Com o crescimento, poderá haver variação do peso e ser necessário ajustar a dose de manutenção com base em tabelas fornecidas pela empresa produtora, que discriminam categorias entre os 20 e os 150kg24.
Foram publicados vários ensaios clínicos randomizados controlados com placebo26,27,28,29 e vários estudos observacionais30,31para avaliar a eficácia e segurança do omalizumab em asmáticos em idade pediátrica. Entre os ensaios clínicos destaca‑se o estudo de Lanier et al.27, que incluiu 627 crianças com idades entre os 6 e os 12 anos com asma alérgica mal controlada, em que se verificou que o tratamento com omalizumab durante um ano reduziu a taxa de exacerbações em 43% e de exacerbações graves e hospitalizações em 50% versus placebo27. No estudo ICATA (Busse et al.), com 419 doentes entre os 6 e os 20 anos com asma alérgica não controlada, constatou‑se que a adição de omalizumab à terapeutica‑base durante 60 semanas reduziu, versus placebo, o número de dias com sintomas em 24,5%, a taxa de exacerbações em 18% e houve ainda uma redução da dose de ICS. Numa análise post hoc, os autores realçaram que o benefício nas exacerbações abrangeu o período da primavera e do inverno, ou seja, a época polínica e o período de maior frequência das infeções virais. Estes dados sugerem que o omalizumab poderá ter um papel não só na prevenção de exacerbações de causa alérgica mas também de outras causas, nomeadamente por infeções26. O efeito preventivo de exacerbações com desencadeante viral é igualmente sugerido pelos resultados do estudo seguinte. Ao contrário do ICATA, foi aplicado no período verão‑outono e poderá indicar um efeito independente da sazonalidade.
O estudo PROSE (Back to school - PROSE study)29 foi um estudo sazonal, em contexto de “regresso às aulas” após as férias de verão, realizado em crianças com idades entre os 6 e os 17 anos, com asma persistente não controlada, com >200ug de fluticasona equivalente/dia e que tinham tido uma exacerbação tratada com corticosteroide sistémico nos últimos 19 meses. O estudo incluiu três braços terapêuticos, a aplicar durante 90 dias, entre 4 a 6 semanas antes do regresso às aulas: 1) duplicação da dose habitual de ICS; 2) associação de omalizumab à terapêutica de manutenção habitual; ou 3) associação de placebo em vez de omalizumab. A associação de omalizumab à terapêutica reduziu a taxa de exacerbações quando comparada com o placebo (11,3% vs 21,0%; OR 0,48).
A melhoria obtida com o omalizumab não foi significativamente diferente da obtida com o aumento da dose de ICS (8,4% vs 11,1%; OR 0,73). O benefício do omalizumab foi particularmente observado nos doentes que tiveram exacerbações durante o período de run‑in, tanto versus placebo (6,4% vs 36,3%; OR 0,12) como versus a duplicação da dose de ICS (2,0% vs 27,8%; OR 0,05). Apesar de o omalizumab ter diminuído o número de episódios sintomáticos, a duração dos episódios não foi afetada. A resposta positiva ao omalizumab associou‑se a uma melhor produção de IFN‑α em resposta a rinovírus, sugerindo que a terapêutica anti‑IgE poderá ser benéfica também em exacerbações de asma desencadeadas por esta infeção viral29.
Em crianças com asma grave, uma resposta total e precoce ao omalizumab associou‑se a FEV1 normal, à presença de comorbilidades atópicas (sensibilizações múltiplas, dermatite atópica ativa e alergia alimentar) e a níveis elevados de eosinofilia sérica, IgE total e FeNO11. Alguns dados recentes contestam a associação da resposta ao omalizumab com a eosinofilia: o estudo STELLAIR constatou que a eficácia do omalizumab em doentes adultos e pediátricos com asma grave era equivalente em subgrupos com número elevado e reduzido de eosinófilos periféricos32.
A possibilidade de utilizar o omalizumab para prevenir a evolução para asma em crianças está a ser avaliada pelo ensaio clínico PARK (Preventing Asthma in High Risk Kids).
Neste ensaio, 250 crianças de idade pre‑escolar (24‑47 meses) com elevado risco de asma (2 a 4 episódios de sibilância no último ano, testes positivos para alergia a aeroalergénios e um familiar em primeiro grau com história de asma ou atopia) receberão omalizumab (ou placebo) durante dois anos e, dois anos após suspensão da terapêutica, será avaliada a prevalência de asma ativa, a gravidade da asma, o número de episódios de sibilância nos doentes e o número de novas sensibilizações alérgicas. Este ensaio de fase 2 tem data estimada de conclusão a 27 de novembro de 202533.
TERAPÊUTICA ANTI‑IL‑5 E ANTI‑IL‑5RΑ
Atualmente, para o tratamento de asma eosinofílica em adultos estão comercializados em Portugal três anticorpos monoclonais dirigidos à IL‑5 ou ao seu receptor (IL‑5Rα): o mepolizumab, o reslizumab e o benralizumab20. Destes, apenas o mepolizumab está aprovado na Europa para idades inferiores a 18 anos.
Mepolizumab
O mepolizumab é um anticorpo monoclonal humanizado (IgG1κ) dirigido à IL‑5 que bloqueia a sua ligação à cadeia alfa do recetor da IL‑534. Foi aprovado pela FDA e pela EMA em 2015 para o tratamento de asma eosinofílica grave em adultos e adolescentes com idade igual ou superior a 12 anos35. A EMA aprovou em agosto de 2018 a utilização do mepolizumab para crianças a partir dos 6 anos35.
Vários ensaios clínicos randomizados de fase III, duplamente cegos, controlados por placebo, multicêntricos, com mepolizumab, incluíram adultos e adolescentes com idades superiores a 12 anos. Contudo, foi incluído um número reduzido de doentes pediátricos (cerca de 30 numa amostra superior a 800 doentes, correspondendo a 2‑4% do total), nenhum dos ensaios se dedicou à avaliação exclusiva desta faixa etária e não foram descritas subanálises desta população34, o que limita a extrapolação de dados.
Apesar do número reduzido de adolescentes com idade igual ou superior a 12 anos e da ausência de estudos em crianças com idades entre os 6 e os 11 anos, a EMA aprovou em agosto de 2018 a utilização do mepolizumab para crianças a partir dos 6 anos35. A extensão da indicação a idades inferiores foi baseada na existência de dados dos ensaios fase 3 em doentes com mais de 12 anos, na semelhança fisiopatológica da asma nos grupos etários 6‑11 anos e ≥12 anos, no perfil de segurança semelhante nos grupos etários 6‑11 anos e ≥12 anos, na consistência terapêutica e na consistência de mecanismos de ação do mepolizumab nas várias idades35.
Entre os estudos realizados incluem‑se o DREAM (que incluiu 621 doentes com idades entre os 12 e os 74 anos36), o MENSA (que incluiu 576 doentes com idades entre os 12 e os 82 anos37), o SIRIUS (que incluiu 135 doentes com idades entre os 16 e os 74 anos, diagnóstico de asma eosinofílica grave com necessidade de terapêutica diária com glucocorticoide oral, para além de terapêutica com corticoide inalado em altas doses38), o COSMOS (extensão de 52 semanas dos estudos MENSA e SIRIUS, incluindo 651 doentes, dos quais 414 tinham sido tratados previamente com mepolizumab e 237 com placebo39, e o COLUMBA (extensão open‑label do DREAM que incluiu 347 doentes que continuaram tratamento durante uma média de 3,5 anos - máximo de 4,5 anos40).
Os detalhes de cada um destes ensaios estão descritos em artigo recente desta Revista20. Em 2019, foi publicado um pequeno ensaio clínico open‑label, não controlado, para avaliar a eficácia, segurança e farmacodinâmica do mepolizumab em crianças com asma eosinofílica grave com idades entre os 6 e os 11 anos41. O ensaio incluiu 30 crianças tratadas durante 52 semanas com 40 mg ou 100 mg de mepolizumab, de acordo com o peso inferior ou superior a 40 kg. Quando comparado com o baseline, o tratamento com mepolizumab reduziu o número de eosinófilos circulantes (para cerca de 15,5% do valor basal entre as 12 e as 52 semanas), reduziu o número de exacerbações (80% das crianças tiveram uma redução de pelo menos 50%) e melhorou o controlo sintomático (entre outros, uma redução média de 66% no score ACQ‑7 entre as 12 e as 52 semanas). Cerca de 90% das crianças desenvolveram eventos adversos (23% tiveram eventos adversos graves mas nenhum foi relacionado com o tratamento, de acordo com os investigadores, tendo resolvido sem a suspensão do mesmo). Não foram detetados anticorpos anti-mepolizumab41.
Em Portugal, o mepolizumab está comercializado desde finais de 2016, estando atualmente indicado como tratamento adjuvante da asma eosinofílica refratária grave em adultos, adolescentes e crianças com 6 ou mais anos. A dose recomendada é de 100 mg para adultos e adolescentes com 12 ou mais anos, e 40 mg para crianças entre 6 e 11 anos, administrados por via subcutânea uma vez a cada 4 semanas. As reações adversas mais frequentemente notificadas durante o tratamento foram cefaleias, reações no local de administração e dorsalgia35.
Reslizumab
O reslizumab é um anticorpo monoclonal humanizado (IgG4κ), que, tal como o mepolizumab, é dirigido à IL‑5, inibindo a sua atividade20. Ao contrário do mepolizumab, que é administrado por via subcutânea, o reslizumab é administrado por via endovenosa e a dose ajustada ao peso (3 mg/kg), administrado a cada 4 semanas42.
O programa BREATH incluiu quatro ensaios clínicos com reslizumab, randomizados, de fase 3, duplamente cegos, controlados por placebo, multicêntricos, que incluíram adultos e adolescentes com idades superiores a 11 anos (embora nenhum dos ensaios tenha incluído apenas doentes de idade pediátrica ou tenham sido descritas subanálises desta população)34. Os detalhes e resultados de cada um destes ensaios estão descritos em outras revisões sobre reslizumab43 e em artigo recente desta Revista20.
No total, os vários ensaios de fase 3 com reslizumab incluíram 39 adolescentes asmáticos (12 a 17 anos), que foram aleatorizados para o reslizumab nas doses 0,3 mg/kg e 3 mg/kg ou placebo. O perfil de segurança foi semelhante ao placebo mas, em termos de eficácia, o reslizumab não reduziu o número de exacerbações da asma neste grupo etário (razão entre as taxas de exacerbações da asma [reslizumab/placebo] de 2,09)43.
Dado o pequeno tamanho da amostra e os desequilíbrios iniciais resultantes da análise de subgrupos, não se podem tirar conclusões sobre a eficácia do reslizumab na população pediátrica43.
O reslizumab foi aprovado pela FDA e pela EMA em 2016 como tratamento de manutenção add‑on em adultos com diagnóstico de asma eosinofílica grave34. Em Portugal está aprovado desde 201842. Até ao momento não houve extensão da indicação do reslizumab a crianças ou adolescentes, e não temos conhecimento de novos ensaios clínicos a decorrer com reslizumab dirigidos à idade pediátrica.
Benralizumab
O benralizumab é um anticorpo monoclonal humanizado (IgG1κ) que se liga à subunidade alfa do recetor da IL‑5 (IL‑5Rα, CD125)20, resultando na apoptose das células que expressam IL‑5Rα, sobretudo eosinófilos e basófilos, através da citotoxicidade mediada por células dependentes de anticorpo (ADCC antibody‑dependent cell‑mediated cytotoxicity)34.
Dois ensaios clínicos de fase 3 realizados com o benralizumab incluíram adultos e adolescentes com idades superiores a 12 anos - os estudos SIROCCO e CALIMA34,44.
Nestes estudos foram incluídos 108 adolescentes asmáticos (sob terapêutica com altas doses de corticóide inalado associado a broncodilatador de longa ação e com duas ou mais exacerbações no ano anterior), com idades entre os 12 e os 17 anos, dos quais 46 receberam placebo, 40 receberam benralizumab a cada 4 semanas nas primeiras 3 doses, e depois a cada 8 semanas, e 22 receberam benralizumab a cada 4 semanas45. A taxa de exacerbação da asma em adolescentes que receberam tratamento foi de 0,70 (n=40, IC 95%: 0,42; 1,18) comparado com 0,41 para o placebo (n=46, IC 95%: 0,23; 0,73)42. Dado o pequeno tamanho da amostra e os desequilíbrios iniciais das amostras não é possível tirar conclusões sobre a eficácia do benralizumab na asma na população pediátrica45. As extensões BORA/MELTEMI, atualmente em desenvolvimento, poderão trazer mais informações sobre a eficácia e a segurança do benralizumab em adolescentes46.
O benralizumab foi aprovado pela FDA em 2017 como tratamento de manutenção add‑on em doentes com diagnóstico de asma eosinofílica grave para idades iguais ou superiores a 12 anos e pela EMA em 2018 em adultos45.
Em Portugal teve aprovação de entrada no mercado em 2019. A dose recomendada de benralizumab é 30 mg administrados por injeção subcutânea a cada 4 semanas para as primeiras 3 doses, e depois a cada 8 semanas. As reações adversas mais frequentemente notificadas durante o tratamento foram cefaleia e faringite45.
TERAPÊUTICA ANTI‑IL‑4/IL‑13
Dupilumab
A IL‑4 e IL‑13 estão envolvidas não só na fisiopatologia da asma, como também na fisiopatologia de outras patologias atópicas, como a dermatite atópica e a rinossinusite crónica. O dupilumab é um anticorpo monoclonal humano do tipo IgG4 que se liga à subunidade α do recetor da interleucina‑4 (IL‑4Ra), bloqueando a sinalização das interleucinas IL‑4 e IL‑13 e inibindo respostas Th247.
O dupilumab foi aprovado para o tratamento da dermatite atópica moderada a grave, em adultos no ano de 201748
e em adolescentes em 2019. Em 2018 foi aprovado pela FDA e em 2019 pela EMA como tratamento adjuvante de manutenção em adultos e adolescentes acima dos 12 anos com asma grave e endótipo Th2 caraterizado por aumento dos eosinófilos no sangue e/ou aumento do FeNO49. Em Setembro de 2019 foi também aprovado para o tratamento da rinossinusite crónica grave com polipose nasal49. O dupilumab é administrado por via subcutânea numa dose inicial de 400 mg, seguida de 200 mg administradas em semanas alternadas (em doentes com asma grave sob corticoterapia oral, a dose inicial é de 600 mg e as subsequentes de 300 mg).
Vários estudos avaliaram a eficácia e a segurança do dupilumab no tratamento da asma grave em adultos e adolescentes48. O estudo QUEST, publicado em 2018, incluiu 1902 doentes com asma grave e idade igual ou superior a 12 anos (média de idades de 47,9 anos), incluindo um total de 107 adolescentes. Este estudo avaliou o efeito do tratamento com dupilumab administrado de 2 em 2 semanas na dose de 200mg ou 300mg, durante um período de 56 semanas. O dupilumab reduziu significativamente a frequência de exacerbações de asma (redução da taxa anualizada de exacerbações de 65,8% vs. placebo), tendo havido também uma melhoria da função pulmonar (às 12 semanas de tratamento verificou‑se um aumento do FEV1 entre 140‑220μl acima dos valores obtidos no grupo placebo)47. O estudo VENTURE incluiu 210 doentes com idade igual ou superior a 12 anos (média de idades de 51,3 anos) com asma grave sob corticoterapia sistémica. O estudo avaliou a eficácia do tratamento com dupilumab durante um período de 24 semanas, tendo como outcome primário a variação da dose diária de corticosteroide sistémico necessária para controlo da doença.
Os doentes que receberam dupilumab apresentaram uma redução de 70,1% da dose de corticoide sistémico versus redução de 41,9% no grupo placebo50,51.
Nos doentes em tratamento com dupilumab para a dermatite atópica foi observado um aumento da frequência de conjuntivite de várias etiologias, e outros distúrbios oculares, como queratite, para além de reações no local da injeção21,49. Nos ensaios clínicos para asma, a reacção adversa mais frequente foi eritema no local de injeção. Foram notificados casos muito raros de reação anafiláctica no programa de desenvolvimento da asma49.
Relativamente à faixa etária das crianças com idades compreendidas entre os 6 e os 12 anos está a decorrer um ensaio clínico de fase 3, randomizado e controlado com placebo, que inclui 402 crianças - o estudo VOYAGE -, cujo objetivo primário é avaliar a eficácia do dupilumab em doentes com asma persistente não controlada, através da comparação da taxa anual de exacerbação durante o período de tratamento com dupilumab versus placebo. Este ensaio clínico tem como data prevista de conclusão o mês de novembro de 202052.
TERAPÊUTICA ANTI‑TSLP
A linfopoetina do estroma tímico (TSLP), uma alarmina produzida pelas células epiteliais em resposta a estímulos pro‑inflamatorios, induz a produção de citocinas Th2 em células dendríticas e ILC2. Os níveis de TSLP encontram‑se
aumentados nas vias aéreas dos doentes com asma21. Atualmente encontram‑se em desenvolvimento vários anticorpos monoclonais anti‑TSLP, estando em fases mais avançadas o tezepelumab (fase 3)53 e o CSJ117 (fase 2, ainda sem ensaios na idade pediátrica, mas que tem a particularidade interessante de poder ser administrado por via inalatória)54.
Tezepelumab
O tezepelumab é um anticorpo monoclonal humano do tipo IgG2 de administração subcutânea. Vários ensaios clínicos têm avaliado a eficácia do tezepelumab em adultos, não existindo ainda dados sobre a sua segurança e eficácia em crianças e adolescentes55.
O ensaio NAVIGATOR53, um ensaio clínico randomizado de fase 3, controlado com grupo placebo, teve como objetivo principal avaliar a eficácia e a segurança do tezepelumab em adultos e adolescentes com 12 ou mais anos e com asma grave. A duração do ensaio foi de 52 semanas e atingiu o outcome primário com uma redução estatisticamente significativa e clinicamente significativa da taxa anual de exacerbações.
CONCLUSÃO
Os ensaios clínicos e estudos de vida real são promissores relativamente à eficácia dos anticorpos monoclonais na asma grave associados a um bom perfil de segurança em idades pediátricas. Nas crianças e adolescentes, as recentes aprovações de biológicos que atuam nas vias da IL‑5 (mepolizumab) e da IL‑4/IL‑13 (dupilumab) vieram alargar o espectro de alvos terapêuticos para além da IgE (omalizumab, que já se encontra comercializado para idades pediátricas há cerca de 10 anos). De uma forma geral podemos dizer que os ensaios clínicos publicados em asma grave pediátrica têm uma duração curta (1 a 2 anos, alguns deles com extensões de mais 2‑3 anos), avaliando apenas outcomes incluídos no período do estudo e, excetuando o omalizumab, foram conduzidos num reduzido número de doentes, com muitos dos resultados a serem extrapolados a partir de grupos maioritariamente constituídos por adultos. Seria desejável que, sobretudo em crianças e adolescentes, os resultados fossem avaliados em períodos mais longos, inclusive até à idade adulta, e que incluíssem avaliações do desenvolvimento pulmonar durante o crescimento, para além dos critérios habituais (exacerbações, exacerbações graves, scores de qualidade de vida, etc.). É previsível que o melhor controlo da asma durante a infância e adolescência permita também melhorias colaterais muito importantes nestas faixas etárias, por exemplo no crescimento estatoponderal, na performance escolar, na capacidade de fazer exercício físico e desporto, na integração social e em outros parâmetros da qualidade de vida e crescimento integral.
| Acrónimos e abreviaturas |
|---|
| FeNO, fração exalada de óxido nítrico; FEV1, forced expiratory volume in one second; ICS, corticosteroide inalado; IL, interleu- cina; ILC-2, células linfoides inatas tipo 2; INFARMED, Infarmed - Autoridade Nacional do Medicamento e Produtos de Saúde, IP; IV, endovenosa; LABA, agonista β-adrenérgico de longa ação; SC, subcutânea; Th, T-helper; TNF, tumour necrosis factor; TSLP, thymic stromal lymphopoietin |














