INTRODUÇÃO
Os Aspergillus são um género de fungos saprófitos que engloba cerca de 200 espécies diferentes, podendo ser encontrados na água e no solo, em decomposição orgânica e em ambientes internos. A espécie mais frequentemente associada a doenças respiratórias em humanos é o Aspergillus fumigatus (Af )1. Na maioria dos indivíduos, a inalação diária de esporos de Af não tem consequências clínicas; porém, em pessoas suscetíveis, particularmente com doença pulmonar de base, esta inalação pode desencadear uma resposta inflamatória do tipo 2 levando ao aparecimento de aspergilose broncopulmonar alérgica (ABPA).
Na evolução de sensibilização a Af para ABPA interactuam uma multiplicidade de fatores genéticos demonstrando uma suscetibilidade individual, mas também factores ambientais2. O desenvolvimento desta doença depende de um mecanismo de hipersensibilidade complexa, predominantemente IgE‑mediada.
Importa salientar que a ABPA pode ser causada, em menor escala, por outras espécies de Aspergillus, como Aspergillus niger, Aspergillus flavus e Aspergillus oryzae.
A ABPA tem uma prevalência estimada de 1‑13% em asmáticos, com o seu diagnóstico em adultos entre a 3.ª e a 5.ª décadas de vida, ao passo que a doença é diagnosticada em idades mais precoces em cerca de 2‑9% dos doentes com fibrose cística3. Em Portugal, foi estimada uma incidência de 119/100 000 pessoas por ano, contudo denota‑se um subdiagnóstico português relativamente à sensibilização a fungos, o que pode comprometer a abordagem e prognóstico destes doentes. O diagnóstico precoce e o tratamento dirigido permitem atrasar o declínio da função pulmonar2.
O objetivo desta revisão é apresentar a mais recente evidência sobre a fisiopatologia, critérios de diagnóstico e novas abordagens terapêuticas para a ABPA.
PATOFISIOLOGIA
Embora a patofisiologia da doença ainda não esteja completamente esclarecida, acredita‑se que a resposta sistémica após a inalação de esporos de Af possa ser diferente de acordo com cada indivíduo e competência da sua resposta imunológica2:
• Indivíduos imunocompetentes conseguem eliminar facilmente o fungo através da resposta imune inata das vias aéreas, não ocorrendo manifestações de infeção fúngica; o isolamento do fungo em secreções brônquicas ou lavado broncoalveolar traduz um processo de colonização.
• Indivíduos imunodeprimidos não eliminam eficazmente os esporos devido à deficiente resposta imunológica; nestes casos, ocorre colonização e germinação nas vias aéreas, com formação de hifas septadas que desencadeiam uma resposta inflamatória crónica do tipo aspergilose invasiva.
• Indivíduos atópicos (nomeadamente asmáticos), doentes com fibrose cística ou doenças pulmonares cavitárias (por exemplo, pós‑tuberculose): a inalação dos esporos desencadeia um mecanismo de hipersensibilidade complexa, maioritariamente IgE‑mediada.
Em todos os casos, a lesão celular resulta da combinação da resposta imunológica ao fungo com a colonização das vias aéreas pelo mesmo (associada a libertação de micotoxinas e enzimas proteolíticas). Contudo, os mecanismos imunológicos de destruição pulmonar na ABPA não estão totalmente esclarecidos, envolvendo uma resposta imune inata e mediada por células4. Por outro lado, para além da resposta imunológica, há outros fatores igualmente importantes na patofisiologia da doença, nomeadamente alterações estruturais, o aumento da viscosidade do muco e a diminuição da clearance fúngica.
Os conídios (esporos responsáveis pela reprodução) de Af, pelas suas pequenas dimensões e hidrofobicidade, são facilmente inalados, atingindo as pequenas vias aéreas.
Ao contactarem com as células do epitélio alveolar são fagocitados por estas, bem como por células apresentadoras de antigénios e por macrófagos alveolares. De facto,
estes últimos são o principal tipo celular envolvido na resposta imune inata contra o Af.
Após a fagocitose dos esporos, os macrófagos alveolares libertam diferentes citocinas e quimiocinas, incluindo fator de necrose tumoral (TNF‑α, do tumor necrosis factor α), proteína inflamatória dos macrófagos (MIP‑1α, do inglês macrophage inflammatory protein 1α), interleucina‑1β (IL‑1β), IL‑1α, IL‑6, fator de estimulação granulocítica (G-CSF, granulocyte colony‑stimulating factor) e fator de estimulação macrófago‑granulocítica (GM‑CSF, granulocyte‑macrophage colony‑stimulating factor), permitindo o subsequente recrutamento de outras células do sistema imune inato, incluindo neutrófilos granulócitos, macrófagos circulantes e células dendríticas5. Estas últimas são a principal interface entre a resposta imune inata e adaptativa contra o Af, uma vez que processam o antigénio e o apresentam com o complexo major de histocompatibilidade (MHC, major histocompatibility complex) a células T CD4+ naïve presentes no tecido linfoide broncoalveolar, desencadeando a sua diferenciação em linhagens efetoras, com predomínio de linfócitos T helper do tipo 2 (Th2) nos doentes com ABPA6.
O reconhecimento imunológico dos conídios de Af ocorre através de uma variedade de recetores de reconhecimento de padrões (PRR, pattern recognition receptors) presentes em células do sistema imune inato e capazes de reconhecer padrões moleculares associados a patogénicos (PAMP, pathogen‑associated molecular patterns) que estão presentes na parede celular dos conídios após a sua germinação7. Um estudo elaborado por Becker K. et al. demonstrou que o reconhecimento do β‑glucano (um componente da parede celular fúngica de Af ) pelo recetor CR3 (do inglês complement receptor 3) expresso em neutrófilos e monócitos, levou à produção de IL‑5 e IL‑13, citocinas associadas a uma resposta imune adaptativa do tipo 28. Outros PRR, nomeadamente a dectina‑1 e os recetores toll‑like (TLR, toll‑like receptors) do tipo 2 e do tipo 4 estão também envolvidos no reconhecimento de componentes da parede do Af e na resposta antifúngica, embora o seu papel na patofisiologia da ABPA ainda não esteja completamente esclarecido.
Após ativação, os linfócitos Th2 promovem a libertação de IL‑4, IL‑5 e IL‑13, com estimulação de linfócitos B que se diferenciam em plasmócitos e produzem anticorpos de várias classes, com predomínio de IgE e IgG.
Um estudo realizado por Knutsen AP et al. Evidenciou que os linfócitos B de doentes com ABPA apresentam maior sensibilidade para a IL‑4, produzindo maiores quantidades de IgG, IgE e IgA contra antigénios de Af após estimulação9. De facto, polimorfismos da subunidade α do recetor da IL‑4 (IL‑4Rα) poderão ser responsáveis por este efeito através de ganho de função do recetor, resultando na produção aumentada de IgE10. Embora em menor escala, ocorre também uma inflamação Th1 mediada, com a formação de anticorpos IgG específicos para Af. Nalguns doentes, poderá ocorrer ainda uma resposta imunológica mediada por células Th17, sendo nestes casos ativada por reatividade cruzada com antigénios de Candida albicans11.
Os monócitos também contribuem significativamente para a indução de respostas T‑helper durante a infecção por Aspergillus, que se pensa ser mediada pela sua diferenciação em células dendríticas com expressão de CD11b na superfície celular6. Ocorre ainda recrutamento e ativação de mastócitos e eosinófilos, e a ligação da IgE específica a mastócitos alveolares com a consequente ativação pelo antigénio resulta na desgranulação mastocitária e libertação de histamina, leucotrienos e outros mediadores, desencadeando broncospasmo e hipersecreção de muco12. Adicionalmente, a desgranulação eosinofílica permite a libertação de mediadores como a proteína básica major (MBP, major basic protein), proteína catiónica eosinofílica (ECP, eosinophil cationic protein) e eotaxina, resultando na destruição epitelial10. Os eosinófilos são ainda capazes de produzir armadilhas extracelulares (conhecidas por eosinophil extracellular traps) com o objetivo de fagocitar os conídios de Af, o que não se revela, contudo, eficaz no controlo do crescimento fúngico, contribuindo por outro lado para o aumento da viscosidade do muco13.
Por último, a germinação dos esporos fúngicos e a consequente formação de hifas septadas contribui não só para o aumento da viscosidade do muco, como para a resposta inflamatória crónica. A libertação de protéases pelas hifas septadas estimula as células epiteliais a produzir e libertar IL‑8, o que contribui para a destruição epitelial por destacamento celular e promove o recrutamento de neutrófilos14. Além disso, algumas toxinas fúngicas inibem o batimento ciliar, ao passo que as proteases são responsáveis pela diminuição da actividade fagocítica das células do sistema imune, o que impede a clearance fúngica e perpetua o processo inflamatório, contribuindo para o desenvolvimento de remodeling e o aparecimento de bronquiectasias15.
Vários fatores genéticos e de suscetibilidade do hospedeiro desempenham um papel importante na determinação de quais doentes sensibilizados a Af evoluem para ABPA. Doentes indianos com ABPA apresentaram anticorpos IgG específicos para um antigénio de ribonuclease citotóxico (18 kDa) e um antigénio de protéase elastinolítico (45 kDa) presentes no Af16. Por outro lado, estudos prévios já tinham encontrado uma associação entre os genótipos do antigénio leucocitário humano (HLA, human leukocyte antigen)‑DR2/DR5 e o desenvolvimento de ABPA, comparativamente a asmáticos sem a doença17. Em contraste, o genótipo HLA‑DQ2 parece ter um papel protetor18. Adicionalmente, foram encontradas muitas associações entre polimorfismos da IL‑10, recetores da IL‑13 e do TLR‑3 e o desenvolvimento de ABPA18,19.
Nos doentes com fibrose cística e ABPA, as mutações do gene que codifica o regulador da condutância transmembranar da fibrose cística (CFTR, cystic fibrosis transmembrane conductance regulator) também se relacionam com maior suscetibilidade de desenvolver a doença.
Doentes com mutações do CFTR apresentam um muco alveolar mais espesso, o que permite maior acumulação de esporos, com a subsequente formação de hifas fúngicas após a sua germinação15,18. A Figura 1 permite sumarizar os principais aspetos da patofisiologia da ABPA.
Atendendo aos mecanismos fisiopatológicos descritos, depreende‑se que a biópsia do parênquima pulmonar afetado destes doentes evidencia frequentemente infiltrado inflamatório pluricelular com predomínio eosinofílico, cristais de Charcot‑Leyden (constituídos por material eosinofílico resultante de destruição celular), espirais de Curschmann (fibrilas de muco), fibrose parenquimatosa, bronquiectasias, impactação mucóide intrabrônquica e micélio (agregados de hifas septadas de Af )20.
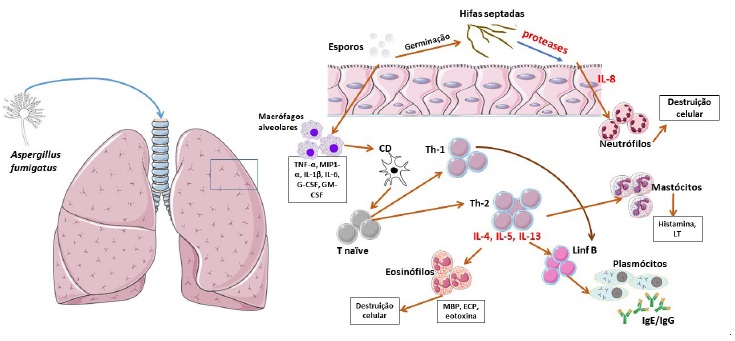
Figura 1 Patofisiologia da aspergilose broncopulmonar alérgica. Os conídios (esporos responsáveis pela reprodução) de Af, pelas suas pequenas dimensões e hidrofobicidade são facilmente inalados, atingindo as pequenas vias aéreas. Os macrófagos alveolares fagocitam os esporos e libertam TNF-α, MIP1-α, IL-1β, IL-1α, IL-6, G-CSF e GM-CSF, permitindo o recrutamento de células dendríticas. Estas processam o antigénio e apresentam-no com o complexo major de histocompatibilidade a células T CD4+ naïve do tecido linfoide broncoalveolar, com subsequente diferenciação em linfócitos Th2 e Th1 (em menor escala). Através da libertação de IL-4, IL-5 e IL-13, há estimulação de eosinófilos e linfócitos B que se diferenciam em plasmócitos e produzem anticorpos essencialmente do subtipo IgE, mas também do tipo IgG. A desgranulação eosinofílica provoca libertação de MBP, ECP e Eotaxina, resultando em lesão do epitélio respiratório. Por fim, a libertação de proteases fúngicas das hifas septadas estimula as células epiteliais a produzir e libertar IL-8, que contribui para a destruição de epitélio por destacamento celular, e promove ainda o recrutamento de neutrófilos. Há descrição de ativação mastocitária direta pelo fungo, através de um mecanismo IgE-independente.
APRESENTAÇÃO CLÍNICA E ABORDAGEM DIAGNÓSTICA
Clinicamente, a ABPA manifesta‑se por sintomas de sibilância, hiperreatividade brônquica, infiltrados pulmonares e bronquiectasias centrais que podem evoluir para fibrose. As bronquiectasias estão frequentemente associadas a broncorreia crónica e tosse produtiva que pode incluir rolhões de expetoração acastanhada contendo hifas. Podem surgir ainda sintomas constitucionais inespecíficos, como perda de peso, astenia, anorexia, febre e mialgias e, por vezes, hemoptises(2).
Do ponto de vista imagiológico, estes doentes apresentam opacidades pulmonares com impactação mucóide e bronquiectasias centrais mais frequentes nos lobos superiores21. A pneumonia eosinofílica é um achado frequente, embora não seja uma característica major da doença, devendo ser confirmada por lavado broncoalveolar.
Alguns doentes apresentam‑se com consolidação pulmonar assintomática1. Raramente, os doentes com ABPA têm concomitantemente rinossinusite alérgica por Aspergillus, que se caracteriza
pela presença de muco constituído por hifas fúngicas e infiltrado eosinofílico nos seios perinasais22.
A ABPA raramente é identificada na ausência de asma ou fibrose cística, sendo a DPOC e a doença fibrocavitária pós‑tuberculosa condições predisponentes2.
Critérios de diagnóstico
A primeira classificação diagnóstica de ABPA foi criada por Rosenberg‑Patterson em 1977 23. Desde então, foram propostos novos critérios diagnósticos, sendo atualmente utilizados os critérios do grupo de interesse da Sociedade Internacional de Micologia Humana e Animal (ISHAM) de 201324. Atualmente, estão em desenvolvimento novos critérios diagnósticos para a doença, com sensibilidade superior a 90%25. A Tabela 1 resume os vários critérios diagnósticos de ABPA existentes até ao momento. Os critérios específicos para doentes com fibrose cística foram elaborados com base no estudo epidemiológico de fibrose cística26.
De acordo com Greenberger et al., o diagnóstico de ABPA em asmáticos requer pelo menos cinco dos seguintes critérios: asma subjacente, bronquiectasias centrais, teste cutâneo positivo para Af, elevação da IgE específica para Af (> 0,35 kU/L), elevação da IgE total (> 417 UI/mL ou 1000 ng/mL), aumento da IgG específica para Af (> 27 mg/L), precipitinas positivas de Af; e infiltrados pulmonares na imagiologia torácica20. Nestes doentes, podem ocorrer exacerbações frequentes e/ou agravamento da asma previamente controlada. Por outro lado, num doente com asma mal controlada, eosinofilia periférica e expetoração acastanhada, deve ser pesquisada a presença de ABPA concomitante2. Tal como será abordado mais em detalhe nos diagnósticos diferenciais, é fundamental a distinção entre ABPA e a asma com sensibilização a Af, sendo que nesta última os doentes apresentam testes cutâneos por picada positivos para Af e valores de IgE específica aumentados, mas sem doseamento de IgG para o fungo nem as alterações imagiológicas típicas, como é o caso das bronquiectasias centrais e a impactação mucoide2.
Tabela 1 Critérios diagnósticos de ABPA.
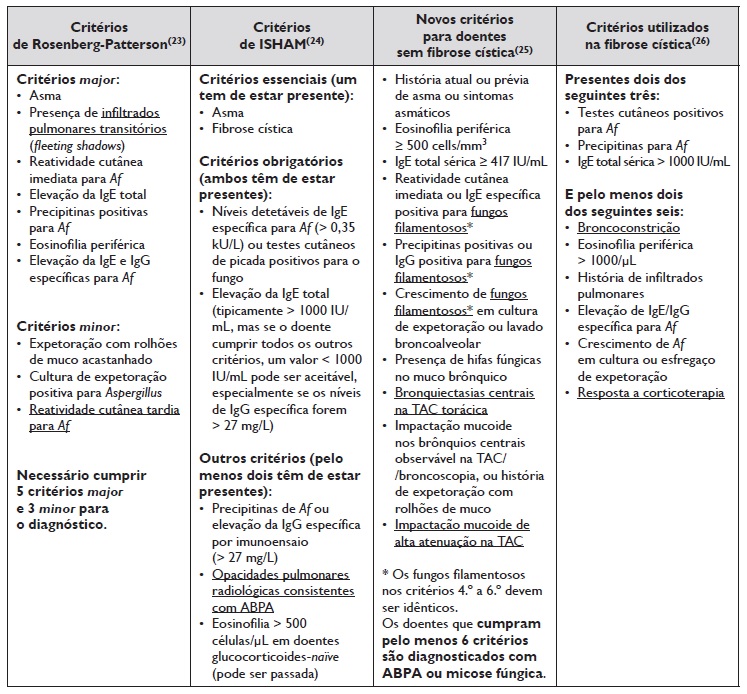
A negrito encontram-se as condições necessárias para o diagnóstico e sublinhado as principais diferenças entre os diferentes sistemas de critérios de diagnóstico.
Em doentes com fibrose cística, o diagnóstico de ABPA geralmente é realizado em idade pediátrica e a doença deverá ser ativamente pesquisada nos doentes que apresentem deterioração clínica apesar do tratamento optimizado para a doença. Está aconselhada a monitorização anual da IgE total: se a concentração for > 500 IU/mL, complementar o estudo com pesquisa de IgE específica para Af ou teste cutâneo por picada. Por outro lado, se o valor de IgE total for 200‑500 IU/mL, dever‑se‑á repetir se houver elevada suspeição clínica e pedir outros meios complementares, nomeadamente tomografia axial computadorizada (TAC) torácica de alta resolução26. Estes doentes têm, frequentemente, infiltrados pulmonares e bronquiectasias pela própria fibrose cística, pelo que é necessário correlacionar as alterações radiológicas com os resultados analíticos. É igualmente importante distinguir ABPA de infeção por Af, que poderá estar presente nestes doentes. O processo infecioso por Af associa‑se à presença de elevada carga fúngica e sintomas de tosse produtiva e dispneia, mas sem manifestações de hipersensibilidade, nomeadamente ausência de IgE específica para Af27.
Relativamente aos meios complementares de diagnóstico necessários para verificar o cumprimento dos critérios existentes até ao momento, convém salientar que o valor de eosinofilia periférica é frequentemente superior a 1000 células/μL e, quando superior a 2000 células/μL, deverão ser pesquisadas outras causas de hipereosinofilia.
Além disso, o doseamento dos precipitados de anticorpos anti‑Aspergillus (precipitinas) é um teste qualitativo que apresenta menor sensibilidade diagnóstica quando comparado com as serologias específicas (IgG e IgE).
Nos últimos anos, o isolamento de antigénios de Af através de técnicas de biologia molecular permitiu melhorar o diagnóstico serológico de ABPA, pela possibilidade de quantificar a IgG e a IgE específicas para os diferentes componentes moleculares, dos quais se destacam:
Asp f 1 (alergénio major e específico do Af, excretado após a germinação e formação de hifas), Asp f 2 (alergénio intracelular), Asp f 3 (proteína peroxissomal excretada), Asp f 4 e Asp f 6 (alergénios intracelulares)(28). De facto, o diagnóstico de ABPA com base nos critérios ISHAM pode apresentar falsos positivos, em virtude da inclusão de micoses broncopulmonares alérgicas causadas por outros fungos. A deteção de IgE e IgG específicas para componentes moleculares específicos do fungo, como é o caso do Asp f 1, poderia obviar a este problema29. Por outro lado, a avaliação dos componentes moleculares poderá permitir distinguir ABPA de sensibilização a Af.
Diferentes estudos demonstraram que a presença de IgE específica para o alergénio recombinante Asp f 1 (rAsp f 1) e rAsp f 3 permitiram caracterizar um perfil serológico de indivíduos sensibilizados a Af com 100% de especificidade e 88% de sensibilidade, ao passo que a presença de IgE específica para rAsp f 2, rAsp f 4 e rAsp f 6 foi detetada exclusivamente no soro de indivíduos com ABPA28,30,31. Não obstante, Hemmann et al. Demonstrou que os valores séricos de IgE, IgG, IgG1 e IgG4 específicas para rAsp f 3 foram significativamente mais elevados em doentes com ABPA comparativamente aos asmáticos sensibilizados ao Af e aos controlos saudáveis32.
Apesar de não ser realizado por rotina, o teste de ativação de basófilos (TAB) utilizando extratos comerciais de Af (Allergopharma, Alemanha) e por quantificação dos níveis dos marcadores de superfície CD203c e CD63 demonstrou ser útil no diagnóstico de ABPA em doentes com fibrose cística33. O mesmo, contudo, não se mostrou útil como meio complementar de diagnóstico de ABPA em asmáticos, com sensibilidade diagnóstica inferior a 50%34.
No que concerne à imagiologia, a radiografia torácica apresenta uma sensibilidade diagnóstica de apenas 50%, pelo que na maioria dos casos há necessidade de realizar TAC torácica de alta resolução, que revela maior sensibilidade para a visualização de bronquiectasias e apresenta imagens típicas em dedo de luva (por impactação mucoide) e um aspeto de tree‑in‑bud pela presença de bronquiectasias centrais35.
CLASSIFICAÇÃO
A ABPA pode ser classificada de várias formas, como evidenciado na Tabela 2. A classificação convencional, amplamente utilizada, divide‑a em cinco estádios, de acordo com a sua evolução clínica e analítica35. Por outro lado, o ISHAM propôs novos critérios clínicos de classificação, incluindo um estádio 0, em que a doença é diagnosticada por investigação dos critérios diagnósticos, embora não esteja presente nenhum sinal ou sintoma sugestivo de ABPA24. Os critérios propostos pelo ISHAM dividem ainda o estadio 1 com base nos achados da TAC torácica e da broncoscopia e criam um estádio 2, denominado ABPA em resposta, em que ocorre uma melhoria clínica, analítica e imagiológica, mesmo não estando presentes todos os critérios de doença em remissão.
Com base nos achados da TAC torácica de alta resolução também é possível classificar a ABPA em vários subgrupos36:
• ABPA‑S (ABPA serológica): apresenta critérios diagnósticos de ABPA na ausência de qualquer achado radiológico de ABPA na TAC torácica.
• ABPA‑B (ABPA com bronquiectasias): apresenta critérios diagnósticos de ABPA e bronquiectasias.
• ABPA‑HAM (ABPA‑High attenuation mucus): ABPA na presença de impactação mucoide de alta atenuação na TAC, característica da doença com especificidade próxima dos 100%.
• ABPA‑CPF (ABPA‑Chronic pleuropulmonary fibrosis): Cumpre os critérios diagnósticos de ABPA com pelo menos duas características radiológicas sugestivas de fibrose (incluindo lesões fibrocavitárias, fibrose pulmonar, espessamento pleural) sem a presença de impactação mucoide ou muco de alta atenuação. Importa salientar que a evolução da ABPA para os diferentes estádios não ocorre obrigatoriamente de forma sequencial.
DIAGNÓSTICO DIFERENCIAL
O diagnóstico diferencial incide em distinguir ABPA de infeção fúngica, sendo que alguns destes diagnósticos podem coexistir como complicações da própria ABPA.
Embora a ABPA seja mais prevalente em doentes com asma ou fibrose cística, há outras doenças consideradas fator de risco para o desenvolvimento de doença pulmonar induzida por Aspergillus, a destacar tuberculose pulmonar, bronquiectasias, pneumoconioses, cavidades pulmonares pós‑enfarte ou pós‑radioterapia, sarcoidose, abcessos pulmonares crónicos, neoplasias pulmonares e imunossupressão primária ou secundária37. As doenças respiratórias do trato respiratório inferior associadas a Aspergillus encontram‑se resumidas na Figura 2 (Adaptado de38 e 2).
A micose broncopulmonar alérgica diz respeito a uma entidade muito semelhante à ABPA, contudo causada por outro fungo que não o Af. De entre os possíveis agentes, destacam‑se outras espécies de Aspergillus (A. flavus, A. niger, A. oryzae, A. ochraceus), Candida, Helminthosporium, Penicillium, Bipolaris, Scedosporium39. Os doentes apresentam características clínicas de ABPA (como impactação mucoide, eosinofilia, elevação da IgE total), mas apresentam testes cutâneos e serologias negativos para Aspergillus fumigatus. O diagnóstico é efetuado após isolamento em cultura de expetoração de um destes agentes, ou nalguns casos na presença de uma exposição suspeita (como é o caso da exposição a A. oryzae em fábricas de produção de molho de soja). Também pode ser complementado com a deteção de precipitinas e/ou IgE ou IgG específicas para o fungo em questão2.
O aspergiloma diz respeito a uma massa constituída por muco, células inflamatórias e hifas septadas do género Aspergillus (frequentemente Af ). Ocorre mais frequentemente em doentes com doença pulmonar preexistente, nomeadamente com lesões cavitárias de tuberculose resolvidas2. Distingue‑se da ABPA pelo facto de ser uma lesão localizada, não se encontra associada a bronquiectasias nem presença de hipersensibilidade (nomeadamente, sem testes cutâneos por picada nem IgE específica positivos).
A aspergilose pulmonar crónica ocorre tipicamente em doentes com alterações pulmonares estruturais prévias, nomeadamente pós‑infeções por micobactérias38.
Contudo, também pode ocorrer em doentes com ABPA, DPOC, após transplante pulmonar, infeções respiratórias inferiores recorrentes e sarcoidose2. A doença caracteriza‑se pela presença de tosse, perda de peso e hemoptises com pelo menos 3 meses de evolução.
Imagiologicamente, são visíveis nódulos/cavidades pulmonares e a cultura da expetoração evidencia crescimento de Aspergillus38.
A forma mais comum da doença é a aspergilose pulmonar crónica cavitária, também conhecida como aspergiloma complexo. Outras formas menos frequentes são o aspergiloma simples e o nódulo de Aspergillus, mais conhecido por bola fúngica38. Em doentes imunodeprimidos, a aspergilose pulmonar crónica pode evoluir para uma forma invasiva designada aspergilose pulmonar crónica necrotizante3.
Estes subtipos não se encontram associados a mecanismos de hipersensibilidade IgE‑mediada, pelo que os testes cutâneos por picada e as IgE específicas são negativas.
A aspergilose pulmonar invasiva é uma infeção aguda/subaguda grave mais prevalente em doentes com imunossupressão, nomeadamente com neutropenia, neoplasias hematológicas, submetidos a transplante de células hematopoiéticas ou órgão sólido, neoplasias, HIV, necessidade de altas doses de corticoterapia e/ou sob terapêutica imunossupressora e estadias prolongadas em unidades de cuidados intensivos2. O diagnóstico deve ser ponderado em doentes com factores de risco relevantes para aspergilose pulmonar invasiva e/ou existência de uma infeção pulmonar persistente
apesar do tratamento com antibioterapia de largo espetro1.
Além da presença na radiografia e TAC torácico de múltiplas áreas de consolidação, bem como lesões nodulares de tamanho variável, o crescimento do fungo em cultura da expetoração é fundamental para o diagnóstico.
Contudo, poderá ser difícil em alguns doentes distinguir infeção de simples colonização, pelo que é fundamental correlacionar as características clínicas com os achados.
Blot et al. propuseram um algoritmo diagnóstico que permite distinguir colonização de aspergilose pulmonar invasiva em doentes admitidos em unidades de cuidados intensivos e que apresentam culturas de expetoração com crescimento de Aspergillus40. Distingue‑se da ABPA pelo facto de ter uma evolução mais abrupta e de não se associar a um mecanismo IgE‑mediado, pelo que, mais uma vez, os testes cutâneos por picada e as serologias IgE específicas para Af são negativas.
A asma com sensibilização a Aspergillus diz respeito à presença de asma e de reação de hipersensibilidade IgE‑mediada a antigénios de Aspergillus (frequentemente Af ) 41. Nestes casos, os doentes apresentam testes cutâneos por picada e/ou IgE específica positiva para Af, mas sem outras manifestações, nomeadamente ausência de bronquiectasias, impactação mucoide e ausência de IgG específica para o fungo. Na verdade, a sensibilização a Aspergillus em asmáticos - demonstrada através de testes cutâneos por picada ou IgE específica para Af - é variável entre 16‑38% dependendo da região geográfica42. Um estudo realizado por Maurya et al. demonstrou que 28,5% dos doentes asmáticos avaliados tinham testes cutâneos positivos para antigénios de Aspergillus. Estes doentes apresentavam doença mais grave, com valores significativamente mais elevados de duração média da doença (p<0,001), eosinofilia periférica (p<0,0001), IgE total média (p<0,05) e maior utilização anual de corticoterapia (p<0,004)43.
Os doentes que apresentam asma grave com sensibilização a fungos, são um subgrupo de asmáticos com sensibilização a antigénios fúngicos, não necessariamente espécies de Aspergillus, que apresentam exacerbações frequentes com necessidade de hospitalização2. Os critérios de diagnóstico da doença incluem44:
1. Asma grave (mal controlada);
2. Testes cutâneos positivos para fungos ou elevação de IgE específica ≥ 0,4 kU/L;
3. IgE total < 1000 kU/L.
Os doentes com asma fúngica, ao contrário da ABPA, não apresentam impactação mucoide ou bronquiectasias e os agentes etiológicos podem ser outros que não o Aspergillus(21). Como referido nesta revisão, é fundamental distinguir ABPA de asma com sensibilização a Af, uma vez que os doentes asmáticos sensibilizados ao Af podem apresentar elevação de IgE total e IgE específica. Tanimoto et al. demonstraram que o diagnóstico molecular poderá auxiliar na distinção das duas entidades, visto que doentes com ABPA apresentaram níveis de IgE específica para Asp f 1 e Asp f 2 significativamente superiores a asmáticos sensibilizados ao Af45. Contudo, outros estudos já demonstraram que a presença de IgE específica para os alergénios rAsp f 1 e rAsp f 3 permitiram caracterizar um perfil serológico de indivíduos sensibilizados a Af com 100% de especificidade e 88% de sensibilidade, ao passo que a presença de IgE específica para rAsp f 2, rAsp f 4 e rAsp f 6 foi detetada exclusivamente no soro de indivíduos com ABPA28,30,31).
A pneumonite de hipersensibilidade, também designada alveolite alérgica extrínseca, é uma doença pulmonar intersticial que surge após exposição repetida de indivíduos suscetíveis a diferentes antigénios46. A forma mais conhecida é o pulmão do fazendeiro, que ocorre em trabalhadores agrícolas por inalação de feno, palha ou cereais contaminados com esporos de Aspergillus. Relativamente ao diagnóstico, os critérios são distintos da ABPA e imagiologicamente a TAC torácica de alta resolução apresenta o sinal de cabeça de queijo (headcheese sign), patognomónico da doença e resultante da existência de opacidades em vidro despolido, padrão de mosaico e parênquima normal justapostos47.
TRATAMENTO
Na ausência de tratamento, a ABPA evolui para um processo de fibrose pulmonar que mimetiza sequelas fibróticas pós‑tuberculosas2. O tratamento tem como objetivo controlar sintomas, prevenir exacerbações e preservar a função pulmonar, através da abordagem de dois aspetos diferentes da doença: 1) atenuação da resposta imunológica e inflamação subjacente; e 2) reduzir a carga de alergénios de Af presentes nas vias aéreas. O primeiro pode ser atingido através da utilização de anti‑inflamatórios e imunomoduladores, ao passo que o último é conseguido através da utilização de antifúngicos3.
Os corticoides sistémicos e o itraconazol são, até ao momento, a terapêutica mais utilizada na ABPA. Terapêuticas adjuvantes, como é o caso da corticoterapia inalada e dos broncodilatadores, são simultaneamente utilizadas. Embora a utilização de corticoides inalados seja fundamental para atingir o controlo da asma subjacente, a mesma não previne exacerbações da ABPA nem atrasa a progressão da lesão pulmonar48. Por outro lado, medidas como a evicção alergénica são difíceis de implementar, visto o Af ser um alergénio ubiquitário, e a imunoterapia específica com alergénios fúngicos recombinantes também nunca foi descrita49.
Atualmente, a corticoterapia oral é o gold standard do tratamento da ABPA. Na ABPA aguda e nas exacerbações, o doente deverá ser medicado com prednisolona 0,5 mg‑2 mg/kg/dia durante duas semanas, posteriormente 0,5 mg‑2 mg/kg em dias alternados durante 6‑8 semanas50.
Quando ocorre uma descida da IgE total superior ou igual a 35% e é visível a resolução dos infiltrados radiológicos, o doente deverá iniciar redução progressiva da corticoterapia 2,5‑5 mg a cada duas semanas, até suspensão.
Após este tratamento, os valores de IgE total deverão ser monitorizados a cada 6‑8 semanas para avaliar se o doente mantém critérios de remissão2. Se houver critérios a favor de recidiva, deverá ser retomada a corticoterapia.
É igualmente importante monitorizar os efeitos adversos da corticoterapia sistémica, nomeadamente osteoporose, insulinorresistência, aumento ponderal, epigastralgias, entre outros.
Os doentes com ABPA em estádio IV, de acordo com a classificação convencional, frequentemente necessitam de manter corticoterapia por longos períodos para atingir o controlo e raramente conseguem suspender o tratamento.
No estádio V, dada a presença de doença pulmonar fibrótica, é necessário associar outras terapêuticas para o tratamento de cor pulmonale e da hipoxemia concomitantes.
A terapêutica antifúngica é utilizada na doença refratária à corticoterapia, na recidiva com a redução da corticoterapia, em doentes corticodependentes ou que apresentam complicações inerentes à corticoterapia crónica51. O seu efeito terapêutico ainda se encontra em investigação, contudo sabe‑se que, ao reduzirem a carga fúngica, reduzem também o estímulo antigénico, permitindo diminuir dessa forma a resposta inflamatória.
Ao contrário das moléculas mais antigas (anfotericina B, miconazol e cetoconazol), a terapêutica com itraconazol evidenciou melhoria clínica, permitindo utilizar doses mais baixas de corticoterapia sem agravamento da ABPA52. Assim, nas exacerbações de ABPA e nos casos corticodependentes, poderá utilizar‑se itraconazol 200 mg duas vezes por dia, durante 4 a 6 meses, com redução progressiva em 4 a 6 meses. Nalguns casos de doença aguda também se associa o itraconazol durante 4 meses, observando‑se, porém, frequentemente recidiva ao suspender o fármaco2.
A terapêutica com itraconazol não é isenta de riscos, pelo que devem ser monitorizados os níveis plasmáticos do fármaco para avaliar a biodisponibilidade, bem como sinais de hepatotoxicidade53. Além disso, o itraconazol inibe o citocromo P450, aumentando as concentrações plasmáticas dos corticoides, o que, por um lado, pode justificar a melhoria clínica sob doses mais baixas de corticoterapia, contudo colocando o doente em maior risco de efeitos adversos, nomeadamente pela supressão da glândula suprarrenal. A inibição do citocromo P450 pode contribuir para a existência de efeitos adversos sistémicos mesmo com a corticoterapia inalada. A evidência clínica
demonstra que o metabolismo da beclometasona se encontra menos afetado, comparativamente ao da budesonida e da fluticasona54.
Os novos azoles, voriconazol e posaconazol, têm demonstrado eficácia terapêutica na ABPA55. O voriconazol apresenta melhor biodisponibilidade oral e é mais bem tolerado (menos efeitos adversos gastrointestinais), todavia a fototoxicidade é mais frequente e está descrita uma associação com o aparecimento de cancro cutâneo na terapêutica a longo prazo56. Por outro lado, o posaconazol apresenta um perfil de resistência semelhante ao itraconazol, porém com maior absorção e melhor
tolerância. Um estudo retrospetivo em 32 doentes com fibrose cística e ABPA demonstrou que o posaconazol é mais eficaz do que o itraconazol e o voriconazol na redução da IgE específica para Af57. A anfotericina B nebulizada, utilizada no tratamento da aspergilose invasiva, foi proposta como opção terapêutica na ABPA.
Contudo, o agravamento do broncoespasmo e da tosse são efeitos adversos frequentes e que tornam o fármaco mal tolerado58.
É importante referir que há registo de estirpes de Af resistentes aos antifúngicos descritos. Atualmente, a utilização de antifúngicos é ainda cautelosa e deve ser ponderado o risco‑benefício antes de a iniciar. O ensaio clínico MIPA avaliou a eficácia do itraconazol em monoterapia versus prednisolona e revelou que a prednisolona foi mais eficaz na indução de resposta do que o itraconazol na fase aguda de ABPA, embora tenha apresentado mais efeitos adversos59.
Os agentes biológicos, com demonstrada eficácia terapêutica na asma grave, têm sido utilizados em doentes asmáticos com ABPA, com resultados promissores. A maioria da evidência descrita é relativa a séries de casos.
O omalizumab, um anticorpo monoclonal anti‑IgE, apresentou resultados favoráveis em doentes asmáticos com ABPA, com redução das exacerbações, da necessidade de hospitalizações e da dose diária de corticoide.
Estes resultados foram semelhantes em doentes com fibrose cística60. Por outro lado, Tolebeyan A. et al. Reviram oito casos clínicos sem melhoria com a utilização de omalizumab e nos quais foi utilizado mepolizumab, um anticorpo monoclonal anti IL‑5, com boa resposta clínica, analítica e imagiológica61. De salientar que quatro destes doentes eram corticodependentes e um deles apresentava necessidade de oxigenoterapia de longa duração.
Por outro lado, Bernal‑Rubio L. et al. também descrevem um caso clínico de um doente com ABPA sem resposta terapêutica ao omalizumab e que apresentou melhoria após tratamento com benralizumab, um anticorpo monoclonal antirrecetor da IL‑562. Adicionalmente, este fármaco também evidenciou eficácia no tratamento da impactação mucoide em dois doentes medicados inicialmente com mepolizumab que apresentaram inicialmente melhoria clínica e analítica, mas não imagiológica63.
Por fim, o agente biológico mais recentemente aprovado para o tratamento da asma grave e da dermatite atópica, através do bloqueio do IL‑4Rα, o dupilumab, também apresentou resultados positivos no tratamento de doentes asmáticos com ABPA. Uma doente com 47 anos, com diagnóstico de asma grave há 20 anos e ABPA há 3 anos, foi medicada com benralizumab durante 3 meses sem melhoria clínica, tendo sido substituído por omalizumab, também sem melhoria após 5 meses de terapêutica; foi introduzido dupilumab com evidência de resolução dos sintomas, descontinuação de corticoide oral e normalização da função pulmonar64.
É importante referir que os doentes descritos apresentavam na sua maioria asma grave. Atualmente, em Portugal, estes agentes biológicos encontram‑se aprovados para o tratamento da asma grave de tipo 2. A realização de ensaios clínicos utilizando estes fármacos no tratamento da ABPA versus a terapêutica gold standard atualmente disponível poderá permitir expandir o arsenal terapêutico da ABPA.

















