INTRODUÇÃO
A histamina é um dos principais mediadores envolvidos na homeostasia corporal, sendo libertada por mastócitos, basófilos e plaquetas 1.
Está envolvida em várias funções em distintos órgãos-alvo do aparelho respiratório, cardiocirculatório, gastrointestinal e do sistema nervoso central 2,3,4.
Foram já descritos quatro recetores para a histamina (HR): 1, 2, 3 e 4 5,6, estando envolvidos de modo diferencial na patofisiologia de várias doenças. Nos últimos anos têm sido descritos os mecanismos de ativação destes recetores, bem como eventuais estratégias terapêuticas com base no conhecimento destes mecanismos.
Pretende-se com o presente artigo apresentar uma revisão sobre o papel da histamina e a importância dos seus recetores na fisiopatologia da doença alérgica, bem como em algumas doenças autoimunes, neurodegenerativas e no cancro, com particular ênfase nos novos antagonistas dos HR, e na terapêutica de diferentes patologias.
MÉTODOS
Os autores procederam a uma revisão da literatura narrativa, não sistemática sobre o papel da histamina, os seus recetores e respetivas funções fisiológicas, bem como o seu papel na patologia alérgica, autoimune e neoplásica. Foi efetuada uma pesquisa de artigos publicados na base de dados Pubmed, https:\\www.ncbi.nlm.nih.gov, com data de última consulta a 29 de Novembro de 2021. Foram utilizados os seguintes termos MESH: Antihistamines, H1 receptors antagonists; H2-receptor antagonists; H3- receptor antagonists; H4 receptors antagonists; allergy. Foram incluídos artigos de revisão, ensaios clínicos e estudos em modelo animal publicados na última década na língua inglesa. Alguns estudos adicionais referenciados na bibliografia dos mesmos foram também considerados pela sua relevância.
Histamina
A histamina é uma amina endógena produzida sobretudo por mastócitos e basófilos, que a armazenam nos seus grânulos, mas esta molécula pode também ser secretada por plaquetas, células dendríticas ou linfócitos, e mesmo por células não imunes, como os neurónios histaminérgicos e as células da mucosa gástrica, como as células enterocromafins (ECL) 7.
A síntese da histamina ocorre através da descarboxilação da histidina pela enzima L-histidina descarboxílase (HDC), presente em células parietais da mucosa gástrica, mastócitos e basófilos 1. A histamina é degradada por outras duas enzimas: a diamina oxidase (DAO), que degrada a histamina no epitélio intestinal, condicionando a sua absorção sistémica: e a histamina Nmetiltransferase (HNMT) 7,8, que se encontra ao nível do sistema nervoso central.
Esta amina tem uma miríade de funções fisiológicas em diferentes órgãos e sistemas. A nível cardiocirculatório induz vasodilatação com aumento da permeabilidade vascular e queda da resistência vascular periférica, com consequente diminuição da pressão arterial 4,5.
Adicionalmente, induz a contração do músculo liso em diferentes órgãos, como pulmões, útero e estômago, estimulando também neste último a secreção de ácido gástrico 5.
Em paralelo, a histamina é um importante neurotransmissor2, com um papel importante na regulação do ciclo do sono-vigília 9. Destaca-se ainda a sua interação com outras funções fisiológicas, já que se apresenta como um agente modulador da hematopoiese, e promove também processos de proliferação e diferenciação celular, regeneração tecidular e cicatrização, osteoclastogénese e mesmo o desenvolvimento embrionário 1,3,5,7,10.
Tipos de recetores histaminérgicos
Os efeitos biológicos da histamina são mediados pela sua ligação a quatro subtipos de recetores: os histamine receptors (HR)1, HR2, HR3 e HR4, que pertencem à família dos recetores acoplados à proteína G (G protein-coupled receptors, GPCRs) 5,6,11,12.
Estes recetores são ativados na presença de diferentes concentrações de histamina. No entanto, foi demonstrado recentemente que os GPCRs podem apresentar uma ativação espontânea 13. Tal como na maioria dos GPCRs, também os HR existem em formas inativas e ativas, tendo sido descritos diferentes agonistas e antagonistas de HR 5,14. Nos modelos funcionais dos recetores de histamina podemos considerar três estados distintos.
O primeiro, que traduz o estado de repouso, descreve a isomerização do recetor entre estado ativado e inativado, em posição de equilíbrio (R=R*) 15.
O segundo ocorre na presença de um agonista (histamina) que tem uma afinidade preferencial para o estado ativado, estabilizando o recetor nesta conformação, causando consequentemente um desvio do equilíbrio para o estado ativado (R*) 15. Finalmente, o terceiro estado ocorre na presença de um antagonista (anti-histamínico), que apresenta uma afinidade preferencial para o estado inativado, estabilizando o recetor nesta conformação e causando consequentemente um desvio do equilíbrio para o estado inativado 5,7,15.
O Histamine Receptor 1 (HR1)
O HR1 é expresso de forma ubiquitária no organismo, podendo ser encontrado em células imunes, como os eosinófilos e os linfócitos B, bem como no músculo liso dos vasos e do aparelho respiratório e ainda em células nervosas, endoteliais e epiteliais 5,6.
A ativação do HR1 estimula as vias sinalizadoras do fosfatidil inositol, ativa a fosfolipase C e aumenta o cálcio intracelular (Ca2+), com produção de inositol trifosfato (IP3) e diacilglicerol (DAG). Verifica-se então uma ativação do fator de transcrição nuclear kappa B (NFKB) 15 com produção de mediadores inflamatórios que induzem broncoconstrição e o aumento da permeabilidade vascular 5,7. Como já referido, estes recetores são expressos em várias células e estão envolvidos principalmente nas reações de hipersensibilidade do tipo 1, onde se constata a presença de sintomas cutâneos, como o eritema, o prurido e o edema 5.
O Histamine Receptor 2 (HR2)
O HR2 é expresso numa enorme variedade de células, como os linfócitos B, linfócitos T, células dendríticas, células parietais gástricas, células do músculo liso e nos tecidos cerebral e cardíaco. Entre outros efeitos, a ativação deste recetor induz produção de secreções mucosas nas vias respiratórias, aumenta a permeabilidade vascular e a secreção de ácido gástrico 5.
O reconhecimento de que as células Th1 expressam predominantemente HR1, enquanto as células Th2 expressam maioritariamente HR2 3, é mais um elemento que suporta o papel importante da histamina na tolerância imunológica a alergénios 3. Além do seu papel bem caracterizado, nas respostas alérgicas inflamatórias agudas, a histamina também demonstrou condicionar a inflamação crónica e regular a resposta imune 6.
Num estudo recente realizado em 29 adultos saudáveis demonstrou-se que a inibição de HR2 com a ranitidina induziu alterações substanciais e prolongadas nas populações de células B co19+ e células T CD25+, com consequente diminuição da IL-2. Assim, estes dados deverão ser tidos em conta, em contexto de vacinação e/ou estratégias imunoterapêuticas, como potenciais fatores contribuintes para respostas imunes variáveis ou modificadas 16.
Num estudo publicado recentemente, realizado em culturas celulares in vitro, verificou-se que a estimulação com IL-4 e IL-13 pode levar a um aumento dos níveis de HR2 e HR4 em macrófagos M2 humanos, células tipicamente presentes em processos de inflamação alérgica, como ocorre na dermatite atópica (DA) 17.
O reconhecimento destas vias de estimulação relevante, uma vez que os macrófagos podem assumir um importante papel modulador pela libertação de citocinas e quimiocinas, após contacto dos seus HR com a histamina local, abrindo-se espaço para o desenvolvimento de novas estratégias terapêuticas 18.
A literatura parece suportar a ideia de que a ligação da histamina ao HR2 tem um efeito negativo na polarização das respostas Th1, inibindo-se a produção de citocinas como IL-2, IL-12, ou IFN-gama. Esta polarização pode promover perfis Th2, como já se reportou em alguns estudos 19-21. Porém, a ligação da histamina ao HR2 induzirá sobretudo um aumento de IL-10, secretada por células dendríticas ou células T 18. Ativa-se assim um mecanismo contrarregulador da proliferação e da ativação celular, com um potencial de regulação negativa, quer das respostas Th1, quer das respostas Th2, como sugerem estudos mais recentes 18,21.
Contudo, a expressão de HR2 em linfócitos, e em particular nas células T reguladoras (Treg), está ainda mal compreendida, com alguns autores a considerarem a estimulação deste recetor como favorável a eventos supressores, ou, pelo contrário, a não interferir de todo na ação das células Treg 22,23. Pode acrescentar-se ainda que antagonistas do HR2, como a cimetidina, parecem degradar o fator de transcrição Fax p3, levando a uma perda da função supressora das células Treg; no entanto, não é claro de que modo este mecanismo supressor se relaciona com a histamina e o HR2 24.
A histamina parece deste modo assumir um importante papel contrarregulador, através do HR2 e do consequente aumento da IL-10, contribuindo para a supressão de respostas inflamatórias aberrantes 6.
É reconhecida a capacidade das células Treg 1 suprimirem a ação das células T efetoras por intermédio da ação da IL-10 e dos H2R, potenciando a tolerância imunológica 25.
Em suma, o H2R poderá assumir um papel essencial nos mecanismos de tolerância periférica ou na supressão ativa de respostas inflamatórias; no entanto, o seu contributo neste contexto está longe de ser totalmente compreendido.
O Histamine Receptor 3 (HR3)
Este recetor encontra-se maioritariamente localizado no sistema nervoso central (SNC), com maior expressão nas áreas neuronais do córtex cerebral, dos gânglios basais, hipocampo e hipotálamo, tal como demonstrou um estudo in vitro recente, realizado com o enerisant, um potente antagonista dos HR3 26,27.
O HR3, para além de regular a libertação de histamina fundamentalmente a nível central, modula igualmente a libertação de outros importantes neurotransmissores, como a acetilcolina, a dopamina, a serotonina ou o ácido gama aminobutírico (GABA) 5,6,28.
O Histamine Receptor 4 (HR4) Este recetor é preferencialmente expresso na medula óssea e em células hematopoiéticas periféricas do sistema imune inato e adaptativo, apresentando ainda expressão fraca a moderada em células de órgãos como o timo, o baço, o intestino ou o coração 5.
A expressão deste recetor é estimulada por várias citocinas, onde se incluem IFN-y, TNF-α, IL-6, IL-10 ou IL-13, levando à inibição da adenosina monofosfato cíclico (cAMP), bem como à acumulação e ativação da quinase ativada por mitogénio (MAPK) 2,5. Estudos recentemente realizados demonstraram que a ativação do HR4 conduz à acumulação de células inflamatórias por mecanismos quimiotáticos, com um aumento de secreção de IL-31 pelas células Th2 2,5,17.
Apesar de se saber pela literatura que todos os recetores da histamina desempenham papéis importantes na nociceção, estudos recentes vieram demonstrar que os HR4 parecem assumir um papel mais relevante nesta área 5. Para além deste facto, parecem também assumir relevância no desenvolvimento de doenças autoimunes, na neoplasia do cólon e da mama, bem como na patologia alérgica 6. Em estudos realizados em modelos animais, com patologia asmática, artrite, colite e prurido, os antagonistas dos recetores HR4 parecem ter um papel relevante na resposta anti- inflamatória 29-31.
A Tabela 1 resume algumas características de cada um dos subtipos recetores da histamina 15.
Tabela 1 Recetores de histamina e sinais de ativação (Adaptado de Criado et al, 2010) (13).
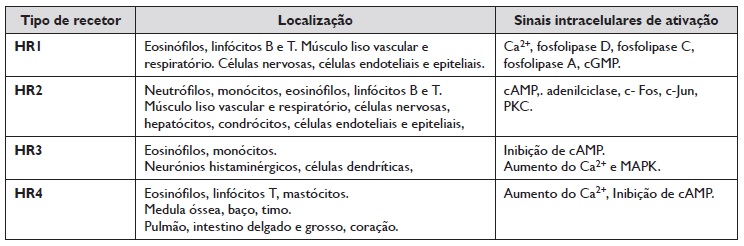
cGMPc - guanosina monofosfato cíclico; cAMP - adenosina monofosfato cíclico; PKC - proteína quinase C;
MAPK - proteína quinase ativada por mitogénio
Recetores histaminérgicos e doença A ativação do HR1 pela histamina constituiu a pedra de toque da fisiopatologia das doenças alérgicas mais prevalentes, como a asma, a dermatite atópica e a rinite alérgica. Quer o aumento da secreção das citocinas Th2 (IL-4, IL-5, IL-1O e IL-13, quer a inibição da produção das citocinas Th1 (IFN-y, IL-12 e IL-2), são mediadas pela histamina, verificando-se através da sua ação uma tendência do organismo para a resposta Th2 5,13.
Os recetores HR2 estão envolvidos na secreção de ácido gástrico e no aumento da permeabilidade vascular, podendo contribuir para a patologia ulcerosa gástrica. A ativação deste recetor pode ainda contribuir para a produção de secreções brônquicas na asma 5,7,15.
Os recetores HR3 estão envolvidos na modulação da atividade neurotransmissora do SNC 2, podendo ter um papel relevante na fisiopatologia de algumas patologias, como a doença de Alzheimer, a esquizofrenia ou a narcolepsia. A neuromodulação e o estado de alerta estão relacionados com os neurónios histaminérgicos 26,32. Recentemente foi realizado um ensaio clínico com antagonistas do HR3, que revelou o seu efeito positivo na aprendizagem e na memória. Assim, parece que a sinalização da histamina é um alvo terapêutico promissor para melhorar as deficiências cognitivas nos doentes com alterações neuropsiquiátricas, como a doença de Alzheimer 33.
Os resultados da investigação acerca do papel do HR4 indicam a sua associação com o desenvolvimento de várias patologias, desde doenças alérgicas e autoimunes, onde se consideram artrite reumatoide (AR), lúpus eritematoso sistémico, síndrome de Sjögren, ou esclerose múltipla, a condições como úlcera gástrica e vários tipos de cancro 34-36. No contexto das doenças autoimunes, este recetor parece estar mesmo envolvido no seu desenvolvimento e progressão. É o que acontece em doentes com AR, onde o HR4 ativado parece induzir osteoclastogénese através do seu papel quimiotático para as células mastocitárias 2,5,29.
Estudos recentes com a base de dados do Cancer Genome Atlas (CGA) permitiram reconhecer que o gene do HR4 é expresso numa diversidade de células neoplásicas (incluindo células de tumores de bexiga, rim, mama, gastrointestinais, pulmão, endometriais e melanoma) 30. Neste contexto, existem já diversos ligandos do HR4 a serem testados para o tratamento destas patologias, representando potenciais alvos moleculares a ter em conta no futuro 30,37. Sabe-se também que, de acordo com o tipo de neoplasia, a expressão do gene HR4 poderá ser alta (como acontece nas neoplasias do fígado, do rim e do esófago) ou baixa (observada nas neoplasias do cólon, gástricas, da bexiga, da mama e do útero) 30. Mais ainda, parece ser de extrema relevância a observação de que mesmo num tipo específico de neoplasia os níveis de expressão de HR4 podem variar entre estádios iniciais e avançados da doença, o que sugere a sua participação no desenvolvimento da neoplasia 30. Por fim, a expressão de H4R parece ainda estar associada ao prognóstico de algumas neoplasias.
De facto, alguns autores sugerem mesmo que no futuro este recetor possa ser considerado um potencial biomarcador, complementar aos exames imuno-histoquímicos realizados nestas patologias 38-40. Porém, são necessários ainda mais estudos com amostras de maior dimensão para que se possa definir, de forma mais clara e objetiva, a associação entre a expressão de HR4 e o prognóstico de diferentes neoplasias 30.
Antagonistas de recetores de histamina
Os anti-histamínicos anti-H1 bloqueiam a ligação da histamina aos recetores HR1, impedindo o desencadear da cascata inflamatória e o aparecimento dos sintomas e sinais associados à doença alérgica.
Existem duas subclasses que são utilizadas, os anti-histamínicos de 1.ª geração, aprovados pela FDA em 1930 e os anti-histamínicos de 2.ª geração, introduzidos na década de 80 41.
Os anti-histamínicos de 1.ª geração (difenidramina, prometazina, hidroxizina e clorfenidramina) atravessam a barreira hematoencefálica, causando sonolência, sedação, cansaço, fraqueza, efeitos anticolinérgicos e alterações da memória 41.
Os anti-histamínicos de 2.ª geração têm sido desenvolvidos nos últimos 40 anos. Alguns deles derivam de anti-histamínicos de 1.ª geração, mas oferecem claras vantagens em relação a estes, uma vez que apresentam pouca ou nenhuma atividade anticolinérgica e pouco ou nenhum efeito sedativo 41. Estes fármacos atuam ao nível da glicoproteína P (gP), que está presente em vários tipos de células, como as endoteliais capilares ou as epiteliais intestinais, entre outras 15. É precisamente por atuar ao nível da gP que esta classe de anti-histamínicos não atravessa a barreira hematoencefálica, já que esta não permite a sua passagem para o SNC 15.
Não deve ser igualmente esquecido que a sua menor capacidade de passagem através da barreira hematoencefálica decorre igualmente da sua menor lipofilicidade 15,41. Contudo, também têm alguns efeitos adversos e alguns deles interagem com outros fármacos, mas após uma extensa pesquisa realizada ao longo dos últimos anos pode afirmar-se que são seguros e que os seus efeitos secundários são mais ténues ou inexistentes em relação aos anti-histamínicos de 1ª geração 41.
São exemplos de anti-histamínicos de 2ª geração algumas moléculas, como a fexofenadina, loratadina, cetirizina, ebastina, desloratadina, bilastina, rupatadina e levocetirizina 15.
Um estudo recente avaliou um antagonista do HR3, a tioperamida, em modelo animal, onde mostrou apresentar efeito regulador do ciclo sono-vigília e do défice cognitivo, podendo ser um potencial fármaco na doença de Alzheimer 42. O pitolisant é o único antagonista/agonista inverso dos recetores H3, que se encontra aprovado pelas autoridades europeias/EUA para a manutenção dos estados de alerta em doentes com narcolepsia 43.
A identificação de outros alvos histaminérgicos e noradrenérgicos poderá revestir-se da maior importância no estudo do ciclo sono-vigília 26,32. Tendo em conta o que se referiu sobre o HR4, os seus antagonistas poderão ser eficazes no controlo do prurido de diferentes patologias, como na DA, urticária aguda, rinite alérgica e conjuntivite alérgica 31.
Num estudo recente, onde se pretendeu avaliar a eficácia da quercetina no influxo de cálcio induzido pela histamina no queratinócito humano, constatou-se que esta pode diminuir o influxo de cálcio induzido pelo HR4 através do canal TRPV1, apresentando uma ação eficaz antiprurido (em ratinhos BALB/c) e anti-inflamatória 44.
Encontra-se em fase experimental, o tratamento com um antagonista de HR4 (composto 48 - pyrido[2,3- e] tetrazolo[1,5-a]pyrazine) para atenuação de prurido e inflamação na DA, prevendo-se que o seu efeito inibitório seja bastante eficaz no tratamento da doença 34.
Esta nova classe de antagonistas HR4, testada já em diversos modelos animais, apresenta elevada seletividade para estes recetores, assim como um perfil farmacocinético favorável, pelo que parece ser um candidato promissor para o tratamento da DA 34. Existem ainda diversos estudos recentes, efetuados também em modelos animais, que utilizaram uma combinação de antagonistas HR1 (mepiramina) e HR4 (JNJ-39758979). Os seus resultados parecem revelar um efeito sinérgico anti-inflamatório importante também no tratamento da DA 45. A conjugação de antagonistas HR4 com agonistas de HR2 permitiu ainda reduzir a inflamação em modelo animal de psoríase, o que reforça a necessidade de explorar a ação imunomoduladora combinada dos diferentes recetores 46.
Tendo em conta o seu padrão de expressão e a sua ação, os HR4 parecem também ser um alvo terapêutico interessante no tratamento da asma 28, visto que a asma é uma patologia tipicamente caracterizada pelo envolvimento de eosinófilos e mastócitos 28. Numa publicação recente observou-se que em ratinhos sem o gene HR4 ocorreu uma redução significativa da reação alérgica causada pela administração da proteína ovalbumina 47. Foi também demonstrado que a quimiotaxia dos eosinófilos é bloqueada por antagonistas seletivos do HR4 (JNJ7777120, JNJ39758979) em modelos animais de inflamação alérgica cutânea, devido à ativação das células T 48-50. Alguns antagonistas seletivos do HR4 demonstraram, também em modelo animal, um efeito benéfico na mediação da função pulmonar e da inflamação 51. Nestes casos, os antagonistas do HR4 poderão atuar diretamente pela redução do número de células T no local da inflamação, ou de forma indireta quando envolvidos na função das células dendríticas, que poderão estar implicadas na modulação da resposta imune na asma 51.
Por fim, o HR4 medeia a expressão do ligando do recetor ativador do fator nuclear kappa B (RANKL) e a diferenciação osteoclástica, induzida pela ação da histamina e das citocinas da resposta Th17. Assim, o bloqueio deste recetor com um antagonista de HR4 (JNJ7777120) poderá constituir um novo alvo terapêutico para a prevenção da destruição óssea associada à AR 29,36.
CONCLUSÃO
A histamina é uma amina endógena com um papel fundamental na homeostasia, assumindo uma miríade de funções.
São atualmente conhecidos 4 recetores para a histamina, com funções primordiais homeostáticas no organismo e com uma importante implicação também na fisiopatologia de diversas doenças. O HR1 e o HR2 já se encontram bem caracterizados pela comunidade científica e apresentam fármacos disponíveis no mercado.
O HR3 tem revelado em estudos in vitro um papel neuromodulador promissor e ainda o HR4 que, também em estudos in vitro, parece estar envolvido em patologias tão prevalentes a nível global como as alérgicas, autoimunidade e cancro.
Existem diversos fármacos disponíveis no mercado que bloqueiam os recetores H1 (anti-histamínicos de 1.ª e de 2.ª geração) e ainda os que bloqueiam os recetores H2, como a cimetidina e a famotidina. Recentemente foram descritos anti-H3 com potencial terapêutico na doença neurológica. Em modelos animais, antagonistas HR4 demonstraram igualmente eficácia e segurança e estão a ser estudados em ensaios clínicos, quer em monoterapia quer em combinação com bloqueio dos HR1, na doença alérgica, na doença autoimune e em algumas neoplasias.
Em suma, parece fundamental continuar a explorar no futuro os potenciais benefícios farmacológicos destas novas subclasses de anti-histamínicos, em paralelo com os atualmente em uso clínico, visto que alguns dados mais recentes indicam que outros recetores da histamina poderão ter um papel relevante em patologia humana e serem alvos terapêuticos promissores no futuro.















