INTRODUÇÃO
A dermatite atópica (DA) é a doença inflamatória crónica cutânea mais frequente, afeta até 20% das crianças e 2-8% dos adultos na maioria dos países do mundo 1. Do estudo multicêntrico de Odhiambo et al. estimou-se que, em Portugal, a prevalência de sintomas de DA nas faixas etárias dos 6-7 anos e 13-14 anos foi de 9,3% e 5,2%, respetivamente 2.
A DA é frequentemente a primeira manifestação da doença alérgica. Estima-se que 50% dos casos surjam no primeiro ano de vida e 85% dos doentes desenvolvam sintomas nos primeiros 5 anos de vida. Esta não é uma patologia exclusiva da faixa etária pediátrica e aproximadamente 1 em 4 adultos com DA reportam o início dos sintomas durante a idade adulta 3, existindo casos reportados com início 60 anos, estimando-se uma prevalência de DA de 2-3% na população idosa 4.
A sua fisiopatologia é complexa, envolvendo fatores genéticos (por exemplo, mutaçõ es do gene da filagrina) e ambientais (como alergénios e alteraçõ es do microbioma cutâneo). Tem por base uma disfunçã o da imunidade inata e adaptativa com inflamaçã o predominantemente T2 5.
Caracteriza-se clinicamente por lesões cutâneas papulovesiculares intensamente pruriginosas que evoluem para descamaçã o, alteração da pigmentação e posterior liquenificação, afetando significativamente, de forma negativa, a qualidade de vida dos doentes. O diagnóstico de DA é clínico e baseia-se nos critérios sugeridos por Hanifin and Rajka 6.
O tratamento da DA deve ser orientado de acordo com a sua gravidade, tendo por base a instituição de medidas gerais, como a utilizaçã o diária de emolientes e a terapêutica farmacológica, como a aplicação de corticoides e/ou imunossupressores tópicos nas zonas de lesões ativas, em esquema de alívio e/ou proativo. No caso das exacerbaçõ es agudas pode haver indicação para a utilização de corticoides orais por curtos períodos de tempo. Nos casos de maior gravidade, sem controlo com a terapêutica de 1.ª e 2.ª linha, os imunossupressores sistémicos posicionam-se na 3.ª linha, sendo que o único tratamento on label na Europa nesta categoria é a ciclosporina, aprovada para o tratamento de adultos com DA, podendo ser usada off label em idade pediátrica. O metotrexato e a azatioprina podem ser considerados como alternativas off label 7.
O tratamento da DA tem vindo a evoluir para uma medicina de precisão/personalizada. Um grande avanço científico e clínico surgiu com o desenvolvimento do dupilumab, um anticorpo monoclonal totalmente humano que tem como alvo a subunidade alfa do recetor da IL-4, desta forma inibindo a sinalizaçã o IL-4/IL-13, citocinas‑chave nas doenças inflamatórias T2, como a DA. Atualmente está aprovado para o tratamento da DA moderada a grave em adultos e adolescentes com idade igual ou superior a 12 anos e para o tratamento da DA grave em crianças dos 6 aos 11 anos, que são candidatos a terapêutica sistémica 8.
A avaliação e monitorização do tratamento com dupilumab inclui uma observação médica, com avaliação da gravidade e atividade da doença através dos scores EASI (Eczema area and severity index) e SCORAD (SCORing atopic dermatitis), e avaliação da qualidade de vida através do questionário DLQI (Dermatological life quality of life índex) 9.
Os ensaios clínicos e os estudos de vida real demonstraram uma melhoria significativa dos scores de gravidade e qualidade de vida dos doentes com DA moderada a grave sob tratamento com dupilumab 10,11, sendo que, até à data, não existem biomarcadores inflamatórios e imunológicos que possam predizer boa ou má resposta ao tratamento 12.
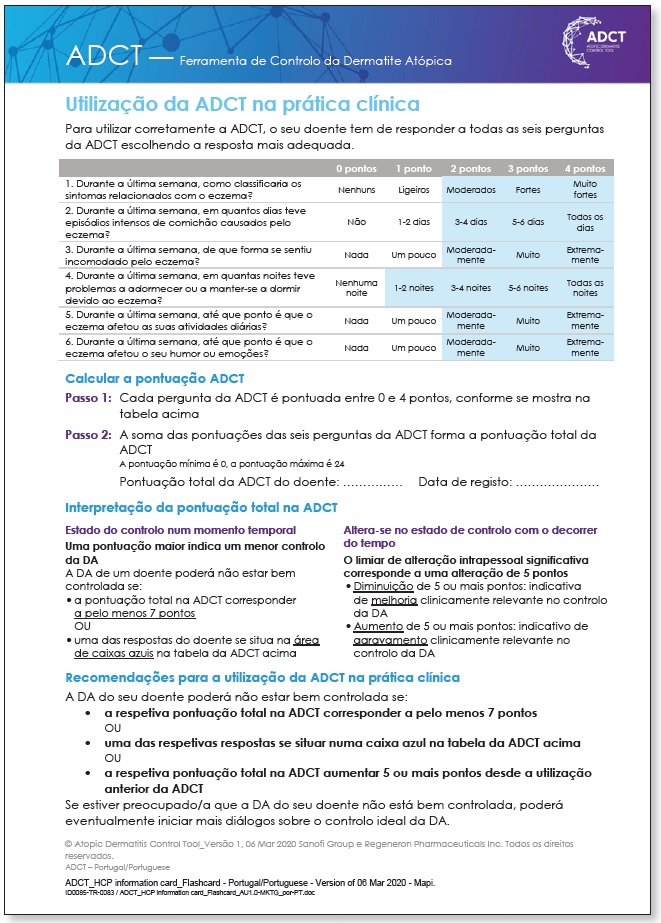
Recentemente foi desenvolvida uma outra ferramenta para avaliação do controlo da DA, testada e validada nos Estados Unidos da América, o Atopic dermatitis control tool (ADCT) 13,14, com versão traduzida e validada para português de Portugal. É constituída por 6 perguntas que permitem avaliar as dimensões de controlo da DA identificadas como relevantes por doentes e médicos, nomeadamente gravidade dos sintomas da DA, frequência de episódios intensos de prurido, extensão do incómodo relacionado com a DA, impacto da DA no sono, nas atividades diárias e no humor ou nas emoções. Atualmente a avaliação do ADCT ocorre por um método visual e uma avaliação numérica. O método visual implica que a doença não esteja controlada se uma das respostas do doente se situar na área de caixas azuis da tabela ADCT15 (Anexo 1).
Por ser um questionário breve e de fácil leitura, foi concebido para facilitar, na prática clínica diária, um diálogo pertinente entre doentes e médicos sobre o controlo da DA, permitindo melhorar a monitorização da doença.
O estudo aqui descrito teve como objetivos avaliar o controlo da doença a longo prazo em doentes com DA sob tratamento com dupilumab e avaliar a aplicabilidade e relevância da ferramenta ADCT neste contexto.
MÉTODOS
Desenho do estudo, população e colheita de dados Estudo observacional retrospetivo que incluiu doentes com DA seguidos em consulta de Imunoalergologia em dois centros hospitalares portugueses. Os doentes completaram pelo menos 6 meses de tratamento com dupilumab numa dose inicial de 600mg (2 injeções de 300mg) seguida por 300mg administrados em semanas
alternadas sob a forma de injeçã o subcutânea 8.
O controlo da doença foi avaliado através do questionário ADCT num único momento temporal. Considerou-se mau controlo uma pontuação ≥7 pontos ou uma resposta na área de caixas azuis na tabela ADCT, de acordo com a interpretação recomendada e validada 15; (Anexo 1).
Foram avaliadas correlações entre o ADCT e a duração da doença, scores de gravidade SCORAD e EASI, escalas numéricas (NRS) do prurido e sono, escala de qualidade de vida DLQI, IgE total e número total de eosinófilos no sangue periférico. Foram analisadas a evolução dos scores de gravidade da doença e de qualidade de vida, bem como a evolução dos biomarcadores IgE total e eosinófilos ao longo do tratamento com dupilumab em relação ao valor basal, definido como T0.
Neste sentido, foi feita uma avaliação clínica incluindo todos os scores referidos antes do início do tratamento com dupilumab e no momento da avaliação do ADCT, realizada entre os 6 e 12 meses de tratamento com dupilumab em 12 doentes (41,4%) e depois dos 12 meses em 17 doentes (58,6%). A avaliação laboratorial foi feita em T0 e depois aos 6 e 12 meses de terapêutica com dupilumab. Por fim, os doentes foram divididos em dois grupos, bem controlados e mal controlados, de acordo com o ADCT, e foi avaliada a diferença entre grupos no que diz respeito à duração da DA, scores de avaliação da gravidade e qualidade de vida e evolução dos biomarcadores.
Análise estatística
As variáveis categóricas são apresentadas como frequências e percentagens e as variáveis contínuas como médias e desvios-padrão (variáveis com distribuiçã o normal) ou medianas e amplitude interquartil (variáveis com distribuiçã o assimétrica). A distribuiçã o normal foi confirmada pelo teste de Shapiro-Wilk ou pela análise dos valores de assimetria e achatamento. Para a análise bivariada foram utilizados os teste T-student ou Mann-Whitney para comparação de variáveis entre os grupos de doentes bem e mal controlados de acordo com o ADCT, e os testes T-emparelhado ou Wilcox para avaliação da evolução dos biomarcadores e scores de gravidade e qualidade de vida ao longo do tratamento com dupilumab. Para avaliar a correlação entre o ADCT e os biomarcadores e scores de avaliação da DA foram usados o coeficiente de correlação de Pearson ou Spearman, conforme apropriado. Valores p <0,05 foram considerados estatisticamente significativos. A análise estatística foi realizada com recurso ao software IBM-SPSS (versão 25.0).
RESULTADOS
Características da população e controlo da DA
Foram incluídos 29 doentes, 15 (51,7%) do género feminino, com idade média de 35,6 ± 12 anos [17-61]. A idade média do diagnóstico da DA foi de 6,1±8,91 anos (1-30) e a duração mediana da doença de 29 anos (AIQ 17) 14-47]. A duração média de tratamento com dupilumab foi de 14±6,68 meses [6-28], sendo que 12 doentes (41,4%) cumpriram menos de 1 ano de tratamento.
A coorte de doentes selecionada é proveniente de uma consulta de Imunoalergologia de dois centros hospitalares, com um endofenótipo de DA bem definido, com inflamação predominantemente T2, presença de sensibilização alérgica e com outras doenças atópicas associadas (Tabela 1). A pontuação média do ADCT foi de 3,96±3,2 (0-12).
Tabela 1 Caracterização demográfica e clínica da população do estudo
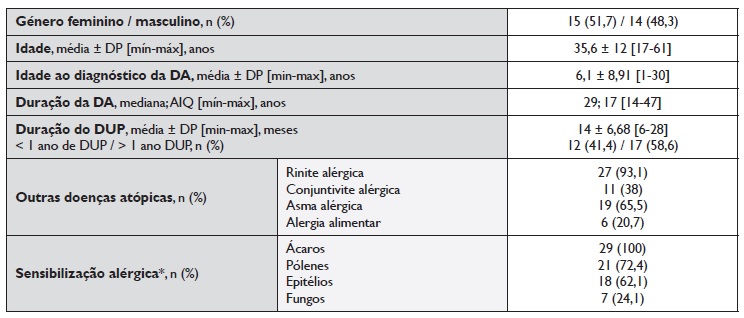
AIQ: amplitude interquartil; DA: dermatite atópica; DP: desvio-padrão; DUP: dupilumab; * testes cutâneos em picada positivos (pápula ≥ 3mm)
Nesta amostra, 12 doentes (41,4%) reportaram mau controlo da DA de acordo com o ADCT, sendo que, no momento desta avaliação, 6 (50%) tinham completado menos de 1 ano de dupilumab, com uma duração média de tratamento de 12±7,8 meses neste subgrupo de doentes. Não se verificou uma diferença significativa na mediana do ADCT entre os doentes com menos e mais de 1 ano de tratamento com dupilumab, no entanto salienta-se a percentagem mais elevada de doentes bem controlados no grupo que completou mais de 1 ano de tratamento (64,7%), em comparação com o grupo que não atingiu 1 ano (50%). Curiosamente, o grupo de doentes sob dupilumab há mais de 1 ano apresentou uma mediana de EASI basal inferior aos doentes com menos de 1 ano de tratamento (22,2 vs 41,3), podendo a diferença da gravidade basal da DA influenciar o resultado do controlo da doença (Tabela 2).
Tabela 2 Evolução do valor mediano do SCORAD, EASI e DLQI desde T0 até ao momento atual de acordo com o controlo da doença definido pelo ADCT e com a duração do tratamento com dupilumab

DLQI: Dermatological life quality of life índex; DUP: dupilumab; EASI: eczema area and severity index); SCORAD: SCORing atopic dermatitis; * valores p<0,05 considerados estatisticamente significativos.
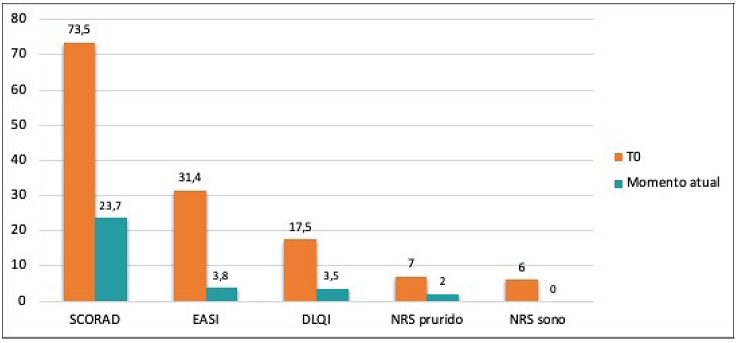
Evolução dos scores de avaliação da gravidade da DA e dos biomarcadores ao longo do tratamento com dupilumab Globalmente verificou-se uma redução significativa no EASI, SCORAD, NRS-prurido, NRS-sono e DLQI desde o início do tratamento com dupilumab (T0) até ao momento em que foi avaliado o controlo da DA através da ferramenta ADCT, referido como o momento atual (p<0,001) (Figura 1). Dividindo os doentes por grupos, com menos ou mais de 1 ano de tratamento com dupilumab e com mau ou bom controlo da DA de acordo com o ADCT, e analisando a evolução dos scores EASI, SCORAD e DLQI, verificou-se uma redução significativa do valor mediano destes scores em todos os grupos, com exceção da evolução do EASI no grupo de doentes sob dupilumab há mais de 1 ano que se consideraram mal controlados, cuja redução não foi estatisticamente significativa (Tabela 2).
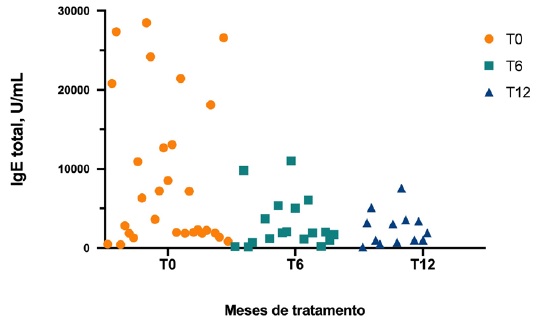
Avaliando os biomarcadores, o valor mediano da IgE total antes do início do dupilumab foi de 12668 U/mL (mínimo 6313 U/mL, máximo 24192 U/mL) e a mediana de IgE total diminuiu significativamente aos 6 (T6) e 12 (T12) meses de terapêutica, relativamente a T0 (Figura 2). Não se verificou o mesmo no valor de eosinófilos, ou seja, a mediana de eosinófilos não diferiu significativamente em relação ao basal nos diferentes timepoints (Figura 3).
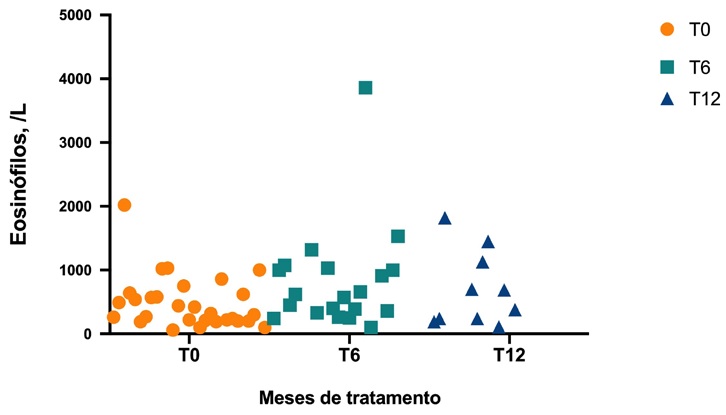
Figura 3 Evolução da contagem de eosinófilos no sangue periférico ao longo do tratamento com dupilumab
Avaliação das diferenças entre grupos (bem vs mal controlados) de acordo com a pontuação do ADCT
Os doentes bem controlados de acordo com o ADCT apresentaram valores atuais tendencialmente mais baixos de SCORAD, EASI e DLQI, com redução significativa no valor mediano destes scores, independentemente da duração do tratamento (Tabela 2).
Na amostra do estudo verificou-se uma correlação positiva entre o ADCT e o SCORAD (r=0,452; p=0,023) e DLQI (r=0,763; p<0,001) avaliados no mesmo momento temporal, mantendo-se esta correlação positiva quando realizada dividindo os doentes por grupos bem e mal controlados.
Não se verificou correlação significativa entre o ADCT e o EASI. Da mesma forma, houve uma correlação positiva entre o NRS-prurido e NRS-sono e as perguntas 2 (r= 0,716; p<0,001) e 4 (r=0,545; p=0,005) do questionário ADCT relativas a episódios intensos de prurido e a problemas em adormecer ou em manter-se a dormir.
O grupo de doentes com mau controlo da doença de acordo com a pontuação do ADCT apresentou valores de IgE total basal inferiores (p=0,046) quando comparado com o grupo de doentes com doença controlada.
Analisando os outros scores de avaliação clínica, e especificamente a diferença entre os valores no momento da avaliação do ADCT e os valores basais, verificou-se que doentes com IgE total basal mais elevada tiveram uma melhoria mais acentuada no DLQI ao longo do tratamento com dupilumab (r=0,553; p=0,003). Esta correlação não se verificou para os scores de gravidade e atividade da doença SCORAD e EASI.
Não se verificaram diferenças significativas entre estes grupos relativamente à duração da DA e à gravidade inicial da doença avaliada através do SCORAD, EASI e DLQI em T0.
DISCUSSÃO
O presente estudo utilizou, pela primeira vez em Portugal, a ferramenta ADCT para avaliar o controlo da DA a longo prazo em doentes sob tratamento com dupilumab em dois serviços de Imunoalergologia do nosso país.
No total foram incluídos 29 doentes, sendo que todos cumpriram um período mínimo de 6 meses de tratamento com dupilumab, critério necessário para a aplicação da ferramenta ADCT para avaliar o controlo a longo prazo da DA.
Na coorte de doentes estudados verificou-se um discreto predomínio do género feminino (51,7%), e a idade média do diagnóstico da DA foi de 6,1±8,91 anos, o que está de acordo com os dados descritos na literatura, sabendo-se que a maioria dos doentes com DA desenvolve os sintomas durante a primeira infância 2,3,16.
Os doentes estudados responderam a todas as 6 perguntas do ADCT num único momento temporal para avaliar o controlo da DA após um período mínimo de 6 meses de tratamento com dupilumab. Esta ferramenta, recentemente validada nos EUA, foi desenvolvida para avaliar as diferentes dimensões de controlo da DA identificadas como relevantes por doentes e médicos 13,14. É reconhecido que o prurido crónico e a privação de sono têm um impacto negativo significativo nestes doentes e afetam diferentes aspetos, como o humor, a atividade sexual, a interação social, as atividades laboral e académica 17,18.
Sendo o ADCT, um score de avaliação da DA totalmente subjetivo, é expectável que este se correlacione com outros scores que avaliem exclusivamente sintomas subjetivos quando realizados no mesmo momento temporal, nomeadamente o DLQI, o NRS-prurido e o NRS-sono, o que foi constatado neste grupo de doentes.
Verificou-se uma correlação positiva entre o ADCT e o SCORAD realizados no mesmo timepoint, uma vez que esta ferramenta de avaliação, para além de avaliar a gravidade e extensão das lesões cutâneas, inclui uma avaliação subjetiva da intensidade do prurido e perturbação do sono. No entanto, não se verificou uma correlação significativa entre o ADCT e o EASI, o que pode ser explicado pelo facto de este ser um score de avaliação unicamente objetivo, ao contrário dos restantes.
Se por um lado, 12 doentes (41%) reportaram um mau controlo da DA tendo em conta a avaliação por ADCT, também se verificou no mesmo grupo de doentes uma redução significativa no EASI, SCORAD, NRS-prurido, NRS-sono e DLQI desde o início do tratamento com dupilumab até ao momento de avaliação do ADCT (entre os 6 e os 24 meses de tratamento com dupilumab). Quando avaliada a evolução dos scores por grupos, de acordo com o controlo da doença e a duração do tratamento, a única redução não significativa foi a do valor mediano do EASI no grupo de doentes sob dupilumab há mais de 1 ano que se consideraram mal controlados. Este resultado pode estar relacionado com o facto de este grupo de doentes apresentar uma mediana de EASI basal inferior quando comparada com o grupo de doentes mal controlados com menos de 1 ano de tratamento (23,6 vs 41,3) (Tabela 2).
Esta incongruência verificada entre a elevada percentagem de doentes não controlados de acordo com o ADCT e a excelente evolução dos scores de avaliação da gravidade da doença ao longo do tratamento implica uma reavaliação da interpretação do questionário ADCT. Recorrendo a um exemplo prático e analisando a pergunta 4 do ADCT, correspondente a dificuldades em adormecer ou manter-se a dormir devido à DA, verifica-se que uma resposta de 1-2 noites/semana implica mau controlo da DA 15 (Anexo 1). Sabemos que a perturbação do sono é atualmente reportada em 47% a 80% das crianças e em 33% a 90% dos adultos com DA, sendo um fator major na diminuição da qualidade de vida nestes doentes.
Contudo, as perturbações do sono afetam atualmente quase 1/4 da população mundial e podem ter várias outras causas, nomeadamente depressão, ansiedade e stress pós-traumático 19, factos que podem facilmente enviesar a resposta dos doentes.
Estas são algumas causas que podem explicar o mau controlo da doença encontrado em 41% dos nossos doentes usando o ADCT, que parece não acompanhar a boa resposta clínica ao tratamento com dupilumab avaliada pelos outros scores. Esta falta de concordância entre a avaliação subjetiva do doente e a avaliação objetiva do médico sobre o controlo da DA já foi discutida previamente14,20 e não existem estudos que relacionem o ADCT com scores de gravidade e extensão da DA. Em relação a outras ferramentas de avaliação auto-reportadas, o ADCT tem sido relacionado com o DLQI e doentes com doença não controlada estão em maior risco de percecionar a DA como tendo um impacto significativo na qualidade de vida. No entanto, no estudo de Staumont-Sallé et al, no grupo de doentes com DA não controlada de acordo com o ADCT, 10% relataram que a DA não teve qualquer impacto na sua qualidade de vida e 28,3% relataram que a DA teve um impacto ligeiro 21.
Para além disso, utilizando unicamente o método numérico para avaliar o controlo da doença através do ADCT, apenas 4 dos doentes estudados (13,8%) apresentaram doença não controlada, pelo que talvez seja necessário rever a interpretação desta ferramenta de avaliação.
Nestes 4 doentes não se verificou uma redução significativa no EASI, SCORAD, NRS-prurido, NRS-sono e DLQI desde o início do tratamento com dupilumab (T0) até ao momento atual (p>0,05).
Sabemos que a avaliação clínica da DA é difícil, uma vez que devem ser tidos em conta os múltiplos sinais, sintomas e dimensões da doença, e que a avaliação do controlo global da doença é fundamental para a sua monitorização, otimização terapêutica e melhoria da qualidade de vida. O ADCT apresenta várias vantagens neste sentido, sendo um questionário breve, de fácil leitura, autorreportado e de simples interpretação para o doente e para o médico, sendo a sua realização acessível durante uma consulta. Ao contrário de outras ferramentas de avaliação autorreportadas, como as escalas visuais ou analógicas do prurido e do sono, que avaliam apenas uma dimensão desta complexa doença, o ADCT permite avaliar várias dimensões de controlo da DA.
Consideramos como desvantagem o baixo limiar utilizado para definir doença não controlada e, por esse motivo, talvez o ADCT não deva ser utilizado como instrumento de avaliação inicial, mas sim como uma ferramenta de follow-up, podendo ser sobretudo útil para a deteção precoce de perda de controlo da DA numa avaliação longitudinal, estando definido que um aumento de 5 ou mais pontos é indicativo de agravamento clinicamente relevante no controlo da DA 15 (Anexo 1).
Foram já realizados e publicados estudos que mostraram a evolução de biomarcadores séricos ao longo de 16 semanas de tratamento com dupilumab. Especificamente, no estudo de Guttman-Yassky et al, publicado em 2019, o tratamento com dupilumab reduziu significativamente as determinações séricas de biomarcadores da via Th2, incluindo IgE total 22. Também no presente estudo se verificou que a mediana de IgE total diminuiu significativamente aos 6 e 12 meses de terapêutica com dupilumab (Figura 2).
Analisando particularmente o biomarcador IgE total nesta coorte de doentes, o valor mediano de IgE total antes do início do dupilumab foi de 12 668 U/mL, sendo que 34,5% dos doentes (n=10) apresentaram valores superiores a 10 000 U/mL (Figura 2). Sabe-se que doentes com DA apresentam frequentemente elevados níveis de IgE total e que níveis mais elevados deste biomarcador têm sido associados a doença mais grave 23. Este estudo incluiu exclusivamente doentes com DA moderada a grave, todos eles com outras doenças atópicas associadas, com um endofenótipo de DA bem definido, com inflamação predominantemente T2 e níveis de IgE total basal tendencialmente mais elevados pela presença de sensibilização alérgica (Tabela 1).
Até à data não existem biomarcadores inflamatórios e imunológicos que possam predizer boa ou má resposta ao tratamento com dupilumab nos doentes com DA.
Neste estudo, o grupo de doentes com mau controlo da doença de acordo com o ADCT apresentou valores de IgE total basal inferiores e doentes com IgE total basal mais elevada tiveram uma melhoria mais acentuada no DLQI ao longo do tratamento com dupilumab, sugerindo a IgE total basal como preditor de resposta clínica ao tratamento com dupilumab. No entanto, não se verificou correlação deste biomarcador com os scores de gravidade e atividade da doença SCORAD e EASI, o que torna a afirmação anterior especulativa, tendo em conta a associação encontrada apenas com scores de avaliação subjetiva da DA numa amostra reduzida de doentes com níveis de IgE total muito elevados, sendo necessários mais estudos de vida real neste sentido.
Consideramos como limitações deste estudo o facto de a avaliação do ADCT ter sido realizada em momentos díspares dentro da população estudada e num único momento temporal, não permitindo analisar a evolução deste score ao longo do tratamento com dupilumab, o que pode influenciar a interpretação dos resultados obtidos.
CONCLUSÕES
Confirmamos a eficácia demonstrada deste fármaco em ensaios clínicos e estudos de vida real, com uma redução significativa no EASI, SCORAD, NRS-prurido, NRS-sono e DLQI ao longo do tratamento com dupilumab.
Neste estudo, 41% dos doentes reportaram mau controlo da DA de acordo com o ADCT, não se tendo verificado diferença significativa na mediana da pontuação do ADCT entre os doentes com menos e mais de 1 ano de tratamento com dupilumab.
Nesta coorte de doentes verificou-se uma correlação positiva entre o ADCT e o SCORAD e DLQI avaliados no mesmo momento temporal, sem correlação significativa demonstrada entre o ADCT e o EASI, possivelmente relacionado com o facto de este último ser um score unicamente objetivo, ao contrário dos restantes. Concluímos que, dada a ausência de concordância entre a avaliação subjetiva do doente e a avaliação objetiva do médico sobre o controlo da DA, e tendo em conta o baixo limiar utilizado na interpretação do ADCT para definir doença não controlada, pode ser necessário rever a interpretação desta ferramenta de avaliação, com eventual utilização apenas do método numérico para analisar a resposta dos doentes às seis perguntas do questionário ADCT ou eventual reformulação do método visual.
Por fim, verificou-se neste estudo que valores de IgE total basal inferiores se associaram a mau controlo da DA de acordo com o ADCT e que doentes com IgE total basal mais elevada tiveram uma melhoria mais acentuada no DLQI ao longo do dupilumab, sugerindo de forma especulativa uma associação entre IgE total basal e resposta clínica ao tratamento com dupilumab, sendo necessários mais estudos neste sentido.