Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Acessos
Acessos
Links relacionados
-
 Similares em
SciELO
Similares em
SciELO
Compartilhar
Nascer e Crescer
versão impressa ISSN 0872-0754
Nascer e Crescer vol.21 no.3 Porto set. 2012
Vigilância pré-natal e decisão do parto
Cristina Dias1
1 Maternidade Júlio Dinis, CH Porto
INTRODUÇÃO
A Restrição de Crescimento Intra-Uterino (RCIU) é ainda nos dias de hoje um problema complexo para o Obstetra e também para o Pediatra por se associar a morbilidade e mortalidade fetal/neonatal. Paralelamente à morbilidade associada à prematuridade e à asfixia intraparto associam-se outras complicações neonatais, nomeadamente a lesão cerebral hipoxia com as respectivas sequelas, a enterocolite necrotizante, a hemorragia pulmonar, a retinopatia, a insuficiência renal, a trombocitopenia, a policitemia, a hipoglicemia, a hipocalcemia, a hiperbilirrubinemia, a instabilidade térmica e a sépsis.
A longo prazo estão descritos outros efeitos adversos, incluindo uma pequena diminuição no QI e uma redução nos scores das funções cognitivas, na memória visual e na coordenação motora. Estes défices funcionais parecem ser diretamente proporcionais ao grau de prematuridade e às alterações de fluxo das artérias umbilical e cerebral média(20,21,22,23).
Estão descritos ainda efeitos deletérios da RCIU na saúde do adulto. Assim, segundo a Teoria de Barker, estes indivíduos têm maior risco de mais tarde, já na vida adulta, apresentarem alterações metabólicas-endócrinas que levam ao aparecimento de hipertensão, dislipidemia, diabetes tipo 2 e doença isquémica cardíaca(24,25).
DEFINIÇÃO
A definição mais comum de RCIU é um peso fetal estimado (PFE) abaixo do percentil 10 para a idade gestacional. No entanto, esta definição não distingue os fetos constitucionalmente pequenos (FCP) (70%) daqueles que têm realmente restrição de crescimento (30%). Esta distinção é extremamente importante, condicionando não só a atitude do obstetra como também o prognóstico fetal. Assim, um feto constitucionalmente pequeno tem um bom prognóstico, ao contrário do feto com RCIU. O prognóstico fetal está também relacionado com a causa do RCIU. Assim, sempre que a causa se deve a fatores intrínsecos fetais, tais como aneuploidias, malformações congénitas ou infeções congénitas, o prognóstico é mais reservado porque a maioria das vezes não temos forma de melhorar estas condições. Por outro lado, quando a causa se deve a insuficiência útero-placentar o prognostico é melhor, mas, ainda assim associado a complicações. Cerca de 5-10% de todas as gravidezes apresentam um feto com um crescimento abaixo da normalidade. No entanto, este grupo de fetos não é homogéneo e inclui essencialmente três tipos de fetos que correspondem a diferentes grupos etiológicos e a diferentes prognósticos obrigando assim a uma diferente atitude pelo obstetra:
Fetos com RCIU por insuficiência placentar. Correspondem a cerca de 50% dos casos e associam-se a situações de pré eclampsia, visto que os processos fisiopatológicos são comuns para ambas as patologias.
Fetos pequenos para a idade gestacional sem anomalias. São fetos constitucionalmente pequenos, representando o espectro inferior do peso esperado para este feto.
Fetos pequenos para a idade gestacional com anomalias. Tratam-se de fetos pequenos por uma condição extrínseca à placenta.
A função do obstetra passa por identificar um crescimento abaixo do ideal, determinar a causa e severidade do mesmo, conferenciar com neonatologistas e com uma monitorização fetal apertada, selecionar o timmingideal de nascimento e via de parto mais apropriada para este feto.
Assim, para um correcto diagnóstico e orientação temos de conjugar as seguintes variáveis: ecomorfologia detalhada, biometria para determinação do peso fetal, estudo anatómico fetal, avaliação do índice de líquido amniótico, fluxometria doppler da artéria umbilical, artéria cerebral media, ductos venoso e veia umbilical.
FISIOPATOLOGIA
A fisiopatologia do RCIU mais aceite na actualidade é a vasoconstrição crónica das artérias espiraladas devido à invasão trofoblástica inadequada. Nas fases iniciais desta situação patológica, o feto adapta-se diminuindo a velocidade de crescimento e captando de uma maneira mais eficiente o oxigénio (desenvolvendo nomeadamente policitemia). No entanto, se a situação se mantem, o feto entra numa fase de hipoxia que se pode prolongar durante semanas. Abaixo de determinado nível de saturação de oxigénio são activados uma serie de quimiorreceptores que poem em marcha todo um conjunto de alterações hemodinâmicas que por sua vez têm como principal função preservar o aporte de oxigénio aos órgãos nobres; é a chamada centralização. São sinais desta situação:
A vasodilatação cerebral ou brain sparing.
O oligohidramnios que se observa nos fetos com insuficiência placentar.
A redistribuição cardíaca, que consiste na instalação de uma situação que não é fisiológica. Ou seja, o ventrículo esquerdo vai irrigar um território com baixa resistência que é o cérebro, enquanto que o direito vai irrigar um território de progressivamente alta resistência, a placenta.
Se a situação persiste, o feto poe em marcha mecanismos de obtenção de energia por via anaeróbia, a partir da glicose, que levam à acidose. Entre os órgãos mais afectados nesta fase está o coração fetal, visto que as fibras do miocárdio sofrem fenómenos de necrose e são substituídos por tecido fibroso, o que, por sua vez vai induzir uma alteração da função diastólica. Se esta situação persiste a morte fetal ocorre em horas.
CONDUTA OBSTETRICA
Diagnóstico
A monitorização fetal óptima dos fetos com RCIU ainda não foi estabelecida. Uma avaliação ecográfica com biometrias seriadas, perfil biofísico fetal, doppler arterial e venoso, estudo citogenetico para despiste de cromossomopatias e um estudo analítico para despiste de infecção fetal são as armas actualmente existentes à nossa disposição. O que nos propomos é tentar identificar os fetos que estão em risco in útero e que poderão beneficiar de um parto pré termo. Este diagnóstico atempado é de grande importância, inclusive em termos de saúde pública, isto porque trabalhos recentes têm demonstrado que o risco de complicações perinatais aumenta até 4 vezes nas gravidezes em que não é detetado a RCIU durante a gravidez.
O diagnóstico passa então por:
Correcta anamnese tendo como objectivo a identificação dos factores de risco. Apesar de estes serem múltiplos e nem sempre bem definidos, podemos identificar determinadas situações associadas a um aumento do risco de RCIU, tais como:
-Historia previa de RCIU ou morte perinatal-Fatores ambientais, tais como álcool, tabaco e outras drogas
-Infecções
-Doenças maternas como trombofilias, obesidade, diabetes HTA e doenças renais e vasculares.
Exame físico através da palpação abdominal e determinação da altura uterina têm uma sensibilidade muito baixa, cerca de 30%.
Ecografia obstétrica é o método standard de avaliação do crescimento fetal. Requer no entanto uma correcta determinação da idade gestacional com ecografia precoce.
Distinção entre RCIU e FCP
A distinção entre estes 2 grupos de fetos é essencial do ponto de vista clínico visto que ambos vão apresentar grandes diferenças no prognóstico, evolução e orientação ante natal. Os parâmetros utilizados para diferenciar estes dois grupos são:
Os fetos com um PFE inferior ao percentil 3 são considerados como sofrendo alterações severas do crescimento fetal, pelo que são considerados, na maioria dos protocolos, como RCIU independentemente de outros critérios.
A fluxometria da artéria umbilical (AU) é o parâmetro essencial para distinguir entre RCIU e FCP, ou, por outras palavras entre risco e ausência de risco. Os motivos pelos quais a maioria dos protocolos utiliza este parâmetro para diferenciar estes dois grupos resumem-se a quatro pontos:
-Todos os ensaios randomizados que demonstraram o benefício do Doppler nos fetos com suspeita de RCIU realizaram-se a nível da artéria umbilical.
-Na presença de um fluxo umbilical normal, a ocorrência de mortalidade perinatal é um evento excepcional.
-Um fluxo anormal na AU é um bom estratificador do risco de resultados perinatais adversos e alterações do desenvolvimento psicomotor.
-Existe evidência de que fetos pequenos com Doppler da AU normal não requerem habitualmente internamento hospitalar e não necessitam de controle intensivo.
O crescimento fetal é diretamente influenciado por fatores individuais, tendo cada feto o seu próprio potencial de crescimento. Assim, entre estas variáveis estão a raça, a idade, a paridade, o peso e altura materna, o sexo do feto e o número de fetos. Existe uma ampla e crescente evidencia dos benefícios de ajustar as curvas de crescimento às características individuais. Estes valores ajustados reduzem o número de falsos diagnósticos de RCIU.
Profilaxia e Tratamento
Apesar da maioria dos estudos concluírem que o tratamento com ácido acetilsalicílico diminui o risco de desenvolvimento de pré-eclampsia, não se demonstrou que diminui a incidência de baixo peso ao nascer, nem de RCIU. Ensaiaram-se múltiplos tratamentos para o RCIU, entre eles o repouso absoluto, hiperoxigenação materna, β-mimeticos, heparina de baixo peso molecular, dadores de óxido nítrico, suplementos nutricionais e expansores do plasma, no entanto nenhum deles demonstrou um efeito benéfico pelo que não estão recomendados.
Controle do bem-estar fetal
O controle do bem-estar fetal tem como objectivo decidir qual é o momento otimo para finalizar a gestação, que será aquele em que os riscos de continuar a gravidez deixando o feto num ambiente hostil serão maiores que os riscos da prematuridade. A integração das diferentes provas de bem-estar fetal parece ser a estratégia mais adequada, visto que se complementam. Estas dividem-se em marcadores crónicos e agudos:
Crónicos - Alteram-se nas fases de hipoxemia fetal e podem persistir alterados durante semanas.
Agudos - Alteram-se na fase de acidose e costuma preceder a morte fetal em horas a dias.
Marcadores crónicos
Artéria umbilical – As alterações a nível da artéria umbilical são secundárias ao processo de vasoconstrição que ocorre nas artérias espiraladas terciários (26). O fluxo ao nível da artéria umbilical apresenta uma resistência crescente ao longo de deterioração fetal, pelo que em estadios avançados se observa ausência e posteriormente inversão do fl uxo diastólico. Cerca de 80% dos fetos apresentam fluxo diastólico nulo duas semanas antes do feto mostrar sinais de acidose (27). Por outro lado outros estudos mostram que 40% dos fetos com acidose apresentam fluxo diastólico invertido (27). Este aparece cerca de uma semana antes dos marcadores agudos pelo que é considerado por alguns autores como um marcador subagudo (27) . Ainda que a associação entre fluxo invertido com acidose e maus resultados perinatais esteja amplamente descrita (com sensibilidades e especificidades de cerca de 60%), grande parte desta associação explica-se pela alteração concomitante dos marcadores agudos e pela prematuridade extrema. No entanto, uma atitude expectante num feto com fluxo diastólico invertido e ausência de marcadores de sofrimento fetal agudo é controverso (28).
Artéria cerebral media (ACM) – As alterações a nível da ACM refletem o que foi já definido como vasodilatação cerebral. O aumento do diâmetro vascular reduz a impedância e condiciona um aumento das velocidades diastólicas, com redução dos Índices de Pulsatilidade (IP) das artérias cerebrais. O seguimento do Doppler da ACM durante o processo de deterioração fetal demonstra que este parâmetro altera-se de maneira progressiva sem se observar nenhum ponto de inflexão (29). Em 80% dos fetos observa-se vasodilatação cerebral duas semanas antes da alteração dos marcadores agudos (27). Neste momento é objeto de debate e investigação se a vaso-dilatação cerebral é unicamente um fenómeno adaptativo do feto sem repercussões posteriores no seu desenvolvimento psicomotor. Existem resultados controversos, porem parece observar-se que os fetos que apresentaram esta alteração manifestam posteriormente um desenvolvimento psicomotor inferior ao normal (30).
Avaliação do liquido amniótico (LA) – O mecanismo fisiopatológico da existência de oligohidramnios nos casos de RCIU não está claramente definido, podendo ser em parte explicado pela diminuição da perfusão renal em situações de centralização hemodinâmica. A quantidade de LA em fetos com RCIU vai diminuindo progressivamente(29). Em 20% dos casos observamos oligoamnios uma semana antes da alteração dos marca-dores agudos (31). Um indice de líquido amniótico inferior a 5cm associa-se a indice de Apgar patológico aos 5m, no entanto não se conseguiu demonstrar associação com acidose (32).
Marcadores agudos
Veias precordiais – Perante a persistência de hipoxia crónica desenvolve-se uma situação de acidose metabolica que provoca a destruição das fibras miocardicas. Esta situação implica uma diminuição de distensibilidade do miocárdio com aumento das pressões telediastolicas, portanto, uma maior dificuldade no retorno venoso ao coração direito. A associação entre as alterações a nível dos fluxos venosos e os resultados perinatais adversos é clara e independente da idade gestacional (33). A sensibilidade e especificidade para a mortalidade perinatal é cerca de 70% e 50% respectivamente (33).
Cardiotocografia (CTG) – Em situações graves de hipoxemia, estímulos provenientes de quimio e barorreceptores periféricos que geram estímulos parasimpaticos que provocam desacelerações no registo cardiotocografico. Para além disso, em estadios avançados de compromisso fetal, o efeito da acidose sobre o SNC e o efeito direto sobre a atividade cardíaca favorecem o aparecimento de desacelerações e a perda de variabilidade. A CTG tem capacidade para detetar fetos doentes em cerca de 90% dos casos, porem com uma especificidade muito baixa (cerca de 40%), devendo assim complementar-se com a informação do perfil biofísico. Apesar de CTG apresentar traçados não reactivos em fases muito iniciais do processo de deterioração do feto com RCIU (31), a perda da variabilidade precoce ocorre só uns dias antes da descompensação fetal, coincidindo com alterações dos fluxos venosos (29), sugerindo as alterações mais agudas do atingimento fetal que ocorrem na fase terminal da deterioração fetal.
Perfil Biofísico Fetal (PBF) – Com a persistência da hipoxia produz-se uma diminuição progressiva da quantidade de líquido amniótico, sendo este um parâmetro do perfil biofísico que reflete cronicidade. Em estadios avançados de hipoxia um outro fenómeno que se observa é o desaparecimento dos movimentos respiratórios. Finalmente quando aparece a acidose há atingimento do tónus e dos movimentos grosseiros. A associação entre o perfil biofísico e a hipoxia é pobre ao contrário da correlação com a acidose que parece aceitável, sendo que os parâmetros melhor correlacionados são o tónus e os movimentos grosseiros. A associação entre PBF alterado e a mortalidade perinatal foi confirmado unicamente em estudos observacionais, ainda que
o número de casos confira validade aceitável. Apesar do PBF apresentar uma sensibilidade muito boa tanto para a mortalidade como para a morbilidade perinatal, a sua eficácia clínica vê-se limitada pela taxa de falsos positivos que ronda os 50%, sendo a CTG e o VLA de avaliação mais subjetiva e por consequência os parâmetros individuais que mais agravam a especificidade.
PROPOSTA DE PROTOCOLO DE ACTUAÇÃO
Diagnóstico provável: FETO CONSTITUCIONALMENTE PEQUENO
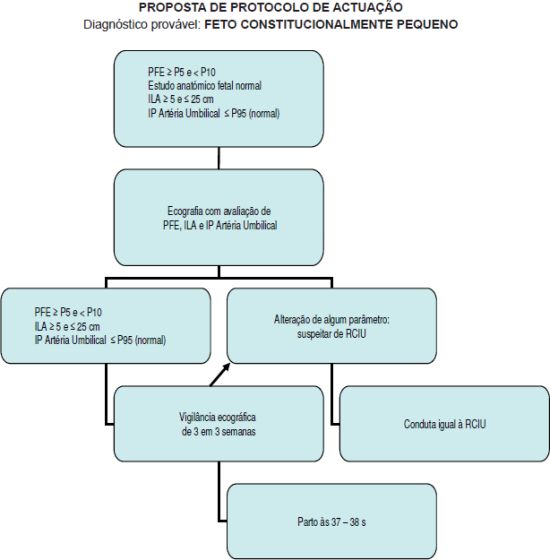
Imagem 1
Diagnóstico provável: RESTRIÇÃO DE CRESCIMENTO INTRA-UTERINO
Se:
PFE < P5
ou
PFE ≥ P5 com ILA < 5 ou > 25 cm e/ou IP Artéria Umbilical > P95
Nestes casos propôr internamento onde devem ser efectuados/as:
Estudo da causa
· Estudo analítico (hemograma, plaquetas, funções renal e hepática, sumário de urina, urina de 24h)
· Serologias maternas (CMV, rubéola, toxoplasmose, sífilis, varicela)
· Ponderar cariótipo fetal (IG < 28-32s, hidrâmnios)
· Ecocardiografia fetal
Vigilância
· CTG diário
· ILA 2 a 7x semana
· Perfil Biofísico (PB) 2 a 7x semana
- ILA, CTG, Movimentos fetais, Tónus muscular, Movimentos respiratórios
· Fluxometria Doppler 2 a 7x semana
- artérias umbilical (AU) e cerebral média (ACM), ductus venosus (DV) e/ou veia umbilical (VU)
· Biometrias fetais (15-15 dias)
Atitude
· Repouso
· Indução da maturidade pulmonar segundo protocolo do serviço
Programação do parto
· Condição fetal
· Idade gestacional
· Patologia materna
< 28s
· Mais provável ser secundária a anomalia cromossómica/ genética
· Morbilidade/mortalidade associada à prematuridade extrema
· Cada dia in utero aumenta a probabilidade de sobrevivência
· Problemático o uso do CTG
· Atitude intervencionista quase só por motivos maternos
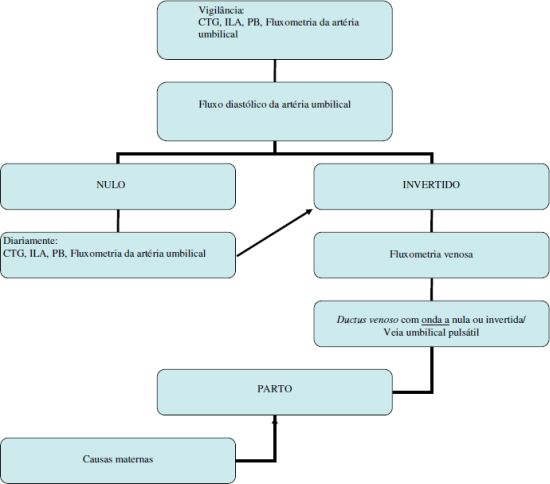
Imagem 2
≥ 28s e < 34s
· Mortalidade neonatal diminui até às 32s e a morbilidade até às 34s
· Morbimortalidade maior nos fetos com RCIU
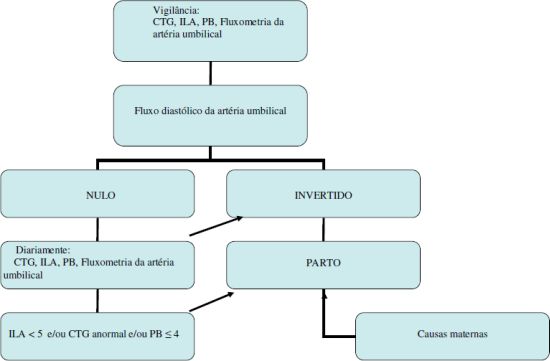
Imagem 3
≥ 34s
· Melhor prognóstico neonatal
· Grande percentagem de fetos Constitucionalmente Pequenos
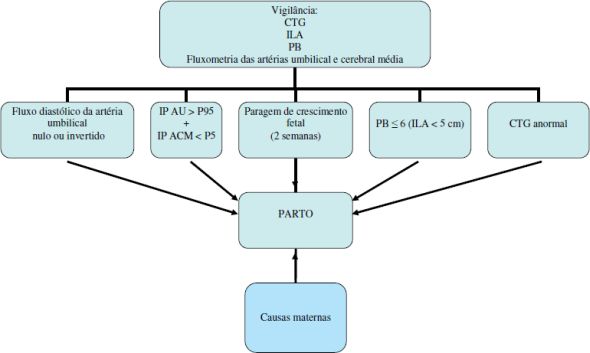
Imagem 4
PARTO
· Via de parto: vaginal/cesariana (ponderar em cada caso)
· Gasimetria do sangue do cordão umbilical
· Pedir sempre exame histológico da placenta
· Se RCIU precoce e grave e de causa desconhecida:
- Cariótipo da placenta
Após alta hospitalar referenciar para a Consulta de RCIU
· Rever toda a informação
· Solicitar exames considerados necessários
· Aconselhar sobre futuras gravidezes
BIBLIOGRAFIA
1. Gardosi J., Clinical Stategies for Improving the detection of Fetal Growth Restricion, Clin Perinatol 38 (2011) 21-31 [ Links ]
2. Todros T., Piccoli E., Cardaropi S., Guiot C., Gaglioti P., Oberto M., Vasario E., Caniggia I., Review: Feto-placental vascularization: a multifaceted approach, Placenta 32, Supplement B.Trophoblast Research, Vol.25 (2011) S165-S169 [ Links ]
3. Ross G Michael, Mansano R Z (Feb 9 2011), Fetal Growth Restricion, http://emedicine.medscape.com
4. Divon M Y, Ferber A (Jun 15 2010), Diagnosis of fetal growth restricion, http://www.uptodate.com [ Links ]
5. Divon M Y, Ferber A (Sept 27 2010), Overview of causes of and risk factors for fetal growth restricion, http://www.uptodate.com [ Links ]
6. Resnik R (Sept 24 2010), The fetal biophysical profile, http://www.uptodate.com
7. Manning F A (May 2010), Fetal growth restricion: evaluation and management, [ Links ] http://www.uptodate.com
8. Mandy G T (Feb 20 2009), Small for gestational age infant Links ]uptodate.com" target="_blank">http://www.uptodate.com
9. Best Practice & Research Clinical Obstetrics and Gynaecology 23 (2009), IUGR: a contemporary review, 739-855 [ Links ]
10. Best Practice & Research Clinical Obstetrics and Gynaecology 23 (2009), IUGR: a contemporary review, A1-A7 [ Links ]
11. Grivell RM, Wong L, Bhatia V (2009), Regimens of fetal surveillance for impaired fetal growth (review), The Cochrane Library [ Links ]
12. Chauhan S P, Gupta L M, Hendrix N W, et al. Intrauterine growth restricion: comparison of ACOG practice bulletin with other national guidelines, Am J Obstet Gynecol 2009; 200:409. e1-409.e6 [ Links ]
13. Gómez Roig MD, Crecimiento intrauterino restringido, XVI Curso Intensivo de Formación Continuada Medicina Materno-Fetal (2009), 125-131, Aula Clinic, Barcelona [ Links ]
14. Miller J, Turan S, Baschat A A, Fetal Growth Restricion, Semin Perinatl 2008; 32:274-280 [ Links ]
15. Proposta de protocolo diagnóstico e conduta clínica nos fetos com restrição do crescimento, Serviço de Medicina Materno-Fetal da Maternidade Dr. Alfredo da Costa [ Links ]
16. Gilson G J, Fetal Growth Restricion, E10-E16
17. Gardosi J, New Definition of Small for Gestational Age based on Fetal Growth Potential, Horm Res 2006; 65 (suppl 3): 15-18 [ Links ]
18. Clinical Obstetrics & Gynaecology, Second Edition, Magowan B, Owen P, Drife J, Saunders Elsevier, Small babies, 283-289 [ Links ]
19. Medicina Materno-Fetal, 3ª Edição, Mendes da Graça L, Lidel, Restrição de Crescimento intra-uterino, 421-428 [ Links ]
20. Wieneroither H, Steiner H, Tomaselli J, et al. Intrauterine blood fl ow and long-term intellectual, neurologic, and social development. Obstet Gynecol 2001;97:449 [ Links ]
21. Baschat AA. Neurodevelopment following fetal growth restriction and its relationship with antepartum parameters of placental dysfunction. Ultrasound Obstet Gynecol 2011;37:501 [ Links ]
22. Figueras F, Cruz-Martinez R, Sanz-Cortes M, et al. Neurobehavioral outcomes in preterm, growth restricted infants with and without prenatal advanced signs of brain-sparing. Ultrasound Obstet Gynecol 2011; 38:288 [ Links ]
23. Eixarch E,Meler E, Iraola A, et al. Neurodevelopmental outcome in 2-year-old infants who were small-for gestacional age term fetuses with cerebral fluid flow redistribution. Ultrasound Obstet Gynecol 2008; 32:894 [ Links ]
24. Kanaca-Gantenbein C, Mastorakos G, Chrousos GP. Endocrine – related causes and consequences of intrauterine growth retardation. Ann N Y Acad Sci 2003; 997:150 [ Links ]
25. Kaijser M, Bonamy AK, Akre O, et el. Perinatal risk factors for ischemic heart diseases: disentangling the roles of birth rate and preterm birth. Circulation 2008; 117:405
26. Sebire NJ, Umbilical artery Doppler revisited; Patholophysiology of changes in intrauterine growth restriction reviewed. Ultrasound Obstet Gynecol 2003; 21:419-22 [ Links ]
27. Ferrazzi E, Bozzo M, Regano S, et al. Temporal sequences of abnormal doppler changes in the peripheral and central circulation systems of the severraly growth restricted fetus. Ultrasound Obstet Gynecol 2002; 19:140-6 [ Links ]
28. Thornton JG, Hornbuckle J, Vail A, Spinglehalter DJ, Levene M. Infant well-being at two years of age in the growth restriction intervention trial: multicentric randomized controlled trial. Lancet 2004; 364:513-20 [ Links ]
29. Hesher K, Bilardo CM, Stigter RH, et al. Monitoring of fetuses with intrauterine growth restriction: a longitudinal study. Ultrasound Obstet Gynecol 2001; 18 564-70 [ Links ]
30. Scherjon S, Briet J, Oosting H, Kok J. The discrepancy between maturation of visual – evoked potentials and cognitive outcome at five years in very preterm infants with and without hemodynamic signs of fetal brain sparing. Pediatrics 2000; 105: 385-91 [ Links ]
31. Baschat AA, Gembruch U, Harman CR. The sequence of changes in Doppler and biophysical as severe fetal growth restrictions worsens. Ultrasound Obstet Gynecol 2001; 18: 571-7 [ Links ]
32. British College of Obstetrician and Gyanecologist. The investigation and management of The Small-for-Gestational Age Fetus. Green-Top Guidelines 2002 (Guideline nº31) [ Links ]














