Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Acessos
Acessos
Links relacionados
-
 Similares em
SciELO
Similares em
SciELO
Compartilhar
Nascer e Crescer
versão impressa ISSN 0872-0754
Nascer e Crescer vol.25 no.2 Porto jun. 2016
CASOS CLÍNICOS / CASE REPORTS
Toxocara canis, o passageiro clandestino de um voo
Toxocara canis, a stowaway that crossed the sky…
Andreia Filipa MotaI; Virgínia MachadoI; Sofia PeçasI; Vera ViegasI; Alexandra EmílioI; Marisa VicenteI
I S. de Pediatria, Centro Hospitalar de Setúbal. 2910-446 Setúbal, Portugal. andreiafilipam.mota@gmail.com; v.machado@outlook.com; sofiappecas@gmail.com; vera.r.viegas@gmail.com; alexandraisemilio@gmail.com; emarisav@gmail.com
RESUMO
A toxocarose humana é uma helmintozoonose, frequente em idade pediátrica, transmitida por ingestão de ovos presentes no solo. Crianças residentes em zonas com condições de sanea- mento precárias, que coabitem com animais de estimação não desparasitados e que apresentem geofagia, incorrem em elevado risco de desenvolvimento de toxocarose.
Apresenta-se o caso de um rapaz de 5 anos, residente até há um mês em Cabo Verde, que recorreu ao serviço de urgência por febre, tosse e síndrome de dificuldade respiratória. Analiticamente destacava-se leucocitose e eosinofilia. A tomografia computorizada torácica revelava hiperdensidade irregular na base pulmonar direita. Perante serologia do Toxocara canis sugestiva de infeção aguda admitiu-se o diagnóstico de larva migrans visceral, atuando-se em conformidade terapêutica.
A síndrome de larva migrans visceral atinge diversos órgãos, sendo o envolvimento pulmonar grave raro. Apesar de maiori- tariamente assintomática e autolimitada, quando sintomática a apresentação inespecífica e as limitações da interpretação serológica dificultam o diagnóstico e a abordagem terapêutica adequada.
Palavras-chave: Zoonose; toxocarose; eosinofilia; pneumonia.
ABSTRACT
Human toxocariasis is primarily a soil-transmitted helminth zoonosis, common in children. Children living in areas with poor sanitary conditions, in close contact with pets not dewormed and with geophagia, are at high risk of toxocariasis.
A 5-year-old boy, who lived in Cape Verde until a month ago, presented at our emergency department with fever, cough and respiratory distress. His lab tests showed leukocytosis and marked eosinophilia. Thoracic tomography-computer scan showed an irregular hyperdensity in the right lung base. The Toxocara canis serology suggested acute infection. We admitted visceral larva migrans syndrome, and started the adequate therapeutic.
Visceral larva migrans syndrome may involve several organs, however severe pulmonary disease is rare. Despite being mainly asymptomatic and self-limited, if there are symptoms, its non- specificity associated to limitation of serological results makes the diagnosis and the appropriate approach difficult.
Keywords: Zoonosis; toxocariasis; eosinophilia; pneumonia.
INTRODUÇÃO
A toxocarose humana é uma helmintozoonose multissistémica, causada por um nemátodo intestinal pertencente ao género Toxocara, cujas espécies mais frequentes são o T. canis e o T. cati, dada a proximidade dos hospedeiros definitivos com o Homem.1-5, 6
Ainda que desconhecida a real prevalência da toxocarose, principalmente pelo subdiagnóstico, estima-se que seja eleva- da, com distribuição mundial assimétrica, sendo maior na baía do Mediterrâneo e nos países tropicais e subtropicais.6,9 A prevalência nacional é igualmente desconhecida.6
A habitação em zonas com condições sanitárias precárias, próximo de animais não desparasitados, associado a práticas de pica e geofagia são os principais fatores de risco para a ocorrência de toxocarose, sendo as crianças a principal população afetada.1,2,4-6,9,11
O Homem é um hospedeiro acidental, infestando-se pela ingestão de ovos presentes no solo ou em alimentos contaminados mal cozinhados.1-6 A impossibilidade de maturação da larva no sistema digestivo do hospedeiro humano promove a sua migração para os diferentes tecidos, condicionando nestes a reação inflamatória local (de gravidade variável), que é a base da toxocarose .24,10 Nos adultos, a maioria das infestações são assintomáticas, enquanto nas crianças são muitas vezes sintomáticas, dependendo os sintomas da díade: resposta imunológica do hospedeiro-inócuo parasitário.2,3,5,9-11 Reconhecem-se três síndromes principais: larva migrans visceral (LMV), se envolvimento de órgãos abdominais, promovida por grandes inóculos parasitários ou infestações repetidas; toxocarose oculta, semelhante à anterior, mas cuja clínica é ligeira ou inexistente; e larva migrans ocular (LMO), restrita ao globo ocular e nervo ótico.2,5,6,9,10
A eosinofilia define-se por mais de 500 eosinófilos/μL no san- gue periférico, e surge com frequência na doença atópica, infestações parasitárias, doenças do tecido conjuntivo e vasculites, pelo que a sua prevalência e etiologia são região-dependentes.1
Os autores apresentam um caso de LMV com envolvimento pulmonar, pela sua raridade, não obstante a frequência da infes- tação, destacando a dificuldade diagnóstica.
CASO CLÍNICO
Rapaz de 5 anos, natural de Cabo Verde, residente em Por- tugal no mês anterior ao internamento. Aparentemente assintomático até duas semanas antes do internamento, altura em que iniciou rinorreia mucosa, tosse acessual irritativa de agravamento progressivo e diarreia incaraterística e autolimitada sem repercus- são no estado geral e sem necessidade de recurso aos serviços de saúde. Uma semana antes do internamento, iniciou dispneia e vómitos pós-prandiais, pelo que foi admitido no serviço de pediatria. Negava febre, dor abdominal, anorexia, perda ponderal ou alterações oftalmológicas, bem como adoção de medidas farmacológicas. No país de origem habitava em zona rural com condições precárias de saneamento e higiene, mantendo contacto diário com animais domésticos (cães e gatos) não desparasitados, que tinham acesso livre às áreas de cultivo. Referia, no entanto, consumo de água potável e alimentos bem cozinhados.
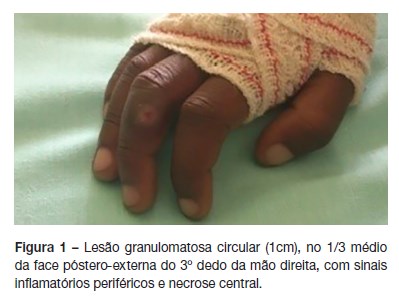
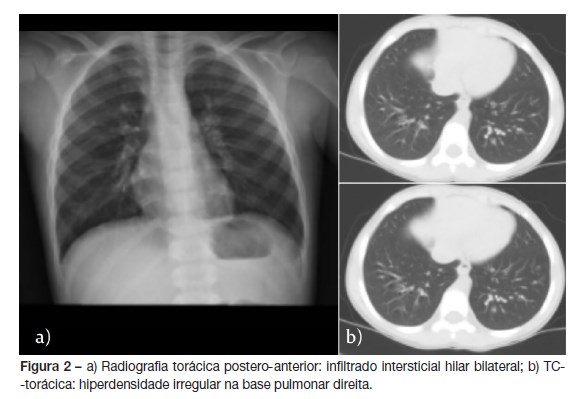
Sem antecedentes pessoais de pica, geofagia, alergia ou outros nosológicos. À admissão apresentava-se queixoso, com acessos de tosse espástica, polipneico, tiragem global e hipoxémia (saturação periférica [FiO 21%] = 88%); palidez mucocutânea; diminuição do murmúrio vesicular no terço inferior direito e escassos fervores subcrepitantes dispersos no hemitórax direito, aumento do tempo expiratório; lesão granulomatosa circular (1cm), no 1/3 médio da face póstero-externa do 3º dedo da mão direita, com sinais inflamatórios periféricos e necrose central (figura 1); gânglios palpáveis infracentimétricos de limites regulares, consistência elástica, móveis nos planos adjacentes, dolorosos à palpação e sem alterações da pele suprajacente nas cadeias cervicais; abdómen mole, depressível e indolor, não se palpando organomegálias, nomeadamente baço ou fígado. Restante exame objetivo sem alterações, incluindo exame neurológico. Analiticamente destacava-se Hb 11,2g/dL; leucócitos 33.700/uL com 70% neutrófilos e 17% (5.729/uL) eosinófilos; esfregaço de san- gue periférico: marcada eosinofilia, sem blastos; pCr 0,52mg/dL; VS 65mm/1h; hipergamaglobulinémia; IgE total 2221kU/L; estudo da autoimunidade sem alterações. Hemocultura, prova de Mantoux e serologias para Mycoplasma pneumoniae, Chlamydophila pneumoniae, citomegalovírus, vírus Epstein-Barr, da imunodeficiência humana 1 e 2 e hepatites virais negativas. Serologias para Toxocara canis e Ascaris suum sugestivas de infeção aguda pelo método de ELISA, como posterior confirmação pelo método de Westerblot. Radiografia torácica: infiltrado intersticial hilífugo bilateral. Tomografia computorizada torácica (TC-torácica): hiperden- sidade irregular na base pulmonar direita (figura 2). Radiografia da mão direita sem sinais de osteomielite. Eletrocardiograma: ritmo sinusal, sem outras alterações. Ecografia abdominal sem organomegálias ou outras alterações. Admitiu-se LMV, tendo cumprido cinco dias de albendazol (10mg/Kg/dia, per os), com resolução clínica, analítica e imagiológica. Em ambulatório, por reaparecimento de eosinofilia, repetiu ciclo terapêutico com albendazol, por intolerância gástrica ao mebendazol. Após oito meses, mantém eosinofilia periférica ligeira, apesar de clinicamente estável e sem alterações no exame objetivo.
DISCUSSÃO
Em 1950, Wilder identifica e descreve pela primeira vez o Toxocara num granuloma retiniano de uma criança.6 Dois anos mais tarde, Beaver et al descrevem o primeiro caso de LMV, após identificação de larvas do género T. canis no fígado de crianças com hepatoesplenomegália e hipereosinofilia.2,6,10,11 Posteriormente, vários outros parasitas foram associados à LMV.2,10
O Toxocara é um nemátodo pertencente à ordem Ascaridiodea e à família Toxocaridae, cujas espécies T. canis e T. cati têm como hospedeiros definitivos o cão e o gato, respetivamente.6-8 Quando o Toxocara alcança o tubo digestivo do hospedeiro definitivo, após a ingestão de ovos presentes no solo ou no leite das progenitoras, ocorre a eclosão das larvas, que podem permanecer viáveis neste meio até 25 anos.6 Após a eclosão, as larvas podem migrar para os diferentes tecidos, mantendo-se na sua forma ativa e alcançando a capacidade reprodutiva após 60 a 90 dias ou ficando quiescentes (hipobiose). 6-8 Os ovos são excretados nas fezes do animal infestado, tornando-se infestan- tes (embrionados) após, pelo menos uma semana de incubação no solo, local onde podem permanecer ativos durante vários anos.2,5,6,11
O Homem é um hospedeiro acidental da infestação por To- xocara, sendo mais frequente a infestação por T. canis, consequência dos hábitos de defecação do cão.2,6,11 A pica e a geo- fagia, comuns em crianças, são comportamentos promotores desta ingestão e consequente infestação, particularmente se associados a coabitação com cães e gatos não desparasitados e a condições socioeconómicas e de higiene precárias.6,8 No caso clínico descrito, apesar de ser negado a existência de pica ou geofagia, o ambiente onde a criança residira apresentava caraterísticas socioeconómicas desfavoráveis, bem como fatores de risco (cães e gatos não desparasitados e condições de higiene deficitárias), o que levou à suspeita diagnóstica. Apesar de também negado na história clínica o consumo de alimentos mal cozinhados, os animais tinham acesso aos terrenos de cultivo, o que, como descrito na literatura, aumenta o risco da transmis- são do parasita.6,7
A ingestão de ovos embrionados pelo Homem permite a migração da larva, através da parede do tubo digestivo, para os vários órgãos, promovendo inflamação e infiltração eosinofílica tecidual local.6,8,10,11 A clínica traduz essencialmente a resposta inflamatória do tipo alérgico, e não a infestação, sendo a sua variabilidade espelho dos múltiplos órgãos que podem ser atingidos. 3,6-11
A constelação de sinais e sintomas clássicos, dor abdominal, anorexia, febre, tosse, sibilância e hepatomegália, resultado da migração da larva para o pulmão e fígado, é atualmente rara nos países ocidentais.2,5,6,9,10,12,13
Analiticamente os achados mais comuns são leucocitose, hipereosinofilia (>2.000/uL) e hipergamaglobulinémia, podendo também ocorrer aumento da IgE total e específica. No caso clínico descrito, a avaliação clínica, a história epidemiológica, a serologia sugestiva de infeção aguda, os achados laboratoriais e imagiológicos excluíram o envolvimento hepático e neurológico, mas a sintomatologia respiratória, tosse espástica e a síndro- ma de dificuldade respiratória, sugeriram a resposta inflamatória pulmonar no hospedeiro, cuja dissociação clínico-radiológica conduziu à realização de TC-torácica, qual evidenciou hiperdensidade irregular na base pulmonar direita.1,3,4 6,12,13 Ainda que a imagiologia não seja patognomónica, pode fornecer dados que apoiem o diagnóstico, como verificado no presente caso clínico, estabelecendo-se assim o diagnóstico de LMV com componente pulmonar.1,6
O diagnóstico definitivo no hospedeiro habitual baseia-se na deteção de ovos ou larvas do parasita causador. No entanto no Homem, hospedeiro acidental, não ocorre maturação da larva, tornando-se a pesquisa de ovos nas fezes inapropriada.6,8,10,11 Paralelamente, a biópsia do tecido inflamado não está recomendado por rotina, por ser um método invasivo e pelo elevado número de falsos negativos.6,10 Deste modo, a positividade dos testes serológicos, cuja especificidade e sensibilidade é respe- tivamente 92% e 72%, consideram-se um método indireto globalmente aceite para o diagnóstico, que pode ser confirmado por western blot, e complementado pela técnica de polymerase chain reaction para a distinção entre infeção aguda e infeção no passado.2,3, 6,11,15 A IgE específica anti-toxocara encontra-se au- mentada em doentes sintomáticos, podendo também ser utilizada como método diagnóstico e seguimento após tratamento.6,8
São comuns as reações cruzadas entre o T. canis e o A. suum, agente frequentemente presente nas fezes de crianças, nomeadamente das oriundas de países tropicais, o que poderá ter ocorrido no caso descrito. No entanto, a existência de IgM positiva na primeira serologia para T. canis, que negativou seis semanas após terapêutica, mantendo-se a positividade para as IgG, associada aos outros achados analíticos e à clínica, estabeleceu o diagnóstico.5,15
No passado, dada a variabilidade clínica e a limitação dos testes de diagnóstico, a toxocarose foi considerada rara. Atualmente, a correlação da investigação epidemiológica com a avaliação clínica, laboratorial e imagiológica traduz-se no aumento da sua prevalência a nível mundial, apesar de se manter importante variação geográfica (3 a 86%).2,14 Não obstante o aumento de prevalência, particularmente em crianças, quadros clínicos graves, nomeadamente pneumonia intersticial hipoxemiante como no caso clinico descrito, são raros.3,11
Atualmente não existe consenso sobre o tratamento mais indicado para a infestação por Toxocara.6 Muito embora, o prognóstico da infestação por Toxocara sob a forma de LMV seja favorável, há quadros clínicos exuberantes e graves, sendo lícito tratar a doença aquando do seu diagnóstico.6,8,10,11 Esquemas terapêuticos com albendazol e mebendazol são muitas vezes adotados, apesar de não estarem aprovados com esta finalidade, desconhecendo-se a duração ideal do tratamento, que varia entre cinco a 21 dias.3,6,9,11 A terapêutica de primeira linha estabelecida em protocolos nacionais é o albendazol (10mg/Kg/ dia), em duas tomas diárias, durante cinco dias (dose máxima 400mg/dose), tal como foi realizado no caso clínico descrito. O mebendazol na dose de 20 a 25mg/kg/dia, durante três a cinco dias, é uma alternativa (dose máxima 200mg/dose).6 Casos em que a infestação parasitária seja grave podem exigir o recurso a múltiplas terapêuticas anti-helmínticas.10
Se associada à LMV houver manifestações alérgicas exuberantes, pode ser necessário recorrer à corticoterapia para controlo sintomático, embora esta abordagem não seja consensual.6,8 Atualmente mantém-se a opinião que a melhor opção terapêutica deverá ser estabelecida caso a caso.6
A suspeita diagnóstica neste caso clínico foi reforçada pela resolução da sintomatologia e das alterações imagiológicas após o curso terapêutico com albendazol, apesar de mantida a hipe- reosinofilia. A eosinofilia é o principal marcador de atividade da doença para seguimento pós-terapêutica, podendo no entanto, não ser totalmente objetiva, pelo que necessita da monitorização com o doseamento de IgE específica anti-Toxocara, o que permi- te evidenciar a persistência ou a resolução da infestação.2,6,7
Medidas preventivas à escala da comunidade, devem igualmente ser adotadas pela Saúde Pública de países ou regiões com elevada prevalência.
CONCLUSÃO
Em pediatria, a LMV é frequente, ainda que subdiagnosticada. Apesar do reconhecimento da elevada prevalência da infestação em animais coabitantes, e das precárias condições higiénico-sanitárias de algumas regiões, a prevalência mundial e nacional, em humanos, permanece baixa, uma vez que a maioria das infestações humanas são assintomáticas e resolvem espontaneamente. Deste modo, sempre que exista contexto epidemiológico sugestivo (condições socioeconómicas desfavoráveis, higiene precária, coabitação com animais domésticos não desparasitados ou residência em áreas de elevada prevalência), coexistência de pica ou geofagia, clínica favorável e achados analíticos compatíveis (leucocitose, eosinofilia e hipergamaglobulinémia), a hipótese diagnóstica de LMV deverá ser considerada.
REFERENCIAS BIBLIOGRÁFICAS
1. Lim J-H. Foodborne eosinophilia due to visceral larva migrans: a disease abandoned. Journal of Korean Medical Sciences 2011; 27: 1-2. doi:10.3346/jkms.2012.27.1.1. [ Links ]
2. Stoicescu RM. Marked hypereosinophilia in a toddler: a case report. Journal of Medicine and Life 2011; 4: 105-8. [ Links ]
3. Mustafa D, Mehmet Ü, Fatma F, Selçuk K. Eosinophilic pneumonia due to Toxocariasis: an adult case report. Turkiye Parazitol Derg 2012; 36: 258-9. doi: 10.5152/tpd.2012.61. [ Links ]
4. Lim Y et al. Pulmonary Toxocariasis masquerading as metastatic tumor nodules in a child with osteosarcoma. Pediatr Blood Cancer 2009. 53: 1343–5. doi: 10.1002/pbc.22213. [ Links ]
5. Pinelli E, Herremans T, Harms MG, Hoek D, Kortbeek LM. Toxocara and Ascaris seropositivity among patients suspected of visceral and ocular larva migrans in the Netherlands: trends from 1998 to 2009. Eur J Clin Microbiol Infect Dis 2011; 30: 873–9. doi: 10.1007/s10096-011-11709. [ Links ]
6. Castelo TM, Dinis A, Rocha G. Toxocarose. Protocolo de Actuação. Acta Pediatr Port 2008; 39(4): 171-5. [ Links ]
7. Magnaval JF, Glickman LT, Dorchies P, Morassin B. Highlights of human toxocariasis. Korean J Parasitol. 2001;39:1-11. doi:10.3347/kjp.2001.39.1.1. [ Links ]
8. Despommier D. Toxocariasis : clinical aspects , epidemiology, medical ecology , and molecular aspects. Clin Microbiol Rev 2003;16:265-272. doi:10.1128/CMR.16.2.265. [ Links ]
9. Ecevit Ç, Bağ Ö, Vergin C, Öztürk A. Visceral larva migrans presenting with hypereosinophilia. Turkiye Parazitol Derg 2013; 37: 58-60. doi: 10.5152/tpd.2013.15. [ Links ]
10. Yu T, Zhao L-N, Fan M-J, Wu H, Chen Q-K. Visceral larva migrans associated with earthworm and gecko ingestion: a case report. Journal of Medical Case Reports 2012, 6: 21013. doi:10.1186/1752-1947-6-210. [ Links ]
11. Carvalho E, Rocha R. Toxocaríase: larva migrans visceral em crianças e adolescentes. J Pediatr (Rio J) 2011; 87: 100-110. doi:10.2223/JPED.2074. [ Links ]
12. Moreira-Silva SF, Rodrigues MG, Pimenta JL, Gomes CP, Freire LH, Pereira FEL. Toxocariasis of the central nervous system: with report of two cases. Rev Soc Bras Med Trop. 2004;37:169-174. doi:10.1590/S0037-86822004000200011. [ Links ]
13. Altcheh J, Nallar M, Conca M, Biancardi M, Freilij H. Toxocariasis: aspectos clínicos y de laboratorio en 54 pacientes. An Pediatría. 2003;58:425-431. doi:10.1157/13046522. [ Links ]
14. Turrientes MC et al. Visceral larva migrans in immigrants from latin america. Emerging Infectious Diseases 2011; 17: 1263-5. doi: 10.3201/eid1707.101204. [ Links ]
15. Nunes, Cáris Maroni et al. Cross-reactions between Toxocara canis and ascaris suum in the diagnosis of visceral larva migrans by western blotting technique. Rev. Inst. Med. trop. S. Paulo [online]. 1997, vol.39, n.5, pp. 253-256. Doi:10.1590/S0036-46651997000500002. [ Links ]
Endereço para correspondência
Andreia Filipa Mota
Serviço de Pediatria
Centro Hospitalar de Setúbal
Rua Camilo Castelo Branco
2910-446 Setúbal
Email: andreiafilipam.mota@gmail.com
Recebido a 01.12.2015 | Aceite a 17.02.2016














