Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Acessos
Acessos
Links relacionados
-
 Similares em
SciELO
Similares em
SciELO
Compartilhar
Medicina Interna
versão impressa ISSN 0872-671X
Medicina Interna vol.25 no.2 Lisboa jun. 2018
https://doi.org/10.24950/rspmi/original/268/2/2018
ARTIGOS ORIGINAIS / ORIGINAL ARTICLES
Estudo Retrospectivo Comparativo Entre Primo-Infecções e Recidivas em Enterocolite a Clostridium difficile
Retrospective Comparative Study Between Primary-Infection and Relapse of Clostridium difficile Disease
Cristiana V. Gonçalves1, Vasco Evangelista1, João F. Coelho1, Andreia S. Carlos1, António M. Baptista1, José P. Graça 1
1Serviço de Medicina Interna, Hospital Beatriz Ângelo, Loures, Portugal
RESUMO
Introdução: A enterocolite a Clostridium difficile é uma das mais preocupantes infecções da atualidade pela incidência, gravidade e frequência de recidivas
Métodos: Estudo retrospectivo, baseado nos registos dos doentes com infecção comprovada, internados no Hospital Beatriz Ângelo (18 meses). Os casos foram divididos em dois grupos: primo-infecção e recidiva. Foram avaliados: idade; sexo; local de aquisição da infecção; antibioterapia prévia; utilização prévia de inibidores da bomba de protões; critérios de gravidade: idade > 65 anos, leucócitos > 20 000/uL e creatinina > 1,5 vezes o valor basal do doente; antibioterapia efetuada; duração terapêutica; duração do internamento e mortalidade.
Resultados:A gravidade foi superior nas primo-infecções (leucócitos > 20 000/uL 21,3% vs 12,0%, creatinina > 1,5 vezes o valor basal 38,3% vs 20,8%) assim como a mortalidade (23,4% vs 4,0%). Embora a vancomicina em monoterapia ou em associação ao metronidazol esteja recomendada nas situações graves, nos doentes com primo-infecção e que apresentavam 2 ou 3 critérios de gravidade, o metronidazol isolado foi a escolha mais frequente (46,2% para 2 critérios e 57,1% para 3 critérios). Nas recidivas constatou-se maior utilização da vancomicina mesmo nos casos menos graves (100,0% para 0 critérios e 68,8% para 1 critério). A utilização de inibidores da bomba de protões foi superior nas recidivas (84,0% vs 65,2%).
Conclusão: Este estudo sugere maior gravidade e mortalidade nas primo-infecções; realça a importância de estadiar em gravidade de modo a optar pela melhor terapêutica e apoia a ideia de que os inibidores da bomba de protões possam ser factor de risco.
Palavras-chave: Clostridium difficile; Infecções por Clostridium; Inibidores da Bomba de Protões; Metronidazole; Recidiva; Vancomicina.
ABSTRACT
Introduction:Clostridium difficile infection has worryingly increased in incidence, severity and relapse rates.
Methods: An 18-month retrospective analysis was carried out based on the clinical records of patients with confirmed infection hospitalized in Beatriz Ângelo Hospital, Portugal. Subjects were divided into two groups: primary-infection and relapse. The following clinical characteristics were assessed: age, gender, community versus hospital acquired infection, previous antibiotic therapy, proton-pump inhibitors use, severity criteria (namely, > 65 years, leukocytes > 20 000/uL and creatinine > 1.5 above baseline), antibiotics used, duration of antibiotic therapy, hospital length-of- stay and mortality.
Results: Overall severity was higher in primary-infections (leukocytes > 20 000/uL 21.3% vs 12.0%, creatinine> 1.5 from baseline 38.3% vs 20.8%), as were patients mortality rates (23.4% vs 4.0%). Although vancomycin is recommended – in monotherapy or in association with metronidazole – in severe disease, our study showed that in patients with primary-infection plus 2 or 3 severity criteria, metronidazole alone was the most frequent choice (46.2% if 2 criteria present and 57.1% if 3 criteria present). In recurrent infections vancomycin was the initial choice even in less severe cases (100.0% if no criteria and 68.8% if 1 criteria present). Proton-pump inhibitors use was higher in relapses (84.0% vs 65.2%).
Conclusion:This study suggests that primary-infections comprise greater clinical severity and mortality; emphasizes the importance of a severity scoring system to assure appropriate antibiotic regimens and supports the idea that proton-pump inhibitors might be a risk factor.
Keywords:Clostridium Infections; Clostridium difficile; Metronidazole; Proton Pump Inhibitors; Recurrence; Vancomycin
Introdução
A enterocolite a Clostridium difficile é uma das mais preocupantes infecções da actualidade, não só pela sua incidência crescente associada a maior gravidade das infecções e a um aumento paralelo da mortalidade, mas também pela elevada frequência de recidivas após terapêutica.1,2
Estudos recentes sugerem que a infecção a Clostridium difficile superou os casos de Estafilococos aureus meticilino-resistentes tornando-se no agente infeccioso mais frequente no contexto de infecção associada aos cuidados de saúde.1,3
O aumento da incidência e da gravidade tem sido associado à emergência de estirpes virulentas, nomeadamente o ribotipo BI/NAP/027.2,4 Estas estirpes apresentam características que contribuem para a sua hipervirulência: são mais produtoras de toxinas5; podem produzir uma outra toxina recentemente identificada, a toxina binária, que parece agir de forma sinérgica com as toxinas A e B e são altamente resistentes às quinolonas, o que promove a sua selecção em ambientes onde se utilizam muito estes antibióticos.4,6 Acrescenta-se que o genoma deste microorganismo é altamente mutável e adaptável o que leva à emergência de novas estirpes epidémicas.7,8
Além disso, tem-se verificado um aumento da incidência de enterocolite a Clostridium difficile em populações previamente consideradas de baixo risco, como são os casos da população pediátrica,9,10 em particular em crianças submetidas a transplantes de órgãos sólidos, gastrostomia ou jejunostomia e, nas puérperas.1,11 Na verdade, a enterocolite por Clostridium difficile deixou de ser apenas uma infecção associada aos cuidados de saúde como tem sido considerada, verificando-se um aumento do número de casos adquiridos na comunidade.12,13 Muitos dos doentes com infecções adquiridas na comunidade estavam previamente sob inibidor da bomba de protões ou tinham estado sob antibioterapia, contudo uma parte significativa destes doentes não tinha tido exposição aos factores atrás descritos.13,14
Doentes com enterocolite a Clostridium difficile têm internamentos mais prolongados, maiores taxas de re-internamento, custos associados ao internamento mais elevados e uma taxa de mortalidade superior aos doentes sem infecção a Clostridium difficile.15
Esclarecida a importância crescente da infecção a Clostridium difficile, os autores desenvolveram um estudo retrospectivo cujo objectivo foi comparar as primo-infecções e recidivas em doentes com enterocolite a Clostridium difficile, colmatando assim uma lacuna existente na literatura.
Métodos
Trata-se de um estudo retrospectivo, baseado nos registos clínicos de 72 doentes com infecção comprovada a Clostridium difficile, definida pela presença de diarreia com muco e pesquisa de toxina A e B positiva e/ou colonoscopia com identificação de pseudomembranas. Foram tidos em conta os doentes com as características atrás descritas e que tenham estado internados durante 18 meses, 19 de Janeiro de 2012 a 19 de Julho de 2013, no Departamento de Medicina do Hospital Beatriz Ângelo.
Os casos foram divididos em dois grupos: primo-infecção (n = 47 doentes) e recidiva (n = 25 doentes). No grupo de doentes com primo-infecção foram tidos em conta apenas os doentes com primeira infecção a Clostridium difficile de acordo com os critérios atrás definidos; no grupo das recidivas foram tidos em conta os doentes com a primeira recidiva, ou seja, primeira recorrência com infecção comprovada 8 semanas após completar terapêutica e sem sintomatologia, segundo a definição da Australasian Society of Infectious Diseases. Nenhum dos doentes entrou nos dois grupos em simultâneo.
Foram avaliados: idade, sexo, local de aquisição da infecção, antibioterapia prévia (últimos 3 meses), utilização prévia de inibidores da bomba de protões, grau de gravidade (critérios: idade > 65 anos, leucócitos > 20 000/uL, creatinina sérica > 1,5 vezes o valor basal do doente), antibioterapia efectuada, duração terapêutica, duração do internamento e mortalidade.
Definiu-se como tendo infecção adquirida na comunidade os doentes cuja colheita de fezes foi realizada em ambiente de ambulatório ou até 3 dias após admissão Hospitalar, sem exposição aos Cuidados de Saúde nos 12 meses prévios.
Na análise estatística utilizou-se o programa estatístico Stata 11 (Stata Corporation, Collegue Station, TX, USA). Os resultados são apresentados como média ± desvio padrão ou como frequências relativas, conforme apropriado. Usou-se o teste de qui-quadrado para a comparação de proporções e o teste t de Student para a comparação de médias entre os dois grupos. Adotou-se o nível de significância de 5%.
Resultados
Os dois grupos estudados apresentavam idade média semelhante (77,0 ± 14,2 anos nas primo-infecções e 77,3 ± 1 2,7 anos nas recidivas, t(70) = 0,09, p = 0,92), com predomínio do género feminino em ambos os grupos (70,2% nas primo-infecções e 60,0% nas recidivas, ?2(1) = 0,77, p = 0,38).
As primo-infecções e recidivas foram adquiridas mais frequentemente na comunidade (59,6% das primo-infecções e 56,0% das recidivas, ?2(1)) = 0,09, p = 0,77).
Na população do estudo, a utilização prévia de inibidor da bomba de protões foi superior nas recidivas (84,0% vs 65,2%), mas a diferença de proporções não atingiu significância estatística (?2(1)) = 2,82, p = 0,09) (Fig 1).
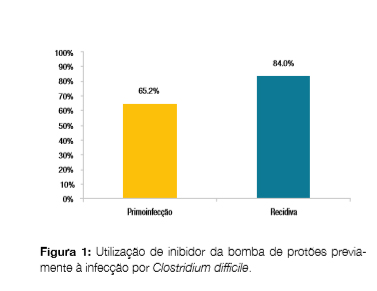
A maioria dos doentes tinham realizado antibioterapia previamente (87,2% nas primo-infecções e 91,7% nas recidivas, ?2(1) = 0,31, p = 0,58).
Os beta-lactâmicos foram os antibióticos mais associados, com particular destaque para o aparecimento de um carbapenem (meropenem) como segundo agente mais relacionado com esta infecção, juntamente com as quinolonas (Fig 2).
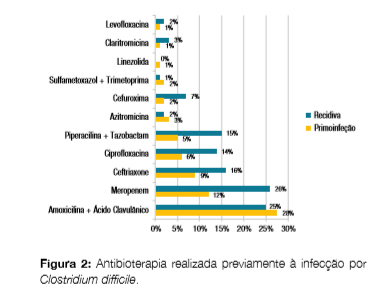
Nos dois grupos (primo-infecções versus recidivas), grande parte dos doentes apresentaram um critério de gravidade (42,6% nas primo-infecções e 64,0% nas recidivas, ?2(1) = 3,00, p = 0,08) e este esteve em relação com o critério idade em 97,2% dos casos.
Assim, avaliando os restantes critérios de gravidade, verificou-se que a gravidade global foi superior nas primo-infecções (leucócitos > 20 000/uL 21,3% vs 12,0%, ?2(1) = 0.95, p = 0.33; creatinina sérica > 1,5 vezes a creatinina basal do doente 38,3% vs 20,8%, ?2(1) = 2,21, p = 0,14), (Fig 3).
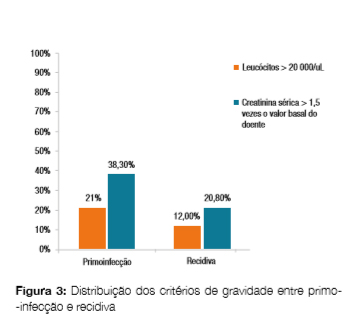
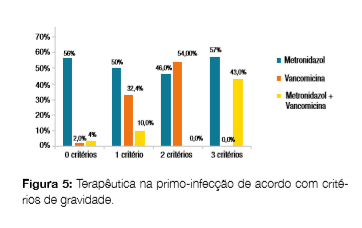
Nas primo-infeções o metronidazol foi o antibiótico mais utilizado (53,2%), enquanto nas recidivas a vancomicina foi mais utilizada (48,0%, ?2(1) = 4,31, p = 0,04, resíduos ajustados 2,57 e 1,84, respectivamente) não havendo diferenças estatísticas nas proporções apresentadas nos dois grupos (primo-infecções versus recidivas) em relação à escolha da opção de terapêutica combinada (metronidazol + vancomicina, 19,2% nas primo-infecções e 24,0% nas recidivas, ?2(1) = 0,23, p = 0,63) (Fig 4). Para as situações de maior gravidade nas primo-infecções (2 e 3 critérios), verificou-se a preferência pelo metronidazol isolado (55,6% vc 50,0% com 0 ou 1 critério, ?2(1) = 0,14, p = 0,71) sem grande diferença per centual para 2 e 3 critérios (46,2% para 2 critérios e 57,1% para 3 critérios, ?2(1) = 0,24, p = 0,63). Quando se progride em gravidade no grupo de doentes com primo-infecção, observa-se uma redução na utilização da vancomicina isolada (53,9% nos doentes com 2 critérios de gravidade e 0,0% nos doentes com 3 critérios de gravidade) em comparação com a terapêutica combinada (0,0% nos doentes com 2 critérios de gravidade e 42,9% nos doentes com 3 critérios de gravidade) (Fig 5).
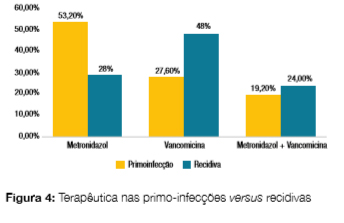
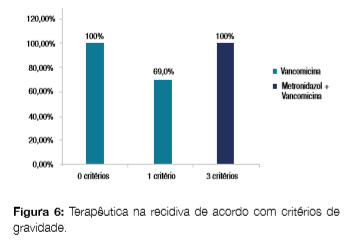
Nas recidivas, constata-se uma maior utilização de vancomicina mesmo nos casos de menor gravidade (100,0% para 0 critérios e 68,8% para 1 critério), havendo maior consciencialização na terapêutica combinada nos casos mais graves (100% para 3 critérios) (Fig 6).
A média da duração da terapêutica foi superior nas recidivas (13,8 ± 5,6 dias vs 11,9 ± 4,7 dias), mas sem diferença estatisticamente significativa (t(69) = 1,46, p = 0,15). Excluindo os falecidos, a média da duração da terapêutica também foi superior nas recidivas (14,1 dias vs 13,95 dias), mas sem significado estatístico (t(57) = 0,20, p = 0,84). A demora média dos dois grupos foi semelhante, com 13 dias para as primo 10-infecções e 12 dias para as recidivas (t(70) = 0,34, p = 0,73). A mortalidade foi superior nas primo-infecções em comparação com as recidivas (23,4% vs 4,0%, ?2(1) = 4,42, p = 0,04, resíduos ajustados 3,78 e -3,38, respectivamente).
Discussão
Parece existir na comunidade científica um consensus relativamente à Infecção grave e ameaçadora de vida, nomeadamente, nos casos de perfuração intestinal, choque séptico ou peritonite. No entanto, relativamente aos casos de doença menos grave, mas que poderão evoluir de forma desfavorável parece existir maior controvérsia.15
Quando se pretende iniciar terapêutica e, analisando as guidelines disponíveis nos últimos 6 anos, surgem diversos critérios a ter em conta, nomeadamente, idade, comorbilidades, grau de imunodeficiência ou admissão em uma Unidade de Cuidados Intensivos.15 Todas as guidelines consultadas16-22 estão de acordo em relação à utilização de metronidazol oral como primeira escolha antibiótica para o tratamento no caso de doença de gravidade ligeira a moderada, sem factores de risco para recorrência e, vancomicina oral no caso de se considerar doença com critérios de gravidade. Na verdade, na American College of Gastroenterology, World Society of Emergency Surgery e na Australasian Society for Infectious Diseases sugere-se que se altere a estratégia terapêutica de metronidazol para vancomicina se ao fim de 3-7 dias de tratamento não se verificar melhoria clínica.17,19-21
A terapêutica para doença ameaçadora de vida deve passar para combinação de vancomicina administrada oralmente (ou por sonda nasogástrica) e metronidazol endovenoso com a adição de vancomicina rectal no caso de ileus paralítico.16
Na avaliação dos dois grupos neste estudo, o critério idade foi o mais prevalente, sendo de notar que, nas guidelines consultadas, apenas em uma delas houve referência ao critério idade.18 Este facto relaciona-se provavelmente com a existência de uma relação quase linear com o avançar da idade sem um cut-off bem definido.15 Os 65 anos, definidos pela European Society of Clinical Microbiology and Infectious Diseases,18 são talvez o cut-off mais utilizado e portanto também o considerado no nosso estudo.
As alterações encontradas por tomografia computorizada (TC) e colonoscopia são também tidas em conta em algumas guidelines como critério de gravidade,18,21 no entanto, perante a ausência de evidência científica sólida não foram tidas em conta neste estudo (com excepção para o megacólon tóxico onde a TC tem um valor diagnóstico indubitável).
Talvez pelo facto do critério idade ter sido o transversalmente mais prevalente levou a que os clínicos nos doentes que apresentavam apenas este critério de gravidade não tivessem prescrito vancomicina nestes doentes. No entanto, verifica-se que nas primo-infecções mesmo nos doentes com 2 ou 3 critérios de gravidade (idade, leucocitose e creatinina), o metronidazol em monoterapia foi a escolha mais frequente.
Neste estudo verificou-se que, muito embora as primo-infecções tenham apresentado maior gravidade e mortalidade, a primeira escolha de tratamento foi o metronidazol, não obstante o facto de as orientações recomendarem a utilização da vancomicina oral nos casos de maior severidade. Na verdade, parece existir uma tendência para iniciar tratamento com metronidazol em monoterapia nos doentes com primo-infecção e vancomicina isolada nos doentes com recidiva, independentemente da presença de critérios de gravidade. No entanto, parece haver maior preocupação em realizar terapêutica combinada nos doentes considerados mais graves quando comparado com a vancomicina em monoterapia.
A utilização de inibidor da bomba de protões tem sido mencionada nos últimos anos como factor de risco para enterocolite a Clostridium difficile, pois facilita a sobrevivência do microorganismo no ambiente gástrico e porque promove um desequilíbrio na flora intestinal visto que aumenta o pH a este nível.22,23 Este estudo demonstra uma tendência para que estes fármacos possam constituir um factor preditor para infecção a Clostridium difficile, no entanto, são necessários mais estudos que confirmem esta hipótese. De facto, foram publicados dois estudos recentemente que não demonstram esta relação e, além disso, neste estudo, também não se estabeleceu uma associação estatisticamente significativa (p = 0,09).24,25
A relação entre primo-infecção e antibioterapia prévia é já bem conhecida, sendo que os resultados deste estudo estão em concordância com o amplamente descrito na literatura, verificando-se que 87,2% dos doentes tinha estado sob antibioterapia nos 3 meses prévios à primo-infecção. Analisando o relatório da Monitorização do consumo de antibióticos no ambulatório da Associação Regional de Saúde do Norte (ARSN), 2013-2015,26 constata-se que os antimicrobianos representam 4,8% do total de medicamentos dispensados no ambulatório, definindo-se ambulatório como as prescrições realizadas no âmbito dos cuidados de saúde primários, hospitais públicos e privados e outros locais privados (consulta entre outros). Neste relatório, é ainda possível observar um aumento na dispensa anual de antibióticos em 6,5% entre 2013 e 2015. Neste estudo, os beta-lactâmicos foram os antimicrobianos mais associados com enterocolite a Clostridium difficile, em parte também relacionado com a sua maior utilização, confirmando-se no relatório da ARSN que as penicilinas representam o grupo de antibióticos mais utilizado, destacando-se um aumento no seu consumo de 5,1% entre 2013 e 2015. Desta forma, perante o crescente consumo de antibióticos em Portugal e que acompanha a tendência verificada na restante Europa, os autores deste estudo, recordam que os antibióticos devem ser utilizados de forma criteriosa, devendo-se manter a promoção da sua adequada prescrição e utilização junto da comunidade médica, sensibilizando-se ainda a população geral para as consequências da sua utilização indiscriminada e sem indicação médica.
Conclusão:
Este estudo demonstra que as primo-infecções são situações habitualmente de maior gravidade clínica e associadas a maior mortalidade quando comparadas com as recidivas. No entanto, apesar da gravidade, verifica-se que existe uma tendência para não estadiar em gravidade na altura do diagnóstico. Deste modo, este estudo realça a importância de avaliar a gravidade de cada doente de modo a se optar pela melhor terapêutica de acordo com a evidência de eficácia na literatura.
Agradecimentos/Acknowledgements :
Os autores deste estudo agradecem ao Sr. Prof. Doutor António Oliveira pela sua colaboração, dedicação e disponibilidade no tratamento dos dados estatísticos
Referencias
1. Lessa FC, Gould CV, McDonald LC. Current status of Clostridium difficile infection epidemiology. Clin Infect Dis. 2012;55 Suppl 2:S65-70. [ Links ]
2. Kelly CP, LaMont JT. Clostridium difficile--more difficult than ever. N Engl J Med. 2008;359:1932-40. [ Links ]
3. Miller BA, Chen LF, Sexton DJ, Anderson DJ. Comparison of the burdens of hospital-onset, healthcare facility-associated Clostridium difficile Infection and of healthcare-associated infection due to methicillin-resistant Staphylococcus aureus in community hospitals. Infect Control Hosp Epidemiol. 2011;32:387-90. [ Links ]
4. McDonald LC, Killgore GE, Thompson A, Owens RC Jr, Kazakova SV, Sambol SP, et al. An epidemic, toxin gene-variant strain of Clostridium difficile. N Engl J Med. 2005;353:2433-41. [ Links ]
5. Warny M, Pepin J, Fang A, Killgore G, Thompson A, Brazier J, et al. Toxin production by an emerging strain of Clostridium difficile associated with outbreaks of severe disease in North America and Europe. Lancet. 2005;366:1079-84. [ Links ]
6. Stabler RA, Dawson LF, Phua LTH, Wren BW. Comparative analysis of BI/ NAP1/027 hypervirulent strains reveals novel toxin B-encoding gene (tcdB) sequences. J Med Microbiol. 2008; 58: 771 - 5. [ Links ]
7. Stabler RA, He M, Dawson L, Martin M, Valiente E, Corton C,et al. Comparative genome and phenotypic analysis of Clostridium difficile 027 strains provides insight into the evolution of a hypervirulent bacterium. Genome Biol. 2009;10:R102. [ Links ]
8. Belmares J, Johnson S, Parada JP, Olson MM, Clabots CR, Bettin KM, et al. Molecular epidemiology of Clostridium difficile over the course of 10 years in a tertiary care hospital. Clin Infect Dis. 2009;49:1141-7. [ Links ]
9. Sandora TJ, Fung M, Flaherty K, Helsing L, Scanlon P, Potter-Bynoe G, et al. Epidemiology and risk factors for Clostridium difficile infection in children. Pediatr Infect Dis J. 2011;30:580-4. [ Links ]
10. Tai E, Richardson LC, Townsend J, Howard E, Mcdonald LC. Clostridium difficile infection among children with cancer. Pediatr Infect Dis J. 2011 ;30:610-2. [ Links ]
11. Kuntz JL, Yang M, Cavanaugh J, Saftlas AF, Polgreen PM. Trends in Clostridium difficile infection among peripartum women. Infect Control Hosp Epidemiol. 2010;31:532-4. [ Links ]
12. Pituch H. Clostridium difficile is no longer just a nosocomial infection or an infection of adults. Int J Antimicrob Agents. 2009;33 Suppl 1:S42-5. [ Links ]
13. Dial S, Delaney JA, Schneider V, Suissa S. Proton pump inhibitor use and risk of community-acquired Clostridium difficile-associated disease defined by prescription for oral vancomycin therapy. CMAJ. 2006;175:745-8. [ Links ]
14. Chitnis AS, Holzbauer SM, Belflower RM, Winston LG, Bamberg WM, Lyons C, et al. Epidemiology of community-associated Clostridium difficile infection, 2009 through 2011. JAMA Intern Med. 2013;173:1359-67. [ Links ]
15. Fehér C, Mensa J. A comparison of current guidelines of five international societies on clostridium difficile infection management. Infect Dis Ther. 2016;5:207-30. [ Links ]
16. Cohen SH, Gerding DN, Johnson S, Kelly CP, Loo VG, McDonald LC, et al. Clinical practice guidelines for Clostridium difficile infection in adults: 2010 update by the society for healthcare epidemiology of America (SHEA) and the infectious diseases society of America (IDSA). Infect Control Hosp Epidemiol. 2010;31:431-55. [ Links ]
17. Surawicz CM, Brandt LJ, Binion DG, Ananthakrishnan AN, Curry SR, Gilligan PH, et al. Guidelines for diagnosis, treatment, and prevention of Clostridium difficile infections. Am J Gastroenterol. 2013;108:478-98; quiz 499. [ Links ]
18. Debast SB, Bauer MP, Kuijper EJ; European Society of Clinical Microbiology and Infectious Diseases. European Society of Clinical Microbiology and Infectious Diseases: update of the treatment guidance document for Clostridium difficile infection. Clin Microbiol Infect. 2014;20 Suppl 2:1-26. [ Links ]
19. Sartelli M, Malangoni MA, Abu-Zidan FM, Griffiths EA, Di Bella S, McFarland LV, et al. WSES guidelines for management of Clostridium difficile infection in surgical patients. World J Emerg Surg. 2015;10:38. [ Links ]
20. Cheng AC, Ferguson JK, Richards MJ, Robson JM, Gilbert GL, McGregor A, et al. Australasian society for infectious diseases guidelines for the diagnosis and treatment of Clostridium difficile infection. Med J Aust. 2011; 194:353 - 8. [ Links ]
21. Trubiano JA, Cheng AC, Korman TM, Roder C, Campbell A, May ML, et al. Australasian Society of Infectious Diseases updated guidelines for the management of Clostridium difficile infection in adults and children in Australia and New Zealand. Inter Med J. 2016; 46; 479 - 93. [ Links ]
22. McDonald EG, Milligan J, Frenette C, Lee TC. Continuous proton pump inhibitor therapy and the associated risk of recurrent Clostridium difficile infection. JAMA Intern Med. 2015; 175; 784 - 94. [ Links ]
23. Deshpande A, Pasupuleti V, Thota P, Pant C, Rolston DD, Hernandez AV, et al. Risk factors for recurrent Clostridium difficile infection: a systematic review and meta-analysis. Infect Control Hosp Epidemiol. 2015; 36; 452-60. [ Links ]
24. Novack L, Kogan S, Gimpelevich L, Howell M, Borer A, Kelly CP, et al. Acid suppression therapy does not predispose to Clostridium difficile Infection: the case of the potential bias. PLoS One. 2014; 9; e110790. [ Links ]
25. Weiss K, Louie T, Miller MA, Mullane K, Crook DW, Gorbach SL. Effects of proton pump inhibitors and histamine-2 receptor antagonists on response to fidaxomicin or vancomycin in patients with Clostridium difficile-associated diarrhea; BMJ Open Gastroenterol.2015;2; e000028. [ Links ]
26. Comissão de Farmácia e Terapêutica. Relatório da monitorização do consumo de antibióticos no ambulatório da Associação Regional de Saúde do Norte, 2013-2015. Porto: CFT; 2016. [ Links ]
Correspondência: Cristina V. Gonçalves cristianavgoncalves@gmail.com
Serviço de Medicina Interna, Hospital Beatriz Ângelo, Loures, Portugal Avenida Carlos Teixeira, 3, 2674-514, Loures
Conflitos de Interesse: Os autores declaram a inexistência de conflitos de interesse na realização do presente trabalho.
Conflicts of interest: The authors have no conflicts of interest to declare.
Fontes de Financiamento: Não existiram fontes externas de financiamento para a realização deste artigo.
Financing Support: This work has not received any contribution, grant or scholarship.
Direito à Privacidade e Consentimento Informado: Os autores declaram que nenhum dado que permita a identificação do doente aparece neste artigo.
Confidentiality of data: The authors declare that they have followed the protocols of their work center on the publication of data from patients.
Proteção de Seres Humanos e Animais: Os autores declaram que não foram realizadas experiências em seres humanos ou animais.
Protection of human and animal subjects: The authors declare that the procedures followed were in accordance with the regulations of the relevant clinical research ethics committee and with those of the Code of Ethics of the World Medical Association (Declaration of Helsinki).
Recebido: 25/03/2017
Aceite: 03/10/2017














