Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Acessos
Acessos
Links relacionados
-
 Similares em
SciELO
Similares em
SciELO
Compartilhar
Medicina Interna
versão impressa ISSN 0872-671X
Medicina Interna vol.26 no.2 Lisboa jun. 2019
https://doi.org/10.24950/rspmi/O/241/18/2/2019
ARTIGOS ORIGINAIS / ORIGINAL ARTICLES
Sete Anos de Neutropenias Febris num Serviço de Medicina Interna
Seven Years of Febrile Neutropenia in Internal Medicine Department
Mónica Pinho1
 https://orcid.org/0000-0002-5352-2123
https://orcid.org/0000-0002-5352-2123
Catarina Rodrigues1
 https://orcid.org/0000-0003-4516-1935
https://orcid.org/0000-0003-4516-1935
Lúcia Guedes2
 https://orcid.org/0000-0001-6626-0380
https://orcid.org/0000-0001-6626-0380
Érico Costa2
 https://orcid.org/0000-0003-0600-4427
https://orcid.org/0000-0003-0600-4427
Ermelinda Gonçalves2
 https://orcid.org/0000-0002-7730-9837
https://orcid.org/0000-0002-7730-9837
1Serviço de Oncologia Médica, Centro Hospitalar de Entre o Douro e Vouga, Santa Maria da Feira, Portugal
2Serviço de Medicina Interna, Centro Hospitalar de Entre o Douro e Vouga, Santa Maria da Feira, Portugal
Resumo:
Introdução:A neutropenia febril permanece uma complicação grave dos tratamentos de quimioterapia, representa uma causa importante de morbi-mortalidade e recurso aos serviços de saúde, e pode comprometer a eficácia dos tratamentos antineoplásicos. Os dados disponíveis na literatura sobre doentes oncológicos internados por neutropenia febril são escassos. O objetivo do estudo é a caracterização dos doentes internados num serviço de Medicina Interna com neutropenia febril pós-quimioterapia.
Material e Métodos: Estudo observacional transversal decorrido entre janeiro de 2008 e dezembro de 2014 num Serviço de Medicina Interna. Foram incluídos doentes oncológicos sob quimioterapia internados com o diagnóstico de neutropenia febril. A colheita dos dados demográficos e clínicos foi feita a partir dos dados do processo clínico em papel e informatizado. A análise dos dados foi feita com recurso ao SPSS versão 23.0.
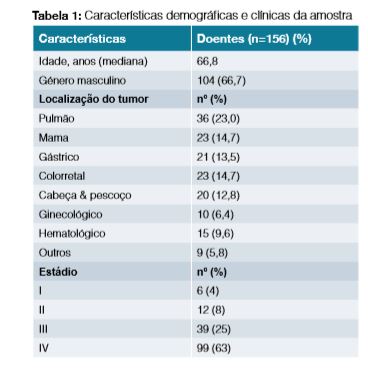
Resultados: Foram selecionados 187 episódios de internamentos num total de 156 doentes; 54,5% pertenciam ao género masculino e a idade mediana foi de 67 anos. A maioria dos doentes (63,0%) apresentava doença oncológica em estadio avançado e 39,0% tinham neutropenia severa. Os fatores de crescimento foram utilizados em 80,8% dos internamentos. Colheram-se hemoculturas em 77,9% dos episódios com 20,0% de bacteriemias confirmadas; os microrganismos Gram-negativos foram os agentes mais frequentes. O uso da associação de pelo menos dois antibióticos mostrou uma tendência decrescente e os carbapenemes foram os mais requisitados. A taxa de mortalidade foi de 17,0%, dos quais 62,5% apresentavam neutropenia profunda e 75,0% doença oncológica estadio IV.
Conclusão: A criação de protocolos e a sua auditoria permitem avaliar o trabalho realizado no serviço e melhorar os cuidados de saúde prestados.
Palavras-chave: Antibacterianos; Antineoplásicos/efeitos adversos; beta-Lactâmicos; Fator Estimulador de Colónias de Granulócitos; Hospitalização; Neutropenia Febril/induzida quimicamente; Neutropenia Febril Induzida por Quimioterapia.
Abstract:
Introduction: Febrile neutropenia remains a serious side effect of chemotherapy and is a major cause of morbidity and mortality, as well as healthcare resource, and may compromise the efficacy of antineoplastic treatments by delaying and dose reductions of chemotherapy. The data about oncological inpatients with febrile neutropenia is scarce on literature, so this study pretends to characterize this population in a period of seven years at an internal medicine department and knowing more about this medical approach.
Results: 156 inpatients were included in a total of 187 hospitalizations by febrile neutropenia. More than 50% was man, with a median age of 67 years old and 63.0% had advanced oncological disease. Fewer was present in 85.6% of admissions and 39.0% had severe neutropenia. Blood cultures were collected in 77.9% of episodes and 20.0% had bacteraemia. Gram-negative agents were the most frequent and the antibiotic association had a downward trend, being the carbapenems the most used. Mortality rate was about 17.0%, of which 62.5% had severe neutropenia and 75.0% stage IV.
Conclusion: The creation of protocols and their auditing make it possible to evaluate the clinical work performed on the service and to improve the health care provided.
Keywords:Anti-Bacterial Agents; Antineoplastic Agents/ adverse effects; beta-Lactams; Chemotherapy-Induced Febrile Neutropenia: Febrile Neutropenia/ chemically induced; Granulocyte Colony-Stimulating Factor; Hospitalization.
Introdução
Nas últimas décadas tem-se assistido a uma incidência e prevalência crescentes de doenças oncológicas e a um progresso notável ao nível da sobrevivência destes doentes à custa de diagnósticos mais precoces e desenvolvimento no tratamento cirúrgico e médico.1,2 Não obstante os avanços na área do tratamento biológico e da imunoterapia, a quimioterapia (QT) continua a ocupar um papel central na abordagem adjuvante e paliativa destes doentes,1 sendo a neutropenia uma consequência importante e um dos principais fatores de risco para infeção.2,3 Trata-se de uma causa importante de morbi-mortalidade, comprometendo a eficácia dos tratamentos antineoplásicos uma vez que pode implicar adiamentos e reduções de dose e, por outro lado, representa um aumento da utilização dos recursos médicos.2,4,5
Embora existam algumas variações, de acordo com a European Society for Medical Oncology (ESMO), a neutropenia febril (NF) define-se como a presença de temperatura oral > 38,3°C ou > 38,0°C em duas medições consecutivas com um intervalo de 2 horas entre si e uma contagem absoluta de neutrófilos inferior a 0,5×109/L, ou que seja expectável que venha a diminuir para valores inferiores a 0,5×109/L.2,6 A estratificação dos doentes permite orientar a estratégia terapêutica de forma individualizada.2 O método de estratificação mais amplamente utilizado é o índice de prognóstico MASCC (Multinational Association of Supportive Care in Cancer), prospetivamente validado e que permite, em base exclusivamente clínica, determinar o risco de mortalidade.2,6 Os doentes de alto risco devem ser internados para antibioterapia endovenosa, podendo os de baixo risco ser tratados em ambulatório com antibioterapia oral após um breve período de observação.2,3,6 Um diagnóstico atempado e a instituição precoce de tratamento antibiótico é essencial para que a sua abordagem seja bem sucedida.6
A mortalidade associada à NF tem vindo a diminuir de forma constante ao longo dos anos2; contudo, mantém-se significativa, variando entre 5% a 20%.2,7,8,9
No Serviço de Medicina Interna (SMI) do nosso hospital existe um protocolo desde 2010 que visa a uniformização da abordagem do doente neutropénico, sendo o seu cumprimento avaliado sistematicamente (vide Anexo 1). É feita a monitorização da estratificação de risco dos doentes, prescrição de antibiótico de acordo com a gravidade clínica e uso adequado de fatores de crescimento de colónias de granulócitos/granulocyte-colony stimulating factor (G-CSF). São escassos os estudos disponíveis na literatura sobre doentes oncológicos internados por NF, pelo que o objetivo deste estudo foi a caracterização destes doentes e da sua abordagem em regime de internamento num SMI.
Material e Métodos
Procedeu-se a um estudo observacional transversal que decorreu entre janeiro de 2008 e dezembro de 2014 num SMI de um hospital periférico português.
Foi utilizada uma amostra de conveniência, tendo sido selecionados todos os doentes com doença oncológica admitidos no SMI, com o diagnóstico principal de NF decorrente do tratamento antineoplásico. Excluíram-se todos os doentes que não cumpriam os critérios definidores de NF e que não tinham sido submetidos a tratamento de QT nas últimas 6 semanas. Procedeu-se à colheita de dados demográficos e clínicos: idade e género, localização e estadio da doença oncológica, sintomas à admissão e contagem absoluta de neutrófilos para estratificação do risco, tipo de antibioterapia, exames microbiológicos solicitados e agentes microbiológicos isolados, uso de fatores de crescimento de granulócitos e aplicação de medidas de isolamento. Foi ainda avaliada a duração do internamento e o tempo decorrido até à contagem de neutrófilos > 1000/mm3.
A recolha de dados foi feita por médicos a exercerem a atividade no SMI. As variáveis contínuas foram expressas em mediana. Todas as variáveis foram submetidas a análise descritiva e apresentadas como percentagem. A análise estatística descritiva foi feita com recurso ao software SPSS versão 23.0. O trabalho teve a aprovação da comissão de ética do hospital.
Resultados
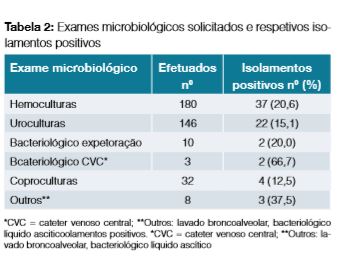
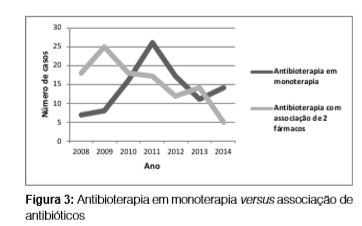
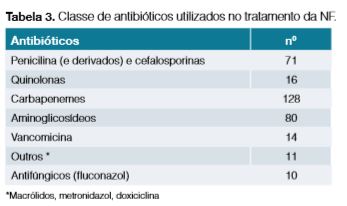
Foram analisados 231 episódios de internamentos, tendo sido incluídos no estudo 187 num total de 156 doentes; foram excluídos 44 episódios. Mais de metade dos doentes pertencia ao género masculino (66,7%), com idade mediana de 67 anos ± 12,0. A maioria (90,3%) apresentava tumores sólidos e doença oncológica em estadio avançado (63,0%), distribuídos como mostra a Tabela 1. Cerca de 40,0% desenvolveram NF após o primeiro ciclo de QT e 17% contavam com pelo menos um internamento prévio pelo mesmo motivo. Observou-se neutropenia profunda (neutrófilos = 100 mm3) em mais de 1/3 das admissões como demonstrado na Fig 1, conferindo por si só alto risco de complicações. O foco infecioso mais frequente filiava-se no trato gastrointestinal seguido do trato respiratório como se verifica na Fig 2. Procedeu-se à colheita de hemoculturas em 77,9% dos episódios, urocultura em 63,2% dos episódios e bacteriológico das vias do CVC em 1,3%. Foram documentados casos de bacteriemia em 20,5% dos internamentos (Tabela 2); os microrganismos Gram-negativos foram os agentes mais comummente isolados, sendo a Escherichia coli o agente causal da maioria das bacteriemias e infeções urinárias. No tratamento da NF foram utilizados diversos esquemas de antibioterapia, observando-se o recurso a associação de pelo menos dois antibióticos com uma tendência decrescente no decorrer dos anos (Fig 3), sendo os carbapenemes seguindo-se os aminoglicosídeos os antibióticos mais utilizados (Tabela 3). O tempo mediano de recuperação da contagem de neutrófilos para um valor superior a = 1000/mm3 foi de 2,6 dias ± 1,6. Os G-CSF foram utilizados em 80,8% das admissões e de forma inapropriadamente prolongada em 12,6%. As medidas de isolamento, enquanto medida de proteção do doente imunodeprimido, foram instituídas na maioria dos episódios de internamentos (92,0%).

A duração média de internamento foi de 8,3 dias ± 5,9, semelhante ao tempo médio de internamento por outras causas no SMI, na mesma data. A taxa de mortalidade foi de 17,0%, dos quais 62,5% apresentavam neutropenia severa e 75,0% doença oncológica estadio IV.
Discussão
Os resultados deste estudo mostram que a maioria dos doentes internados por NF apresentam doença oncológica avançada, o que lhes confere desde logo uma maior suscetibilidade a intercorrências infeciosas. Além do estadio da neoplasia, a localização, o tratamento antineoplásico (esquema e intensidade do regime) e as características inerentes ao doente (idade, história prévia de NF, baixo status funcional e comorbilidades) são outros fatores de risco para o desenvolvimento de NF2,10
No decorrer do estudo o número de internamentos por NF apresentou uma tendência decrescente que poderá estar relacionada com uma melhoria na prevenção e à evolução dos tratamentos antineoplásicos, permanecendo, contudo, estável o número de internamentos por neutropenia profunda, que por si só confere alto risco de complicações e justifica a necessidade de internamento.
Neste estudo foram utilizados G-CSF na maioria dos internamentos. A utilização dos G-CSF enquanto terapêutica adjuvante de antibioterapia no tratamento da NF não está preconizada por rotina pela menor evidência clínica em comparação com o seu papel na profilaxia, efeitos secundários associados e custos inerentes.4 Uma metanálise da Cochrane de 2005 que incluiu 1518 doentes de 13 ensaios clínicos, demonstrou redução no tempo de internamento e no tempo de recuperação da contagem de neutrófilos, contudo sem impacto na sobrevivência global.3,11 Com o objetivo de prevenir a NF, que frequentemente ocorre no primeiro ciclo de QT, as guidelines europeias e americanas recomendam o uso de G-CSF em ambulatório, nos doentes sob esquemas de QT que conferem risco de NF superior a 20%.2,7,8,9 Por outro lado, a National Comprehensive Cancer Network (NCCN) propõe ainda a avaliação de alguns critérios que conferem risco alto de complicações infeciosas e/ou se relacionam com outcomes clínicos desfavoráveis que podem auxiliar na decisão de utilizar G-CSF, incluindo idade > 65 anos, sépsis grave, neutropenia severa ou prolongada (> 10 dias), pneumonia, infeções fúngicas invasivas ou outras infeciosas identificadas, episódios prévios de neutropenia febril.8
O estudo microbiológico é um passo fundamental na instituição de antibioterapia adequada, estando descritas taxas de isolamento de agentes microbiológicos em doentes neutropénicos de 20%.2,12,13 Além disso, o conhecimento da frequência e dos padrões de resistência dos agentes patogénicos causadores de infeção de cada instituição reveste-se de fundamental relevância para um tratamento de sucesso.6 As linhas de orientação europeias e americanas recomendam o rastreio séptico com colheita de pelo menos dois set de hemoculturas, uma da via do cateter venoso central (CVC) se presente e outra proveniente de venopunção periférica, ou duas em diferentes locais de venopunção na ausência de CVC; o pedido de outros exames microbiológicos deve ser orientado pelos sintomas/sinais do doente.3,6,13,15 Apesar das recomendações, nesta análise verificou-se um número elevado de uroculturas solicitadas de forma inadequada uma vez que os sintomas urinários foram pouco prevalentes. Por outro lado, as hemoculturas do CVC foram efetuadas raramente, apesar da elevada rentabilidade das mesmas (isolamentos positivos em 2/3 dos pedidos).
A classe de antibióticos mais comummente utilizada foi a dos carbapenemes, seguida dos aminoglicosídeos e das cefalosporinas de terceira geração, o que se adequa aos esquemas de antibioterapia empírica recomendados pela Infectious Diseases Society of American (ISDA) no tratamento da NF com necessidade de internamento, considerados doentes de alto risco.3 De acordo com o protocolo de serviço em vigor, a atribuição de alto risco às diferentes situações clínicas era dependente de vários critérios além da neutropenia profunda, critério avaliado nesta análise, como por exemplo, a presença de insuficiência renal ou hepática, mucosite grave ou patologia pulmonar crónica. Assim, a presença de outros critérios que não foram objeto desta análise pode justificar o elevado uso de carbapenemes. Ainda, uma meta-análise que comparou o tratamento da NF com antibioterapia em monoterapia ou com associação de diferentes antibióticos, mostrou eficácia sobreponível; contudo este resultado não foi tão claro nos casos de neutropenia severa ou bacteriemia documentada,2 o que pode justificar que na maioria dos internamentos em análise se tenha optado pela associação de pelo menos duas classes diferentes de antimicrobianos.
A mortalidade associada à NF tem vindo a diminuir2 contudo, mantém-se significativa, com taxas de mortalidade que variam entre os 5% e 20%, aumentando de forma proporcional em relação com a gravidade da infeção e as comorbilidades do doente.2,7,9,14 A taxa de mortalidade verificada no estudo está de acordo com o descrito na literatura.2,13,7,8 Porém, ao comparar com a taxa de mortalidade dos restantes doentes admitidos no SMI no mesmo período, esta mostrou ser superior (17% versus 12%). A maioria dos óbitos apresentava neutropenia severa (neutrófilos = 100 mm3) e doença oncológica avançada, por si mesmo conferem um alto risco de complicações.15
Conclusão
Sendo os doentes oncológicos um grupo particularmente vulnerável a complicações infeciosas, a identificação precoce de um evento infecioso e a sua abordagem atempada e eficiente pode melhorar os outcomes clínicos, através da evolução favorável do evento agudo e a menor interferência possível no tratamento dirigido à doença oncológica A criação de protocolos e a sua auditoria permite uniformizar a sua abordagem, avaliar o trabalho realizado no serviço com o objetivo de melhorar os cuidados de saúde prestados.
Agradecimentos
Ao Dr. Fernando Moreira, Diretor de Serviço de Medicina Interna do CHEDV, onde o trabalho foi realizado. Dra Ana Raquel Freitas, assistente hospitalar de Medicina Interna do CHEDV, pela colaboração e apoio.
Referências
1. Schelenz S, Giles D, Abdallah S. Epidemiology, management and economic impact of febrile neutropenia in oncology patients receiving routine care at a regional UK cancer centre. Ann Oncol. 2012; 23:1889-93. doi: 10.1093/annonc/mdr520. [ Links ]
2. Naurois J, Klastersky J, Rolston K, Rapoport B, Maschmeyer G, Aapro M, et al. Management of febrile neutropenia: ESMO Clinical Practice Guidelines. Ann Oncol. 2016; 27:111-8. doi: 10.1093/annonc/mdw325. [ Links ]
3. Freifeld AG, Bow EJ, Sepkowitz KA, Boeckh MJ, Ito JI, Raad II, et al, Clinical Practice Guideline for the Use of Antimicrobial Agents in Neutropenic Patients with Cancer: 2010 Update by the Infectious Diseases Society of America. Clin Infect Dis. 2011;52:56-93. doi: 10.1093/cid/cir073. [ Links ]
4. Aapro MS, Cameron DA, Pettengell R, Bohlius J, Crawford J, Kearney N, et al. European Organisation for Research and Treatment of Cancer (EORTC) Granulocyte Colony-Stimulating Factor (G-CSF) Guidelines Working Party (2006) EORTC guidelines for the use of granulocyte-colony stimulating factor to reduce the incidence of chemotherapy-induced febrile neutropenia in adult patients with lymphomas and solid tumours. Eur J Cancer. 2006; 42:2433–53. doi: 10.1016/j.ejca.2006.05.002.
5. Cameron D. Management of chemotherapy-associated febrile neutropenia. Br J Cancer. 2009; 101:18-22. doi:10.1038/sj.bjc.6605272. [ Links ]
6. Taplitz RA, Kennedy EB, Bow EJ, Crews J, Gleason C, Hawley DK, et al. Outpatient management of fever and neutropenia in adults treated for malignancy: American Society of Clinical Oncology and Infectious Diseases Society of America Clinical Practice Guideline Update. Clin Oncol. 2018; 36:1443-53. doi: 10.1200/JCO.2017.77.6211. [ Links ]
7. Kuderer NM, Dale DC, Crawford J, Cosler LE, Lyman GH. Mortality, morbidity, and cost associated with febrile neutropenia in adult cancer patients. Cancer. 2006; 106:2258-66. doi: 10.1002/cncr.21847. [ Links ]
8. Lyman GH, and Rolston K. How we treat febrile neutropenia in patients receiving cancer chemotherapy. J Oncol Pract. 2010; 6:149–52. doi: 10.1200/JOP.091092.
9. Chindaprasirt J, Wanitpongpun C, Limpawattana P, Thepsuthammarat K, Sripakdee W, Sookprasert A, et al. Mortality, length of stay, and cost associated with hospitalized adult cancer patients with febrile neutropenia. Asian Pac J Cancer Prev. 2013; 14:1115-9. doi:10.7314/APJCP.2013.14.2.1115. [ Links ]
10. Baden LR, Bensinger W, Angarone M, Casper C, Dubberke ER, Freifeld AG, et al. National Comprehensive Cancer Network (NCCN) Clinical Practice Guidelines in Oncology. Prevention and treatment of cancer-related infections. Version 1.2018. [Consultado em 2018 October 30]. Disponível em: http://www.nccn.org [ Links ]
11. Crawford J, Becker PS, Hutchinson F, Armitage J, Blayney DW; Chavez J, et al. NCCN Clinical Practice Guidelines in Oncology (NCCN Guidelines) Myeloid Growth Factors. Version 1.2018. [Consultado em 2018 October 30]. Disponível em: http://www.nccn.org [ Links ]
12. Perron T, Emara M, Ahmed S. Time to antibiotics and outcomes in cancer patients with febrile neutropenia.BMC Health Serv Res. 2014; 14:162. doi: 10.1186/1472-6963-14-162. [ Links ]
13. Freres P, Gonne E, Collignon J, Giot JB, Gennigens C, Jerusalem G. Prise en charge de la neutropénie fébrile chez le patient cancéreux. Rev Med Liège 2015; 70:195-200. [ Links ]
14. Carpeño JC, Gascón-Vilaplana P, Antón-Torres A, Lópes-López R, Barnadas-Molins A, Cruz-Hernández JJ, et al. Epidemiology and characteristics of febrile neutropenia in oncology patients from Spanish tertiary care hospitals: PINNACLE study. Mol Clin Oncol. 2015; 3:725-9. doi: 10.3892/ mco.2015.524. [ Links ]
15. Furno P, Bucaneve G, Del Favero A. Monotherapy or aminoglycoside-containing combinations for empirical antibiotic treatment of febrile neutropenic patients: a meta-analysis. Lancet Infect Dis. 2002; 2:231–42. doi:10.1016/S1473-3099(02)00241-4.
Correspondência:Monica Pinho – monicasofiap@gmail.com
Serviço de Oncologia Médica, Centro Hospitalar de Entre o Douro e Vouga, Santa Maria da Feira, Portugal.
R. Dr. Cândido Pinho 5 4520-211 Santa Maria da Feira
Direito à Privacidade e Consentimento Informado: Os autores declaram que nenhum dado que permita a identificação do doente aparece neste artigo.
Confidentiality of data: The authors declare that they have followed the protocols of their work center on the publication of data from patients.
Proteção de Seres Humanos e Animais: Os autores declaram que não foram realizadas experiências em seres humanos ou animais.
Protection of human and animal subjects: The authors declare that the procedures followed were in accordance with the regulations of the relevant clinical research ethics committee and with those of the Code of Ethics of the World Medical Association (Declaration of Helsinki).
Proveniência e revisão por pares: Não comissionado; revisão externa por pares.
Provenance and peer review. Not Commissioned; externally peer reviewed.
Recebido: 15/11/2018
Aceite: 17/03/2019














