Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Acessos
Acessos
Links relacionados
-
 Similares em
SciELO
Similares em
SciELO
Compartilhar
Jornal Português de Gastrenterologia
versão impressa ISSN 0872-8178
J Port Gastrenterol. v.17 n.1 Lisboa jan. 2010
Pâncreas Divisum no Lado Oculto da Pancreatite Aguda Recorrente: um Desafio Diagnóstico e Terapêutico
Miguel Bispo, Pedro Barreiro, Tiago Bana, David Serra, Pedro Marques, Isabel Seves, Gilberto Couto, Paula Peixe, Leopoldo Matos
Serviço de Gastrenterologia, Centro Hospitalar de Lisboa Ocidental
Resumo
O pâncreas divisum constitui a variante anatómica do pâncreas mais frequente, manifestando-se clinicamente numa minoria dos doentes. Considera-se que o mecanismo subjacente nestes casos consiste na obstrução relativa ao fluxo através da papila minor, constituindo um desafio diagnóstico e terapêutico. Os autores descrevem o caso clínico de uma mulher de 61 anos, com episódios recorrentes de pancreatite aguda, cuja investigação etiológica inicial foi inconclusiva. O diagnóstico de pâncreas divisum foi sugerido por ecoendoscopia e CPRM e confirmado por CPRE. Foi realizada esfincterotomia endoscópica da papila minor e colocada prótese pancreática no ducto de Santorini, com eficácia clínica a longo-prazo. É revisto o papel actual de diferentes modalidades (CPRM, ecoendoscopia e CPRE) neste diagnóstico e são discutidas as abordagens terapêuticas disponíveis.
Pancreas Divisum Lying Beneath Recurrent Acute Pancreatitis: a Diagnostic and Therapeutic Challenge
Abstract
Pancreas divisum is the most common pancreatic anatomic variant, with a minority of patients becoming symptomatic. The underlying mechanism in these cases is thought to be a relative outflow obstruction at the minor papilla, representing a diagnostic and therapeutic challenge. The authors present the case of a 61 year-old female, with recurrent acute pancreatitis, with initial inconclusive work-up. Endoscopic ultrasonography and MRCP findings suggested pancreas divisum, which was confirmed on ERCP. Endoscopic minor papillotomy was performed and a pancreatic stent was placed in Santorinis duct, with clinical success on long-term. State-of-the-art on pancreas divisum multimodality diagnosis is reviewed and current perspectives on therapeutic management of these patients are discussed.
INTRODUÇÃO
O pâncreas divisum constitui a variante anatómica do pâncreas mais frequente, com uma prevalência de 4,0 a 14,0% em séries de autópsias1. Resulta da ausência de fusão do sistema de ductos pancreáticos dorsal e ventral durante o segundo mês de gestação1, pelo que grande parte da secreção exócrina pancreática é drenada para o duodeno pelo ducto pancreático dorsal (de Santorini) através da papila minor.
A relação etiológica entre pâncreas divisum e pancreatite tem sido nas últimas décadas objecto de controvérsia2,3. Dos argumentos que contrariam esta associação, salientam-se a raridade do aparecimento de sintomas nos doentes com pâncreas divisum (<5,0%)2 e a prevalência equiparável de pâncreas divisum em doentes com e sem pancreatite em séries iniciais2. No entanto, evidências mais recentes favorecem esta associação num subgrupo de doentes, destacando-se a maior prevalência de pâncreas divisum em doentes com pancreatite idiopática nas séries de maior dimensão4, a evidência de obstrução relativa ao fluxo através da papila minor (por métodos de imagem com estimulação por secretina) em doentes com pâncreas divisum e pancreatite5, a melhoria clínica verificada após descompressão (endoscópica ou cirúrgica) do ducto dorsal em várias séries4,6-8 e a evidência histológica de inflamação confinada ao sistema ductal dorsal em peças cirúrgicas7. Uma vez que o mecanismo subjacente nos doentes sintomáticos consiste numa obstrução relativa ao fluxo de drenagem dorsal através da papila minor, alguns autores preferem designar esta condição de síndrome do ducto dorsal dominante9.
Para além do diagnóstico definitivo de pâncreas divisum ser difícil, não sendo habitualmente identificado na ecografia e tomografia computadorizada (TC) convencionais e implicando a canulação da papila minor na colangiopancreatografia retrógrada endoscópica (CPRE), constitui também um desafio terapêutico para o gastrenterologista, sendo tecnicamente exigente e associando-se a uma taxa de complicações significativa e, por vezes, recidiva dos sintomas4,6-8.
CASO CLÍNICO
Uma mulher de 61 anos, raça caucasiana, foi referenciada à consulta de Gastrenterologia, na sequência de 4 episódios de pancreatite aguda num período de 7 meses. O primeiro episódio não apresentou critérios de gravidade e foi associado a litíase biliar, tendo sido realizada CPRE, com esfincterotomia endoscópica (ETE) e extracção de cálculos do ducto colédoco. Não foi nesse exame realizada pancreatografia, tendo sido a doente submetida a colecistectomia por via laparoscópica duas semanas após o episódio. Seguiram-se 3 internamentos por pancreatite aguda com intervalos de cerca de 8 semanas, cuja investigação etiológica inicial não foi esclarecedora. Estes episódios de pancreatite aguda foram auto-limitados, sem critérios de gravidade clínico-laboratoriais ou na TC, salientando-se a ausência de elevação das aminotransferases ou dos parâmetros de colestase durante os episódios e a inexistência de alterações no lipidograma. Após cada episódio, constatava-se rápida melhoria clínica mediante suspensão da dieta oral e analgesia, sendo os episódios de pancreatite intercalados por períodos assintomáticos. A doente negava história de consumo de álcool, ingestão de medicamentos ou drogas, ou história familiar de doença pancreática. Os seus antecedentes pessoais eram irrelevantes, não apresentando internamentos ou cirurgias no passado. Negava ainda a ocorrência de dor abdominal, alterações do trânsito intestinal ou queixas dispépticas entre os episódios de pancreatite. Não se registaram alterações no exame objectivo. Apresentava 3 ecografias e duas TCs abdominais (realizadas durante os internamentos por pancreatite), sem alterações relevantes (apenas com edema do pâncreas). Tinha realizado ainda CPRE (repetida na sequência do segundo episódio de pancreatite), sem evidência de litíase residual do colédoco, e CPRM (realizada após tentativa sem sucesso de pancreatografia endoscópica através da papila major), que apresentava múltiplos artefactos, tendo sido considerada inconclusiva.
Para avaliação do parênquima pancreático, região ampular e via biliar principal, foi realizada ecoendoscopia. Esta não evidenciou alterações sugestivas de pancreatite crónica ou coledocolitíase residual. Na ecoendoscopia a partir do bulbo duodenal (Fig. 1), salientava-se a ausência de stack sign, não sendo portanto possível a visualização do ducto pancreático a percorrer a cabeça pancreática paralelamente à via biliar principal. Dada a associação estabelecida entre a ausência de stack sign e pâncreas divisum numa pequena série prospectiva10, valorizou-se esta hipótese diagnóstica. Foi realizada CPRM (Fig. 2), em que se observou ectasia incipiente do ducto pancreático dorsal (de Santorini) até à transição do istmo para a cabeça pancreática, onde deixava de ser perceptível (terminação não visualizada) e ducto ventral (de Wirsung) vestigial a drenar para a papila major. Dado as alterações na CPRM serem globalmente sugestivas de pâncreas divisum, foi realizada CPRE para confirmação diagnóstica e com intuito terapêutico. Após tentativa não conseguida de pancreatografia através da papila major, procedeu-se a canulação da papila minor com esficterótomo Erlangen-type (Tapertome, Boston Scientific) e à injeccção de contraste radiopaco, observando-se o ducto dorsal dominante (Fig. 3a): pacreatografia diagnóstica de pâncreas divisum. Posteriormente, procedeu-se a ETE da papila minor (fio diatérmico às 11 horas), com cerca de 6 mm e colocação de prótese plástica 5F – 7 cm no ducto dorsal (Fig. 3b). Não se registaram complicações durante e no período de observação após o procedimento, tendo a doente alta após 24 horas.
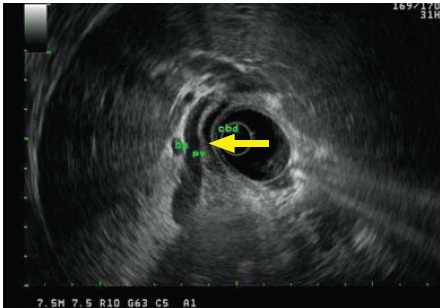
Fig.1. Ecoendoscopia radial – Bulbo duodenal. Parênquima pancreático sem alterações. Visualização da veia porta (PV), via biliar principal (CBD – Seta) e artéria hepática (HA). Salienta-se a ausência de stack sign, não sendo portanto possível a visualização do ducto pancreático a percorrer a cabeça pancreática paralelamente à via biliar principal (CBD).
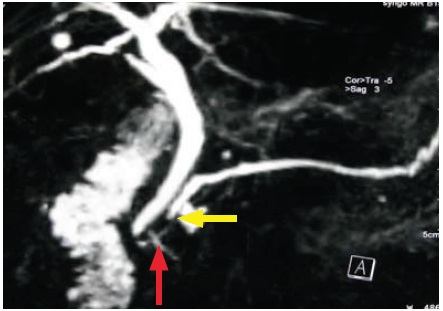
Fig. 2. CPRM (aquisição coronal oblíqua, T2). Incipiente ectasia do ducto pancreático dorsal até à transição do istmo para a cabeça pancreática, onde deixa de ser perceptível (Seta amarela) (terminação não visualizada). O ducto ventral (Wirsung) é vestigial (Seta vermelha) e drena para a ampola de Water.
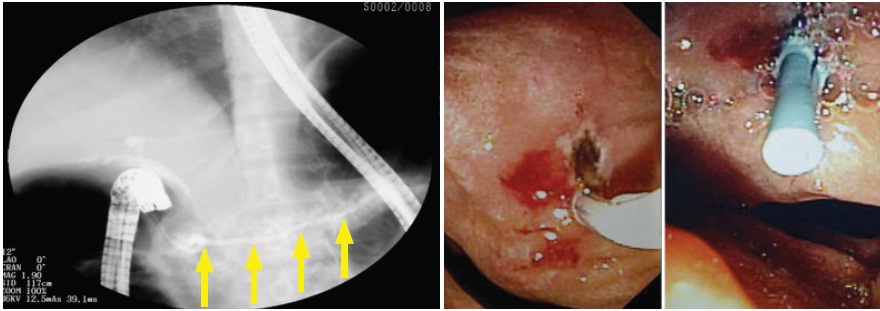
Fig. 3a e 3b. CPRE. Pancreatografia após canulação da papila minor, onde se observa ducto dorsal dominante (Setas), sendo diagnóstica de pâncreas divisum (Fig. 3a). ETE da papila minor (fio diatérmico às 11 horas), com cerca de 6 mm, seguida da colocação de prótese plástica 5F - 7 cm (Fig. 3b).
A doente manteve-se clinicamente estável em ambulatório, cumprindo uma dieta com restrição lipídica. Foi realizado controlo radiográfico 6 semanas após a CPRE, onde se excluiu migração da prótese, tendo-se procedido à sua remoção endoscópica. Após um período de seguimento de cerca de 10 meses, a doente permanece clinicamente estável, sem registo de recorrência dos sintomas.
DISCUSSÃO
Na maioria das séries4-8, a associação entre pâncreas divisum e pancreatite aguda recorrente é mais consistente do que a associação com pancreatite crónica ou dor abdominal crónica, esperando-se no primeiro caso um maior benefício da terapêutica desobstrutiva da papila minor4,6-8.
Curiosamente neste caso clínico, os episódios recorrentes de pancreatite aguda tiveram início após um primeiro episódio de pancreatite litiásica de baixa gravidade. Na presença de pâncreas divisum, a obstrução por cálculos biliares na papila major condiciona apenas obstrução do pequeno ducto ventral (Wirsung vestigial), pelo que se espera que a pancreatite litiásica não apresente critérios de gravidade9. Ocorreram posteriormente 3 episódios bem documentados de pancreatite aguda, intercalados por períodos assintomáticos. Dada a baixa sensibilidade dos métodos imagiológicos não invasivos convencionais (ecografia e TC) no diagnóstico de pâncreas divisum4, estes não apresentaram alterações significativas. A ausência de stack sign na ecoendoscopia radial, correspondendo à impossibilidade de visualizar (a partir do bulbo duodenal) o ducto pancreático a percorrer paralelamente a porção intra-pancreática da via biliar principal, associou-se à presença de pâncreas divisum numa pequena série prospectiva recente10. Este achado, presente em 67,0% dos doentes com pâncreas divisum e em apenas 16,7% do grupo-controlo10, constituiu nesta doente o primeiro dado suspeito de pâncreas divisum. Mais recentemente, foi descrita a elevada acuidade da ecoendoscopia linear no diagnóstico de pâncreas divisum numa série retrospectiva de 22 casos (confirmados por CPRE) em 162 doentes (sensibilidade, especificidade, valores preditivos positivo e negativo de 95%, 97%, 86%, e 99%, respectivamente)11. O elevado valor da CPRM na definição da anatomia pancreática ductal e no diagnóstico de pâncreas divisum está mais bem definido na literatura12,13, podendo a sua sensibilidade ser optimizada pela administração endovenosa de secretina (sensibilidade >90%)13. Neste caso, a CPRM foi muito sugestiva de pâncreas divisum, definindo a necessidade de repetir a CPRE com canulação da papila minor. Apesar da emergência destes novos métodos de imagem (CPRM e ecoendoscopia), promissores na abordagem diagnóstica do pâncreas divisum, a CPRE permanece actualmente o método diagnóstico gold-standard8.
Dado na maioria dos casos (>95%) o pâncreas divisum ser considerado uma variante assintomática, torna-se necessário definir quando está indicada a intervenção terapêutica14,6. Considera-se existir benefício terapêutico nos doentes com pâncreas divisum e dois ou mais episódios bem documentados de pancreatite aguda idiopática, sem necessidade de qualquer investigação adicional8. A exemplo do presente caso, estes doentes com pancreatite recorrente idiopática são os que melhor respondem à terapêutica4,6-8. Por sua vez, nos doentes com pâncreas divisum e pancreatite crónica, dor abdominal crónica, um episódio isolado de pancreatite, ou sempre que a relação entre pâncreas divisum e pancreatite é duvidosa pela coexistência de outro factor predisponente (ex. álcool), haverá benefício em demonstrar primeiro a existência de obstrução relativa ao fluxo através da papila minor por método não invasivo8,9. A realização de um exame de imagem com estimulação de secretina poderá identificar quais destes doentes beneficiam mais da terapêutica8,9. Warshaw et al.9, demonstrou que a evidência ecográfica de dilatação prolongada (≥ 15 minutos) do ducto dorsal após administração endovenosa de secretina, correlacionou-se com uma maior probabilidade de melhoria clínica após a terapêutica: melhoria clínica em 92% dos doentes com teste de secretina positivo vs melhoria clínica em 40% dos doentes com teste de secretina negativo (sem dilatação prolongada).
A estratégia terapêutica mais eficaz do pâncreas divisum continua a ser assunto de controvérsia, tendo sempre como objectivo aliviar a obstrução e melhorar a drenagem pancreática via papila minor. As diferentes abordagens terapêuticas endoscópicas disponíveis (tais como a ETE ou dilatação da papila minor, com posterior colocação de prótese) apresentam eficácia clínica semelhante à descrita na terapêutica cirúrgica tradicional (esfincteroplastia ou esfincterectomia da papila minor), com menor morbilidade associada, em várias séries retrospectivas recentes4,6-8 e numa única série prospectiva14.
Globalmente, espera-se eficácia clínica após endoterapia da papila minor em cerca de 75% dos doentes com pancreatite recorrente idiopática, traduzindo-se pela diminuição do número de episódios de pancreatite e hospitalizações7,8. Nos doentes com pancreatite crónica ou dor abdominal crónica, espera-se eficácia clínica da terapêutica em cerca de 50% dos doentes (com redução da dor e menor necessidade de terapêutica analgésica e hospitalizações)7,8. Lans et al.14 no único estudo prospectivo randomizado existente (englobando 19 doentes com pâncreas divisum e pancreatite recorrente idiopática), descreveu melhoria sintomática em 90% dos doentes submetidos a terapêutica endoscópica (com colocação de prótese pancreática no ducto dorsal) vs 11% no grupo-controlo.
As taxas de sucesso clínico e de complicações das diferentes técnicas de tratamento endoscópico são equiparáveis nos vários estudos retrospectivos publicados. A técnica mais usada é a ETE da papila minor (ou, mais correctamente, papilotomia, uma vez que a papila minor não possui um verdadeiro esfíncter), com uma incisão de 4 a 6 mm posicionada entre as 10 e 12 horas, seguida da colocação de prótese7. A prótese pancreática evita a obstrução precoce do orifício de ETE por edema e fibrose e diminui o risco de pancreatite pós-procedimento, devendo ser removida no período máximo de 2 meses, de forma a evitar lesões ductais induzidas pela prótese e risco de obstrução4,8. Assim, recomenda-se o controlo radiográfico após aproximadamente 4 semanas e remoção endoscópica da prótese no caso de não ter migrado espontaneamente para o lúmen duodenal8. A técnica de ETE realizada no presente caso, considerada a técnica standard (pull-type), apresentou resultados semelhantes à ETE com faca pré-corte (needle-knife) na maior série retrospectiva descrita na literatura7. Nesse estudo7 (n = 184), após um período médio de seguimento de 5 anos, os resultados das taxas de reintervenção endoscópica (~30%), de reestenose (~20%) e de complicações precoces (~8%) foram semelhantes em ambos os grupos de tratamento. Foram descritos resultados semelhantes após dilatação com balão da papila minor (sem ETE), seguida da colocação de prótese pancreática, numa pequena série retrospectiva15. As taxas de complicações após ETE da papila minor (independentemente da técnica usada) nas três maiores séries descritas na literatura foram de 8,2% (pancreatite aguda em 6,5% e hemorragia em 1,7%)7, 11,0% (apenas casos de pancreatite aguda)8 e 11,7% (pancreatite aguda em 10,7% e perfuração em 1,0%)6. Apesar do aceitável número de complicações da endoterapia da papila minor, salientam-se as elevadas taxas de reestenose (~20%) e necessidade de reintervenção (~30%), esta última particularmente mais elevada no subgrupo de doentes com pâncreas divisum associado a pancreatite crónica e alterações ductais7. São necessários estudos prospectivos para definir se este último subgrupo de doentes continua a ser candidato à endoterapia da papila minor e qual o papel actual da terapêutica cirúrgica.
Bibliografia
1. Neuhaus H. Therapeutic pancreatic endoscopy. Endoscopy 2002; 34:54-62. [ Links ]
2. Delhaye M, Engelholm L, Cremer M. Pâncreas divisum: congenital anatomic variant or anomaly? Contribution of endoscopic retrograde dorsal pancreatography. Gastroenterology 1985; 89:951-958.
3. Carr-Locke DL. Pancreas divisum: the controversy goes on? Endoscopy 1991; 23:88-90.
4. Heyries L, Barthet M, Delvasto C, Zamora C, Bernard JP, Sahel J. Long-term results of endoscopic management of pancreas divisum with recurrent acute pancreatitis. Gastrointest Endosc 2002; 55:376-381.
5. Tulassay Z, Jakab Z, Vadasz A. Secretin provocation ultrasonography in the diagnosis of papillary obstruction in pancreas divisum. Gastroenterol J 1991; 51:47-50.
6. Chacko LN, Chen YK, Shah RJ. Clinical outcomes and nonendoscopic interventions after minor papilla endotherapy in patients with symptomatic pancreas divisum. Gastrointest Endosc 2008; 22:11-17.
7. Attwell A, Borak G, Hawes R, Cotton P, Romagnuolo J. Endoscopic pancreatic sphincterotomy for pancreas divisum by using a needle-knife or standard pull-type technique: safety and reintervention rates. Gastrointest Endosc 2006; 64:705-711.
8. Gerke H, Byrne MF, Stiffler HL, Obando JV, Mitchell RM, Jowell PS, et al. Outcome of endoscopic minor papillotomy in patients with symptomatic pancreas divisum. JOP 2004; 5:122-131.
9. Warshaw AL, Simeone JF, Schapiro RH. Evaluation and treatment of the dominant dorsal duct syndrome (pancreas divisum redefined). Am J Surg 1990; 159:59-66.
10. Bhutani MS, Hoffman BJ, Hawes RH. Diagnosis of pâncreas divisum by endoscopic ultrasonography. Endoscopy 1999; 31:167-169.
11. Lai R, Freeman ML, Cass OW, Mallery S. Accurate diagnosis of pâncreas divisum by linear-array endoscopic ultrasonogrphy. Endoscopy 2004;36:705-709.
12. Kamisawa T, Tu Y, Egawa N, Tsuruta K, Okamoto A, Kamata N. MRCP of congenital pancreaticobiliary malformation. Abdom Imaging 2007; 32:129-133.
13. Matos C, Metens T, Deviére J. Pâncreas divisum: evaluation with secretin-enhanced magnetic resonance cholangiopancreatography. Gastrointest Endosc 2001; 53:728-733.
14. Lans JI, Geenen JE, Johanson JF. Endoscopic therapy in patients with pancreas divisum and acute pancreatitis: a prospective, randomized, controlled clinical trial. Gastrointest Endosc 1992; 38:430-434.
15. Ertan A. Long-term results after endoscopic pancreatic stent placement without pancreatic papillotomy in acute recurrent pancreatitis due to pancreas divisum. Gastrointest Endosc 2000; 52:9-14.
Correspondência: Miguel Bispo; Serviço de Gastrenterologia; Centro Hospitalar de Lisboa Ocidental, E.P.E. – Hospital de Egas Moniz; Rua da Junqueira 126, 1349-019, Lisboa.; Tel.: +351 919 00 2599, Fax: +351 213 62 4139; e-mail: gastregas@hegasmoniz.min-saude.pt
Recebido para publicação: 18/07/2008 e Aceite para publicação: 16/12/2008













