Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Acessos
Acessos
Links relacionados
-
 Similares em
SciELO
Similares em
SciELO
Compartilhar
Jornal Português de Gastrenterologia
versão impressa ISSN 0872-8178
J Port Gastrenterol. v.17 n.2 Lisboa mar. 2010
Doença de Whipple
Luís Oliveira1, Ricardo Gorjão2, João Ramos de Deus3
1Interno de Gastrenterologia – Hospital Fernando Fonseca;
2Assistente Hospitalar Graduado de Gastrenterologia – Hospital Fernando Fonseca;
3Chefe de Serviço de Gastrenterologia – Hospital Fernando Fonseca; Serviço de Gastrenterologia, Hospital Fernando Fonseca, Amadora
Resumo
Os autores procedem à revisão da entidade nosológica conhecida como Doença de Whipple. Descrevem as características epidemiológicas, etiopatogénicas e clínicas desta doença, referem e discutem os avanços no seu diagnóstico e terapêutica. Trata-se de uma doença bacteriana rara, crónica, de carácter multissistémico, provocada pelo bacilo gram-positivo, Tropheryma Whipplei, da família das Actinobacterias e do grupo Actinomycetes. Por ter uma apresentação clínica variada e por se tratar de uma doença rara é muitas vezes diagnosticada tardiamente. É necessário monitorizar a sua evolução clínica durante e após a terapêutica.
Palavras-chave: Doença de Whipple; Tropheryma Whippleii; Infecção.
Whipples disease
Abstract
The authors review the entity known as Whipples disease, describing its epidemiology and clinical presentation, discussing and updating recent advances relevant to its diagnostic and therapeutic management. Whipples disease is a rare, chronic bacterial illness, with multisystemic involvement, caused by a gram-positive bacillus, Tropheryma Whipplei, of the Actinobacterias family and Actinomycetes group. Due to its multiform presentation and rarity it is often misdiagnosed and warrants close follow-up to assess therapeutic response.
Keywords: Whipple Disease; Tropheryma Whippleii; Infection.
INTRODUÇÃO
« George Hoyt Whipple, in 1907, recognized the first case of the disease that now bears his name. His patient was a 36 year-old doctor, who had gradual weigh loss, indefinite abdominal signs and polyarthritis. His stools consisted of neutral fat and fatty acids. The patient died in approximately five years from the appearance of the symptoms. On May 9, 1907 George Hoyt Whipple, then an instructor in Pathology at John Hopkins University performed an autopsy on this patient who had been domiciled at Constantinople (Turkey). The findings at autopsy consisted of polyserositis, aortic valve lesion and deposition of fat within intestinal mucosa and mesenteric lymph nodes with marked infiltration by foamy macrophages. Furthermore Whipple reported the presence of rod-like bacilli approximately 2μm long in the lamina propria of the intestine but he didnt consider that to be the etiology of the disease. Using special stains he noticed the presence of fatty acids but he didnt manage to detect any neutral fat and so he made the mistake of considering this disease to be caused by an abnormality of fat metabolism. Hence he named this disease intestinal lipodystrophy. »
Em 1907, George Hoyt Whipple (1878-1976), jovem patologista em início de carreira, publicou o seu segundo artigo científico relatando os resultados da autópsia que realizara a um doente de 36 anos, vítima de uma doença nunca antes reconhecida que evoluíra ao longo de 5 anos, provocando febre, emagrecimento, diarreia, tosse e artrite1. Whipple visualizou deposição de lípidos e julgou que se tratava de uma patologia do metabolismo lipídico, pelo que escolheu o termo descritivo lipodistrofia intestinal para a nomear1.
Foram descritos poucos casos ao longo de várias décadas pois o diagnóstico só podia ser confirmado por autópsia. O primeiro diagnóstico antemortem foi realizado em 1947, por observação de nódulos linfáticos do mesentério retirados por laparotomia2 e o primeiro diagnóstico por biópsia peroral do intestino ocorreu apenas em 19583.
Em 1949 uma nova técnica de coloração histoquímica, introduzida por Black-Schafer, foi aplicada a vários tecidos (intestino delgado, nódulos linfáticos, pulmões ) extraídos de um doente com lipodistrofia intestinal4. A reacção positiva ao reagente Periodic Acid-Schiff (PAS) revelou que os depósitos no citoplasma dos macrófagos, descritos por Whipple, não continham lípidos mas material glicoproteíco. Em 1960, por meio da microscopia electrónica, foi possível identificar bactérias no citoplasma dos macrófagos5,6. Foi, assim, estabelecida a natureza infecciosa da doença, permitindo um avanço significativo no seu tratamento com o recurso a antibióticos7.
Entre 1963 e 1970 ficou claro, através dos resultados das autópsias e da observação clínica, que a infecção não se confinava ao intestino mas que, frequentemente, envolvia outros órgãos, podendo afectar o aparelho osteo-articular, o sistema nervoso central e o sistema cardiovascular, causando uma doença multissistémica8,9.
Só em 1991-2, foi possível caracterizar o microorganismo através de análise por PCR da sequência genética 16S-23S ribossoma DNA (rDNA). O bacilo foi classificado no grupo dos Actinomycetes e denominado Tropheryma Whipplei10,11.
Em 1999 Raoult et al, utilizando técnicas laboratoriais especiais, conseguiram cultivar a bactéria pela primeira vez recorrendo a linhas celulares originárias de fibroblastos humanos10,12,13,92.
Em 2003 é completada a sequência e a análise do genoma bacteriano14,10, condensado em 925.938 pares de bases, sem possibilidade de organizar vias biossintéticas fundamentais e com reduzida capacidade de metabolismo energético, demonstrando tratar-se de um organismo com restrita autonomia, embora capaz de sobreviver e de se multiplicar fora das células hospedeiras. De facto, o conhecimento do genoma veio possibilitar o cultivo da bactéria in vitro sem recurso a células hospedeiras91.
Actualmente esta infecção crónica, de carácter multi-sistémico e recidivante2,3,8,9 causada pelo bacilo gram positivo diástase-resistente Tropheryma Whipplei, relacionado filogeneticamente com o Mycobacetrium avium10,11,15,16 é designada por Doença de Whipple (DW) em honra do patologista que a descreveu originalmente com notável clareza, objectividade e detalhe.
Epidemiologia
Desconhecemos o habitat natural do Trophryma Whipplei. A sua relação filogenética com bactérias presentes no ambiente e o facto de ter sido detectada no solo (o que poderia explicar uma maior prevalência entre os agricultores17) e em águas de esgoto parecem sugerir uma fonte ambiental7,18,19,20,21. Por outro lado existem evidências de que esta bactéria possa pertencer à flora comensal humana: estudos de PCR permitiram detectar a presença do Tropheryma Whiplei em amostras de saliva, suco gástrico e em biópsias duodenais de indivíduos sem a doença20,21,23,24. No entanto, à luz dos conhecimentos actuais, esta controvérsia permanece por resolver aguardando-se que novos estudos possam vir a esclarecer esta dúvida22.
A DW é uma doença rara17-25 mas a verdadeira incidência da doença ainda não é conhecida. Alguns estudos7 sugerem a ocorrência, em todo o mundo, de aproximadamente 12 novos casos/ano, porém este número representa seguramente uma subestimativa do total de casos. De facto, após a introdução de novos métodos de diagnóstico, nomeadamente a análise de PCR28, verificou-se um aumento do número de casos descritos e publicados. Cerca de 80% dos indivíduos afectados são do sexo masculino26, na sua maioria de raça caucasiana, residentes na Europa e América do Norte7. A idade média na altura do diagnóstico é de 49 anos, mas a doença pode surgir em qualquer faixa etária (na literatura estão descritos doentes com idades compreendidas entre os 3 meses e os 83 anos)25-27. Estudos realizados em populações da Europa e da América do Norte identificaram uma maior prevalência da doença nas zonas rurais (de modo particular entre os agricultores) e revelaram que cerca de 26% dos doentes apresentava, numa proporção 3 a 4 vezes superior ao esperado, o antigénio de histocompatibilidade da classe I HLA B277,20,29-31. Contudo esta última associação não foi encontrada noutras populações estudadas (italiana32, argentina30). Apesar de não existir um padrão de transmissão familiar na DW, foram descritos alguns casos em familiares de doentes portadores de DW5,20,21,29,30-33, sendo no entanto necessários mais estudos para esclarecer se existem ou não alterações genéticas susceptíveis de predispor para este tipo de infecção.
Etiopatogenia
A etiologia da DW permaneceu desconhecida até há bem pouco tempo, embora houvesse fortes suspeitas de ter origem bacteriana1,17,25. Em 1960 a microscopia electrónica (Fig.1) permitiu detectar estruturas baciliformes trilaminares, presentes na mucosa e nos macrófagos do intestino, que correspondiam às estruturas PAS positivo observadas na microscopia óptica5,6,34-36 (Fig.2). Em 1991 foi possível sequenciar uma fracção do genoma, 16S-23D rDNA, e identificar o organismo como sendo um actinomiceto gram positivo diastase-resistente, inicialmente designado T. Whipeli, e, posteriormente, T. Whipplei, medindo aproximadamente 0,2-2,5 μm de diâmetro e 2,5 μm de comprimento15,35,37, cuja presença nos tecidos foi possível visualizar com o desenvolvimento das técnicas de biologia molecular de hibridação e fluorescência in situ.
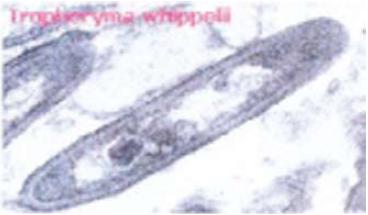
Fig. 1. Microscopia Electrónica. Fonte: Von Herbay A. Whipple`s Disease Online (www.whipplesdisease.net)
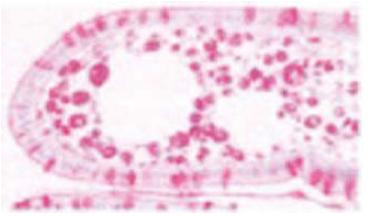
Fig. 2. Microscopia óptica. Fonte: Von Herbay A. Whipple's Disease Online (www.whipplesdisease.net)
Continuamos, porém, a desconhecer os pormenores da fisiopatologia da doença. Vários investigadores38 indicam como provável uma susceptibilidade individual ao organismo, ou seja, parece haver um defeito na imunidade celular, envolvendo a activação e interacção dos macrófagos com os linfócitos T, que resultaria na deficiente fagocitose e degradação intracelular do bacilo, permitindo a sua disseminação a partir do aparelho gastrointestinal. De facto, estes doentes apresentam macrófagos com incapacidade de degradar o microorganismo a nível intracelular39 bem como uma resposta deficiente de hipersensibilidade cutânea retardada40-42. Esta alteração dos macrófagos resulta da existência de um défice da expressão de proteínas membranares do receptor 3 alfa da cadeia do complemento (CD11b), um dos responsáveis pela fagocitose intracelular42. Nestes doentes existe também um defeito intrínseco na produção de IL-12, o que induz uma menor produção de INF-G e, consequentemente, uma diminuição de produção de imunoglobulinas G2 e da capacidade de fagocitose intracelular dos macrófagos intestinais12,40,42. Assim, parece que a alta concentração de bactérias viáveis na mucosa intestinal está relacionada com o defeito de imunidade celular, caracterizada pela deficiência de resposta Tr 1 e da presença reduzida de linfócitos CD4+ na lâmina própria. Este facto sugere que a mucosa intestinal seja a porta de entrada do bacilo43.
Manifestações clínicas
A DW é uma doença sistémica com manifestações clínicas variadas7-9 mas que atinge de modo particular o intestino delgado7. A forma mais comum de apresentação é uma síndrome de má absorção com diarreia e perda ponderal, podendo originar, se não for tratada, estados de caquexia26. A diarreia é, frequentemente, do tipo esteatorreia com fezes volumosas. As manifestações clínicas mais frequentemente associadas à diarreia são a dor abdominal, a febre e linfadenopatias periféricas e abdominais (mesentéricas e retroperitoniais)8,9,26,27,44,44a. Em casos raros podem surgir linfomas malignos nos doentes com DW45-47. As queixas osteo-articulares surgem em cerca de 90% dos doentes, sendo predominantemente oligo ou poliartralgias simétricas, migratórias e de curta duração; geralmente precedem o diagnóstico em cerca de 10 anos (nalguns casos em mais de 30 anos)20-22,26,27,29-31,48,49. Em 45% dos doentes com DW, o Sistema Nervoso Central (SNC) é também atingido pela infecção25,26,50. O SNC é afectado de forma isolada em apenas 5% dos doentes25. Em aproximadamente 15 a 20% dos doentes as queixas gastrintestinais são frustres e a DW pode manifestar-se simplesmente através das alterações neurológicas26,51. As alterações neurológicas mais frequentes da DW são distúrbios cognitivos, e dos movimentos oculares, alterações do movimento (mioclonias) e alterações hipotalâmicas44,45. Esta doença ainda se pode manifestar sob a forma de convulsões, alterações neurológicas focais e alterações da linguagem (disfasia)44,44a,45,50,52. As manifestações cardíacas são sobretudo endocardites, miocardites e pericardites11, sendo a válvula mitral a mais frequentemente atingida pela infecção53. Outras manifestações raras da DW são: hiperpigmentação da pele26,27,44,44a uveíte, vitreíte, neurite, rectobulbar e papiledema7,23.
Diagnóstico
Em caso de suspeita de DW o procedimento imediato para diagnóstico é a endoscopia digestiva alta26,27,44,44a. Os achados endoscópicos mais frequentes são o espessamento das pregas da mucosa, com exsudados esbranquiçados confluentes alternando com erosões e áreas de friabilidade da mucosa21,54 (Fig.3). Deve-se proceder à colheita para análise histológica de pelo menos cinco biópsias ao longo da mucosa duodenal proximal e distal e do jejuno proximal55. O padrão histológico clássico da doença caracteriza-se pela presença, na lâmina própria, de infiltrados de macrófagos de citoplasma granular com inclusões PAS positivas e diastase resistentes (que correspondem a restos mais ou menos intactos de bactérias fagocitadas), podendo também observar-se dilatação linfática. Contudo, a presença de macrófagos com material PAS positivo não é patognomónico desta doença, podendo ocorrer em casos de infecção por Mycobacterium avium-intracellulare, Rhodococcus equi, Bacillus cereus, Corinebacterium, Histoplasma ou por outros fungos. Consoante as manifestações clínicas da doença poderão ser recolhidas outras amostras para estudo, nomeadamente, do tecido valvular cardíaco, de nódulos linfáticos, do tecido sinovial ou do líquor38.
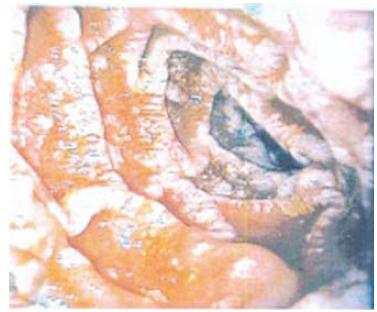
Fig. 3 – Mucosa duodenal. Espessamento das pregas da mucosa com presença de exsudados esbranquiçados confluentes, erosões e áreas de friabilidade da mucosa. Fonte: Luís Oliveira (Serviço de Gastrenterologia do Hospital Fernando Fonseca)
A coloração Ziehl-Neelsen é útil para proceder ao diagnóstico diferencial com as infecções provocadas por bacilos álcool-ácido resistentes56-58.
O facto das biópsias intestinais serem negativas não invalida o diagnóstico, pois a doença pode estar confinada à submucosa. Além disso as biópsias podem ser normais em algumas fases da evolução da doença, de modo particular, nas situações de doença inicial ou após antibioterapia59-61.
A microscopia electrónica contribuiu de modo decisivo, a partir de 1961, para a detecção do bacilo. Apesar da microscopia electrónica ser considerada o exame gold-standard para obter a confirmação do diagnóstico, a PCR é geralmente utilizada com esse objectivo62,63, pois a microscopia electrónica é um método mais dispendioso e exigente uma vez que implica procedimentos laboratoriais complexos, nem sempre acessíveis. Por essa razão só se recorre à microscopia electrónica para esclarecer os casos em que a PCR e/ou a histologia são duvidosas28 (Quadro 1).
Quadro 1 - Métodos de Diagnóstico da doença de Whipple
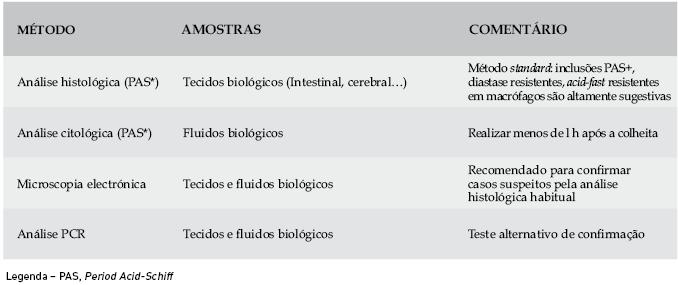
A imunohistoquímica é outra ferramenta que pode contribuir para o diagnóstico. Apresenta boa sensibilidade diagnóstica e permite, com o recurso a anticorpos, detectar o bacilo em macrófagos circulantes no sangue periférico13,60,61,64,65.
As bactérias activas podem ser detectadas em biópsias do intestino delgado através da técnica FISH (Fluorescence in situ hybridization and laser scanning microscopy) capaz de determinar a localização do rRNA que indica a presença de bactérias metabolicamente activas.
O estudo serológico é, por enquanto, considerado como um método com baixa sensibilidade e especificidade para ser útil ao diagnóstico38. A presença de anticorpos IgM num título de pelo menos 1:50 está significativamente associada à DW. Os anticorpos IgG embora sejam detectados mais frequentemente em doentes com DW, também podem estar presentes em títulos superiores a 1:100 em indivíduos sem a doença. No entanto este método produz reacções cruzadas com outros microorganismos, pelo que novos estudos terão de ser realizados antes que seja utilizado no diagnóstico12,66.
A cultura da bactéria é um método de diagnóstico utilizado, na prática, apenas em protocolos de investigação, podendo ser realizada nos fibroblastos humanos (MRC5) e nos monócitos de sangue periférico15,67.
A PCR dirigida a sequências do genoma da bactéria presentes em tecidos e em fluidos orgânicos é um método de diagnóstico com elevada sensibilidade e especificidade68, utilizado nas situações atípicas e/ou quando o diagnóstico não é confirmado pela histologia10,17,24,68. Este método permite a identificação do bacilo a partir de amostras do coração69, vítreo64, células do sangue periférico70,71, pulmão72,90 e líquor73. Existem vários segmentos do genoma – baseados no 16S rRNA, 23S rRNA ou RpoB do bacilo – que podem ser usados para confirmar a presença da bactéria através da PCR74. Actualmente existem análises quantitativas com PCR em tempo real, para segmentos de ADN RpoB, com cut-off baseado no número de cópias de ADN do bacilo (102 a 105 cópias de ADN nos indivíduos infectados e nenhuma nos indivíduos saudáveis), de modo a evitar falsos positivos38. No entanto, para evitar falsos positivos por contaminação, alguns autores58, recomendam a análise em mais do que um tecido orgânico e a utilização de dois conjuntos de primers, bem caracterizados, obtidos a partir de dois genes diferentes do bacilo38.
Na DW, os achados laboratoriais são inespecíficos, sendo frequente encontrar anemia hipocrómica microcítica, linfocitopenia, trombocitose, eosinofilia, VS elevada, aumento das proteínas da fase aguda (nomeadamente PCR), hipoalbuminémia, carência de ferro, alterações das provas hepáticas e hidro-electrolíticas7,27,28,38. Nos doentes com esteatorreia, verifica-se diminuição da absorção da xilose, dos carotenos e do colesterol27,38, sendo estas alterações resultantes da síndroma de má absorção intestinal ou da enteropatia perdedora de proteínas38. As alterações do líquor são geralmente inespecíficas, podendo ser normal ou apresentar pleocitose e aumento das proteínas. No sobrenadante da centrifugação do líquor podem ser encontradas células com material PAS positivo75.
Os exames imagiológicos, nomeadamente o RX contrastado do intestino delgado, podem mostrar alterações inespecíficas da morfologia do intestino (espessamento das pregas do duodeno e do jejuno), comuns nas síndromes de má absorção7,27. Na Ecografia Abdominal e na Tomografia Computorizada Abdominal, observa-se, geralmente, aumento dos nódulos linfáticos do mesentério76. A Tomografia Computorizada e a Ressonância Magnética cerebrais poderão ser normais ou revelar alterações inespecíficas, como um padrão de atrofia cerebral, lesões ocupando espaço com captação de contraste, lesões da substância branca ou hidrocefalia26,51,77. Contudo a Ressonância Magnética é superior em relação à Tomografia Computorizada, uma vez que consegue detectar lesões de menores dimensões77.
Diagnóstico diferencial
A maioria dos sintomas não é específica da doença de Whipple. Com base na clínica e nas características endoscópicas e imagiológicas da DW poderemos afirmar que o espectro de diagnóstico diferencial desta doença é vasto.
A presença de células com material PAS positivo pode, raramente, ser causada por outra infecção intestinal, macroglobulinémia, xantelasmas intestinais ou pseudomelanose duodenal. A doença inflamatória intestinal e a maior parte das vasculites com atingimento gastrointestinal, podem mimetizar a DW, cursando com perturbações da função intestinal e da integridade da mucosa, e deverão ser consideradas no diagnóstico diferencial. A presença de granulomas tipo sarcoidose é rara na DW, podendo no entanto surgir, nas biópsias do estômago89, intestino delgado87,88, fígado e nódulos linfáticos impondo nestes casos um diagnóstico diferencial com sarcoidose. Em situações raras, a DW pode estar igualmente associada a linfomas malignos metacrónicos ou síncronos45-47.
Considerando o amplo leque de diagnósticos diferenciais, convém despistar a DW nos doentes com patologia gastrointestinal, dado que é uma doença potencialmente tratável e que do atraso no seu diagnóstico podem resultar alterações neurológicas irreversíveis38.
Tratamento
A DW não tratada pode ser fatal38. Com antibioterapia os doentes geralmente evoluem com melhoria clínica e laboratorial25. Devido à relativa falta de experiência no tratamento da doença e dada a inexistência de trabalhos prospectivos sobre o tipo e a duração do esquema terapêutico, não existe actualmente um consenso quanto aos antibióticos a utilizar38. Sabemos que as recidivas da DW podem ocorrer vários anos após a suspensão da antibioterapia (mesmo que o tratamento inicial tenha sido eficaz78), surgindo com maior frequência nos doentes com envolvimento do SNC79 e nos doentes tratados com um único tipo de antibiótico ou com um antibiótico que não ultrapasse a barreira hematocefálica (BH), como é o caso das penicilinas orais e das tetraciclinas38. Vários autores recomendam a utilização, pelo menos durante um ano, de antibióticos que ultrapassem a BH uma vez que o SNC é frequentemente atingido e está envolvido com maior frequência nas recidivas de DW73,79. Têm sido utilizados empiricamente vários esquemas terapêuticos que incluíram penicilinas orais associadas a estreptomicinas, tetraciclinas, cloranfenicol, macrólidos e cefalosporinas da terceira geração38. Actualmente o esquema mais utilizado como primeira escolha terapêutica38,80,81 é o cotrimoxazol 160/800 mg per os, duas vezes por dia, durante um ano, em detrimento de outros esquemas terapêuticos que utilizavam a tetraciclina, pois este antibiótico não ultrapassa a BH57,58 (Quadro 2).
Quadro 2 - Esquemas terapêuticos da doença de Whipple

O tratamento oral80,81, particularmente nos doentes mais graves ou com envolvimento do SNC, deve ser precedido de tratamento endovenoso com ceftriaxone 2 gr por dia, durante 15 dias ou com outro antibiótico que ultrapasse a BH. As fluorquinolonas não são consideradas boas escolhas terapêuticas porque, segundo estudos recentes82, o T. Whipplei possui resistências naturais a esta classe de antibióticos. Na literatura actual são referidos, no entanto, outros esquemas (Quadro 2) usando, por exemplo, penicilina benzatínica 6-24 MU/ev/id juntamente com estreptomicina 1gr/im/id durante 15 dias, seguido de cotrimoxazol 160/800 mg/po/2 bid ou cefalosporina de terceira geração per os79. Nos casos de recidiva em doentes tratados com cotrimoxazol80 ou intolerantes a este fármaco38 pode utilizar-se a cefixime (400 mg/po/2 bid) durante um ano. O cloranfenicol (500 mg/po/qid) também poderá ser utilizado no tratamento da DW, mas como alternativa, já que apresenta efeitos secundários graves25. O interferão-y foi apenas utilizado experimentalmente83, e em conjunto com a antibioterapia, em doentes refractários aos antibióticos, resultando em alguns casos na erradicação da bactéria do aparelho gastrintestinal e do SNC.
Prognóstico
O prognóstico da doença é bom se esta for atempadamente tratada. Apesar de, na maioria dos doentes, se verificar uma boa resposta à antibioterapia é difícil reverter as alterações neurológicas e, em muitos casos, a deterioração neurológica, quando presente, mantém-se apesar do tratamento instituído38. Observa-se, contudo, melhor resposta à antibioterapia nos doentes com alterações mentais e oftalmológicas do que nos doentes que apresentam alterações estruturais, como enfartes e alterações atróficas25.
Vários autores aconselham a monitorização dos doentes com biópsias duodenais, aos 6 e 12 meses de tratamento84, nos casos em que se regista evolução clínica favorável, podendo suspender-se a terapêutica se não se identificar material PAS positivo nas biópsias38. No entanto, existem estudos que sugerem períodos de controlo mais longos20,21,49. Outros autores recomendam a utilização da PCR, em vez da histologia, para monitorizar a doença durante e após o tratamento20,22,63 ou para decidir a suspensão do mesmo uma vez que, se a monitorização for apenas histológica, um terço dos doentes pode recidivar e não ser detectado, pois as alterações histológicas nem sempre reflectem as alterações clínicas e laboratoriais49. É sabido que a presença na lâmina própria de macrófagos PAS positivos pode manter-se vários anos após a remissão clínica (correspondente a material bacteriano degradado), pelo que a positividade da PAS após o tratamento pode corresponder a um falso positivo e não a recidiva ou a manutenção da doença22,49. Uma PCR negativa exclui a recidiva da doença (valor preditivo negativo de 100%), sendo útil no caso de permanecerem alterações histológicas após o tratamento20,22,49. Porém, a visualização de bacilos intactos por microscopia electrónica confirma doença activa49,63. Nos casos com manifestações neurológicas só se deve suspender a antibioterapia quando a PCR no líquor (LCR) e no duodeno for negativa12. As recidivas da DW são frequentes e podem ocorrer vários anos após o diagnóstico (média 4,2 anos), sendo o SNC um dos locais preferenciais. O seguimento clínico deve, por isso, ser mantido, pelo menos, durante 10 anos pois é elevado o risco de recidivas tardias20,21,29-31,33,85.
CONCLUSÃO
Foi difícil identificar a bactéria que causa a DW e ainda desconhecemos a maior parte dos seus mecanismos adaptativos, das vias metabólicas que usa e dos produtos biossintéticos relevantes para a sua virulência. Contudo a identificação dos factores de risco da doença, o desenvolvimento de novos métodos de diagnóstico – com recurso a técnicas serológicas, histoquímicas, de imunofluorescência e genéticas – vieram facilitar o diagnóstico atempado desta infecção, mesmo nos casos em que a apresentação clínica é atípica.
O desenvolvimento molecular para testar a susceptibilidade aos antibióticos irá, no futuro, ajudar a definir qual a melhor estratégia de tratamento da doença de Whipple.
Por ter uma apresentação clínica variada e por se tratar de uma doença rara, nem sempre é diagnosticada, com manifesto prejuízo para a sobrevivência dos doentes, sendo na maioria dos casos descritos identificada tardiamente. Mesmo quando detectada e adequadamente tratada, a sua evolução clínica tem de ser monitorizada durante a terapêutica, para confirmar a resposta ao tratamento, e por vários anos após o termo desta, de modo a evitar recidivas tardias.
Referências
1. Whipple GH: A hitherto undescribed disease characterized anatomically by deposits of fat and fatty acids in the intestinal mesenteric lymphatic tissues. Bull John Hopkins Hosp 1907; 18:382-391.
2. Olivierii, Oliver-Pascual A, Un caso de lipodistrofia intestinal con lesions ganglions mesentericas de granulomatosis lipofagica (Enfermedad de Whipple) Rev. Esp. Enferm AparDigest 1947;6:213
3. Bolt R. I. Pollard 11M, Standaert L.Transoral small-bowel Biopsy as an aid in the diagnosis of malabsorption states. N Engl .I. Med 1958;259:32
4. Black-Schaffer B. The Tinctoral demonstration of a glycoprotein in Whipples disease. Proc. Soc Exp Biol Med 1949; 72:225-227 [ Links ]
5. Chears WC. I, Ashworth CT. Electron microscopic study of the intestinal mucosa in Whipples disease. Demostration of encapsulated bacillitorm bodies in the lesion. Gastroenterology 1961;41:129.
6. Yardley J, Hendrix T. Combined electron and light microscopy in Whipple´s disease. Bull Johns Hopkins Hosp 1961;109:180.
7. Dobbins W III. Whipple´s disease. Mayo Clin Proc 1988;63:623-624.7.
8. Enziger E, Helwing E. Whipple´s disease. A review of the literature and report of 15 pacients. Virchows Archiv Pathol Anat 1963; 336:238-269.
9. Maizel H, Ruffin J, Dobbins W III. Whipple´s disease. A review of 19 padients from one Hospital and review of the literature since 1950. Medicine 1970;49:175-205.
10. Relman D, Schmidt T, Mac-Dermott R, Falkos. Identification of the uncultured bacillus of Whipples disease. N Engl J Med 1992; 327:293–301.
11. Wilson Kh, Blitchington R, Frothingham R, J.A.P. Wilson. Phylogeny of the Whipple´s disease associated bacterium. Lancet 1991; 338:474.
12. Raoult D, Birrg ML, La Scola B et al. Cultivation of the Bacillus of Whipples disease. N Engl J Med 2000;342:620-625.
13. Ranoult D, La Scola B., Lecocq P., Lepidi Fournier Pe. Culture and immunological detection of Tropheryma Whippelii, from the duodenum of a pacient with Whipple´s disease. JAMA 2001; 285:1039-1043.
14. Benthey S, Maiwald M, Murphy L, M. Pallen, Corin A, Lynn G, David A, et al. Sequencing and analysis of the genoma of the Whipple´s disease bacterium. Lancet 2003; 361: 637-644.
15. La Scola B, Fenollar F, Fournier P, Altweggg M, Mallet M, Rauolt D. Description of Tropheryma whipple gen.nov, sp. nov., the Whipples disease bacillus. Int J Syst Evol Microbiol 2001;51:1471-1479.
16. Matwadt M. Ditton H. Herbay A, Rainey F Stackebrant E. Reassessment of the phylogentic position of the bacterium associated with Whipple`s disease and determination of 16s-23s ribosomal intergenic spacer sequence. Int J. Syst Bacteriol 1996;46:1078-1082.
17. Fenlar F, Raoult D. Mini Review – Whipple´s disease; Clinical and Diagnostic Laboratory Immunology Jan 2001,1-8.
18. Von Herbay A. Epidemiology of Whipple´s disease in Germany Scand J. Gastroenterol 1997;32:52-57.
19. Maiwald et al. Environmental occurrence of Whipple´s disease bacterium. Appl Environ Microbiol. 1998;64:760-762.
20. Thomas M, Didier R. Whipple´s disease seminar on. Lancet 2003; 361:239-246.
21. Flemner M. Flemner R. Toward a new understanding of Whipples disease. Current. Gastroenterology Reports 2000; 2:299-304.
22. Maiwarald M, Herbay A, Persing D, Ditton H. Tropheryma whippelii DNA is rare in the intestinal mucosa of pacients without other evidence of Whipple´s disease. Ann of inter Med 2001;134:115-119.
23. Erhbar H, Bauerfeind P, Dutly F, Koelzhr, Atwegg M. PCR-positive tests for Tropheryma whippelii in patients without Whipples disease. Lancet 1999; 353:2214.
24. Street S, Donoghue H, Neild G. Tropheryma whippelli DNA in saliva of healthy people, Lancet 1999;354:1178-1179.
25. Anderson M. Neurology of Whipple´s disease. J Neurol Neurosurg Psychiatry 2000; 68:2-5.
26. Durand D, Lecomte C, Cathedras P, Rousset H, Godeau P. Whipple´s disease. Clinical Review of 52 cases. The SNFMI Research Group on Whipple´s disease. Societe Nationale Francaise de Medecine Interne. Medicine Tropheryma Whipplei 1997;76:170-184.
27. Fleming J, Wiesner R, Shorter R. Whipple´s disease. Clinical, biochemical and histopatologic features and assessment of treatment in 29 patients. Mayo Clin Proc 1988; 63:539-551.
28. Dutly F, Altwegg M. Whipples Disease and Tropheryma whippelii. Clin Microbiol Rev. 2001;561–583.
29. Feurle G, Dorken B, Schopf E, Lenhard V. HLA-B27 and defects in the T-cell system in Whipple´s disease. Eur J Invest 1979; 9:385-389.
30. Bai J Mota A, Maurino et al. Class I and Class II HLA antigens in homogenous Argentinean population with Whipple´s disease. Lack of association with HLA-B27. Ann J Gastroenterol 1991;86:992-994.
31. Dobbins W III. HLA antigens in Whipple´s disease. Arthrist Rheum 1987;30:102.
32. Olivieri I, Brandi G. Padula A, et al. Lack of association with spondyloarthristis and HLA-B27, in Italian pacients with Whipple´s disease. J Rheumatol 2001;28:1294-1297.
33. Gross J, Wollaeger E, Sauer W, Hiuzengka Dahlinin D, Power M. Whipple´s disease. Report of four cases, including two brothers, with observations on pathologic physiology,diagnosis and treatment. Gastroenterol 1959; 36:65-93.
34. Dykmam D. Cuccherini B, Fuss I Blum L, Woodward J, Strober. W. Whipple´s disease in father-daughter pair.Dg. Dis Sci 1994; 44:2542-2544.
35. Dobbins W, Kawanishi H. Bacillary characteristic in Whipple´s disease on electron microscopic study. Gastroenterology 1981; 80:1468-1475.
36. Cohen A, Schimmel E, Holt P, Isselbacher K. Ultrastructural abnormalities in Whipple´s disease. Proc Soc Exp Biol Med 1960;105:411-414.
37. Silva Mt Macedo P, Moura Nunes J. Ultrastruture of bacilli and the bacillary origin of the macrophagic inclusions in Whipple´s disease. J Gen Microbiol 1985;1312:1001.
38. Marth T, Raoult D. Whipples disease Seminar. Lancet 2003;361:239-246.
39. Bjerknes R, Odegaard S, Bjerkvig R, Borkje B, Laerum Od. Whipples disease. Demonstration of a persisting monocyte and macrophage dysfunction. Scand J Gastroenterol 1988; 23: 611-619.
40. Dobbins W 3rd: Is there an immune deficit in Whipples disease? Dig Dis Sci 1981; 26: 247-252.
41. Groll A, Valberg L, Simom J, Eidingerd, Wilson D, Fordyke D. Immunological defect in Whipple´s disease. Gastroenterology 1972; 63:943-950.
42. Marth Rouxm, Von Herbay A, Meuer S, Feurle G. Persisten reduction of complement receptor 3 alpha- chain expressing mononuclear blood cells and transient inhibitory serum factors in Whipple´s disease. Chin Immunol Immunopathol 1994;72; 217-226.
43. Marth T, Kleen N, Stallmach A, et al. Dysregulated Peripheral and Mucosal Th1/Th2 Response in Whipples disease. Gastroenterology 2002; 123:1468-1477.
44. Von Herbay A, Otto H. Whipple´s disease. Report 22 pacients Klin wochenschr 1988;66: 555.
44a. Marth T, Neurath M, Cuccherini B, Strober W. Defects of monocyte interleukin 12 production and humoral immunity in Whipples disease. Gastroenterology 1997;113: 442-448.
45. Von Herbay A, Otto H. Abdominale lymphone beim Morbus whipple. DFSCH Med Wochenschr 1989; 114: 2028.
46. Gillen C, Coddington R, Monteith P, et al. Extraintestinal lymphoma in association with Whipple´s disease. Gut 1993; 34:1627.
47. Gruner U, Goesch P, Donner A, et al. Morbus Whipple´s disease and non Hodgkin lymphoma. Z. Gastroenterol 2001;39:305.
48. Comer G, Brandt L, Abissi C. Whipple´s disease. A review Am J Gastroenterol 1983;78: 107-114.
49. Petrides P, Muller-Hocker J, Fredricks D, Relman et al. PCR analysis of T. whippelii DNA in a case of Whipples disease: effects of antibiotics and correlation with histology. Am J Gastroenterol 1998; 93:1579–1582.
50. Louis E, lynch T, Kautmann P, et al. Diagnostic guidelines in central nervous system Whipple´s disease. Ann Neurol 1996; 40,561-568.
51. Schinider P, Trattnig S, Kolleger H, et al. MR of cerebral Whipple´s disease AJNR Am J Neuroradiol 1995; 16:1328-1329.
52. Messori A, Di Bella P, Polonara G, et al. An unusual spinal presentation of Whipple´s disease. Am J. Neuroradiol 2001; 22:1004-1008.
53. Ectors N, Geboes K, Devos R, et al. Whipple´s disease: Histological, immunocytochemical and electron-microscopic study of the small-intestinal epithelium. J Pathol 1994; 172,73-79.
54. Geboes K, Ectors N, Heidbuchel H, et al. Whipple´s disease. Endoscopic aspects before and after therapy. Gastrointestinal Endoscopy 1990;36:247-252.
55. Von Herbay A. Whipple´s disease on line. URL http://www.whipplesdisease.net.
56. Strom R, Gruninger Rp. AIDS with mycobacterium aviumintracellulare lesions resembling those of Whipple´s disease. N Eng J Med. 1983;309:1323-1324.
57. Wang H, Tollerd D, Dannar D, et al. Another Whipple´s disease-like disease in AIDS? N Eng J Med 1986; 314:1577-1578.
58. Misbach S, Mapstone. Whipple´s disease revisited. J Clin pathol 2000; 53:750-755.
59. Dausbach C, Shellurne J, Stevens, et al. Lymph-nodes bacilliform bodies resembling those of Whipple´s disease in a pacients without intestinal involvement. Ann Inter Med 1978; 89:64-66.
60. Gubler J, Kuster Dutly F, et al. Whipple endocarditis without overt gastrointestinal disease: Report of 4 cases. Ann Intern Med. 1999; 131:112-116.
61. Caples S, Petrovic L, Ryu J. Successful treatment of Whipple´s disease diagnosed 36 years after symptom onset. Mayo Clin Proc 2001;76:1063-1066.
62. Von Herbay A, Ditton, Maiwald M. Diagnostic application of a polymerase chain reaction assay for the Whipple´s disease bacterium to intestinal biopsies. Gastroenterology 1996;110:1735.
63. Ramzan N, Loftus E, Burgart L, et al. Diagnosis and monitoring of Whipple´s disease by polymerase chain reaction. Ann Intern Med 1995;126:520-527.
64. Raoult D, Lepidi H, Harle J. Tropheryma Whipplei circulating in blood monocytes. N Engl J Med 2001;345-548.
65. Fenollar F, Fournier P, Gerolami R, et al. Quantitative detection of Tropheryma Whipplei DNA by real-time PCR. J Clin Microbiol 2002;40:1119–1120.
66. Schaffner A, Schneemann M. Whipple´s disease – from enigma to genomics (commentary). Lancet 2003;361:632.
67. Schoedon G, Goldenberger D, Forrer, et al. Deactivation of macrophages with interleukin – 4 is the key to the isolation of tropheryma whippelii. J Infecto Dis 1997;176:672-677.
68. Pron B, Poyart C, Abachin E, et al. Diagnosis and follow-up of Whipples disease by amplification of the 16S rRNA gene of Tropheryma whippelii. Eur J Clin Microbiol Infect Dis 1999;18:62–65.
69. Wender D, Mendoza E, Schleeiffer T. Tropheryma whippelii endocarditis confirmed by polymerase chain. Eur Heart J 1995;16:424-425.
70. Rickman L, Freeman W, Green W. Uveitis caused by Tropheryma whippelii. N Engl J Med 1995;332:363-366.
71. Lowsky R, Archer G, Fyles G, et al. Brief report: diagnosis of Whipple´s disease by molecular analysis of peripheral blood. N Engl J Med 1994; 331:1343-1346.
72. Mullerc, Stain C, Burghber O. Tropheryma whippelii in peripheral blood mononuclear cells and cells of pleural effusion. Lancet 1993;341:701.
73. Von Herbay A, Ditton H, Scuhmacher F, et al. Whipple´s disease. Stanging and monitoring by cytology and polymerase chain reaction analysis of cerebrospinal fluid. Gastroenterology 1997;113:434-441.
74. Drancourt M, Carlioz A, Raoult D. RpoB sequence analysis of cultured Tropheryma whippelii J Clin Microbiol 2001; 39:2425-2430.
75. Wietholter H, Dighgans J. Diagnosis of cerebral Whipple´s disease by cerebrospinal fluid cytology. Arch Psychiatr Nervenker 1982;231:283-287.
76. Meier-Willersen H, Maiwald M, Von Herbay A. Morbus whipple in Assoziaton mit opportunistischen Infektionen. Dtsch Med Wochenschr 1993,11:854.
77. Fremer S, Besson G, Bonaz B, et al. Diffuse Lesions in the CNS Revealed by MR Imaging in case of Whipple´s disease. Am J Neuroradiol 2001; 22:493-495.
78. Knox D, Bayless T, Pittman F. Neurological disease inpatients 78. with treated Whipple´s disease. Medicine 1976;55:467-476.
79. Keinath R, Merrell D, Vli-Etstra R, Dobbins O 3RD: Antibiotic treatment and relapse in Whipples disease. Long-term follow-up of 88 patients. Gastroenterology 1985;8:1867-1873
80. Cooper G, Blades E, Remler B, et al. Central nervous system Whipple´s disease: Relapse during therapy with trimethoprim-sulfamenthoxazol and remission with cefixime. Gastroenterology 1994;106:782-786.
81. Feurle G, Marth T. An evaluation of antimicrobial treatment for Whipple´s disease: tetracycline versus trimethoprim-sulfamethoxazol. Dig Dis Sci 1994;39:1642-1648.
82. Masselot F, Boulos A, Maurin M, Rolain J, et al. Molecular evaluation of antibiotic susceptibility Tropheryma Whipplei paradigm. Antibimicrob Agents Chemother 2003;47: 1658-1664.
83. Schneider T, Stallmach A, Marth T, et al. Treatment of refractory Whipple´s disease with recombinant interferon-gamma. Ann Intern Med 1998;129:875-877.
84. Muller N, Schneider T, Zeitz M, et al. Whipples disease: new aspects in pathogenesis and diagnosis. Acta Endoscopica 2001;31:243–253.
85. Flemmer M, Flenner R. Current Insights in Whipples Disease. Curr Treat Options Gastroenterology 2003;6:13-16.
86. Von Herbay A, Morbus Whipple. Histologische Diagnostik nach der Entdeckung von Tropheryma whippelii. Pathologe 2001;22:82
87. Von Herbay A, Maiwald M, Ditton H, et al. Histology of intestinal Whipple´s disease revisited. A study of 48 pacients. Virchows Arch. 1996;429:335.
88. Babaryka I, Thorn L, Langer E. Epitheliod cell granulomata in the mucosa of the small intestine in Whipple´s disease.Virchows Arch. 1979;382:227.
89. Ectors N, Geboes K, Wynants P, et al. Granulomatous gastritis and Whipple´s disease. Am J Gastroenterology 1992;87:509.
90. Muller C, Petermann D, Stain C, et al. Whipples disease. Comparison of histology with diagnosis based on polymerase chain reaction in four consecutive cases. Gut 1997; 40:425–427.
91. Renesto P, Crapoulet, Ogata H, et al. Genome-based design of a cell-free culture medium for Tropheryma Whipplei. Lancet 2003;362:447-449.
92. Maiwald M, Von Herbay A, Fredericks D, et al. Cultivation of Tropheryma Whipplei from cerebrospinal fluid. J Infect. Dis 2005;188:801-808.
93. M. Pyrgioti A. Kyriakidis. Whipples disease. A Review Annals of Gastroenterology 2004;17:43-50.
94. David N, Fredricks, David A, et al. Localization of Tropheryma whippelii rRNA in Tissues from patients with Whipples Disease. J Infect, Dis 2001;183:1229-1237.
Correspondência: E-mail: miguelvieiraoliveira@gmail.com; Tel: +351 214 348 247.
Recebido para publicação: 10/11/2008 e Aceite para publicação: 11/02/2009













