Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Acessos
Acessos
Links relacionados
-
 Similares em
SciELO
Similares em
SciELO
Compartilhar
Jornal Português de Gastrenterologia
versão impressa ISSN 0872-8178
J Port Gastrenterol. v.17 n.4 Lisboa ago. 2010
História natural dos tumores mesenquimatosos do tubo digestivo superior e ecoendoscopia
Hermano Santos, Fernando Castro-Poças, Paula Lago, Teresa Moreira, Jorge Areias
Sector de Ultra-Sons – Serviço de Gastrenterologia Hospital Geral de Santo António, Porto
Resumo
INTRODUÇÃO: A impossibilidade de definir pré-operatoriamente a evolução e o prognóstico dos tumores mesenquimatosos digestivos dificulta, frequentemente, a decisão terapêutica. OBJECTIVOS: avaliar a evolução dos tumores mesenquimatosos do tubo digestivo superior e definir que características ecoendoscópicas se associam a alteração da lesão inicial. MÉTODOS: avaliámos retrospectivamente as ecoendoscopias e os processos dos doentes com tumor mesenquimatoso sujeitos a vigilância ecoendoscópica por um período mínimo de 30 meses ou até exérese. Registámos as características ecoendoscópicas iniciais e a sua evolução. Usámos o programa SPSS versão 15 para identificar as características ecoendoscópicas preditoras dessa evolução. RESULTADOS: avaliámos por ecoendoscopia 82 doentes. A maioria, 85,4%, das lesões manteve características ecoendoscópicas estáveis. Das 12 cujas características se alteraram, em 8 essa alteração ocorreu nos primeiros 12 meses; 6 tiveram indicação cirúrgica. Associaram-se a alteração das características ecoendoscópicas: a localização no antro (p = 0,038), o padrão heterogéneo (p = 0,018) e a dimensão superior a 20 mm (p = 0,038). As lesões esofágicas apresentaram menos alterações (p = 0,004). CONCLUSÕES: a maioria das lesões manteve as suas características inalteradas, nomeadamente as esofágicas; as lesões do antro, heterogéneas e com mais de 20 mm podem merecer vigilância mais estreita, principalmente nos primeiros 12 meses, ou cirurgia.
Natural history of upper digestive tract mesenchymal tumors and ultrasound endoscopy
Abstract
INTRODUCTION: The therapeutic decision of mesenchymal gastrointestinal tumors (MT) is a hard task, as it is very often impossible to predict its evolution. AIMS: to evaluate the evolution of the upper gastrointestinal tract MT not being removed, and to define the echo features associated with the index lesion change. METHODS: retrospective review of the endoscopic ultrasonography (EUS) and files from patients with MT submitted to EUS surveillance, for a minimum period of 30 months or to their resection. The basal EUS features and their evolution have been analysed. The SPSS version 15 was used to identify the EUS features predictors of this evolution. RESULTS: 82 patients were followed. The majority of the lesions maintained the EUS features. From those 12 patients whose characteristics have changed, 8 occurred in the first year. The variables associated to the change in EUS features were the antrum localization (p = 0.038), the heterogenous echotexture (p = 0.018) and the diameter > 20 mm (p = 0.038). Esophageal lesions presented fewer changes (p = 0.004). CONCLUSIONS: the majority of the lesions maintained the EUS characteristics unchanged, particularly the esophageal lesions; strict surveillance in the first 12 months or surgery must be considered for tumors in the antrum, with heterogenous echotexture and larger than 20 mm.
INTRODUÇÃO
Os tumores mesenquimatosos constituem o maior grupo de neoplasias digestivas não epiteliais. Apesar de se admitir que representam apenas cerca de 1% dos tumores digestivos primários1-2 e que o número de novos casos anuais estará entre os 10 e os 20 por milhão de pessoas, a sua verdadeira incidência é difícil de determinar e está, muito provavelmente, subestimada. Kawanowa e colaboradores, num trabalho publicado em 2006, constataram que a frequência de tumores do estroma gastrointestinal (GIST) e leiomiomas microscópicos em estômagos ressecados de doentes com cancro do estômago era muito superior – 35 e 28 em 100, respectivamente. Admitiram que dada a reduzida incidência descrita na literatura, poucos dos GISTs e leiomiomas microscópicos adquirem dimensão clinicamente relevante3.
Apesar de assintomáticos e benignos na sua maioria (apenas 10 a 30% dos GIST têm comportamento maligno)2, a evolução dos tumores mesenquimatosos digestivos é muito heterogénea e impossível de definir pré-operatoriamente. As várias tentativas de predizer o comportamento destas lesões com base nas suas características ecoendoscópicas, sugerem que aquelas com mais de 3 a 4 cm, contornos irregulares e heterogéneas (focos hipo ou hiperecóicos) terão, mais provavelmente, um comportamento agressivo4-6. O exame imunohistoquímico de amostras colhidas por punção aspirativa com agulha fina é, geralmente, determinante no diagnóstico das lesões subepiteliais. Mas, actualmente, a sua utilidade é reduzida na definição do comportamento biológico dos GISTs. A maioria é difícil de penetrar pela agulha7 e, de acordo com o trabalho de Akahoshi K et al, a quantidade de tecido colhida foi suficiente em apenas 71% das lesões com menos de 2 cm8. Além disso, a amostra é, geralmente, insuficiente para o cálculo do índice mitótico9-11.
A história natural dos tumores mesenquimatosos também não está bem estabelecida, ainda mais a dos pequenos e com características ecográficas ditas menos agressivas. Por outro lado, por definição de consenso do National Institute of Health, em 2001, todos os GIST comportam potencial malignidade12.
Este conjunto de factores torna difícil e controversa a decisão terapêutica em muitos destes doentes, nomeadamente nos tumores sem clara indicação cirúrgica. Alguns autores sugerem a sua exérese, independentemente das suas características, visto que mesmo pequenos tumores podem metastizar8,13-14. Todavia, esse risco é reduzido na maioria desses casos e a cirurgia seria excessivamente agressiva e onerosa. Assim, a generalidade dos centros pratica uma abordagem conservadora, com vigilância das lesões sem características ecoendoscópicas agressivas ou em doentes em que o risco cirúrgico seja considerado excessivo15. Contudo, a estratégia de vigilância e os seus riscos não estão estabelecidos, em parte pelo desconhecimento da evolução natural destas lesões não ressecadas.
Assim, os objectivos deste trabalho são avaliar a evolução das lesões do tubo digestivo superior com características ecoendoscópicas de tumor mesenquimatoso não sujeitas a exérese e definir quais dessas características se associam a alteração da lesão.
MATERIAL E MÉTODOS
Analisámos retrospectivamente os relatórios das ecoendoscopias e os processos clínicos dos doentes com diagnóstico ecoendoscópico de tumor mesenquimatoso do tubo digestivo superior feito entre Janeiro de 2000 e Dezembro de 2008. Nesse período, no Hospital Geral de Santo António, diagnosticámos tumor mesenquimatoso em 141 doentes. Excluímos os 17 doentes com indicação cirúrgica no momento do diagnóstico e outros 28 que não foram seguidos naquele hospital. Foram perdidos durante o seguimento (antes do trigésimo mês) 14 doentes.
Realizámos vigilância ecoendoscópica das lesões em 82 doentes por um período mínimo de 30 meses ou até indicação cirúrgica. A duração média do seguimento foi de 34,4 ± 11,9 (6 a 60) meses.
As características ecoendoscópicas com possível interesse prognóstico estudadas foram as seguintes:
Localização: esófago, fundo, corpo e antro gástricos e duodeno;
Dimensão (considerado o maior diâmetro transversal em milímetros);
Camada de dependência: muscular da mucosa, submucosa, muscular própria;
Padrão: homogéneo ou heterogéneo;
Regularidade dos contornos.
Para todos os doentes foi feito o registo das características no momento do diagnóstico e da sua evolução ao longo do período de seguimento. Considerou-se significativo o aumento superior a 5 mm no diâmetro das lesões. A alteração das restantes características ecoendoscópicas foi considerada mediante a avaliação subjectiva do endoscopista.
ESTRATÉGIA DE VIGILÂNCIA
Como exposto na introdução deste texto, e em consequência de alguns dos motivos referidos, a decisão terapêutica pode ser controversa não existindo linhas de orientação bem definidas e consensuais num grande número destes doentes.
De forma geral, a abordagem dos doentes incluídos neste estudo obedeceu ao esquema da Fig. 1. Aos doentes sintomáticos ou com tumores de dimensões superiores a 30 mm ou outras características ecoendoscópicas sugestivas de comportamento agressivo e sem contraindicação cirúrgica foi proposta exérese. Aqueles com lesões de menores dimensões, aspecto ecoendoscópico favorável ou com risco cirúrgico excessivo iniciaram programa de vigilância com ecoendoscopia aos 6 e aos 12 meses após o diagnóstico.
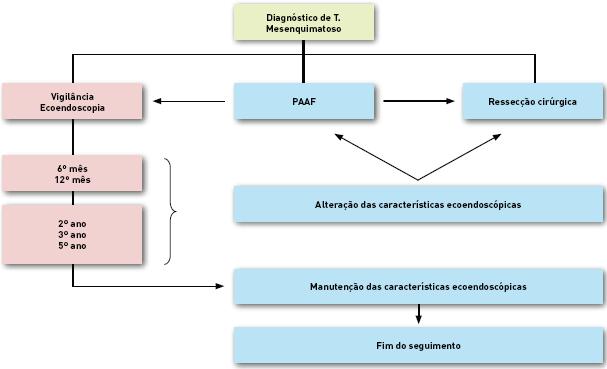
Fig. 1. Diagnóstico de tumor mesenquimatoso. PAAF – Punção aspirativa com agulha fina.
Perante a manutenção das características ecoendoscópicas, o intervalo dos exames foi alargado até completar 5 anos de seguimento, altura em que, perante lesões de características estáveis e favoráveis, a maioria dos doentes terminou o follow-up. Quando as lesões sofreram aumento significativo das suas dimensões ou adquiriram outras características sugestivas de agressividade, foi sugerida exérese cirúrgica. Nos restantes casos, sem clara indicação para ressecção nem características francamente favoráveis, no momento do diagnóstico ou durante o seguimento, foi realizada colheita para exame citológico/imunohistoquímico por punção aspirativa com agulha fina (PAAF).
ANÁLISE ESTATÍSTICA
A análise estatística foi feita com recurso ao programa SPSS, versão 15. Foram utilizados o teste χ2 e o teste exacto de Fisher para estudar a relação entre as variáveis cosideradas e a evolução das lesões. As variáveis significativas nos testes anteriores foram incluídas em análise multivariada por regressão logística para identificar as variáveis independentes associadas a lesão instável. Considerou-se estatisticamente significativo um p < 0,05.
RESULTADOS
Seguimos, com ecoendoscopia, 82 doentes (39 homens e 43 mulheres) com idade média de 54 ± 13,5 anos (18 a 83).
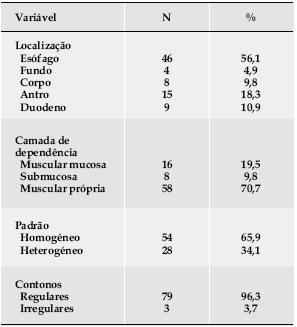
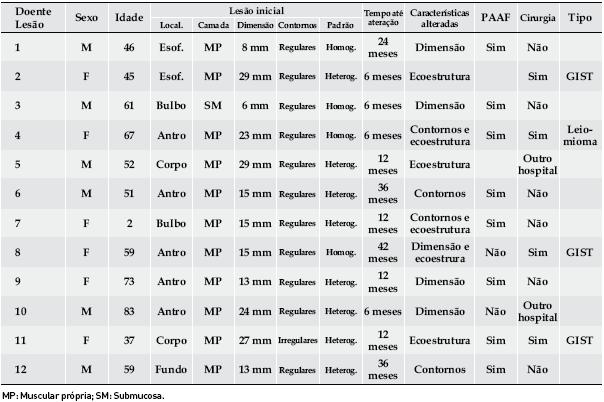
As características ecoendoscópicas e a localização das lesões estão descritas no Quadro 1. Setenta, (85,4%), das lesões mantiveram essas características inalteradas. Dos 12 doentes cujas lesões se alteraram, em 8 essa alteração ocorreu nos primeiros 12 meses após o diagnóstico e ocorreu à custa do aumento das dimensões (5 doentes), do ganho ou aumento de heterogeneidade (6 doentes) ou de irregularidade dos contornos (4 doentes). Oito destes doentes realizaram punção aspirativa por agulha fina. Seis doentes tiveram indicação para exérese das suas lesões sendo que apenas 4 foram operados no Hospital Geral de Santo António.
Quadro 1. Caracterização ecoendoscópica das lesões no momento do diagnóstico.
Os exames histológicos e imunohistoquímicos identificaram um leiomioma no antro (Fig. 2) e 3 GISTs no corpo, antro e esófago, todos com baixo risco de malignidade de acordo com os critérios de consenso internacional12, Fig. 3 e Quadro 2.
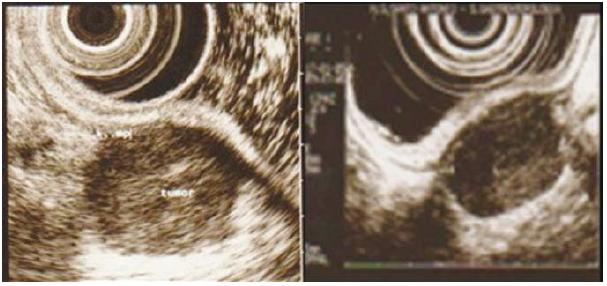
Fig. 2. Leiomioma do antro em doente de 67 anos. À esquerda, lesão inicial com 23 mm de diâmetro transversal. À direita, lesão 6 meses após o diagnóstico, mais heterogénea e com irregularidade dos contornos (doente 4, Quadro 2).
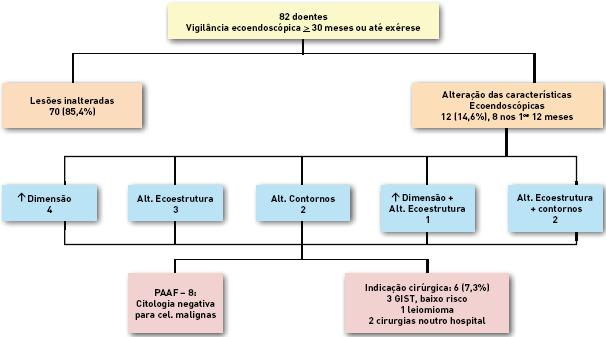
Fig. 3. Representação da evolução dos tumores mesenquimatosos sujeitos a vigilância ecoendoscópica.
Quadro 2. Caracterização das lesões com alteração das características ecoendoscópicas.
Associaram-se a alteração das características ecoendoscópicas das lesões a localização no antro, o padrão heterogéneo e a dimensão superior a 20 mm. Contrariamente, as lesões do esófago apresentaram menos alterações das suas características. Por outro lado, a evolução das lesões não se relacionou com a camada de dependência nem com a irregularidade dos contornos (presente em apenas 3 doentes). (Quadro 3).
Quadro 3. Correlação das características ecoendoscópicas com a evolução das lesões.
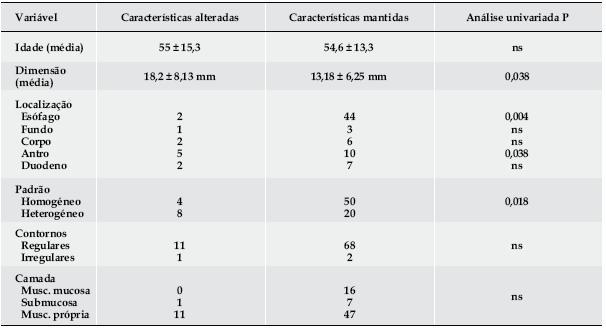
A análise multivariada mostrou que as variáveis que melhor predizem a evolução das lesões são a localização no esófago (evolução mais favorável) e o padrão heterogéneo.
DISCUSSÃO
O acesso generalizado e fácil à endoscopia digestiva aumentou grandemente o número de diagnósticos de tumores subepiteliais do tubo digestivo, assintomáticos e benignos na sua maioria. Apesar de a estratégia terapêutica ser controversa, na maioria dos centros, tem sido preferida uma abordagem conservadora com vigilância das lesões com menor potencial de comportamento maligno. A ecoendoscopia desempenha aqui um papel que, actualmente, pode considerar-se insubstituível na medida em que tem mostrado ser o método com melhor acuidade na caracterização, no diagnóstico e na determinação da terapêutica dos tumores digestivos subepiteliais16-19. Contudo, a estratégia de vigilância (frequência, duração e mesmo o método de avaliação) assim como os riscos e a relação custo/benefício não estão validados. Como referido na introdução deste texto, talvez a principal causa desta indefinição seja o pouco conhecimento da evolução natural destas lesões não ressecadas. Neste contexto, algumas séries foram publicadas nos últimos anos, a maior com 70 doentes e com períodos médios de seguimento entre 17,3 e 37 meses20-25. A conclusão comum a todos os trabalhos é que uma minoria (entre 0 e 20%) das lesões sofre alteração das suas características. Nesse aspecto, os nossos números (alteração das características iniciais em 14,6% das lesões) são muito próximos dos resultados dos 3 trabalhos mais recentes: Ka-Holok et al reportaram 13%22, Gill K R e colaboradores 13,7%20 e 10,2% no estudo de Bruno M21. Na outra série de 2008, de Lachter J, essa percentagem foi de 20%, mas foram apenas incluídos GIST23 enquanto no trabalho com 100% de lesões inalteradas foram seguidas apenas as lesões com menos de 20 mm25
A maioria (8 de 12) das alterações ecoendoscópicas ocorreu nos primeiros 12 meses após o diagnóstico. Atendendo a este facto e sabendo que a maioria das lesões mantém as suas características e tem um comportamento benigno, é questionável a custo-efectividade dum follow-up por tempo indefinido. Admitimos que, perante tumores de características favoráveis e estáveis, um seguimento de 5 anos pode ser adequado.
Outro dado de relevo nas seis séries referidas20-25 é que dessa minoria de lesões que sofrem alterações e que são ressecadas, somente um reduzido número constitui lesões com alto risco de comportamento maligno. No nosso trabalho, todas as lesões removidas corresponderam a lesões com baixo risco (3 GIST) ou sem risco de malignidade (1 leiomioma). A alteração das características ecoendoscópicas não é sinónimo de comportamento maligno. Atendendo ao número de exames necessário para tão raros casos de lesões agressivas e, por vezes, à baixa adesão ao exame, Ka-HoLok e colaboradores põem em causa a custo-efectividade da ecoendoscopia na vigilância destas lesões22. Outros métodos de seguimento foram avaliados, nomeadamente a ecografia transabdominal, menos onerosa e invasiva. Mas a sensibilidade deste exame na detecção de lesões subepiteliais com menos de 3 cm é muito reduzida26-28.
No sentido de diferenciar a vigilância, ou mesmo a terapêutica, para cada caso, optimizando os recursos e os custos, pretendemos, no nosso trabalho, além de descrever a evolução natural dos tumores mesenquimatosos, identificar as características ecoendoscópicas basais que se associaram a um comportamento menos favorável. As lesões do antro, as heterogéneas e aquelas com mais de 20 mm sofreram mais frequentemente alteração das suas características sendo a heterogeneidade o principal determinante dessa evolução. Pelo contrário, a localização no esófago associou-se à manutenção das características ecoendoscópicas. A maior heterogeneidade e dimensões têm sido associadas a maior agressividade em vários trabalhos que incluíram tumores do estroma operados4-6, mas não encontramos dados publicados relativamente a lesões de menores dimensões (< 3 cm) não sujeitas a exérese. Outros estudos referem a relação entre o prognóstico e a localização29-31 independentemente da dimensão e índice mitótico do tumor e da idade do doente30, sugerindo a maior agressividade das lesões do intestino delgado em oposição às esofágicas. Uma explicação possível reside no facto de a maioria dos tumores do esófago serem leiomiomas benignos. Contudo, também é referido o comportamento menos agressivo dos GISTs esofágicos30. Tendo em conta estes e os nossos resultados, a potencial malignidade de todos os GISTs, a impossibilidade de predizer com rigor o seu comportamento biológico e as indefinições em torno da sua vigilância, pensamos ser preferível, nos casos em que o risco cirúrgico o não contra-indique, a exérese dos tumores mesenquimatosos do antro, heterogéneos e com mais de 20 mm relativamente a uma vigilância prolongada, indefinida e onerosa que, regra geral, não evita alguma ansiedade associada. Por outro lado, pode ser razoável alargar o intervalo dos exames no seguimento das lesões homogéneas e pequenas do esófago.
Acreditamos que o reduzido número de lesões do duodeno na nossa série poderá justificar a ausência de associação desta localização com o tipo de comportamento. Essa reduzida dimensão da amostra, apesar de ser a maior série descrita neste contexto, constitui a grande limitação do nosso trabalho, retirando significância estatística a alguns resultados. De facto, a baixa incidência dos tumores mesenquimatosos digestivos justifica, no futuro, a realização de estudos multicêntricos em maior escala que permitam melhor sustentação dos resultados. A par disso, o desenvolvimento da análise molecular das mutações dos genes c-kit, PDGFRA e p53 ou de marcadores de proliferação celular como o Ki-67, em material obtido por punção aspirativa por agulha fina, poderá facilitar a decisão clínica num futuro próximo32-33.
Concluímos, dos nossos resultados, que a maioria das lesões manteve, durante o período de seguimento, as suas características ecoendoscópicas inalteradas, nomeadamente as localizadas no esófago. As lesões do antro, heterogéneas e com mais de 20 mm apresentaram um comportamento mais agressivo. Em face disso, da indefinição da estratégia e duração da sua vigilância e da potencial malignidade de todos os GISTs, os tumores mesenquimatosos com estas características deverão ser considerados para exérese ou merecer vigilância mais estreita principalmente nos primeiros 12 meses.
REFERÊNCIAS
1. Miettinen M, Lasota J. Gastrointestinal stromal tumors-definition, clinical histological, immunohistochemical, and molecular genetic features and differential diagnosis. Virchows Arch 2001;438:1-12.
2. Miettinen M, Sarlomo-Rikala M, Lasota J. Gastrointestinal stromal tumors: recent advances in understanding of their biology. Hum Pathol 1999;30:1213-1220.
3. Kawanowa K, Sakuma Y, Sakurai S, et al. High incidence of microscopic gastrointestinal stromal tumors in the stomach. Hum Pathol 2006;37:1527-1535.
4. Palazzo L, Landi B, Cellier C, et al. Endosonographic features predictive of benign and malignant gastrointestinal stromal cell tumours. Gut 2000;46:88-92.
5. Chak A, Canto MI, Rösch T, et al. Endosonographic differentiation of benign and malignant stromal cell tumors. Gastrointest Endosc 1997;45:468-473.
6. Rösch T, Lorenz R, Dancygier H, et al. Endosonographic diagnosis of submucosal upper gastrointestinal tract tumors. Scand J Gastroenterol 1992;27:1-8.
7. Wiech T, Walch A, Werner M. Histopathological classification of nonneoplastic and neoplastic gastrointestinal submucosal lesions. Endoscopy 2005;37:630-634.
8. Akahoshi K, Sumida Y, Matsui N, et al. Preoperative diagnosis of gastrointestinal stromal tumor by endoscopic ultrasound-guided fine needle aspiration. World J Gastroenterol 2007;13:2077-2082.
9. Rader AE, Avery A, Wait CL, et al. Fine-needle aspiration biopsy diagnosis of gastrointestinal stromal tumors using morphology, immunocytochemistry, and mutational analysis of c-kit. Cancer 2001;93:269-275.
10. Matsui M, Goto H, Niwa Y, et al. Preliminary results of fine needle aspiration biopsy histology in upper gastrointestinal submucosal tumors. Endoscopy 1998;30:750-755.
11. Li SQ, O’Leary TJ, Buchner SB, et al. Fine needle aspiration of gastrointestinal stromal tumors. Acta Cytol 2001;45:9-17.
12. Fletcher CD, Berman JJ, Corless C, et al. Diagnosis of gastrointestinal stromal tumors: A consensus approach. Hum Pathol 2002;33:459-465.
13. Bandoh T, Isoyama T, Toyoshima H. Submucosal tumors of the stomach: a study of 100 operative cases. Surgery 1993;113:498-506.
14. Joensuu H, Fletcher C, Dimitrijevic S, et al. Management of malignant gastrointestinal stromal tumours. Lancet Oncol 2002;3:655-664.
15. Hwang JH, Rulyak SD, Kimmey MB. American Gastroenterological Association Institute technical review on the management of gastric subepithelial masses. Gastroenterology 2006;130:2217-2228.
16. Chak A. EUS in submucosal tumors. Gastrointest Endosc 2002;56:S43-48. [ Links ]
17. Boyce GA, Sivak MV Jr, Rösch T, et al. Evaluation of submucosal upper gastrointestinal tract lesions by endoscopic ultrasound. Gastrointest Endosc 1991;37:449-454.
18. Rösch T, Lorenz R, Dancygier H, et al. Endosonographic diagnosis of submucosal upper gastrointestinal tract tumors. Scand J Gastroenterol 1992;27:1-8.
19. Lambert R, Caletti G, Cho E, et al. International Workshop on the clinical impact of endoscopic ultrasound in gastroenterology. Endoscopy 2000;32:549-584.
20. Gill KR, Camellini L, Conigliaro R, et al. The natural history of upper gastrointestinal Subepithelial Tumors: A multicenter endoscopic ultrasound survey. J Clin Gastroenterol 2009;43:723-726.
21. Bruno M, Carucci P, Repici A, et al. The natural history of gastrointestinal subepithelial tumors arising from muscularis propria: an endoscopic Ultrasound Survey. J Clin Gastroenterol 2009;43:821-825
22. Lok KH, Lai L, Yiu HL, et al. Endosonographic surveillance of small gastrointestinal tumors originating from muscularis propria. J Gastrointestin Liver Dis 2009;18:177-180.
23. Lachter J, Bishara N, Rahimi E, et al. EUS clarifies the natural history and ideal management of GISTs. Hepatogastroenterology 2008;55:1653-1656.
24. Melzer E, Fidder H. The natural course of upper gastrointestinal submucosal tumors: an endoscopic ultrasound survey. Isr Med Assoc J 2000;2:430-432.
25. Sato T, Peiper M, Fritscher-Ravens A, et al. Strategy of treatment of submucosal gastric tumors. Eur J Med Res 2005;10:292-295.
26. Tsai TL, Changchien CS, Hu TH, et al. Demonstration of gastric submucosal lesions by high-resolution transabdominal sonography. J Clin Ultrasound 2000;28:125-132.
27. Futagami K, Hata J, Haruma K, et al. Extracorporeal ultrasound is an effective diagnostic alternative to endoscopic ultrasound for gastric submucosal tumours. Scand J Gastroenterol 2001;36:1222-1226.
28. Polkowski M, Palucki J, Butruk E. Transabdominal ultrasound for visualizing gastric submucosal tumors diagnosed by endosonography: can surveillance be simplified? Endoscopy 2002;34:979-983.
29. Davila RE, Faigel DO. GI stromal tumors. Gastrointest Endosc 2003;58:80-88.
30. Emory TS, Sobin LH, Lukes L, et al. Prognosis of gastrointestinal smooth-muscle (stromal) tumors: dependence on anatomic site. Am J Surg Pathol 1999;23:82-87.
31. Miettinen M, Lasota J. Gastrointestinal stromal tumors: pathology and prognosis at different sites. Semin Diagn Pathol 2006;23:70-83
32. Gomes AL, Bardales RH, Milanezi F, et al. Molecular analysis of c-Kit and PDGFRA in GISTs diagnosed by EUS. Am J Clin Pathol 2007;127:89-96.
33. Meara RS, Cangiarella J, Simsir A, et al. Prediction of aggressiveness of gastrointestinal stromal tumours based on immunostaining with bcl-2, Ki-67 and p53. Cytopathology 2007;18:283-289.
Hermano Santos; Serviço de Gastrenterologia – Hospital Central de Faro – Rua Leão Penedo, 8000 Faro;
E-mail: santos.hermano@gmail.com;
Tel.: +351 965 329 507.
Recebido para publicação: 18/09/2009 e Pronto para publicação: 05/07/2010.













