Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Acessos
Acessos
Links relacionados
-
 Similares em
SciELO
Similares em
SciELO
Compartilhar
Jornal Português de Gastrenterologia
versão impressa ISSN 0872-8178
J Port Gastrenterol. vol.19 no.2 Lisboa fev. 2012
Tumor do estroma gastrointestinal em idade pediátrica
Gastrointestinal stromal tumor in children
Paulo Freirea,*, Francisco Portelaa, Bruno Graçab, Maria Augusta Ciprianoc, Marta Urbanoa, Emanuel Furtadod, Paula Lapae, Gabriela Duquea, Paulo Andradea e Carlos Sofiaa
aServiço de Gastrenterologia, Hospitais da Universidade de Coimbra, Coimbra, Portugal
bServiço de Imagiologia, Hospitais da Universidade de Coimbra, Coimbra, Portugal
cServiço de Anatomia Patológica, Hospitais da Universidade de Coimbra, Coimbra, Portugal
dServiço de Cirurgia II, Hospitais da Universidade de Coimbra, Coimbra, Portugal
eServiço de Medicina Nuclear, Hospitais da Universidade de Coimbra, Coimbra, Portugal
*Autor para correspondência
Resumo
Os tumores do estroma gastrointestinal (GIST) são os mais frequentes tumores mesenquimatosos do tubo digestivo, surgem geralmente após os 40 anos e são excepcionais na idade pediátrica.
Os autores apresentam o caso de uma doente de 14 anos, admitida por anemia microcítica sintomática. A endoscopia digestiva alta revelou volumosa formação submucosa gástrica, tendo os estudos histológico e imunohistoquímico (c-Kit) estabelecido o diagnóstico de GIST. O estudo genético dirigido às mutações dos genes c-Kit e PDGFRA mostrou a ausência de ambas (tumor wild-type). O estadiamento imagiológico evidenciou a existência de adenopatias peri-tumorais e de metastização hepática. Após ressecção cirúrgica do tumor primitivo, iniciou-se terapêutica com imatinib, substituída posteriormente por sunitinib devido a progressão da doença. Após 18 meses de tratamento com este fármaco apresenta doença estabilizada mas sem regressão.
Quando comparados com os GIST no adulto, os GIST em idade pediátrica encerram múltiplas particularidades. Com base no caso clínico exposto, os autores salientam essas singularidades e as suas implicações práticas.
PALAVRAS-CHAVE: Tumor do estruma gastrointestinal; Pediatria;c-KIT
Abstract
Gastrointestinal stromal tumors (GIST) are the most frequent mesenchymal tumors in the digestive tract. Usually, they develop after the fourth decade of life and are particularly unusual in paediatric age.
The authors present the case of a 14-year old female patient admitted for symptomatic microcytic anemia. Upper gastrointestinal endoscopy showed a large gastric submucosal tumor. A diagnosis of GIST was made by histological and immunohistochemical (c-Kit) tests. Genetic assessment of c-Kit and PDGFRA mutations revealed the absence of both (wild-type tumor). The imagiologic staging showed peritumoral adenopathy and hepatic metastization. After surgical resection of the primitive tumor, imatinib therapy was started and later on replaced by sunitinib, due to disease progression. After 18 months of therapy with this drug the disease is stable but without regression.
When compared with GIST in adults, paediatric GISTs have multiple specificities. Based on the clinical case described below, the authors highlight these specific characteristics and their clinical implications.
KEYWORDS: Gastrointestinal stromal tumor; Pediatrics; c-KIT
Introdução
Os tumores mesenquimatosos são raros, representando apenas 0,1 a 3% dos tumores gastrointestinais1. De entre os tumores mesenquimatosos do tubo digestivo, os tumores do estroma gastrointestinal (GIST) são os mais frequentes (representam 80% desses tumores), com uma incidência anual estimada de 15 casos por milhão de habitantes1,2.
No passado considerava-se que tinham origem no tecido muscular do tubo digestivo, mas a descoberta da partilha de características ultraestruturais e imunohistoquímicas com as células de Cajal (conhecidas como células «pacemaker» do tubo digestivo por serem responsáveis pela sua motilidade), identificou estas células como a provável origem destes tumores3.
Os GIST surgem habitualmente entre os 40 e os 80 anos, sendo extraordinariamente invulgares na população pediátrica (< 15 anos)2. Numa revisão recente da literatura indexada escrita em inglês, foram descritos apenas 25 casos em doentes com menos de 15 anos4. Benesch et al publicaram em 2009 um artigo de revisão sobre GIST em crianças e adultos jovens (< 21 anos), baseado numa pesquisa bibliográfica que identificou 113 doentes com essas características (média de idades, 13 anos; extremos, 1 dia 23 anos)5.
Actualmente o diagnóstico anatomo-patologico é estabelecido quando um tumor composto por células fusiformes e/ou epitelióides, revela positividade em imunohistoquímica para a proteina KIT (CD117)2. Esta proteína, produto do proto-oncogene c-Kit, é um receptor para um factor de crescimento (SCF-Stem Cell Factor), tem actividade de tirosina quinase e o seu funcionamento anómalo determina proliferação celular descontrolada6. Cerca de 80% dos GIST têm mutação do gene c-KIT; 5-10% têm mutação do gene do receptor alfa do factor de crescimento derivado das plaquetas (PDGFRA), um homólogo do receptor KIT; e os restantes 10-15% não têm nenhuma destas mutações (wild-type)2.
Tratando-se de tumores resistentes à radioterapia e não respondedores à quimioterapia convencional, a cirurgia assumiu, até recentemente, o protagonismo inerente à única opção terapêutica efectiva. Em 2002, a aprovação pela Food and Drug Administration (FDA) da terapêutica com imatinib, um inibidor da tirosina quinase, em doentes com tumores irressecáveis e/ou metastizados, veio proporcionar a estes doentes uma terapêutica efectiva, reformulando os algoritmos de decisão terapêutica2.
Constatou-se posteriormente que a resposta a este fármaco depende do «status mutacional» dos genes c-KIT e PDGFRA, obtendo-se melhores resultados nos doentes com mutação, especialmente naqueles com mutação do exão 11 do gene c-KIT7. As recomendações actuais indicam a dose de 400 mg/ m2 por dia de imatinib para iniciar a terapêutica e, perante a falência deste esquema, a sua duplicação2,7. Em 2006 a FDA aprovou o sunitinib, um inibidor da tirosina quinase com propriedades anti-angiogenicas, para os doentes com GIST que não toleram ou não respondem ao imatinib2,7.
Os GIST com apresentação em idade pediátrica, além da sua extrema raridade, exibem várias particularidades distintivas da sua ocorrência em idade adulta, com implicações clínicas designadamente no diagnóstico, no prognóstico e na abordagem terapêutica. Neste artigo apresentamos o caso de um GIST numa doente de 14 anos, com ênfase na abordagem terapêutica e efectuamos uma revisão da literatura, salientando as particularidades dos GIST pediátricos.
Caso clínico
MVS, doente do sexo feminino, 14 anos, recorreu ao serviço de urgência por lipotímia. Não tinha história de episódios anteriores semelhantes, mas mencionava cefaleias e astenia com início insidioso e evolução arrastada (cerca de 1 ano). Negava perdas hemáticas gastrointestinais ou ginecológicas bem como dor abdominal. O exame objectivo evidenciou palidez cutaneo-mucosa e excluiu perdas hemáticas macroscópicas. A história familiar incluía uma neoplasia do ovário da avó materna diagnosticada aos 50 anos de idade e tratada com sucesso através de ressecção cirúrgica, não havendo outros elementos relevantes, nomeadamente história de outras neoplasias.
A avaliação analítica revelou uma grave anemia hipocrómica microcítica (hemoglobina = 3,7 g/dL; hemoglobina corpuscular média = 18,6 pg; volume globular médio = 61,6 fL) sideropénica (ferro = 17 mg/dL; ferritina = 0 ng/mL; saturação da transferrina = 5%). Após transfusão, procedeu-se ao estudo do tubo digestivo. A colonoscopia total não detectou alterações, tendo a endoscopia digestiva alta revelado, ao longo de toda a face posterior do corpo e antro, múltiplas formações submucosas volumosas, algumas com ulceração superficial (fig. 1). O exame ecoendoscópico revelou tratar-se de extensa formação neoplásica com aparente origem na camada muscular, com ecoestrutura heterogénea, detectando também três adenopatias peri-gástricas (fig. 2). Durante o procedimento foi efectuada punção com colheita de material que foi enviado para estudo histológico.
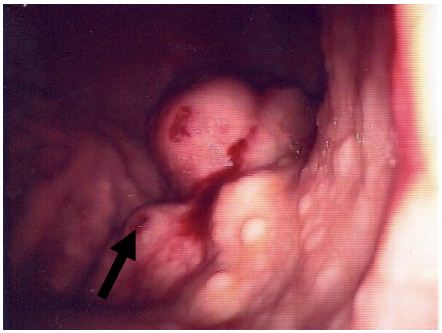
Figura 1 Imagem endoscópica. Formações submucosas na face posterior do corpo gástrico, algumas com ulceração superficial (seta).
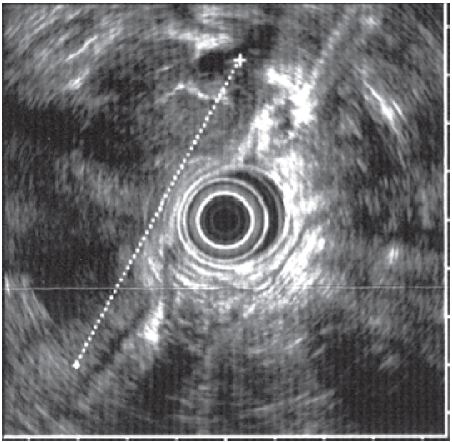
Figura 2 Imagem de ecoendoscopia. Extensa formação neoplásica com aparente origem na camada muscular, com ecoestrutura heterogénea (linha).
O estudo histológico evidenciou neoplasia com células epitelióides e fusiformes (fig. 3: microfotografias A e B). O respectivo estudo imunohistoquímico revelou que as células tumorais eram negativas para desmina e actina do músculo liso e positivas para CD34 (fig. 3: microfotografia C) e CD117/KIT (fig. 3: microfotografia D). Neste contexto, foi estabelecido o diagnóstico de GIST e solicitou-se o estudo das mutações dos genes c-Kit e PDGFRA, que viria a revelar a ausência de ambas (tumor wild-type).
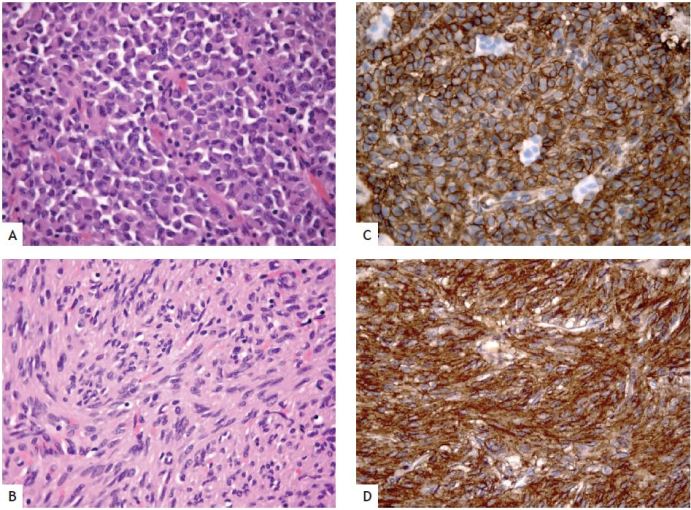
Figura 3 Microfotografia A (Hematoxilina & Eosina, 400×) Células neoplásicas epitelióides. Microfotografia B (Hematoxilina & Eosina, 400×) Células neoplásicas fusiformes. Microfotografia C (Imunohistoquímica CD34, 400×) Positividade difusa para CD34. Microfotografia D (Imunohistoquímica c-KIT/CD117, 400×) Positividade difusa para KIT/CD117.
A tomografia computorizada (TC) toracoabdominal e a tomografia de emissão de positrões com 18 fluorodesoxiglicose (PET 18FDG) caracterizaram a neoplasia como uma volumosa massa lobulada (14 × 5 cm de maiores eixos) na dependência da face posterior do estômago (fig. 4). Revelaram também a existência de dois nódulos no lobo hepático direito (segmento VI), medindo 1,7 e 1,2 cm, compatíveis com metastização hepática (fig. 4) e detectaram ainda pequenas adenopatias peri-tumorais.
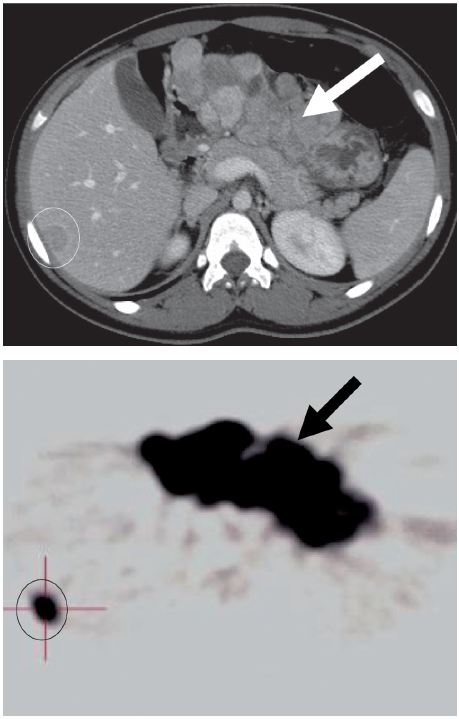
Figura 4 Imagens de TC abdominal e PET 18FDG. Neoplasia gástrica primitiva (seta) e metástase hepática (circulo).
Da discussão multidisciplinar resultou como estratégia terapêutica a realização de cirurgia seguida de quimioterapia com imatinib. Durante a cirurgia constatou-se a existência de metastização hepática maciça e efectuou-se gastrectomia total (fig. 5), linfadenectomia e biopsia excisional duma metástase hepática. O estudo da peça operatória confirmou tratar-se dum GIST, medindo 14 cm de maior eixo, com 4 mitoses/50 campos de grande ampliação e sem invasão das linhas de ressecção. A avaliação dos 18 gânglios linfáticos obtidos detectou doença loco-regional metastática em 4. Quanto à biopsia hepática excisional, confirmou tratar-se de um nódulo metastático, cuja pesquisa das mutações dos genes c-Kit e PDGFRA foi também negativa (wild-type).
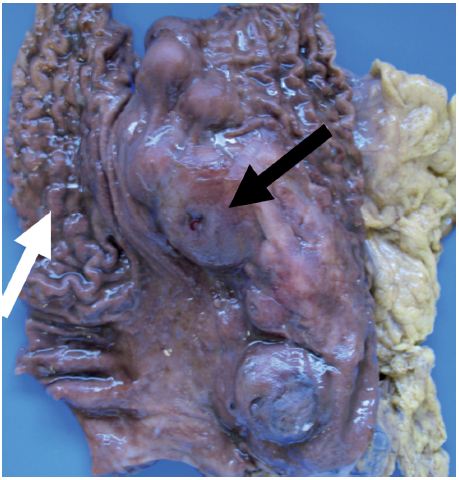
Figura 5 Fotografia de peça de gastrectomia em secção longitudinal. Assinalados estômago normal (seta branca) e neoplasia (seta preta).
Iniciou subsequentemente terapêutica com imatinib na dose de 400 mg/dia e após 4 meses foi efectuada PET 18FDG de controlo, que revelou cerca de 15 áreas de hiperacumulação do radiofármaco a nível hepático, ou seja, progressão da doença em comparação com a avaliação anterior. Neste contexto, suspendeu o imatinib e iniciou terapêutica com sunitinib de acordo com o esquema recomendado (ciclos de 6 semanas: durante quatro semanas na dose de 50 mg/dia e nas duas semanas seguintes pausa terapêutica). As PET 18FDG de controlo, efectuadas com periodicidade de 6 meses, têm revelado doença estabilizada mas sem regressão. A doente mantém actualmente a administração de sunitinib, contabilizando um total de 18 meses de terapêutica com este fármaco e dois anos de sobrevida após o diagnóstico; encontra-se clinicamente assintomática e com valores normais e estabilizados de hemoglobina.
Discussão
Os GIST podem ser detectados em qualquer idade, mas a grande maioria dos doentes tem, no momento do diagnóstico, entre 40 a 80 anos, com uma mediana de idades de 50-60 anos2,4,7. Estes tumores muito raramente são diagnosticados em doentes com menos de 40 anos, sendo excepcionais na idade pediátrica5.
Além da sua extrema raridade, os GIST pediátricos, como o da nossa doente, encerram várias particularidades que os distinguem dos GIST diagnosticados na idade adulta. Desde logo no que se refere ao género, os GIST diagnosticados em adultos apresentam uma ligeira predominância no sexo masculino (54%) enquanto na população pediátrica atingem mais frequentemente doentes do sexo feminino (60%)4. A hemorragia digestiva, com ou sem perdas hemáticas visíveis, é a forma de apresentação em cerca de metade dos adultos e em quase todas as crianças7. Os GIST podem surgir em qualquer parte do tubo digestivo desde o esófago até ao recto2,7. Não obstante, independentemente da idade, a localização mais frequente do tumor primitivo é o estômago verificando‑se, contudo, que esta predilecção é mais marcada na população pediátrica (52% vs 39%)4,5. A localização do tumor primitivo e a sua dimensão são elementos com importância prognóstica, exibindo valor preditivo relativamente ao comportamento tumoral e ao risco de progressão da doença8. Atendendo ao caso clínico em análise, a localização gástrica seria um elemento de bom prognóstico mas a dimensão do tumor, nomeadamente com > 10 cm, constituiu um factor de mau prognóstico2,7.
Cerca de 10-30% dos GIST exibem comportamento clínico maligno com metastização hepática e/ou peritoneal2,7,9. Caracteristicamente não ocorre metastização ganglionar, excepto na população pediátrica em que a sua existência é comum, tal como se verificou com a nossa doente2,4,7.
Endoscopicamente estas lesões manifestam-se como formações submucosas, o que atribui à ecoendoscopia um importante papel na sua caracterização. Este exame permite identificar a localização parietal, avaliar as dimensões, caracterizar a ecoestrutura e, eventualmente, realizar punção da lesão com colheita de material para caracterização histológica10. Relativamente à ecoestrutura, os GIST são habitualmente homogéneos e hipoecóicos. A heterogeneidade ecoestrutural, verificada por exemplo na nossa doente, é considerada igualmente um factor de mau prognóstico10.
A TC toracoabdominopélvica é recomendada para completar o estadiamento da lesão, nomeadamente para excluir a existência de metastização à distância, em especial a nível hepático, local onde a metastização é mais frequente2,7,10.
A PET 18FDG, quando disponível, é, actualmente, uma valiosa ferramenta na avaliação dos doentes com GIST, devido aos inegáveis benefícios que acrescenta ao processo de decisão terapêutica. Embora detenha menor detalhe anatómico que a TC, a PET é mais sensível na detecção de doença metastática11. Na verdade, o estadiamento efectuado com combinação de PET e TC provou ser significativamente superior ao que se obtém quando apenas uma dessas técnicas é utilizada isoladamente7. Por outro lado, nos doentes com doença metastática e, portanto, candidatos a tratamento com inibidores da tirosina quinase, a PET permite avaliar a resposta à terapêutica de forma mais rápida e sensível do que a TC. Esta diferença resulta do facto de a resposta à terapêutica médica se traduzir inicialmente em alterações metabólicas e só mais tarde em modificações morfológicas. Nos doentes respondedores designadamente, são necessários pelo menos 1-2 meses de terapêutica para documentar por TC a existência de resposta, enquanto a PET poderá revelar alterações lesionais sugestivas de resposta cerca de 24 h após a primeira administração do inibidor da tirosina quinase2,10,12.
Nos doentes com quadro clínico, endoscópico e imagiológico sugestivo de GIST em que a cirurgia seja considerada a primeira opção terapêutica, a tendência actual é de dispensar a realização de biopsia pelos riscos associados de hemorragia e disseminação tumoral2. No entanto, tendo como base de discussão o caso da nossa doente, a assunção universal desta estratégia poderá levantar algumas dúvidas. Sendo os GIST excepcionais na idade pediátrica, é difícil congregar nestes doentes um conjunto de dados clínicos e de resultados complementares suficientemente forte para convencer o clínico e o cirurgião a dispensar uma avaliação pre-operatoria do anatomo-patologista. Por outro lado, nas situações em que a decisão terapêutica não é consensual, a avaliação histológica complementada pela pesquisa das mutações dos genes c-Kit e PDGFRA e a consequente previsibilidade da resposta à terapêutica médica poderá ser um elemento fundamental na decisão terapêutica7. Acresce que a hemorragia e a disseminação tumoral são riscos relacionados habitualmente com a biopsia percutânea, assumindo carácter diminuto numa punção por ecoendoscopia duma lesão submucosa gástrica10. Estes elementos sustentaram a nossa decisão de realizar punção guiada por ecoendoscopia e respectiva caracterização histológica da lesão antes da tomada de decisão terapêutica.
Histologicamente 70% dos GIST são compostos por células fusiformes, 20% por células epitelióides e os restantes 10% são mistos, ou seja, têm os dois tipos de células2,5. Os GIST pediátricos, como o presente caso, são geralmente epitelióides ou mistos2,5. A imunohistoquímica, particularmente a utilização de anticorpos contra o KIT (CD117), é um poderoso auxiliar no diagnóstico diferencial dos tumores mesenquimatosos do tubo digestivo. Os GIST, ao contrário dos outros tumores mesenquimatosos, apresentam positividade para o CD117 e CD34 em cerca de 95% e 60-70% dos casos, respectivamente10,13. Por outro lado, os leiomiomas e leiomiossarcomas evidenciam positividade para a desmina e a actina do músculo liso, enquanto nos GIST tal se verifica em apenas 40% e 10% dos casos, respectivamente2,10. No caso da nossa doente, a histologia mostrou tratar-se de um tumor misto, ou seja, composto de células epitelioides e de células fusiformes, com positividade para o CD117, estabelecendo, desta forma, o diagnóstico de GIST. Pelo reconhecido valor prognóstico, a avaliação histológica deve incluir a determinação do número de mitoses existentes por cada 50 campos de grande ampliação, sendo que um valor superior a 5 constitui factor de mau prognóstico8.
Uma vez estabelecido o diagnóstico de GIST, é mandatória a pesquisa das mutações dos genes c-Kit e PDGFRA. Nos adultos, 80 a 85% dos GIST exibem mutação, enquanto os GIST pediátricos são, quase invariavelmente, wild-type2. Desta forma e sem surpresa, a pesquisa das mutações dos genes c-Kit e PDGFRA na nossa doente revelou-se negativa, tornando previsível uma má resposta à terapêutica médica. Salienta-se que além do «status mutational», a dimensão do tumor primitivo (> 10 cm) e a existência de metastização constituíam também factores indicativos de mau prognóstico e preditivos de má resposta terapêutica.
Durante a cirurgia foi efectuada linfadenectomia alargada, procedimento que seria provavelmente desnecessário num doente adulto, mas que é indispensável nos GIST pediátricos devido à frequente metastização ganglionar nestes doentes2,10. A biopsia hepática excisional, mais do que confirmar a natureza das lesões hepáticas, permitiu pesquisar as mutações dos genes c-Kit e PDGFRA e, consequentemente, estabelecer uma previsão da sua resposta à terapêutica médica. A importância desta pesquisa aparentemente redundante, prende-se com o facto de o perfil genético do tumor primitivo e das suas lesões secundárias nem sempre ser coincidente2.
A terapêutica com imatinib na dose standard de 400 mg/ dia não se associou a resposta favorável. Quando este cenário se verifica em adultos, a indicação é de duplicar a dose de imatinib e apenas promover a sua substituição por sunitib quando essa dosagem também se revela ineficaz2. Não obstante, nos GIST pediátricos que não respondem à dose standard de imatinib, o eventual benefício da duplicação da dose de imatinib não está demonstrado e, por outro lado, existem dados resultantes de algumas pequenas séries de doentes que evidenciaram resposta e/ou benefício clínico da sua substituição por sunitinib2,14,15. Baseados nesta evidência, procedemos à substituição do imatinib por sunitinib. Com este fármaco verificou-se estabilização da doença ao longo do período de seguimento, não se registando, contudo, resposta à terapêutica, dado que a definição deste conceito implica redução tumoral. Neste contexto, se estivessem em curso ensaios clínicos envolvendo novos protocolos ou novos fármacos, poderíamos propor à doente a sua inclusão2. A inviabilidade desta hipótese no momento presente, o previsível aumento da sobrevida associado à estabilização da doença e o conhecimento de que a suspensão dos inibidores da tirosina quinase nos doentes não respondedores se associa, invariavelmente, a progressão da doença, justificam a manutenção da terapêutica com sunitinib2,10,15.
O caso clínico descrito congrega um conjunto de características típicas dos GIST em idade pediátrica, nomeadamente: predilecção pelo sexo feminino, tumor primitivo de localização gástrica, existência de metástases ganglionares e hepáticas, histologia mista (coexistência de células epitelióides e células fusiformes), inexistência de mutação dos genes c-Kit e PDGFRA e má resposta à terapêutica com imatinib. A raridade dos GIST em idade pediátrica obsta à concretização de estudos prospectivos, daí que a maioria da informação sobre as características desta entidade seja extraída de casos clínicos ou de pequenas séries descritas retrospectivamente4,5,14. Não obstante, a análise dessas descrições permite perceber que os GIST em idade pediátrica representam uma entidade clínica e biologicamente diferente dos GIST no adulto 4,5. Neste contexto, com o intuito de aprofundar o conhecimento sobre os GIST em idade pediátrica e na tentativa de criar uma base fundamentada que permita suportar futuras recomendações diagnósticas e terapêuticas, foi criado recentemente o European Working Group on pediatric GIST (Pediatric.GIST@amc.nl ) que pretende implementar o registo prospectivo destes doentes incluindo-os, sempre que possível, em ensaios clínicos multicêntricos.
Bibliografia
1. Rossi CR, Mocellin S, Mencarelli R, et al. Gastrointestinal stromal tumors: from a surgical to a molecular approach. Int J Cancer. 2003;107:171-6. [ Links ]
2. Demetri GD, Benjamin RS, Blanke CD, et al. NCCN Task Force report: management of patients with gastrointestinal stromal tumor (GIST) - update of the NCCN clinical practice guidelines. J Natl Compr Canc Netw. 2007;5:S1-29. [ Links ]
3. Kindblom LG, Remotti HE, Aldenborg F, et al. Gastrointestinal pacemaker cell tumor (GIPACT): gastrointestinal stromal tumors show phenotypic characteristics of the interstitial cells of Cajal. Am J Pathol. 1998;152:1259-69. [ Links ]
4. Hayashi Y, Okazaki T, Yamataka A, et al. Gastrointestinal stromal tumor in a child and review of the literature. Pediatr Surg Int. 2005;21:914-7. [ Links ]
5. Benesch M, Wardelmann E, Ferrari A, et al. Gastrointestinal stromal tumors (GIST) in children and adolescents: A comprehensive review of the current literature. Pediatr Blood Cancer. 2009;5:1171-9. [ Links ]
6. De Silva CM, Reid R. Gastrointestinal stromal tumors (GIST): C-kit mutations, CD117 expression, differential diagnosis and targeted cancer therapy with Imatinib. Pathol Oncol Res. 2003;9:13-9. [ Links ]
7. Gutierrez JC, De Oliveira LO, Perez EA, et al. Optimizing diagnosis, staging, and management of gastrointestinal stromal tumors. J Am Coll Surg. 2007;205:479-91. [ Links ]
8. Miettinen M, Lasota J. Gastrointestinal stromal tumors: pathology and prognosis at different sites. Semin Diagn Pathol. 2006;23:70-83. [ Links ]
9. DeMatteo RP, Lewis JJ, Leung D, et al. Two hundred gastrointestinal stromal tumors: recurrence patterns and prognostic factors for survival. Ann Surg. 2000;231:51-8. [ Links ]
10. Casali PG, Jost L, Reichardt P, et al; ESMO Guidelines Working Group. Gastrointestinal stromal tumors: ESMO clinical recommendations for diagnosis, treatment and follow-up. Ann Oncol. 2008;19:ii35-38. [ Links ]
11. Blodgett TM, Meltzer CC, Townsend DW. PET/CT: form and function. Radiology. 2007;242:360-85. [ Links ]
12. Gayed I, Vu T, Iyer R, et al. The role of 18F-FDG PET in staging and early prediction of response to therapy of recurrent gastrointestinal stromal tumors. J Nucl Med. 2004;45:17-21. [ Links ]
13. Miettinen M, Lasota J. Gastrointestinal stromal tumors - definition, clinical, histological, immunohistochemical, and molecular genetic features and differential diagnosis. Virchows Arch. 2001;438:1-12. [ Links ]
14. Janeway KA, Albritton KH, Van Den Abbeele AD, et al. Sunitinib treatment in pediatric patients with advanced GIST following failure of imatinib. Pediatr Blood Cancer. 2009;52:767-71. [ Links ]
15. Demetri GD, Van Oosterom AT, Garrett CR, et al. Efficacy and safety of sunitinib in patients with advanced gastrointestinal stromal tumour after failure of imatinib: a randomised controlled trial. Lancet. 2006;368:1329-38. [ Links ]
*Autor para correspondência
Correio electrónico: pauloavfreire@gmail.com(P. Freire)
Recebido a 26 de janeiro de 2010; aceite a 14 de agosto de 2010













