Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Acessos
Acessos
Links relacionados
-
 Similares em
SciELO
Similares em
SciELO
Compartilhar
Jornal Português de Gastrenterologia
versão impressa ISSN 0872-8178
J Port Gastrenterol. vol.19 no.3 Lisboa maio 2012
Recomendações para a terapêutica da hepatite C
Management for Hepatitis C
José Velosaa,∗, Luís Caldeirab, Ana I. Lopesc, Luís Guerreirod e Rui Marinhoa , em nome da Associação Portuguesa para o Estudo do Fígado
a Serviço de Gastrenterologia e Hepatologia, Hospital de Santa Maria, Lisboa, Portugal
b Serviço de Doenc¸as Infecciosas, Hospital da Santa Maria, Lisboa, Portugal
c Serviço de Pediatria, Hospital de Santa Maria, Lisboa, Portugal
d Serviço de Farmácia, Hospital de Santa Maria, Lisboa, Portugal
*Autor para correspondência
Introdução
A terapêutica da hepatite C crónica com a combinação peginterferão e ribavirina proporciona cura em cerca de 60% dos doentes, manifestada por uma resposta virológica mantida (SVR). Nos portadores do genótipo 1, a taxa de SVR é mais baixa, pouco excedendo os 40%1. A terapêutica tripla, associando à terapêutica dupla com peginterferão e ribavirina, fármacos com ação antivírica direta no vírus da hepatite C (VHC), dos quais estão disponíveis os inibidores da protease boceprevir e telaprevir, aumenta em cerca de 25-30% a taxa de SVR em doentes portadores de genótipo 1, com ou sem experiência de tratamento prévio2-5. Nestes doentes, a adição do inibidor da protease permite, em muitos casos, reduzir a duração da terapêutica, quer em doentes sem experiência terapêutica prévia, quer em não respondedores6.
O benefício da terapêutica tripla não está demonstrado em doentes portadores de outros genótipos que não o 1, pelo que a infeção por estes genótipos deverá continuar a ser tratada apenas com peginterferão e ribavirina1.
Estão bem identificados os fatores que se correlacionam positivamente com a taxa de resposta à terapêutica, sendo os polimorfismos no gene da interleucina 28B (IL28B) e a resposta virológica rápida (RVR), no decurso da terapêutica, os mais robustos7-9. Uma vez transpostos para a prática clínica, permitem racionalizar e individualizar o esquema de tratamento.
Estas normas de orientação clínica pretendem ser um guia prático para o uso dos fármacos indicados no tratamento da hepatite C crónica. Foram elaboradas de acordo com as recomendações (guidelines) emanadas das associações científicas de referência, embora adaptadas à realidade nacional. Visam otimizar os resultados da terapêutica, numa perspetiva de Boa Prática Clínica e de racionalização de meios e custos10.
Assim, foram adotadas as seguintes linhas orientadoras:
a) Indução com peginterferão e ribavirina (lead-in) em todos os doentes naïves, sem cirrose, candidatos a terapêutica tripla;
b) Uso da IL28B e da RVR como preditores de resposta à terapêutica;
c) Utilização da terapêutica dupla com peginterferão e ribavirina nos casos em que os indicadores sugiram uma probabilidade elevada de resposta sustentada.
Definição de hepatite C crónica
Doentes com anti-VHC e RNA VHC séricos repetidamente positivos, com transaminases elevadas ou normais e com evidência de inflamação e fibrose hepática.
Indicações para terapêutica da hepatite C
(tabela 1)
· Todos os doentes naïves com doença compensada deverão ser considerados para tratamento.
· Têm indicação para tratamento imediato os doentes com cirrose compensada.
· O tratamento está fortemente indicado em doentes com fibrose moderada ou avançada (> F2, Metavir).
· Em doentes com doença ligeira a indicação para tratamento deve ser individualizada.
Tabela 1 Indicações para terapêutica dupla ou tripla de doentes com hepatite C crónicaa

Contraindicações à terapêutica
· São contraindicações absolutas ao início da terapêutica:
· Depressão, psicose ou epilepsia não controladas.
· Doenças autoimunes não controladas.
· Doença hepática descompensada (Child Pugh ≥ 7).
· Mulheres grávidas ou a planear engravidar.
· Comorbilidade não controlada, como doença pulmonar obstrutiva crónica, hipertensão ou insuficiência cardíaca.
Como tratar
As doses e a posologia dos peginterferões alfa-2a e alfa-2b, ribavirina, boceprevir e telaprevir, para adultos e crianças, podem ser consultadas no Anexo 2. Os requisitos a que deve obedecer a terapêutica tripla estão descritos na tabela 2.
Tabela 2 Pré-requisitos da terapêutica tripla

Doentes com o genótipo 1
Para as posologias utilizadas na terapêutica dupla ou tripla consultar o Anexo 2.
Doentes sem terapêutica prévia
Terapêutica orientada pela IL28B e pela resposta durante o tratamento (tabelas 3 e 4)
Tabela 3 Monitorização da resposta durante e após a terapêutica
Tabela 4 Pautas de tratamento com inibidores da protease no tratamento inicial
Semana 4 da terapêutica:
Doentes sem cirrose com IL28B CC:
· Com RVR: continuar tratamento com peginterferão + ribavirina até à semana 24.
· Sem RVR: associar um inibidor da protease.
Boceprevir:
· doentes com eRVR (RNA VHC não detetável à semana 8 e 24), após as 4 semanas iniciais de lead-in continuar com a terapêutica tripla até à semana 28.
· doentes sem eRVR (RNA VHC detetável à semana 8, mas <100 UI/mL à semana 12, e indetetável à semana 24): após as 4 semanas iniciais de lead-in continuar com terapêutica tripla até à semana 36, seguida de peginterferão + ribavirina até à semana 48.
Telaprevir:
· doentes com eRVR (RNA VHC não detetável à semana 8 e 16), após as 4 semanas iniciais de lead-in continuar com terapêutica tripla até à semana 16, seguida de peginterferão + ribavirina até à semana 28.
· doentes sem eRVR (RNA VHC detetável à semana 8 e detetável ou indetetável à semana 16 mas, em qualquer circunstância, < 1000 UI/mL): após as 4 semanas iniciais de lead-in, continuar com terapêutica tripla até à semana 16, seguida de peginterferão + ribavirina até à semana 48.
Doentes sem cirrose com IL28B CT/TT:
· Com RVR: continuar tratamento com peginterferão + ribavirina até à semana 24.
· Sem RVR: associar um inibidor da protease.
Boceprevir:
· doentes com eRVR (RNA VHC não detetável às semanas 8 e 24): após as 4 semanas iniciais de lead-in, continuar com terapêutica tripla até à semana 28.
· doentes sem eRVR (RNA VHC detetável à semana 8, mas < 100 UI/mL à semana 12, e indetetável à semana 24): após as 4 semanas iniciais de lead-in, continuar com terapêutica tripla até à semana 36, seguida de peginterferão + ribavirina até à semana 48.
Telaprevir:
· doentes com eRVR (RNA VHC não detetável à semana 8 e 16): após as 4 semanas iniciais de lead-in, continuar com terapêutica tripla até à semana 16, seguida de peginterferão + ribavirina até à semana 28.
· doentes sem eRVR (RNA VHC detetável à semana 8 e detetável ou indetetável à semana 16 mas, em qualquer circunstância, < 1000 UI/mL): após as 4 semanas iniciais de lead-in, continuar com terapêutica tripla até à semana 16, seguida de peginterferão + ribavirina até à semana 48.
Nota: para a aplicação das regras de paragem da terapêutica tripla, consultar a tabela 5.
Tabela 5 Regras de descontinuação da terapêutica com boceprevir e telaprevir
Doentes com genótipo 2 ou 3
O tratamento dos doentes com os genótipos 2 e 3 deverá ser realizado de acordo com as recomendações da EASL1.
Posologia:
Peginterferão alfa-2a: 180_g sc/semana
Peginterferão alfa-2b: 1,5_g/kg de peso corporal, sc/semana
Ribavirina: 800 mg/dia (400 mg de 12 em 12 horas)
Nota: nos doentes com preditores de má resposta (cirrose, IMC > 30 kg/m2, idade avançada ou síndrome metabólica), a dose de ribavirina será semelhante à dos doentes com genótipo 11.
Duração da terapêutica:
A duração do tratamento poderá ser de 16, 24 ou 48 semanas consoante a resposta durante a terapêutica. O RNA VHC sérico deverá ser determinado antes do início da terapêutica e nas semanas 4, 12 e 24 (e, eventualmente, 48) da terapêutica.
RNA VHC não detetado à semana 4:
· 16 semanas de terapêutica em doentes com RNA VHC basal < 400.000-800.000 UI/mL
· 24 semanas de terapêutica em doentes com RNA VHC basal > 800.000 UI/mL (eventualmente 48 semanas se existirem preditores de má resposta)
RNA VHC detetado à semana 4, mas indetetável ou com redução > 2 log à semana 12, mas não detetado à semana 24:
· 48 semanas de terapêutica
RNA VHC com redução < 2 log à semana 12, ou detetável à semana 24:
· Descontinuar a terapêutica
Regra de paragem: todos os doentes com redução de RNA VHC < 2 log à semana 12 (fig. 1).
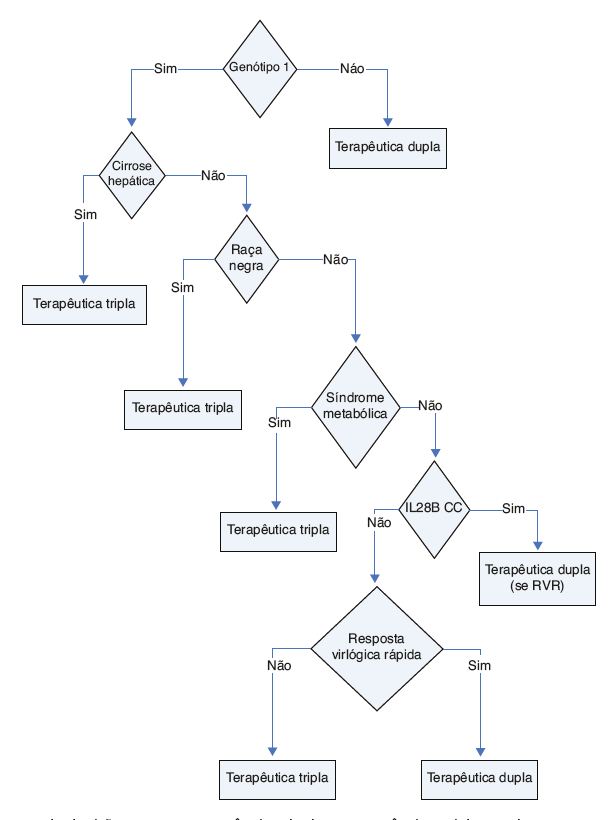
Figura 1 Fluxograma da decisão quanto a terapêutica dupla ou terapêutica tripla em doentes sem terapêutica prévia.
Tratamento de grupos especiais
Crianças e jovens
A combinação de peginterferão alfa e ribavirina é o tratamento standard para crianças e jovens entre os 3 e os 18 anos de idade11. Tem-se revelado bem tolerada e altamente eficaz, particularmente em crianças com os genótipos 2/3. A segurança e eficácia do boceprevir e telaprevir ainda não foram estabelecidas em idade pediátrica (idade inferior a 18 anos).
Critérios para tratamento:
· Crianças e jovens com idade superior a 3 anos (o tratamento pode ser deferido até ao início da idade escolar, atendendo à possibilidade de erradicação espontânea até aos 4-5 anos de idade; deverá ser evitada a instituição da terapêutica durante o surto de crescimento pubertário).
· RNA VHC positivo em 2 determinações com intervalo de pelo menos 6 meses.
· Contexto familiar que assegure o cumprimento do tratamento.
· A realização de biópsia hepática não constitui um requisito pré-tratamento (a elastografia não foi ainda validada em idade pediátrica).
Esquema terapêutico:
· Confirmar imunização para o VHB e VHA.
· Peginterferão alfa:
◦ Peginterferão alfa 2b: 1-1,5_g/kg (ou 60_g/mg semanal); ou
◦ Peginterferão alfa 2a: 180_g/1,73m2 de superfície corporal (máximo de 180_g)
· Ribavirina: 15 mg/kg/dia, oral, dividida em 2 doses (máximo 1200 mg/dia se ≥ 75 kg e 1000 mg/dia se < 75 kg).*
· Duração da terapêutica:
◦ Genótipos 1/4: 48 semanas
◦ Genótipos 2/3: 24 semanas
* Não estando presentemente disponível a formulação da ribavirina em suspensão oral e atendendo a que as cápsulas não deverão ser manipuladas, a capacidade de ingestão da cápsula pela criança será um fator adicional individual determinante da altura para instituição da terapêutica em idade pediátrica.
Monitorização da eficácia da terapêutica:
A monitorização da eficácia terapêutica e da resposta virológica é feita de acordo com os critérios adotados para o adulto.
Retratamento:
Não existe informação nem experiência clínica suficiente sobre o retratamento em idade pediátrica, pelo que não está presentemente recomendado.
Monitorização da segurança da terapêutica:
A monitorização clínica deverá incluir, adicionalmente ao registo de efeitos adversos, o registo antropométrico da velocidade de crescimento e do estádio pubertário.
Doentes com hepatite C aguda
O tratamento deve ser precoce, mas não existe consenso sobre o melhor momento para iniciar a terapêutica. Sugere-se que seja começada após 12 semanas de persistência do RNA VHC sem declínio.
· Peginterferão alfa 2a (180_g sc/semana) ou peginterferão alfa 2b (1,5_g/kg de peso) durante 24 semanas.
Doentes em hemodiálise
Em doentes com insuficiência renal crónica, o tratamento recomendado é a monoterapia com peginterferão alfa nas doses convencionais. O peginterferão alfa-2a, dado que é eliminado por via hepática, pode ter vantagem relativamente ao peginterferão alfa-2b. A ribavirina está contraindicada em doentes com insuficiência renal grave ou em hemodiálise, embora possa ser usada por médicos experientes e em doentes cuidadosamente monitorizados. Nestes casos, a dose será de 200 mg/dia ou em dias alternados.
Doentes com coinfecção VHC/VIH
As indicações para o tratamento da coinfecção VHC/VIH são idênticas às dos doentes com monoinfeção. Com exceção da dose de ribavirina, que deverá ser sempre adaptada ao peso do doente, os regimes terapêuticos são semelhantes aos dos doentes monoinfetados1,12. A duração do tratamento depende da RVR:
· Doentes com RVR:
◦ Genótipos 1/4: 48 semanas de terapêutica
◦ Genótipos 2/3: 24 semanas de terapêutica*
· Doentes sem RVR:
◦ Genótipos 1/4: 72 semanas de terapêutica
◦ Genótipos 2/3: 48 semanas de terapêutica
Regras de paragem da terapêutica:
Semana 12: redução de RNA VHC < 2 log10
Semana 24: RNA VHC positivo
*A duração deverá ser de 48 semanas nos doentes com RNA VHC basal > 600 000 UI/mL ou fibrose avançada.
Nos indivíduos infetados por VIH com situação imunitária boa e estável nos quais não se preveja a necessidade estrita de iniciar antirretrovirais a médio prazo, o manejo da infeção por VHC deve obedecer aos critérios que permitam otimizar a taxa de resposta virológica sustentada. Os dados preliminares dos estudos com terapêutica tripla apontam para taxas de resposta virológica mantida idênticas às dos doentes monoinfetados.
O potencial para interações medicamentosas clinicamente significativas de qualquer dos fármacos inibidores da protease do VHC com os utilizados para o tratamento da infeção por VIH é elevado e passível de modificar a eficácia e a tolerância, quer da medicação para o VIH, quer da medicação para a hepatite C12. Neste contexto, a utilização de inibidores da protease do VHC em doentes já medicados para a infeção por VIH só se justifica no âmbito de ensaios clínicos.
Efeitos adversos associados à terapêutica tripla
Anemia
Graduação da gravidade da anemia:
Grau 1: Hb < 12 g/dL
Grau 2: Hb < 10 g/dL
Grau 3: Hb < 8,5 g/dL
A redução da dose de ribavirina depende do grau de anemia, e deverá ser feita de acordo com as recomendações que constam dos respetivos RCM. Quanto ao uso de eritropoietina, deve ser avaliado caso a caso.
Reações cutâneas
As reações cutâneas são mais frequentes com o telaprevir. A maioria dos casos surge nas primeiras 4 semanas e é ligeiro a moderado.
Graduação da gravidade do exantema:
· Grau 1 (ligeiro): erupção cutânea localizada e/ou de extensão limitada, com ou sem prurido.
· Grau 2 (moderado): erupção difusa atingindo < 50% da superfície corporal, com ou sem descamação superficial, prurido, ou envolvimento das mucosas sem ulceração
· Grau 3 (grave): exantema atingindo > 50% da superfície corporal ou exantema mais qualquer das seguintes características: exantema com vesículas, ulceração superficial das mucosas, descolamento da epiderme, lesões atípicas ou típicas em alvo, púrpura palpável.
· Grau 4: necrólise epidérmica tóxica, síndrome de Stevens-Johnson, pustolose exantemática aguda.
Na reação de grau 2, se houver progressão, deverá ser considerada a descontinuação do telaprevir e, ao fim de uma semana, da ribavirina, se o exantema piorar ou não melhorar após tratamento com corticoides tópicos e/ou anti-histamínicos orais. Na reação de grau 3, o telaprevir deve ser descontinuado de imediato e definitivamente, continuando a terapêutica com peginterferão e ribavirina. Nos doentes com reação de grau 4 todos os fármacos devem ser descontinuados de imediato e permanentemente.
Os corticoides e os anti-histamínicos podem ser usados no tratamento das formas ligeiras e moderadas.
Disgeusia
A necessidade de os inibidores da protease serem ingeridos com alimentos faz com que a disgueusia seja um sintoma que deve ser monitorizado com cuidado.
Interações medicamentosas
O boceprevir e, sobretudo, o telaprevir são metabolizados pelo citocromo p450 3A4 e 3A5 (CYP3A4/5). Existe, portanto, o risco de interação com medicamentos metabolizados pelas mesmas vias. Assim, chamamos a atenção para fármacos que podem induzir o CYP3A e, desse modo, baixar a concentração plasmática dos inibidores da protéase como, por exemplo, a rifampicina, fenitoína e a carbamazepina; outros medicamentos são inibidores, competitivos ou não, do CYP3A, diminuindo o metabolismo do boceprevir e do telaprevir, originando a sua sobredosagem como, por exemplo, os antifúngicos.
Os inibidores da protease podem, por outro lado, ter um efeito inibidor sobre diversos medicamentos, o que pode originar sobredosagem desses fármacos, como é o caso dos antiarrítmicos amiodarona, os derivados da ergotamina, as benzodiazepinas e as estatinas; outros, ainda, podem ter a sua eliminação aumentada com a consequente redução da sua eficácia, como é o caso dos anovulatórios, escitalopram, desipramina e zolpidem.
Consoante as situações, durante a terapêutica com os inibidores da protease pode ser necessário descontinuar alguns fármacos ou proceder a modificações da dosagem.
Tabela 6 Doentes não respondedores a terapêutica prévia com peginterferão + ribavirinaa
Bibliografia
1. EASL clinical practice guidelines: management of hepatitis C virus infection. J Hepatol. 2011;55:245-64. [ Links ]
2. Poordad F, McCone J, Bacon BR, Bruno S, Manns MP, Sulkowski MS, et al. Boceprevir for untreated chronic genotype 1 infection. N Engl J Med. 2011;364:1195-206. [ Links ]
3. Jacobson IM, McHutchinson JG, Dusheiko GM, Di Bisceglie AM, Rajender Reddy K, Bzowej NH, et al. Telaprevir for previously untreated chronic hepatitis C virus infection. N Engl J Med. 2011;364:2405-16. [ Links ]
4. Bacon BR, Gordon SC, Lawitz E, Marcellin P, Vierling JM, Zeuzem S, et al. Boceprevir for previously treated chronic HCV genotype 1 infection. N Engl J Med. 2011;364:1207-17. [ Links ]
5. Zeuzem S, Andreone P, Pol S, Lawitz E, Diago M, Roberts S, et al. Telaprevir for retreatment of HCV infection. N Engl J Med. 2011;364:2417-28. [ Links ]
6. Ghany MG, Nelson DR, Strader DB, Thomas DI, Seeff L. An update on treatment of genotype 1 chronic hepatitis C virus infection: 2011 practice guidelines by the American association for the Study of the Liver Diseases. Hepatology. 2011;54:1433-44. [ Links ]
7. Scherzer TM, Stattermayer AF, Strasser M, Laferl H, Maieron A, Stauber R, et al. Impact of IL28B on treatment outcomes in hepatitis C virus G1/4 patients receiving response-guided therapy with peginterferon alpha-2a (40KD)/ribavirin. Hepatology. 2011:541518-26. [ Links ]
8. Fried MW, Hadziyannis SJ, Shiffman ML, Messinger D, Zeuzem S. Rapid virological response is the most important predictor of sustained virological response across genotypes in patients with chronic hepatitis C virus infection. J Hepatol. 2011, http://dx.doi.org/10.1016/j.jhep.2010.10.032. [ Links ]
9. Sherman KE, Flamm SL, Afdhal NH, Nelson DR, Sulkowski MS, Everson GT, et al. Response-guided telaprevir combination treatment for hepatitis C virus infection. N Engl J Med. 2011;365:1014-24. [ Links ]
10. Liu S, Cipriano LE, Holodniy M, Owens MD, Goldhaber-Fiebert D. New protease inhibitors for the treatment of chronic hepatitis C. A cost-effectiveness analysis. Ann Intern Med. 2012;156:279-90. [ Links ]
11. Schwarz KB, Gonzalez-Peralta RP, Murray KF, Molleston JP, Haber BA, Jonas MM, et al. The combination of ribavirin and peginterferon is superior to peginterferon and placebo for children and adolescents with chronic hepatitis C. Gastroenterology. 2011;140:450-8. [ Links ]
12. EACS, European Guidelines for treatment of HIV infected adults in Europe. Version 6.0 - October 2011. Disponível em: http://www.europeanaidsclinicalsociety.org/index.php?option=comcontent&view=article&id=59&Itemid=41 [ Links ]
*Autor para correspondência
Correio eletrónico: josevelosa@fm.ul.pt (J. Velosa).
Recebido a 19 de abril de 2012; aceite a 19 de abril de 2012
Apêndice. Material adicional
Pode consultar o material adicional para este artigo na sua versão eletrónica disponível em http://dx.doi.org/10.1016/j.jpg.2012.04.032 .













