Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Acessos
Acessos
Links relacionados
-
 Similares em
SciELO
Similares em
SciELO
Compartilhar
Jornal Português de Gastrenterologia
versão impressa ISSN 0872-8178
J Port Gastrenterol. vol.19 no.6 Lisboa nov. 2012
https://doi.org/10.1016/j.jpg.2012.07.011
Diarreia associada ao Clostridium difficile - Casuística de 8 anos
Clostridium difficile associated diarrhea - An eight-year retrospective review
João Dinis Silva∗, Nuno Veloso, Rogério Godinho, Isadora Rosa, Lurdes Gonçalves, Isabel Medeiros e Celeste Viveiros
Departamento de Gastrenterologia, Hospital do Espírito Santo de Évora, EPE, Évora, Portugal
*Autor para correspondência
Resumo
Introdução: O Clostridium difficile é o principal agente da diarreia nosocomial nos países desenvolvidos e a sua incidência, morbilidade e mortalidade têm vindo a aumentar nos últimos anos. Os principais fatores de risco para o desenvolvimento da doença são a antibioterapia prévia, a idade avançada e o tempo de hospitalização.
Objetivos: Caracterizar a ocorrência de diarreia associada ao Clostridium difficile na nossa instituição, num período de 8 anos (2000-2008), com análise dos fatores de risco potencialmente implicados nesta população de doentes.
Material e métodos: Fizemos um estudo retrospetivo, baseado na consulta de processos clínicos identificados por consulta do diagnóstico de diarreia associada ao Clostridium difficile na base de dados do hospital entre 1 de janeiro de 2000 e 31 de dezembro de 2008. Pesquisaram-se fatores de risco, meios de diagnóstico e complicações da doença. Na análise estatística, para as variáveis contínuas, utilizou-se o teste t de Student e para as variáveis categóricas o teste exato de Fisher.
Resultados: Identificaram-se 37 casos de diarreia associada ao Clostridium difficile no período de estudo (média de idades de 76 anos) sendo que 16 casos ocorreram em 2008. As principais classes de antibióticos implicadas foram as penicilinas, as quinolonas, as cefalosporinas e os carbapenemens. Em 2008, os carbapenemens estiveram mais vezes implicados (p = 0,01), utilizaram-se mais inibidores da bomba dos protões (p = 0,02) e registaram-se mais complicações (p = 0,01).
Conclusão: Foi identificado um aumento da incidência de diarreia associada ao Clostridium difficile em 2008, no nosso hospital. Documentou-se igualmente um maior uso de carbapenemes e de IBP nesta população de doentes em 2008.
PALAVRAS-CHAVE Diarreia nosocomial; Clostridium difficile; Colite pseudomembranosa
Abstract
Introduction: In developed countries, Clostridium difficile is responsible for almost all cases of hospital acquired diarrhea and its incidence, morbidity and mortality have increased substantially over the years. The main risk factors implicated are recent antibiotic usage, increasing age and prolonged hospitalization.
Objectives: To characterize the occurrence of Clostridium difficile associated diarrhea in our institution, in an eight-year period between 2000 and 2008, with the analysis of the potentially implicated risk factors.
Material and methods:We conducted a retrospective study where we considered patients admitted to our institution between January/2000 and December/2008 with the diagnosis of Clostridium difficile associated diarrhea and recorded information regarding risk factors, diagnostic procedures, treatment and complications. For the statistical analysis, t Student test and Fishers exact test were used.
Results: We identified 37 cases of Clostridium difficile associated diarrhea in the study period (mean age 76 years), 16 of which occurred in the year 2008. Penicillins, quinolones and cephalosporins were the most commonly involved classes of antibiotics. In 2008, carbapenems were used more frequently (p = 0,01), as were the proton pump inhibitors (p = 0,02) and the number of complications rose significantly (p = 0,01).
Conclusions: In 2008 there was a higher incidence of Clostridium difficile associated diarrhea in our institution. We also encountered an increased use of carbapenems and proton pump inhibitors in that same time period.
KEYWORDS Nosocomial diahrrea; Clostridium difficile; Pseudomembranous colitis
Introdução
A bactéria Clostridium difficile (C. difficile), um bacilo gram positivo, anaeróbio, formador de esporos e produtor de toxinas patogénicas (A e B) é responsável pela quase totalidade dos casos de colite pseudomembranosa (CPM) e por até 20% dos casos de diarreia associada aos antibióticos sem colite1-2. É a causa mais comum de diarreia nosocomial nos países desenvolvidos e, desde 1980, a sua incidência, morbilidade e mortalidade a nível mundial têm aumentado3-5. Recentemente, uma nova estirpe (BI/NAP1/027) produtora de uma toxina binária e resistente às quinolonas, emergiu como responsável por vários surtos no Canadá e EUA6. Dados recolhidos desses surtos referiam taxas de incidência 4 vezes e meia superiores às taxas históricas e um aumento de 5 vezes na mortalidade7. Na Europa, esta estirpe já foi detetada em 16 países, com 9 deles a reportarem surtos8.
Os fatores de risco mais consistentemente associados ao desenvolvimento da doença são a antibioterapia prévia, a idade avançada (especialmente acima dos 60 anos de idade) e o tempo de hospitalização9-10. Apesar de qualquer antibiótico poder estar implicado, os mais frequentemente envolvidos são a clindamicina, as cefalosporinas de terceira geração e as penicilinas de largo espetro4. Recentemente, as quinolonas têm vindo a assumir um papel preponderante11. Outros fatores de risco que têm sido descritos são a gravidade das comorbilidades, a entubação nasogástrica, a supressão da acidez gástrica, a permanência em Unidade de Cuidados Intensivos (UCI) e a exposição a estados imunossupressivos (transplantação, síndrome de imunodeficiência adquirida, doença inflamatória intestinal e neoplasias)12.
O espetro da lesão provocada por esta bactéria engloba o portador assintomático, a diarreia associada aos antibióticos, a CPM e a colite fulminante2. Cerca de 3-8% dos doentes com infeção por C. difficile desenvolvem doença fulminante (perfuração, íleos grave, megacólon tóxico, hipotensão com necessidade de vasopressores e septicemia refratária), com eventual necessidade de colectomia de emergência 5.
A abordagem inicial ao tratamento passa pela descontinuação do antibiótico responsável (resolve a diarreia em 23% dos casos) e, se necessário, pela instituição de terapêutica oral com metronidazol 500 mg 3x/dia ou vancomicina 125 mg 4x/dia, durante 10 dias (média de 4 dias até à resolução da diarreia). A taxa de recidiva varia entre os 10 e os 15%. O metronidazol tem sido recomendado por razões económicas e porque evita a aquisição de resistência à vancomicina por outras bactérias nosocomiais13. Recentemente foram reportadas taxas de falência de tratamento e de recidiva mais elevadas com o metronidazol, parecendo existir especial vantagem na utilização da vancomicina nas formas mais graves da doença14-15.
O objetivo do presente estudo foi caracterizar a ocorrência de diarreia associada ao C. difficile (DACd) na nossa instituição, num período de 8 anos entre 2000 e 2008, com análise e caracterização da amostra relativamente aos fatores de risco, métodos de diagnóstico, tratamento e complicações da doença.
Métodos
Foi feita uma pesquisa do diagnóstico de DACd (CID-9-MC: 008,45) na base de dados dos Grupos de Diagnósticos Homogéneos (GDH) do Hospital do Espírito Santo de Évora, EPE, entre os dias 1 de janeiro de 2000 e 31 de dezembro de 2008. Este hospital presta cuidados de saúde aos cerca de 170 000 habitantes do distrito de Évora e tem uma lotação de 355 camas. Tem em média cerca de 10 000 internamentos por ano, excluindo os atribuídos aos serviços de Ginecologia/Obstetrícia, Pediatria e Psiquiatria.
Consideraram-se casos de diarreia associada ao C. difficile aqueles com teste de pesquisa da toxina positivo e/ou com endoscopia digestiva baixa ou histopatologia compatível com colite pseudomembranosa. A pesquisa da toxina foi realizada por meio de um teste imunoenzimático, utilizando-se para o efeito, a partir de 2006, o kit ImmunoCard Toxins A&B (Meridien Bioscience, Inc., Cincinnati, EUA). Não foi possível identificar o kit utilizado para a realização deste teste entre 2000 e 2006, sabendo-se no entanto que só detetava a toxina A.
Dois episódios de DACd no mesmo doente foram tidos como eventos distintos se separados por mais de 3 meses, e como recidiva se separados por menos de 3 meses. Todos os casos cuja administração de antibióticos foi feita em meio hospitalar foram considerados como DACd de aquisição hospitalar. Os casos complicados foram aqueles em que o doente faleceu ou onde ocorreu megacólon tóxico, perfuração ou choque. Foi recolhida informação respeitante ao sexo, idade, motivo de internamento, antibioterapia (prévia, se até 3 meses antes do início da diarreia), tempo de internamento e internamentos anteriores (se até 3 meses antes do início da diarreia), utilização concomitante de inibidor da bomba de protões (IBP) ou sonda nasogástrica (SNG) nas 48 horas prévias ao início de diarreia, permanência em UCI, exposição a estados imunossupressivos (quimioterapia, neoplasia, transplantação, síndrome de imunodeficiência adquirida e corticoterapia), tipo e tempo de tratamento e evolução.
Compararam-se variáveis contínuas com o teste t de Student e variáveis categóricas com o teste exato de Fisher. Utilizou-se o software Graphpad Prism versão 5.0 para Windows para o tratamento estatístico dos dados.
Resultados
Foram identificados 37 casos de DACd durante o período de 8 anos abrangido pelo estudo. Vinte e quatro doentes (64,9%) eram do sexo feminino e 13 do sexo masculino. A média de idades foi de 76,9±8 anos (57-95 anos).
A pesquisa de toxinas foi realizada em 25 doentes, dos quais 21 (84%) foram positivamente identificados por este método. A endoscopia digestiva baixa foi utilizada em 20 doentes, havendo evidência de pseudomembranas em 19 (95%) deles e um caso de colite que histologicamente correspondia a CPM. Em 8 doentes realizaram-se os 2 métodos de diagnóstico, sendo que a pesquisa de toxinas foi utilizada como primeiro método diagnóstico em 4 deles e executada no mesmo dia que a endoscopia digestiva baixa nos restantes 4. Nos 4 doentes que apresentaram teste de pesquisa de toxinas negativo, todos tinham evidência de pseudomembranas na endoscopia digestiva baixa.
A DACd foi considerada de aquisição e início na comunidade em 9 doentes (24,3%) e de aquisição em meio hospitalar e início na comunidade em 10 doentes (27%). Nos restantes 18 casos (aquisição e início no hospital) o tempo médio até ao início da diarreia foi de 19,6±19,2 dias (3-87 dias). Nos 34 casos em que foi possível obter dados relativos à antibioterapia prévia, em 31 casos (91,2%) houve toma de antibióticos nas 12 semanas anteriores à diarreia. As classes de antibióticos mais utilizadas foram as penicilinas (n=14), as quinolonas (n = 13), as cefalosporinas (n = 7) e os carbapenemes (n = 7) (tabela 1). A maioria dos casos estava associada à toma de uma única classe de antibióticos (n = 18).
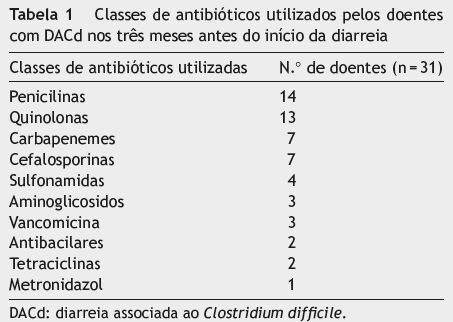
Em 2 doentes não se apurou o tratamento utilizado e em 3 doentes utilizaram-se metronidazol e vancomicina sequencialmente. Nos 32 doentes que fizeram tratamento com um único antibiótico (25-metronidazol; 7-vancomicina), o tempo médio de antibioterapia foi de 10,6±3,9 dias (3-24 dias). Houve registo de complicações em 13 casos (35,1%).
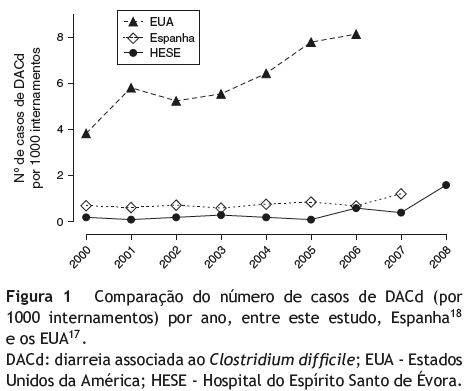
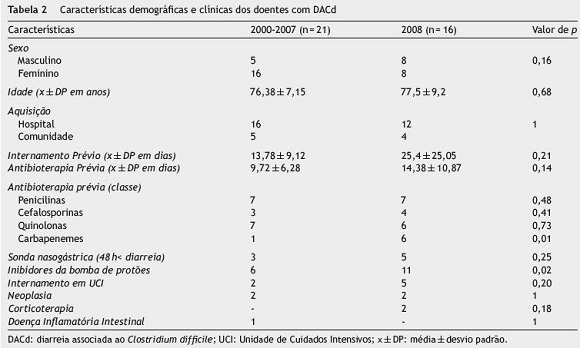
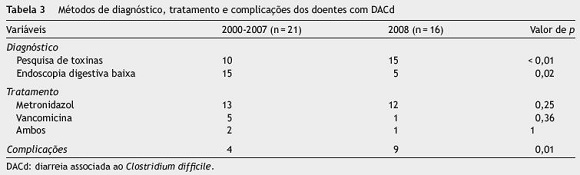
Em 2008 registaram-se 16 casos de DACd (1,6 casos/ 1000 internamentos - fig. 1). A média de idades foi de 77,5±9,2 anos (61-95 anos). Existiram 9 casos com início e aquisição no hospital, com tempo médio de internamento de 25,4±25,1 dias (3-87 dias). Treze doentes realizaram antibioterapia nas 12 semanas precedentes sendo as penicilinas (n = 7), quinolonas (n = 6), carbapenemes (n = 6) e cefalosporinas (n = 4) as mais usadas. Estes e os dados relativos aos outros fatores de risco são apresentados na tabela 2. Os casos encontram-se divididos em 2 grupos (coortes temporais), de acordo com o período de ocorrência da DACd (2000-2007 e 2008), que serviram de base à restante análise de resultados. Em 2008, 11 (68,8%) doentes utilizaram IBP (omeprazol em todos os casos). Neste período de tempo, verificou-se maior utilização de carbapenemes e de IBP do que no período de 2000 a 2007 e estas diferenças tiveram significado estatístico (p <0,05). A pesquisa de toxinas foi realizada em 15 doentes e 14 (93,3%) apresentaram testes positivos. Cinco doentes foram submetidos a endoscopia digestiva baixa, identificando-se pseudomembranas em 4 deles. Aqui também se registaram diferenças significativas, havendo, em 2008, maior recurso à pesquisa de toxinas como método de diagnóstico (p <0,01). Como tratamento, foi utilizado o metronidazol em 13 doentes e a vancomicina em 2. Num caso, foram utilizados os 2 antibióticos. Em média, o tratamento durou 9,8±3,6 dias (3-17 dias). Em 2008, a probabilidade de ter DACd complicada foi significativamente superior (p = 0,01) (tabela 3).
Discussão
O número de casos de DACd no hospital a que se refere este estudo situou-se entre os 0,2-1,6 casos/1000 internamentos, no período de 2000 a 2008 (fig. 1). Comparativamente, num estudo canadiano e considerando um cenário não epidémico, a incidência média foi de 3,06/1000 internamentos e mais recentemente, nos Estados Unidos da América (EUA), observaram-se entre 3,82-8,08 casos/1000 internamentos, de 2000-200616-17. Ligeiramente inferiores e mais de acordo com os nossos dados, em Espanha a incidência permaneceu entre os 0,39 e 1,22 casos/1000 internamentos (1999-2007)18. Apesar das diferenças, o que é de realçar é a tendência para o crescimento do número de casos desta infeção em ambiente hospitalar. O facto de não existir informação precisa relativa ao teste imunoenzimático utilizado entre 2000 e 2006 limita, de algum modo, esta nossa análise por não permitir aferir a sua sensibilidade nem especificidade. No entanto, sabemos que estas seriam inferiores ao teste introduzido depois de 2006 e, de qualquer modo, nas ocasiões em que foi feita a pesquisa e esta se revelou negativa, obteve-se o diagnóstico por endoscopia digestiva baixa (4 casos).
No nosso estudo, as classes de antibióticos mais associadas ao desenvolvimento da doença foram precisamente aquelas já referidas na literatura: penicilinas de largo espetro, cefalosporinas e quinolonas. As diferenças foram essencialmente de 2 ordens: por um lado a clindamicina não surge tão frequentemente associada ao aparecimento de doença na nossa amostra, ao contrário do que vem referido classicamente na literatura, e os carbapenemes aparecem em igualdade com as quinolonas em 20084,12. Neste ano, a sua utilização adquire, inclusive, significado estatístico no que concerne ao aparecimento de DACd, quando comparada com os restantes anos (p = 0,01). Nalguns estudos, o imipenem aparece fortemente associado ao desenvolvimento de DACd e num estudo português surgiu mesmo atrás das quinolonas, tendo sido utilizado em 16,2% dos doentes submetidos a antibioterapia e que desenvolveram CPM19. A relação entre um antibiótico em particular e o desenvolvimento de DACd parece alterar-se com os padrões de uso desse antibiótico a nível institucional e na comunidade e com a suscetibilidade específica do próprio agente causador de diarreia a esse antibiótico20.
A existência de diferenças entre os grupos relativamente ao uso de IBP, tendo estes sido mais utilizados no ano de maior incidência de DACd (2008; p = 0,02) também se encontra descrita na literatura21. Embora existam dados contraditórios em relação ao papel dos IBP na aquisição da DACd em meio hospitalar, experiências feitas em ratos de laboratório e estudos de base populacional relativos à aquisição da doença na comunidade têm fornecido dados consistentes que fundamentam os IBP como fator de risco independente. Parece que o seu mecanismo de ação, proporcionando o aumento do pH gástrico, favorece a sobrevivência da bactéria e deste modo facilita a aquisição da infeção - alterações na resposta leucocitária e o aumento da produção de toxinas são possíveis mecanismos adicionais22-23. Para além disto, os IBP são dos fármacos mais prescritos atualmente, o que também poderá ajudar a compreender a diferença encontrada entre os 2 grupos.
Relativamente ao método de diagnóstico da DACd, encontraram-se diferenças com significado estatístico entre os 2 grupos, sendo a pesquisa de toxinas mais utilizada em 2008 (p <0,01). Até ao ano de 2006, não foi possível apurar qual o teste de pesquisa de toxinas utilizado no nosso hospital, sabendo-se só que detetava unicamente a toxina A, levando provavelmente a um maior recurso à endoscopia digestiva baixa como teste de diagnóstico. Os testes imunoenzimáticos mais recentes já apresentam sensibilidade e especificidade elevadas quando comparados com o testepadrão, que se baseia na citotoxicidade celular, mas estes resultados não se mantêm quando a prevalência das toxinas nas fezes é inferior a 10%, baixando o seu valor preditivo positivo24. No ano de 2008, registou-se também um maior número de casos complicados, sendo a diferença significativa relativamente aos outros anos (p = 0,01). A tendência para um incremento das complicações e da mortalidade já foi observada e relatada noutros estudos, maioritariamente associada a uma estirpe mais virulenta de C. difficile, mas também à existência de mais comorbilidades e de idade superior nas populações afetadas 11. Relativamente à idade, não encontramos diferenças entre os grupos, mas não averiguámos as comorbilidades nem o tipo de estirpe presente, pelo que serão necessários mais estudos para corretamente abordar esta questão.
Conclusão
Em 2008, no nosso estudo verificámos um aumento na incidência de casos de DACd relativamente aos outros anos (2000-2007). Documentou-se igualmente um maior uso de carbapenemes e de IBP nesta população de doentes em 2008. O principal método de diagnóstico utilizado foi a pesquisa de toxinas, por meio de teste imunoenzimático, em oposição à endoscopia digestiva baixa, mais usada nos outros anos. Registaram-se igualmente mais casos complicados de DACd em 2008.
Bibliografia
1. Bartlett JG, Chang TW, Gurwith M, Gorbach SL, Onderdonk AB. Antibiotic-associated pseudomembranous colitis due to toxinproducing clostridia. N Engl J Med. 1978;298:531-4. [ Links ]
2. Kelly CP, Pothoulakis C, Lamont JT. Clostridium difficile colitis. N Engl J Med. 1994;330:257-62. [ Links ]
3. Mylonakis E, Ryan ET, Calderwood SB. Clostridium difficileassociated diarrhea. Arch Intern Med. 2001;161:525-33. [ Links ]
4. Thomas C, Stevenson M, Riley TV. Antibiotics and clostridium difficile-associated diarrhea: a systematic review. J Antimicrob Chemother. 2003;51:1339-50. [ Links ]
5. Jaber MR, Olafsson S, Fung WL, Reeves ME. Clinical review of the management of fulminant clostridium difficile infection. Am J Gastroenterol. 2008;103:3195-203. [ Links ]
6. Macdonald LC, Killgore GE, Thompson A, Owens Jr RC, Kazakova SV, Sambol SP, et al. An epidemic toxin gene-variant strain of clostridium difficile. N Engl J Med. 2005;353:2433-41. [ Links ]
7. Mcfarland L, Beneda HW, Clarridge JE, Raugi GJ. Implications of the changing face of clostridium difficile disease for health care practitioners. Am J Infect Control. 2007;35:237-53. [ Links ]
8. Kuijper EJ, Barbut F, Brazier JS, Kleinkauf N, Eckmanns T, Lambert ML, et al. Update of clostridium difficile infection due to PCR ribotype 027 in Europe, 2008. Euro Surveill. 2008;13, pii:18942. [ Links ]
9. Karlstrom O, Fryklund B, Tullus K, Burman LG. A prospective nationwide study of clostridium difficile-associated diarrhea in Sweden. Clin Infect Dis. 1998;26:141-5. [ Links ]
10. Bartlett JG. Clostridium difficile: old and new observations. J Clin Gastroenterol. 2007;41:524-9. [ Links ]
11. Pepin J, Valiquette L, Alary M, Villemure P, Pelletier A, Forget K, et al. Clostridium difficile-associated diarrhea in a region of Quebec from 1991 to 2003: a changing pattern of disease severity. CMAJ. 2004;171:466-72. [ Links ]
12. Bignardi GE. Risk factors for Clostridium difficile infection. J Hosp Infect. 1998;40:1-15. [ Links ]
13. Gerding DN, Johnson S, Peterson LR, Mulligan ME, Silva J Jr, et al. Clostridium difficile-associated diarrhea and colitis. Infect Control Hosp Epidemiol. 1995;16:459-77. [ Links ]
14. Musher DM, Aslam S, Logan N, Nallacheru S, Bhaila I, Borchert F, et al. Relatively poor outcome after treatment of clostridium difficile colitis with metronidazole. Clin Infect Dis. 2005;40:1586-90. [ Links ]
15. Zar FA, Bakkanagari SR, Moorthi KM, Davis MB. A comparison of vancomycin and metronidazole for the treatment of clostridium difficile-associated diarrhea, stratified by disease severity. Clin Infect Dis. 2007;45:302-7. [ Links ]
16. Alfa MJ, Du T, Beda J. Survey of incidence of Clostridium difficile infection in Canadian hospitals and diagnostic approaches. J Clin Microbiol. 1998;36:2076-80. [ Links ]
17. Zilberberg MD. Clostridium difficile-related hospitalizations among US adults, 2006. Emerg Infect Dis. 2009;15:122-4. [ Links ]
18. Asensio A, Vaque-Rafart J, Calbo-Torrecilas F, Gestal-Otero JJ, López-Fernández F, Trilla-Garcia A, et al. Increasing rates in Clostridium difficile infection (CDI) among hospitalised patients. Euro Surveill. 2008;13, pii:18943. [ Links ]
19. Almeida N, Silva N, Parente F, Portela F, Gouveia H, Alexandrino B, et al. Colite pseudomembranosa - uma casuística de internamentos. J Port Gastrenterol. 2006;13:6-13. [ Links ]
20. Baxter R, Ray T, Fireman BH. Case-control study of antibiotic use and subsequent clostridium difficile-associated diarrhea in hospitalized patients. Infect Control Hosp Epidemiol. 2008;29:44-50. [ Links ]
21. Aseeri M, Schroeder T, Kramer J, Zackula R. Gastric acid suppression by proton pump inhibitors as a risk factor for clostridium difficile-associated diarrhea in hospitalized patients. Am J Gastroenterol. 2008;103:2308-13. [ Links ]
22. Dial S, Delaney JAC, Barkun AN, Suissa S. Use of gastric acidsuppressive agents and the risk of community-acquired clostridium difficile-associated disease. JAMA. 2005;294:2989-95. [ Links ]
23. Cunningham R, Dial S. Is over-use of proton pump inhibitors fuelling the current epidemic of clostridium difficle-associated diarrhoea? J Hosp Infect. 2008;70:1-6. [ Links ]
24. Planche T, Aghaizu A, Holliman R, Riley P, Poloniecki J, Breathnach A, et al. Diagnosis of clostridium difficile infection by toxin detection kits: a systematic review. Lancet Infect Dis. 2008;8:777-84. [ Links ]
Conflito de interesses
Os autores declaram não haver conflito de interesses.
*Autor para correspondência
Correio eletrónico: jdinisilva@gmail.com (J.D. Silva).
Recebido a 23 de novembro de 2011; aceite a 9 de maio de 2012













