Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Acessos
Acessos
Links relacionados
-
 Similares em
SciELO
Similares em
SciELO
Compartilhar
Jornal Português de Gastrenterologia
versão impressa ISSN 0872-8178
J Port Gastrenterol. vol.19 no.6 Lisboa nov. 2012
https://doi.org/10.1016/j.jpg.2012.04.027
Alergia às proteínas do leite de vaca em adolescente com anafilaxia: uma opção terapêutica inovadora
Cows milk allergy in an adolescent with anaphylaxis: A new therapeutic option
Mariana Couto∗, Graça Sampaio, Susana Piedade e Mário Morais de Almeida
Centro de Imunoalergologia, Hospital CUF Descobertas, Lisboa, Portugal
*Autor para correspondência
Resumo
A alergia às proteínas do leite de vaca (APLV) é uma patologia cada vez mais prevalente e com duração mais prolongada. A dieta de evicção é muitas vezes difícil, sendo frequentes as reações adversas por ingestão de alergénio oculto. Reportamos o caso clínico de um adolescente com antecedentes de APLV de longa duração, com clínica de vários episódios de anafilaxia por ingestão de leite de vaca (LV) como alergénio oculto, submetido com sucesso a protocolo de indução de tolerância ao LV, tendo-se alcançado uma dose diária de 200 ml, permitindo uma dieta livre. Este procedimento, realizado em centros especializados e por equipas experientes, constitui uma estratégia terapêutica inovadora, nomeadamente em casos de APLV grave, influenciando a história natural da doença e prevenindo a ocorrência de acidentes, possibilitando assim uma melhoria significativa da qualidade de vida. É importante a sua divulgação para que sejam oferecidas a estes doentes as melhores opções de tratamento.
PALAVRAS-CHAVE Alergia; Adolescente; Anafilaxia; Indução de tolerância; Leite de vaca
Abstract
Cows milk allergy (CMA) is an increasingly prevalent disease, with longer duration. The elimination diet is often difficult and so adverse reactions by ingestion of hidden allergen are common. We report the case of an adolescent with a history of severe CMA, with several episodes of anaphylaxis after accidental ingestion of cows milk (CM), successfully submitted to a CM tolerance induction protocol, reaching a daily dose of 200 ml, which allowed a free diet. Applied by experienced staff in specialized medical centers, this seems to be an innovative therapeutic strategy also in severe cases of CMA, modifying its natural history and conferring protection against hidden allergen ingestion, allowing a significant improvement in quality of life. Its disclosure is important so that the best treatment options are offered to these patients.
KEYWORDS Allergy; Adolescent; Anaphylaxis; Tolerance induction; Cows milk
Introdução
As reações adversas a alimentos dividem-se em 2 tipos: as de causa alérgica, mediadas por mecanismos imunológicos nos quais pode participar ou não a IgE (alergia alimentar IgE ou não-IgE mediada), e as devidas a outras formas de hipersensibilidade / intolerância; esta última inclui as causas metabólicas/enzimáticas, farmacológicas, tóxicas e idiopáticas1. Nas últimas décadas, a alergia alimentar tem assumido uma prevalência e gravidade crescentes, estimando-se que atinja atualmente 5% das crianças com menos de 5 anos e 4% dos adolescentes e adultos2. A apresentação clínica é variável, podendo ocorrer manifestações mucocutâneas, respiratórias, gastrintestinais e, em alguns casos, anafilaxia. As manifestações gastrintestinais são comuns2 (vómitos, diarreia, esofagite e gastrenterite eosinofílicas, proctocolite alérgica) e entram no diagnóstico diferencial com outros distúrbios deste foro, impondo em muitos casos o apoio do gastrenterologista. Trata-se atualmente de uma patologia relativamente à qual, para além da evicção alergénica, as opções terapêuticas específicas são muito limitadas. A possibilidade de uma abordagem ativa, para induzir a tolerância alimentar, tem sido empreendida com sucesso variável3-5.
Nos primeiros anos de vida, a alergia às proteínas do leite de vaca (APLV) afeta cerca de 2,5% das crianças e, considerando as formas IgE (cerca de 60%) e não-IgE mediadas, constitui a alergia alimentar mais comum em idade pediátrica6. Na maioria das crianças é ultrapassada até à idade escolar, mas uma percentagem considerável mantém a clínica durante a segunda década de vida6,7. O tratamento convencional da APLV consiste na evicção das proteínas do leite de vaca (LV), para além da resolução dos episódios agudos.
Nos casos de APLV persistente grave, o prognóstico é menos favorável e a probabilidade de acidentes por exposição a alergénio oculto é elevada, com uma prevalência anual que pode chegar a 20% dos doentes6.
Torna-se essencial, portanto, a identificação de uma alternativa terapêutica, o que justifica o forte empenhamento na investigação de indução de tolerância alimentar ao LV3-5.
Caso clínico
Adolescente do sexo masculino, 16 anos de idade, com antecedentes familiares de atopia (mãe) e pessoais de asma intermitente e rinite alérgica persistente moderada (sem terapêutica preventiva), e urticária ao frio, encontrando-se sensibilizado a pólenes de gramíneas e de oliveira e a ácaros do pó doméstico. No 1.◦ ano de vida foi-lhe diagnosticada APLV, tendo sido seguido em consulta de Imunoalergologia, onde terá sido recomendada a evicção de proteínas de LV e proposta alimentação com soja. Nos últimos anos acabou por abandonar a referida consulta, referindo como motivo o desânimo e a ausência de alternativas terapêuticas.
Em fevereiro de 2010, no bar do nosso hospital, poucos minutos após ingerir um folhado de salsicha que desconhecia conter queijo, teve uma reação anafiláctica (urticária generalizada, dificuldade respiratória e tonturas, sem perda do conhecimento). Não era portador de dispositivo para autoadministração de adrenalina. Foi transportado ao Serviço de Urgência onde foi tratado com adrenalina e metilprednisolona, com resolução do quadro em 6 horas. Foi referenciado à consulta de Imunoalergologia da nossa Unidade, referindo ter tido várias reações anafilácticas com alergénio oculto na adolescência, que motivaram internamentos. Foi-lhe prescrito corticóide nasal para controlo da rinite, esquema de crise de asma com agonista beta-2 de curta ação inalado e esquema terapêutico em caso de anafilaxia por contacto acidental com LV (dispositivo para autoadministração de adrenalina, anti-histamínico e corticóide sistémico).
Em março de 2010 apresentava IgE específicas (ImmunoCAP®, Phadia, Uppsala, Suécia) positivas para LV (59,8 KU/L), caseína (53,3 KU/L), _-lactoalbumina (6,92 KU/L) e _-lactoglobulina (0,87 KU/L) (valores normais < 0,10 KU/L), assim como testes cutâneos com extratos comerciais (Laboratórios Leti, Madrid, Espanha) positivos para LV (6mm de pápula média), caseína (8 mm), _-lactoalbumina (11 mm) e _-lactoglobulina (7 mm). Nessa altura, considerando o quadro clínico, e após explicação detalhada dos riscos e das vantagens do procedimento, é proposto ao adolescente e à família iniciar um protocolo de indução de tolerância às proteínas do LV (detalhado na tabela 1).
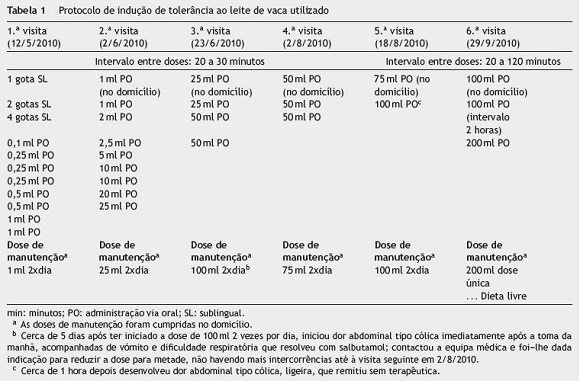
Foi recomendada a ingestão diária das doses de manutenção, sempre após a refeição e sem exercício físico vigoroso nas 2 horas subsequentes. Cerca de 5 dias após ter iniciado a dose de 100 ml 2 vezes por dia (3.a visita), manifestou dor abdominal tipo cólica, reprodutível, imediatamente após a toma da manhã, acompanhada de vómito e dispneia que resolveu com salbutamol. Contactou a equipa médica e foi-lhe dada indicação para reduzir a dose para metade, que manteve sem mais intercorrências até à visita seguinte.
Não se verificaram mais intercorrências significativas até ao final do protocolo, cumprindo atualmente uma dieta sem restrições, com indicação para manter ingestão diária mínima de 200 ml de LV. Tem programadas consultas trimestrais. Em novembro de 2010 repetiu estudo analítico que evidenciou diminuição das IgE específicas para LV (25,8 KU/L) e caseína (35,4 KU/L) e elevação da IgE específica para _-lactoalbumina (23,2 KU/L) e _-lactoglobulina (1,76 KU/L).
Discussão
Os mecanismos imunológicos implicados no aparecimento da alergia alimentar ainda não estão totalmente esclarecidos, embora provavelmente resulte de uma ausência de tolerância oral, ou seja, a inexistência de uma resposta ativa do sistema imunitário a um antigénio apresentado pela mucosa gastrintestinal. Nos doentes alérgicos, porém, essa resposta pode ocorrer naturalmente ou ser induzida. São vários os mecanismos responsáveis pela aquisição de tolerância, nomeadamente a indução de anergia clonal, a deleção clonal das células efectoras e a supressão celular ativa. Os 2 primeiros mecanismos justificariam a aquisição de tolerância favorecendo a alergia (intervenção de citocinas solúveis ou por interação entre recetores da célula T e das células apresentadoras de antigénio - CD80 e CD86) ou da deleção de clones de células T antigénio-específicas (por apoptose), ocorrendo quando o organismo se encontra exposto a elevadas concentrações de antigénio. O último, com indução de células T reguladoras produtoras de citocinas anti-inflamatórias, corresponderia à exposição mantida a baixas concentrações de antigénio.
O LV contém numerosas proteínas das quais 8 têm potencial alergénico, sendo as caseínas (Bos d 8) e as _-lactoglobulinas (Bos d 5) as mais frequentemente responsáveis pela ocorrência de APLV8.
As formas IgE-mediadas constituem mais de metade dos casos de APLV6, apresentando-se habitualmente por sintomatologia (tabela 2) imediata, poucos minutos após a ingestão, com quadros que variam desde apenas sintomas cutâneos (urticária, angioedema) ou gastrintestinais (vómitos, dor abdominal, diarreia), até quadros de anafilaxia potencialmente fatais2, mesmo com ingestão de pequenas doses9.
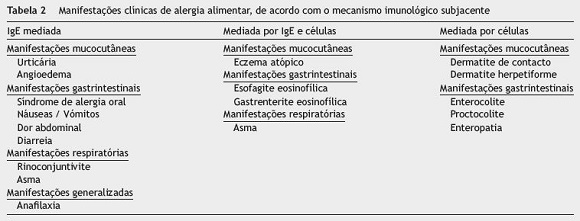
Dos doentes com APLV, 18 a 50% desenvolvem alergias a outros alimentos6,10,11, 32 a 41% desenvolvem asma, 20% eczema atópico e 20 a 31% rinoconjuntivite10, como é o caso do doente que reportamos. Muito embora no passado se acreditasse que o prognóstico era favorável, destacamos que os dados mais recentes revelam uma tendência para duração mais prolongada, reportando uma taxa de resolução da APLV IgE-mediada de 64% aos 12 anos e de 79% aos 16 anos7, sendo a caseína o alergénio mais associado a esta persistência7.
Tradicionalmente, a estratégia de abordagem adotada tem sido a dieta de evicção e o tratamento dos episódios acidentais, com base na justificativa teórica de que a ausência de exposição determinaria a deleção da memória imunológica. Esta abordagem, contudo, não assegura níveis aceitáveis de controlo do risco de ingestão dos alergénios na forma oculta, com consequente ocorrência de reações, face à enorme variedade de produtos alimentares processados e em diferentes situações, apesar do Decreto-Lei n.◦ 126/2005 ter vindo a alterar significativamente a legislação da rotulagem ao introduzir o conceito de alimentos com potencial alergénico major de referenciação obrigatória nos rótulos. Neste cenário de pluralidade de fatores não controláveis potenciadores da ocorrência de reações adversas, com índices de gravidade elevados, como documentado no presente caso clínico, tendência para duração mais prolongada, e o forte impacto na qualidade de vida dos doentes e suas famílias, justifica-se ponderar uma alternativa.
Pensando nos mecanismos primários de tolerância que ocorrem após a exposição a alergénios alimentares, pode-se conceber que, utilizando a mesma metodologia é possível induzir secundariamente o estado de tolerância em indivíduos que a perderam ou que nunca adquiriram este estado de normalidade. Com o objetivo de induzir tolerância e reproduzir o processo natural mais fisiológico, o alergénio implicado deve ser preferencialmente apresentado, no caso dos alergénios alimentares, no tubo digestivo, por via oral ou sublingual.
A indução de tolerância às proteínas do LV tem sido investigada em vários centros, com diferentes protocolos e resultados bastante díspares12-17. Atualmente, as metodologias são ainda muito variáveis, sobretudo na fase de indução, em que nos protocolos convencionais há aumentos de dose diários ou a intervalos de poucas semanas, enquanto nos protocolos rápidos (rush) os aumentos de dose ocorrem em intervalos de minutos a horas; existem também protocolos mistos. A ocorrência de efeitos secundários tem sido a regra nos protocolos orais rápidos12,13. Por outro lado, a duração dos protocolos convencionais é extremamente longa14, tratando-se portanto de uma terapêutica morosa e que consome muito tempo, para doentes e médicos.
A administração de anticorpos monoclonais como terapêutica coadjuvante, tal como no caso da dessensibilização a aeroalergénios com Omalizumab, foi também já investigada no contexto de indução de tolerância alimentar, tendo apresentado bons resultados18. Porém, o inovador protocolo misto que desenvolvemos19, com uma fase de indução rápida seguida de uma abordagem um pouco mais lenta, com via de administração sub-lingual e oral, usando como extrato alergénico o LV em natureza não-diluído, mas prevendo adaptações de doses, tem revelado excelente eficácia (com aquisição de tolerância para 200 ml de LV em menos tempo) e segurança mesmo em quadros com clínica de anafilaxia grave e sem necessidade de terapêutica imunológica coadjuvante, independentemente dos níveis das IgEs específicas, tal como ocorreu no caso em discussão, não tendo estas valor preditivo do sucesso do protocolo; no acompanhamento deste caso observou-se a redução imediata das IgEs específicas para LV e caseína, mas com subida da IgE específica para _-lactoalbumina e _-lactoglobulina.
Este procedimento, realizado em centros especializados e por equipas médicas experientes, com doentes e famílias esclarecidos e francamente motivados, afigura-se como uma estratégia terapêutica inovadora em casos de APLV IgEmediada, constituindo a única possibilidade de modificar a história natural desta patologia comprovada por estudo controlados15-17, e conferindo proteção relativamente à ingestão inadvertida, nomeadamente na forma de alergénio oculto, o que permite uma melhoria significativa da qualidade de vida destes doentes e dos seus familiares.
Durante a realização dos protocolos alguns fatores associam-se a um risco aumentado de reações para doses previamente toleradas; o esforço físico intenso, podendo associar-se a um processo de anafilaxia induzida pelo exercício dependente da ingestão do alimento, tem sido, na nossa experiência, o mais comum19. Esta possibilidade justifica que os doentes com história de anafilaxia continuem a ser portadores de dispositivo para autoadministração de adrenalina, mesmo após conclusão do protocolo. Especialmente na fase de indução, a administração do alergénio não deverá ser feita em jejum19. A terapêutica antialergénica indicada para o controlo das patologias coexistentes deverá ser mantida durante todo o protocolo.
Por fim, salienta-se que os dados disponíveis até à data não permitem estabelecer que a tolerância adquirida desta forma seja duradoura, pelo contrário, os estudos apontam para a dependência da ingestão sustentada do LV, podendo a sua interrupção levar à regressão do estado de tolerância alcançado17,19,20.
Bibliografia
1. Johansson SGO, Hourihane JOB, Bousquet J, Bruijnzeel-Koomen C, Dreborg S, Haahtela T, et al. A revised nomenclature for allergy - An EAACI position statement from the EAACI nomenclature task force. Allergy. 2001;56:813-24. [ Links ]
2. Boyce JA, Assaad A, Burks AW, Jones SM, Sampson HA, Wood RA, et al. Guidelines for the Diagnosis and Management of Food Allergy in the United States: Report of the NIAID-Sponsored Expert Panel. J Allergy Clin Immunol. 2010;126:S1-58. [ Links ]
3. Oliveira S, Câmara R, Marques S. Indução de tolerância a alimentos - Ficção ou realidade? Rev Port Imunoalergologia. 2005;13:347-56. [ Links ]
4. Patriarca G, Nucera E, Pollastrini E, Roncallo C, De Pasquale T, Lombardo C, et al. Oral specific desensitization in food-allergic children. Dig Dis Sci. 2007;52:1662-72. [ Links ]
5. Nowak-Wegrzyn A, Fiocchi A. Is oral immunotherapy the cure for food allergies? Curr Opin Allergy Clin Immunol. 2010;10:214-9. [ Links ]
6. Sampson HA, Burks AW. Adverse Reactions to Foods. In: Adkinson NF, Bochner BS, Busse WW, Holgate ST, Lemanske Jr RF, Simons ER, editores Middletons allergy: principles and practice. 7th ed. Philadelphia: WB Saunders; 2008. p. 1433-66. Cap. 65. [ Links ]
7. Skripak JM, Matsui EC, Mudd K, Wood RA. The natural history of IgE-mediated cows milk allergy. J Allergy Clin Immunol. 2007;120:1172-7. [ Links ]
8. Wal JM. Cows milk allergens. Allergy. 1998;53:1013-22. [ Links ]
9. Sampson HA. Fatal food-induced anaphylaxis. Allergy. 1998;53:125-30. [ Links ]
10. Santos A, Dias A, Pinheiro JA. Predictive factors for the persistence of cows milk allergy. Pediatr Allergy Immunol. 2010;21:1127-34. [ Links ]
11. Host A. Clinical course of cows milk protein allergy and intolerance. Pediatr Allergy Immunol. 1998;9(s11):48-52. [ Links ]
12. Staden U, Rolinck-Werninghaus C, Brewe F, Wahn U, Niggemann B, Beyer K. Specific oral tolerance induction in food allergy in children: efficacy and clinical patterns of reaction. Allergy. 2007;62:1261-9. [ Links ]
13. Martorell-Aragonés A, Félix Toledo R, Cerdá Mir JC, Martorell Calatayud A. Oral rush desensitization to cow milk. Following of desensitized patients during three years. Allergol Immunopathol. 2007;35:174-6. [ Links ]
14. Meglio P, Bartone E, Plantamura M, Arabito E, Giampietro PG. A protocol for oral desensitization in children with IgE-mediated cows milk allergy. Allergy. 2004;59:980-7. [ Links ]
15. Longo G, Barbi E, Berti I, Meneghetti R, Pittalis A, Ronfani L, et al. Specific oral tolerance induction in children with very severe cows milk-induced reactions. J Allergy Clin Immunol. 2008;121:343-7. [ Links ]
16. Skripak JM, Nash SD, Rowley H, Brereton NH, Oh S, Hamilton RG, et al. A randomized double-blind, placebo-controlled study of milk oral immunotherapy for cows milk allergy. J Allergy Clin Immunol. 2008;122:1154-60. [ Links ]
17. Meglio P, Giampietro PG, Gianni S, Galli E. Oral desensitization in children with immunoglobulin E-mediated cows milk allergy - follow-up at 4 yr and 8 months. Pediatr Allergy Immunol. 2008;19:412-9. [ Links ]
18. Noh G, Lee SS. A pilot study of interferon-gamma-induced specific oral tolerance induction (ISOTI) for immunoglobulin Emediated anaphylactic food allergy. J Interferon Cytokine Res. 2009;29:667-75. [ Links ]
19. Piedade S, Morais-Almeida M. Indução de tolerância em alergia alimentar. In: Castro FFM, Galvão CES, editores Imunoterapia. 1a edição São Paulo: Editora Manole Lda; 2011. p. 125-47. Cap.10. [ Links ]
20. Rolinck-Werninghaus C, Staden U, Mehl A, Hamelmann E, Beyer K, Niggemann B. Specific oral tolerance induction with food in children: transient or persistent effect on food allergy? Allergy. 2005;60:1320-2. [ Links ]
Conflito de interesses
Os autores declaram não haver conflito de interesses.
*Autor para correspondência
Correio eletrónico: marianafercouto@gmail.com (M. Couto).
Recebido a 27 de dezembro de 2010; aceite a 13 de fevereiro de 2011













