Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Acessos
Acessos
Links relacionados
-
 Similares em
SciELO
Similares em
SciELO
Compartilhar
Jornal Português de Gastrenterologia
versão impressa ISSN 0872-8178
J Port Gastrenterol. vol.20 no.3 Lisboa maio 2013
https://doi.org/10.1016/j.jpg.2012.12.005
ARTIGO DE REVISÃO
Sépsis e disfunção múltipla de órgãos na cirrose hepática
Sepsis and multiorgan dysfunction in liver cirrhosis
Isabel Militão, Paulo Carrola∗ e José Presa
Unidade de Hepatologia, Centro Hospitalar de Trás-os-Montes e Alto Douro, EPE, Unidade de Vila Real, Vila Real, Portugal
*Autor para correspondência
RESUMO
Os doentes cirróticos têm suscetibilidade aumentada a infeções, as quais agravam o seu prognóstico, evoluindo frequentemente para quadros de sépsis e falência múltipla de órgãos.
O diagnóstico de síndrome da resposta inflamatória sistémica e sépsis encontra-se dificultado nestes doentes pelas alterações clínicas e analíticas habituais da cirrose avançada. A resposta pró-inflamatória exagerada verificada nestes doentes exacerba a disfunção sistémica e piora o prognóstico.
A abordagem terapêutica do doente cirrótico com sépsis deve incluir antibioterapia empírica precoce, monitorização clínica e hemodinâmica intensiva e suporte dos órgãos vitais em falência.
Uma avaliação cuidada do prognóstico é essencial para estabelecer a probabilidade de sobrevivência individual e gerir recursos. São usados múltiplos sistemas de prognóstico nos doentes críticos, incluindo aqueles com cirrose hepática e disfunção multiorgânica, parecendo haver maior vantagem na utilização de sistemas de prognóstico gerais neste grupo de doentes.
Palavras-Chave: Sépsis; Disfunção múltipla de órgãos; Cirrose hepática
ABSTRACT
Cirrhotic patients have an increased susceptibility to infections, which worsen their prognosis, frequently progressing to sepsis and multiorgan failure.
The diagnosis of systemic inflammatory response syndrome and sepsis is difficult in these patients because of the clinical and analytical changes typical of advanced cirrhosis. The exaggerated proinflammatory response observed in these patients exacerbates the systemic dysfunction and worsens their prognosis.
The therapeutic approach in cirrhotic patients with sepsis should include early empirical antibiotic therapy, intensive clinical and hemodynamic monitoring and support of vital organ functions.
A careful assessment of prognosis is essential in establishing the probability of individual survival and management of resources. Multiple prognosis scores are used in critically ill patients, including patients with cirrhosis and multiorgan dysfunction, and it seems that the general prognosis scores are more effective in this group of patients.
Keywords: Sepsis; Multiorgan dysfunction; Liver cirrhosis
Introdução
As infeções são complicações frequentes no doente cirrótico devido à resposta deficitária do seu sistema imunitário e ao aumento quer do crescimento bacteriano intraintestinal quer da translocação bacteriana1.
Uma vez estabelecida, a infeção agrava o prognóstico do doente cirrótico, podendo desencadear um quadro de sépsis, falência múltipla de órgãos e morte.
Os doentes cirróticos têm um maior risco relativo de morte por sépsis do que os doentes não cirróticos, sendo por isso importante o rápido reconhecimento e tratamento da infeção2,3.
Existem poucos dados publicados relativos à abordagem do doente cirrótico com sépsis, à exceção daqueles relacionados com peritonite bacteriana espontânea, para a qual estão definidas linhas orientadoras de diagnóstico, tratamento e profilaxia.
Definições
A sépsis, que consiste na resposta do hospedeiro à infeção, é um estado fisiopatológico complexo caracterizado pela libertação de múltiplas substâncias pró e anti-inflamatórias e pró e anticoagulantes em resposta aos microrganismos4.
Uma resposta clínica similar pode ocorrer na ausência de infeção e esta é designada por síndrome da resposta inflamatória sistémica (SIRS, na sigla em inglês), independentemente da causa. A SIRS é definida por 2 ou mais dos seguintes critérios: (1) temperatura corporal superior a 38 ◦C ou inferior a 36 ◦C; (2) frequência cardíaca superior a 90 batimentos/min; (3) frequência respiratória superior a 20 ciclos/min ou PaCO2 inferior a 32 mmHg; (4) contagem de leucócitos superior a 12 x 109/L ou inferior a 4 x 109/L ou presença de mais de 10% de neutrófilos imaturos. A sépsis corresponde à SIRS em resposta a uma infeção. A sépsis grave define-se por sépsis com evidência de disfunção orgânica ou hipoperfusão tecidual. Por último, o choque sético é a sépsis com hipotensão refratária à administração de fluidos intravasculares, com necessidade de utilização de fármacos vasopressores5,6.
O diagnóstico de SIRS, sépsis e sépsis grave está dificultado num doente com cirrose avançada devido ao facto de estes doentes apresentarem de base hipotensão e frequência cardíaca aumentada secundárias ao estado de circulação hiperdinâmica, redução da contagem de neutrófilos secundária ao hiperesplenismo, frequência respiratória elevada devida à encefalopatia hepática e menor capacidade de elevação da temperatura corporal7. Tais factos podem levar a uma sobrestimativa de SIRS/sépsis nesta população de indivíduos, diminuindo o seu valor no diagnóstico destas entidades.
Epidemiologia
Os doentes com cirrose têm maior suscetibilidade às infeções bacterianas e ao desenvolvimento de sépsis, falência múltipla de órgãos e morte associadas à infeção do que a população geral e essa suscetibilidade aumenta com a gravidade da doença hepática subjacente2,8,9.
Estima-se que a incidência de infeções bacterianas no doente cirrótico se situe entre os 30-50% dos doentes internados por descompensação aguda10. Verifica-se uma maior incidência de infeções nos cirróticos com hemorragia gastrointestinal9.
A mortalidade intra-hospitalar de doentes cirróticos com sépsis é muito elevada e naqueles com choque sético excede os 70%11.
Patogénese
A infeção ativa vários mecanismos que causam lesão tecidual e falência de órgãos, incluindo a produção de citocinas inflamatórias como o fator de necrose tecidual alfa (TNF-_), interleucina-1 e interleucina-6 (IL-6)7.
Certas características do doente com cirrose exacerbam a gravidade da SIRS e, consequentemente, o seu prognóstico.
Os doentes com cirrose têm níveis de endotoxinas mais elevados do que a população em geral, os quais se correlacionam diretamente com o grau de deterioração da função hepática12.
Na cirrose, a resposta pró-inflamatória na infeção é anormalmente intensa, verificando-se uma produção desregulada de citocinas inflamatórias (tempestade de citocinas) que transforma respostas habitualmente benéficas para combater as infeções em respostas inflamatórias excessivas, prejudiciais13,14. Nesse contexto, verifica-se que os indivíduos cirróticos apresentam níveis mais elevados de TNF-_ e IL-6 nas fases mais precoces de infeção do que os indivíduos não cirróticos13. A produção monocitária de TNF-_ induzido pelo lipopolissacarídeo (LPS) bacteriano é maior nos doentes com cirrose do que nos indivíduos sem cirrose15, sendo esta mais acentuada naqueles com cirrose hepática estádio C da classificação de Child-Turcotte- Pugh (CTP) do que nos doentes estádio B, sugerindo uma influência da gravidade da doença hepática na resposta imune inata excessiva16. O óxido nítrico (NO) também se apresenta aumentado na cirrose, sendo os valores mais elevados encontrados nos doentes com função hepática mais deteriorada7. A síntese de NO é induzida na sépsis e este contribui para a formação de espécies reativas de oxigénio, interferência com a agregação plaquetária e acentuação da vasodilatação17,18. A produção da interleucina-10 antiinflamatória induzida pelo LPS encontra-se diminuída nos indivíduos com cirrose19. Os fatores anti-inflamatórios proteína C ativada e lipoproteína de alta densidade (HDL, na sigla em inglês) parecem estar diminuídas na cirrose, contribuindo assim para a resposta inflamatória exagerada nestes doentes11.
A hipocolesterolémia é um fenómeno bem reconhecido nos doentes cirróticos20. Entre as alterações metabólicas induzidas pela sépsis, encontra-se a diminuição da síntese do colesterol total e lipoproteínas, principalmente de HDL e do seu componente apolipoproteína A121. Estas proteínas assumem um papel importante na regulação da inflamação induzida pelo LPS. Desta forma, o estado hipolipidémico dos doentes com cirrose predispõe estes doentes aos efeitos das endotoxinas, com maior síntese de citocinas inflamatórias e pior prognóstico22.
As alterações hemodinâmicas habituais destes doentes, exacerbadas pelos efeitos da inflamação excessiva em contexto sético conduzem os doentes cirróticos numa escalada de morte celular que culmina em falência orgânica múltipla.
Disfunção multiorgânica
A disfunção múltipla de órgãos é comum no indivíduo cirrótico com infeção.
De todos os fatores precipitantes de falência múltipla de órgãos no doente cirrótico, a infeção parece ser aquela que acarreta pior prognóstico23.
Disfunção hepática
Na sépsis, verifica-se um agravamento da função hepática dos doentes cirróticos. A deterioração aguda da função hepática num doente cirrótico previamente compensado é designada de acute-on-chronic liver failure, entidade recentemente definida24-26 e que, uma vez estabelecida, apresenta uma importante taxa de mortalidade. Esta deterioração ocorre num período de semanas após um evento precipitante, como uma infeção/sépsis ou um fármaco hepatotóxico25. A falência hepática manifesta-se pela diminuição da sua função de síntese, com consequente hipoalbuminémia e alterações da coagulação, pela diminuição da sua função de desintoxicação, manifestada por hiperbilirrubinémia e por encefalopatia, e pela interferência na regulação hemodinâmica do organismo25.
Na cirrose, além da clássica teoria da alteração da reserva hepática, existem outras alterações que justificam a disfunção hepática em contexto de sépsis, nomeadamente o aumento da produção de TNF-_, que codifica um sinal próapoptótico para a célula hepática não antagonizado pelas vias antiapoptóticas habituais nas células do fígado não cirrótico27, necrose hepatocitária induzida pela endotelina- 128 e diminuição da síntese proteica hepática29. A disfunção microcirculatória que se estabelece resulta num aumento da pressão portal e diminuição do fluxo sanguíneo hepático que aumenta ainda mais a disfunção dos hepatócitos23. Os achados de Cazzaniga e da sua equipa também associam a SIRS ao desenvolvimento de complicações relacionadas com a hipertensão portal30.
Alterações circulatórias
Mesmo na ausência de infeção, os doentes cirróticos apresentam uma circulação hiperdinâmica, caracterizada por um elevado débito cardíaco, pressão arterial relativamente baixa e resistência vascular sistémica reduzida31.
Quando se desenvolve sépsis nestes doentes, o sistema circulatório torna-se ainda mais hiperdinâmico e hiporreativo às doses farmacológicas dos agonistas dos recetores _---adrenérgicos32. A incapacidade de obter pressões de perfusão adequadas resulta em acidose láctica e contribui para a falência multiorgânica. A disfunção cardíaca e a insuficiência da suprarrenal associadas à própria sépsis também estão relacionadas com a instabilidade hemodinâmica nestes doentes25.
Disfunção renal
A insuficiência renal é das disfunções de órgão mais comuns no doente cirrótico. A infeção parece ser o fator mais comum de desenvolvimento de insuficiência renal nestes doentes, não necessariamente relacionado com a presença de choque sético33-37.
As alterações na microcirculação presentes na SIRS/sépsis parecem ser as responsáveis pelo desenvolvimento de síndrome hepatorrenal (SHR) neste contexto. A vasodilatação esplâncnica e sistémica que se verifica conduz a uma redução do volume de sangue arterial efetivo, com a consequente ativação do sistema neuro-humoral (sistema renina-angiotensina-aldosterona e sistema simpático) que desencadeia vasoconstrição das artérias renais, o que precipita disfunção renal1,37,38.
Os doentes com peritonite bacteriana espontânea (PBE) que desenvolvem disfunção renal associada a uma ativação importante do sistema renina-angiotensina apresentam níveis mais elevados de TNF-_, IL-6 e NO, sugerindo um papel ativo da inflamação no desencadeamento da disfunção renal10,39. Também as infeções não-PBE se associam a compromisso do volume sanguíneo circulante efetivo e disfunção renal em cerca de um terço dos casos36.
Disfunção pulmonar
As complicações pulmonares são frequentes nos doentes com cirrose descompensada. A presença de uma resposta inflamatória exagerada associada a um estado de compromisso imune relativo predispõe ao desenvolvimento de lesão pulmonar aguda23.
A diminuição da complacência torácica resultante da presença de ascite, edema da parede torácica e derrame pleural, comuns entre os indivíduos com cirrose descompensada, contribui para a alteração da dinâmica ventilatória. O risco de pneumonite de aspiração está aumentado devido à encefalopatia e ao aumento da pressão intra-abdominal4,23. A incidência da síndrome de dificuldade respiratória do adulto (ARDS, na sigla em inglês) é também elevada neste grupo de doentes, para a qual parecem contribuir a elevada quantidade de citocinas pró-inflamatórias e NO, bem como o edema pulmonar induzido pelo LPS bacteriano40.
Encefalopatia hepática
A infeção é um precipitante bem reconhecido de encefalopatia hepática. A presença de sintomas neurológicos ocorre em 21-33% dos cirróticos com sépsis e em 60-68% daqueles com choque séptico35.
Os mediadores da SIRS, como o NO e as citocinas pró-inflamatórias, são importantes moduladores do efeito cerebral da amónia nos doentes com cirrose, promovendo um efeito sinérgico entre a inflamação sistémica e os mecanismos que induzem encefalopatia hepática41.
Vários estudos relacionam a encefalopatia associada a infeção nos doentes cirróticos com a produção de espécies reativas de oxigénio, aumento da inflamação a nível cerebral e diminuição da perfusão cerebral41-45.
Alteração da coagulação
As anomalias da coagulação na cirrose são devidas à redução da síntese hepática dos fatores pró-coagulantes (v, vii, x e protrombina) e anticoagulantes (proteína C, proteína S e antitrombina), deficiência de vitamina K e defeitos qualitativos e quantitativos das plaquetas1,4.
Nos doentes cirróticos com sépsis, a disfunção hepática é mais acentuada e, por isso, as alterações da coagulação são maiores. As citocinas inflamatórias libertadas em contexto infeccioso alteram a função plaquetária, aumentam a fibrinólise, aumentam o consumo de fatores de coagulação e levam à produção de substâncias endógenas heparinoides11. O aumento da pressão portal verificado durante a infeção também contribui para o risco de hemorragia por varizes esofágicas nestes doentes, o que realça a influência do tratamento antibiótico na prevenção de hemorragia digestiva nestes doentes46. Um estudo verificou uma maior incidência de hemorragia relacionada com a hipertensão portal nos doentes cirróticos com SIRS do que nos cirróticos sem SIRS30.
Insuficiência da suprarrenal
Mais de 50% dos indivíduos com cirrose hepática desenvolvem insuficiência da suprarrenal em contexto de sépsis, principalmente aqueles com doença hepática mais avançada. A insuficiência da suprarrenal tem elevada importância neste contexto, uma vez que contribui para a instabilidade hemodinâmica do doente, para a disfunção múltipla de órgãos e para o aumento da mortalidade47-49. Este fenómeno tem elevada relevância clínica, uma vez que, sendo prontamente identificado e corrigido, pode melhorar o prognóstico do doente. Num estudo com doentes cirróticos com sépsis, a pressão arterial média, a bilirrubina sérica, a dependência de vasopressores e a bacteriémia foram fatores independentes preditores de insuficiência da suprarrenal nestes doentes48.
Vários mecanismos são apontados como responsáveis pela insuficiência da suprarrenal: o nível elevado de citocinas inflamatórias parece influenciar a produção de cortisol em resposta à corticotropina e a própria produção desta última, a coagulopatia destes doentes pode levar a hemorragia das glândulas suprarrenais, com consequente insuficiência das mesmas, e a deficiente síntese de colesterol no fígado cirrótico diminui a produção de cortisol, na medida em que este é um precursor das hormonas esteroides48,50.
Tratamento
Os doentes com sépsis grave e choque sético necessitam de cuidados emergentes durante o estádio precoce da sépsis (primeiras 6 h), seguidos de cuidados intensivos nos estádios seguintes. Estes doentes beneficiam de uma abordagem conjunta de médicos hepatologistas e intensivistas. Os objetivos do tratamento são a prevenção da deterioração da função hepática, o suporte dos órgãos em falência e a resolução da infeção23. Na figura 1 apresenta-se um algoritmo de abordagem do doente cirrótico com sépsis.
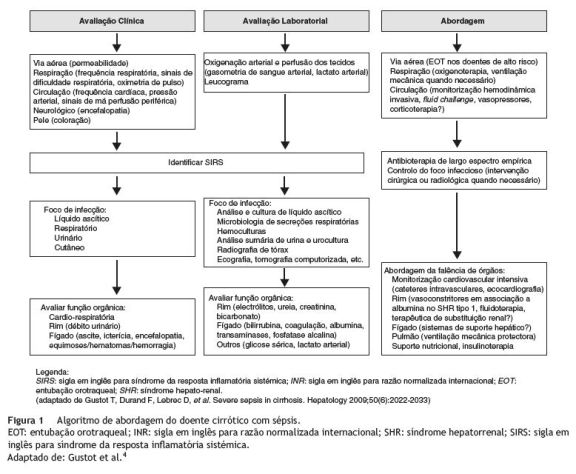
Antibióticos
Os antibióticos são o tratamento basilar da sépsis. A terapêutica deve ser orientada para o local presumível da infeção e deve ser instituída por via endovenosa o mais precocemente possível (idealmente, na primeira hora) de modo a melhorar a sobrevivência, tal como acontece na população geral.
O diagnóstico precoce do local de infeção é crítico e deve ser realizado em simultâneo com o processo de ressuscitação4 (fig. 1). A terapêutica antibiótica deve ser instituída de acordo com o local suspeito de infeção e com os microrganismos mais frequentemente envolvidos. Assim que houver identificação do agente responsável pela infeção, o espectro antibiótico deve ser diminuído (descalação antibiótica) de forma a evitar o desenvolvimento de estirpes resistentes.
Fluidoterapia, albumina e função renal
Devido às especificidades hemodinâmicas dos indivíduos com cirrose, os objetivos específicos para a terapêutica hemodinâmica precoce nos casos de sépsis grave e choque sético ainda não estão estabelecidos.
A ressuscitação inicial da população geral com sépsis deve ser feita com cristaloides ou coloides6. Também nos doentes cirróticos a utilização de fluidos neste contexto é de extrema importância. A reposição da volémia nestes doentes deve ser balanceada de forma a evitar um aumento exagerado da pressão portal e as complicações que daí advêm51. Um estudo mostrou que uma solução de albumina humana a 20% melhora de forma mais significativa os parâmetros hemodinâmicos nos doentes cirróticos com PBE do que um expansor de volume derivado do amido52. A evidência existente recomenda a utilização da albumina humana endovenosa nos doentes cirróticos com SIRS/sépsis, particularmente naqueles com disfunção renal e icterícia, ou seja, naqueles com acute-on-chronic liver failure1. No entanto, ainda não existem dados da utilização de albumina humana em doente com cirrose e sépsis com ponto de partida diferente da PBE, sendo por isso necessários mais estudos1,36.
Devem ser evitadas a utilização de fármacos nefrotóxicos, a depleção do volume intravascular e a realização de paracenteses de grande volume sem reposição de albumina, as quais podem agravar a função renal destes doentes. Estes doentes devem ser monitorizados de forma intensiva.
A recomendação atual para o tratamento do SHR consiste na expansão plasmática com albumina na dose de 1 g/kg no primeiro dia até um máximo de 100 g/d, seguida de 40 g/d, associada a terlipressina na dose de 1-2 mg a cada 4-6 h38. Vasoconstritores alternativos incluem a noradrenalina em perfusão a 0,5-3 mg/h ou midodrina na dose de 2,5-12,5 mg por via oral associada a octreótido 100-200_g por via subcutânea, 3 vezes por dia38,53. A maioria dos estudos clínicos acerca do uso da terlipressina exclui os doentes com sépsis, pelo que o efeito deste fármaco no tratamento do SHR destes doentes é desconhecido38.
Apesar da instituição destas medidas terapêuticas, a função renal piora em cerca de metade dos doentes. Terapêuticas de substituição renal estão indicadas para tratamento de alterações hidroeletrolíticas e do equilíbrio ácido base refratárias, não estando associadas a melhoria do prognóstico no SHR23.
Vasopressores
Os doentes cirróticos têm uma resposta diminuída aos fármacos vasopressores32,54.
Existem poucos dados relativos à utilização de fármacos vasopressores nesta população de doentes.
A noradrenalina e a dopamina são fármacos de primeira linha para o tratamento do choque sético na população geral6. Para o tratamento do choque nos doentes cirróticos, a noradrenalina é titulada para pressões arteriais médias de 65-70 mmHg. A vasopressina ou a terlipressina são fármacos de segunda linha em contexto de sépsis e no doente cirrótico são utilizados com os mesmos objetivos23.
Corticosteroides
O uso de corticosteroides no choque sético é uma matéria sensível na medida em que a recomendação do seu uso não é consensual.
Num pequeno estudo49, a administração de hidrocortisona por via endovenosa (50 mg a cada 6 h) a doentes com insuficiência relativa da suprarrenal resultou em melhoria hemodinâmica (96 versus 58%, p = 0,001) e em melhoria da sobrevivência em Unidade de Cuidados Intensivos (UCI) (68 versus 38%, p = 0,03) e intra-hospitalar (64 versus 32%, p = 0,003).
Um estudo recente55 verificou uma melhoria hemodinâmica (RR 1,5, p = 0,05) com a instituição de corticoides; no entanto, não houve diminuição da taxa de mortalidade aos 28 d. No mesmo estudo, verificou-se um aumento da recidiva do choque após desmame da corticoterapia (RR 2,58, p = 0,03). Este facto levanta a questão de a insuficiência da suprarrenal ser um fenómeno associado à própria cirrose e não apenas ao quadro sético, o que justificaria um aumento do tempo de tratamento com corticoides. Alternativamente, a administração de corticoides pode suprimir o eixo hipotálamo-hipófise-suprarrenal e o desmame da corticoterapia precipitar assim choque adrenérgico. O mesmo grupo de estudo verificou um aumento na ocorrência de hemorragia gastrointestinal nestes doentes (RR 3, p = 0,02), com mortalidade associada muito elevada. O uso de corticosteroides levanta também questões como o desenvolvimento de infeções secundárias, pelo seu papel imunomodulador.
Neste sentido, são necessários mais estudos que permitam concluir se a terapêutica com corticoides (e em que dose e duração) deve ser recomendada.
Controlo da glicemia
A hiperglicemia e a resistência à insulina são comuns na sépsis. Foi demonstrado que o controlo intensivo da glicemia está associado a um aumento da mortalidade nos doentes críticos não cirróticos56. Olson JC e o seu grupo de trabalho recomendam que os valores de glicemia dos doentes cirróticos críticos se situem no intervalo de 140-180 mg/dL23.
Suporte ventilatório
A entubação endotraqueal (EET) é essencial para atingir a proteção da via aérea nos doentes com pontuação baixa na Escala de Coma de Glasgow ou naqueles com hemorragia digestiva alta. A utilização rotineira de sedativos para minimizar o desconforto causado pela EET é raramente necessária nos doentes com encefalopatia grave, podendo mesmo atrasar a extubação e prolongar a alteração do estado de consciência23. O aumento da semivida dos fármacos nestes doentes e a hipersensibilidade cerebral às benzodiazepinas contribuem para a encefalopatia hepática e prolongam o tempo de ventilação mecânica57. Na maioria destes doentes, é possível gerir a EET com recurso à administração intermitente de narcóticos, procedendo-se à extubação assim que o doente for capaz de proteger autonomamente a via aérea23.
Estratégias de proteção pulmonar como volumes correntes à volta dos 6 mL/kg de peso, utilização de PEEP (sigla inglesa para positive end-expiratory pressure) e pressão de planalto inferiores a 30 ccH2O, devem ser utilizadas58.
Sistemas de suporte hepático
A base racional para o desenvolvimento de técnicas extracorpóreas de suporte hepático é a da remoção das substâncias vasoativas, neuro e hepatotóxicas que se encontram acumuladas em circulação ao mesmo tempo que permite a recuperação da função hepática ou a ponte para a transplantação hepática23,25. Os sistemas atualmente em uso humano são o Molecular Adsorbents Recirculating System (MARS®) e o Prometheus®, estando outros sistemas em investigação.
O MARS® consiste num sistema de diálise associada a uma membrana impregnada por albumina, que permite a filtração de substâncias ligadas à albumina. O MARS® mostrou uma melhoria significativa da sobrevivência dos doentes com cirrose hepática descompensada com SHR, relativamente à hemofiltração convencional59.
O Prometheus® combina a separação e absorção do plasma com hemodiálise, para a remoção de toxinas ligadas à albumina e toxinas hidrossolúveis25.
Os dados da utilização de ambos os sistemas sugerem melhoria bioquímica e neurológica, com um efeito hemodinâmico benéfico no caso do MARS®. O benefício na sobrevida é, no entanto, menos óbvio25,60-63.
Os sistemas de suporte hepático no âmbito dos doentes cirróticos com sépsis necessitam de uma melhor avaliação, já que os dados existentes são limitados1.
Prognóstico
Dos eventos precipitantes de falência multiorgânica do doente com cirrose, a infeção é aquele com pior prognóstico23. Um estudo de doentes cirróticos64 revelou que o desenvolvimento de infeção agrava consideravelmente o prognóstico destes doentes, mesmo quando a infeção é resolvida. Este estudo verificou que a mortalidade dos doentes cirróticos com infeção não se modificou muito nas últimas décadas, particularmente, a mortalidade um ano após a infeção, situando-se nos 63%. Arvaniti verificou que a sépsis é responsável por 33,4% dos óbitos nos doentes cirróticos, sendo a segunda causa mais frequente, a seguir à insuficiência hepática64.
Uma avaliação precisa do prognóstico é essencial para determinar os outcomes individuais, para tomar decisões terapêuticas e, no caso de doentes críticos, para determinar quando o suporte de cuidados intensivos é fútil. Vários sistemas de prognóstico têm sido propostos, mas poucos foram validados em doentes cirróticos com sépsis1.
Um estudo recente65 avaliou o valor prognóstico dos sistemas gerais [Sequential Organ Failure Assessment (SOFA), Acute Physiology And Chronic Health Evaluation (APACHE), Simplified Acute Physiology Score (SAPS)] e dos scores específicos de cirrose hepática [CTP e Model for End Stage Liver Disease (MELD)] em doentes cirróticos admitidos em UCI. Ambos os grupos de sistemas têm valor prognóstico na avaliação do risco destes doentes, sendo que os sistemas gerais, particularmente o SOFA, revelaram ter maior valor preditivo de mortalidade65-68. A evidência sugere que, assim que se desenvolve falência orgânica extra-hepática, a mortalidade é determinada pela disfunção multiorgânica e não pela gravidade da doença hepática subjacente25. Num estudo de Levesque68, os doentes cirróticos admitidos em UCI com falência de mais de 3 órgãos ou necessitando de suporte de mais de 2 funções vitais apresentavam uma taxa de mortalidade próxima de 90%. Neste estudo, a necessidade de suporte de funções vitais e a presença de infeção eram preditores independentes de mortalidade nesta população.
Na análise multivariada, a ventilação mecânica, terapêutica vasopressora, níveis de bilirrubina à admissão e presença de infeção estavam relacionados de forma independente com a mortalidade. No mesmo sentido, outro estudo30 demonstrou uma correlação entre a SIRS e a mortalidade intra-hospitalar dos doentes cirróticos, a qual se mostrou independente da gravidade da doença hepática subjacente, estimada pelo MELD, ou da idade do doente, o que sugere um papel ativo da SIRS na mortalidade do doente cirrótico. Também Vincent Das69 concluiu que a gravidade da doença hepática não tem influência no prognóstico dos doentes cirróticos críticos admitidos na UCI, sendo a falência de órgãos não hematológicos o principal fator de risco para mortalidade. Os doentes com 3 órgãos não hematológicos em falência no terceiro dia na UCI apresentam, neste estudo, uma mortalidade de 89%. Num estudo retrospetivo70 de doentes cirróticos críticos, o SOFA e o MELD foram os melhores preditores de mortalidade aos 30 d.
Neste contexto, a função hepática não parece ser o principal fator determinante do prognóstico dos cirróticos com disfunção múltipla de órgãos e, como tal, as escalas de prognóstico gerais parecem ser mais úteis do que o CTP ou o MELD30,66,68-71.
No estudo de Juneja70; a taxa de mortalidade nas primeiras 48 h de ventilação mecânica foi de cerca de 80%, refletindo o mau prognóstico destes doentes.
Um estudo com doentes cirróticos com sépsis72 concluiu que a mortalidade destes doentes era mais elevada nos casos de pneumonia do que na sépsis com outros pontos de partida. Também os doentes com mais do que um local de infeção, com CTP estádio C ou MELD elevado apresentaram maior taxa de mortalidade.
O impacto negativo que a falência renal tem no prognóstico destes doentes foi já demonstrado em diversos estudos33,36,73,74. A importância deste fator está refletida na sua inclusão em alguns sistemas de prognóstico, tais como o MELD e o Royal Free Hospital Score67. Um estudo prospetivo mostrou que a causa da insuficiência renal na cirrose tem valor prognóstico, sendo que a insuficiência renal de causa hemodinâmica, como a que se verifica na SIRS/sépsis, tem maior risco de mortalidade do que a de causa renal intrínseca33.
Conclusão
A sépsis e a disfunção múltipla de órgãos nos doentes cirróticos são entidades que agravam o prognóstico destes doentes, apresentando taxas de mortalidade elevadas.
Apesar da especificidade dos doentes com cirrose, existem poucos estudos publicados relativos à abordagem diagnóstica e terapêutica da sépsis nestes doentes, sendo recomendadas na maioria dos casos as mesmas medidas que para a população em geral, passando por ressuscitação com fluidos, antibioterapia e controlo do foco infeccioso e suporte dos órgãos em falência.
Em termos de monitorização e abordagem em cuidados intensivos, as recomendações não são uniformes, uma vez que a maioria dos estudos exclui os doentes com disfunções mais severas, não sendo possível avaliar por isso o real prognóstico e impacto destas medidas.
Bibliografia
1. Tandon P, Garcia-Tsao G. Bacterial infections, sepsis, and multiorgan failure in cirrhosis. Semin Liver Dis. 2008;28:26-42. [ Links ]
2. Foreman MG, Mannino DM, Moss M. Cirrhosis as a risk factor for sepsis and death: analysis of the National Hospital Discharge Survey. Chest. 2003;124:1016-20. [ Links ]
3. Kang CI, Song JH, Chung DR, Peck KR, Yeom JS, Ki HK, et al. Liver cirrhosis as a risk factor for mortality in a national cohort of patients with bacteremia. J Infect. 2011;63:336-43. [ Links ]
4. Gustot T, Durand F, Lebrec D, Vincent JL, Moreau R. Severe sepsis in cirrhosis. Hepatology. 2009;50:2022-33. [ Links ]
5. Bone RC, Balk RA, Cerra FB, Dellinger RP, Fein AM, Knaus WA, et al. Definitions for sepsis and organ failure and Guidelines for the use of innovative therapies in sepsis. The ACCP/SCCM Concensus Conference Committee. American College of Chest Physicians/Society of Critical Care Medicine. Chest. 1992;101:1644-55. [ Links ]
6. Dellinger RP, Levy MM, Carlet JM, Bion J, Parker MM, Jaeschke R, et al. Surviving Sepsis Campaign: international guidelines for management of severe sepsis and septic shock: 2008. Crit Care Med. 2008;36:296-327. [ Links ]
7. Wong F, Bernardi M, Balk R, Christman B, Moreau R, Garcia-Tsao G, et al. Sepsis in cirrhosis: report on the 7th meeting of the International Ascites Club. Gut. 2005;54:718-25. [ Links ]
8. Fernández J, Navasa M, Gómez J, Colmenero J, Vila J, Arroyo V, et al. Bacterial infections in cirrhosis: epidemiological changes with invasive procedures and norfloxacin prophylaxis. Hepatology. 2002;35:140-8. [ Links ]
9. Borzio M, Salerno F, Piantoni L, Cazzaniga M, Angeli P, Bissoli F, et al. Bacterial infection in patients with advanced cirrhosis: a multicenter prospective study. Dig Liver Dis. 2001;33:41-8. [ Links ]
10. Navasa M, Fernández J, Rodés J. Bacterial infections in liver cirrhosis. Ital J Gastroenterol Hepatol. 1999;31:616-25. [ Links ]
11. Plessier A, Denninger MH, Consigny Y, Pessione F, Francoz C, Durand F, et al. Coagulation disorders in patients with cirrhosis and severe sepsis. Liver Int. 2003;23:440-8. [ Links ]
12. Chan CC, Hwang SJ, Lee FY, Wang SS, Chang FY, Li CP, et al. Prognostic value of plasma endotoxin levels in patients with cirrhosis. Scand J Gastroenterol. 1997;32:942-6. [ Links ]
13. Byl B, Roucloux I, Crusiaux A, Dupont E, Devière J. Tumor necrosis factor alpha and interleukin 6 plasma levels in infected cirrhotic patients. Gastroenterology. 1993;104:1492-7. [ Links ]
14. Wang SS, Lee FY, Chan CC, Lu RH, Chao Y, Lin HC, et al. Sequential changes in plasma cytokine and endotoxin levels in cirrhotic patients with bacterial infection. Clin Sci (Lond). 2000;98:419-25. [ Links ]
15. Devière J, Content J, Denys C, Vandenbussche P, Schandene L, Wybrand J, et al. Excessive in vitro bacterial lipopolysaccharide-induced production of monokines in cirrhosis. Hepatology. 1990;11:628-34. [ Links ]
16. Galbois A, Thabut D, Tazi KA, Rudler M, Mohammadi MS, Bonnefont-Rousselot D, et al. Ex vivo effects of high-density lipoprotein exposure on the lipopolysaccharide-induced inflammatory response in patients with severe cirrhosis. Hepatology. 2009;49:175-84. [ Links ]
17. Lee KC, Yang YY, Wang YW, Lee FY, Loong CC, Hou MC, et al. Increased plasma malondialdehyde in patients with viral cirrhosis and its relationships to plasma nitric oxide, endotoxin, and portal pressure. Dig Dis Sci. 2010;55:2077-85. [ Links ]
18. Guarner C, Soriano G, Tomas A, Bulbena O, Novella MT, Balanzo J, et al. Increased serum nitrite and nitrate levels in patients with cirrhosis: relationship to endotoxemia. Hepatology. 1993;18:1139-43. [ Links ]
19. Le Moine O, Marchant A, de Groote D, Azzar C, Goldman M, Devière J. Role of defective monocyte interleukin-10 release in tumor necrosis factor-alpha overproduction in alcoholics cirrhosis. Hepatology. 1995;22:1436-9. [ Links ]
20. Habib A, Mihas AA, Abou-Assi SG, Williams LM, Gavis E, Pandak WM, et al. High-density lipoprotein cholesterol as na indicator of liver function and prognosis in noncholestatic cirrhotics. Clin Gastroenterol Hepatol. 2005;3:286-91. [ Links ]
21. Van Leeuwen HJ, Heezius EC, Dallinga GM, van Strijp JA, Verhoef J, van Kessel KP. Lipoprotein metabolism in patients with severe sepsis. Crit Care Med. 2003;31:1359-66. [ Links ]
22. Tsai MH, Peng YS, Chen YC, Lien JM, Tian YC, Fang JT, et al. Low serum concentration of apolipoprotein A-I is an indicator of poor prognosis in cirrhotic patients with severe sepsis. J Hepatol. 2009;50:906-15. [ Links ]
23. Olson JC, Wendon JA, Kramer DJ, Arroyo V, Jalan R, Garcia-Tsao G, et al. Intensive care of the patient with cirrhosis. Hepatology. 2011;54:1864-72. [ Links ]
24. Jalan R, Williams R. Acute-on-chronic liver failure: pathophysiological basis of therapeutic options. Blood Purif. 2002;20:252-61. [ Links ]
25. Laleman W, Verbeke L, Meersseman P, Wauters J, van Pelt J, Cassiman D, et al. Acute-on-chronic liver failure: current concepts on definition, pathogenesis, clinical manifestations and potential therapeutic interventions. Expert Rev Gastroenterol Hepatol. 2011;5:523-37. [ Links ]
26. Sarin SK, Kumar A, Almeida JA, Chawla YK, Fan ST, Garg H, et al. Acute-on-chronic liver failure: consensus recommendations of the Asian Pacific Association for the study of the liver (APASL). Hepatol Int. 2009;3:269-82. [ Links ]
27. Liu ZG, Hsu H, Goeddel DV, Karin M. Dissection of TNF receptor 1 effector functions: JNK activation is not linked to apoptosis while NF-kappaB activation prevents cell death. Cell. 1996;87:565-76. [ Links ]
28. Urbanowicz W, Sogni P, Moreau R, Tazi KA, Barriere E, Poirel O, et al. Tezosentan, an endothelin receptor antagonist, limits liver injury in endotoxin challenged cirrhotic rats. Gut. 2004;53:1844-9. [ Links ]
29. Ron D, Walter P. Signal integration in the endoplasmic reticulum unfolded protein response. Nat Rev Mol Cell Biol. 2007;8:519-29. [ Links ]
30. Cazzaniga M, Dionigi E, Gobbo G, Fioretti A, Monti V, Salerno F. The systemic inflammatory response syndrome in cirrhotic patients: relationship with their in-hospital outcome. J Hepatol. 2009;51:475---82. [ Links ]
31. Moreau R, Lee SS, Soupison T, Roche-Sicot J, Sicot C. Abnormal tissue oxygenation in patients with cirrhosis and liver failure. J Hepatol. 1988;7:98-105. [ Links ]
32. Ruiz-del-Arbol L, Urman J, Fernández J, González M, Navasa M, Monescillo A, et al. Systemic, renal, and hepatic hemodynamic derangement in cirrhotic patients with spontaneous bacterial peritonitis. Hepatology. 2003;38:1210-8. [ Links ]
33. Martín-Llahí M, Guevara M, Torre A, Fagundes C, Restuccia T, Gilabert R, et al. Prognostic importance of the cause of renal failure in patients with cirrhosis. Gastroenterology. 2011;140:488-96. [ Links ]
34. Salerno F, Gerbes A, Ginès P, Wong F, Arroyo V. Diagnosis, prevention and treatment of hepatorenal syndrome in cirrhosis. Gut. 2007;56:1310-8. [ Links ]
35. Sort P, Navasa M, Arroyo V, Aldeguer X, Planas R, Ruiz-del-Arbol L, et al. Effect of intravenous albumin on renal impairment and mortality in patients with cirrhosis and spontaneous bacterial peritonitis. N Engl J Med. 1999;341:403-9. [ Links ]
36. Terra C, Guevara M, Torre A, Gilabert R, Fernández J, Martín- Llahí M, et al. Renal failure in patients with cirrhosis and sepsis unrelated to spontaneous bacterial peritonitis: value of MELD score. Gastroenterology. 2005;129:1944-53. [ Links ]
37. Thabut D, Massard J, Gangloff A, Carbonell N, Francoz C, Nguyen-Khac E, et al. Model for end-stage liver disease score and systemic inflammatory response are major prognostic factos in patients with cirrhosis and acute functional renal failure. Hepatology. 2007;46:1872-82. [ Links ]
38. European Association for the Study of the Liver. EASL clinical practice guidelines on the management of ascites, spontaneous bacterial peritonitis, and hepatorenal syndrome in cirrhosis. J Hepatol. 2010;53:397-417. [ Links ]
39. Such J, Hillebrand DJ, Guarner C, Berk L, Zapater P, Westengard J, et al. Nitric oxide in ascitic fluid is an independente predictor of the development of renal impairment in patients with cirrhosis and spontaneous bacterial peritonitis. Eur J Gastroenterol Hepatol. 2004;16:571-7. [ Links ]
40. Doyle RL, Szaflarski N, Modin GW, Wiener-Kronish JP, Matthay MA. Identification of patients with acute lung injury. Predictors of mortality. Am J Respir Crit Care Med. 1995;152:1818-24. [ Links ]
41. Shawcross DL, Davies NA, Williams R, Jalan R. Systemic inflammatory response exacerbates the neuropsychological effects of induced hyperammonemia in cirrhosis. J Hepatol. 2004;40:247-54. [ Links ]
42. Blei AT. Infection, inflammation and hepatic encephalopathy, synergism redefined. J Hepatol. 2004;40:327-30. [ Links ]
43. Pedersen HR, Ring-Larsen H, Olsen NV, Larsen FS. Hyperammonemia acts synergistically with lipopolysaccharide in inducing changes in cerebral hemodynamics in rats anaesthetised with pentobarbital. J Hepatol. 2007;47:245-52. [ Links ]
44. Jiang W, Desjardins P, Butterworth RF. Direct evidence for central proinflammatory mechanisms in rats with experimental acute liver failure: protective effect of hypothermia. J Cereb Blood Flow Metab. 2009;29:944-52. [ Links ]
45. Wright G, Davies NA, Shawcross DL, Hodges SJ, Zwingmann C, Brooks HF, et al. Endotoxaemia produces coma and brain swelling in bile duct ligated rats. Hepatology. 2007;45: 1517-26. [ Links ]
46. Bernard B, Grangé JD, Khac EN, Amiot X, Opolon P, Poynard T. Antibiotic prophylaxis for the prevention of bacterial infections in cirrhotic patients with gastrointestinal bleeding: a metaanalysis. Hepatology. 1999;29:1655-61. [ Links ]
47. Marik PE, Gayowski T, Starzl TE, Hepatic Cortisol Research and Adrenal Pathophysiology Study Group. The hepatoadrenal syndrome: a common yet unrecognized clinical condition. Crit Care Med. 2005;33:1254-9. [ Links ]
48. Tsai MH, Peng YS, Chen YC, Liu NJ, Ho YP, Fang JT, et al. Adrenal insufficiency in patients with cirrhosis, severe sepsis and septic shock. Hepatology. 2006;43:673-81. [ Links ]
49. Fernández J, Escorsell A, Zabalza M, Felipe V, Navasa M, Mas A, et al. Adrenal insufficiency in patients with cirrhosis and septic shock: effect of treatment with hydrocortisone on survival. Hepatology. 2006;44:1288-95. [ Links ]
50. Fede G, Spadaro L, Tomaselli T, Privitera G, Germani G, Tsochatzis E, et al. Adrenocortical dysfunction in liver disease: a systematic review. Hepatology. 2012;55:1282-91. [ Links ]
51. Ginès P, Fernández J, Durand F, Saliba F. Management of critically-ill cirrhotic patients. J Hepatol. 2012;56:S13-24. [ Links ]
52. Fernández J, Monteagudo J, Bargallo X, Jiménez W, Bosch J, Arroyo V, et al. A randomized unblinded pilot study comparing albumin versus hydroxyethyl starch in spontaneous bacterial peritonitis. Hepatology. 2005;42:627-34. [ Links ]
53. Ginès P, Schrier RW. Renal failure in cirrhosis. N Engl J Med. 2009;361:1279-90. [ Links ]
54. Albillos A, Rossi I, Cacho G, Martínez MV, Millán I, Abreu L, et al. Enhanced endothelium-dependent vasodilation in patients with cirrhosis. Am J Physiol. 1995;268:G459-64. [ Links ]
55. Arabi YM, Aljumah A, Dabbagh O, Tamim HM, Rishu AH, Al- Abdulkareem A, et al. Low-dose hydrocortisone in patients with cirrhosis and septic shock: a randomised controlled trial. CMAJ. 2010;182:1971-7. [ Links ]
56. Finfer S, Chittock DR, Su SY, Blair D, Foster D, Dhingra V, et al. Intensive versus conventional glucose control in critically ill patients. N Engl J Med. 2009;360:1283-97. [ Links ]
57. Khamaysi I, William N, Olga A, Alex I, Vladimir M, Kamal D, et al. Sub-clinical hepatic encephalopathy in cirrhotic patients is not aggravated by sedation with propofol compared to midazolam: a randomized controlled study. J Hepatol. 2011;54:72-7. [ Links ]
58. The Acute Respiratory Distress Syndrome Network. Ventilation with lower tidal volumes as compared with traditional tidal volumes for acute lung injury and the acute respiratory distress syndrome. N Engl J Med. 2000;342:1301-8. [ Links ]
59. Mitzner SR, Stange J, Klammt S, Risler T, Erley CM, Bader BD, et al. Improvement of hepatorenal syndrome with extracorporeal albumin dialysis MARS: results of a prospective, randomized, controlled clinical trial. Liver Transpl. 2000;6:277-86. [ Links ]
60. Heemann U, Treichel U, Loock J, Philipp T, Gerken G, Malago M, et al. Albumin dialysis in cirrhosis with superimposed acute liver injury: a prospective, controlled study. Hepatology. 2002;36:949-58. [ Links ]
61. Khuroo MS, Khuroo MS, Farahat KL. Molecular adsorbent recirculating system for acute and acute-on-chronic liver failure: a meta-analysis. Liver Transpl. 2004;10:1099-106. [ Links ]
62. Liu JP, Gluud LL, Als-Nielsen B, Gluud C. Artificial and bioartificial support systems for liver failure. Cochrane Database Syst Rev. 2004;1. CD003628. http://dx.doi.org/10.1002/14651858.CD003628.pub2 [ Links ]
63. Hassanein TI, Tofteng F, Brown Jr RS, McGuire B, Lynch P, Mehta R, et al. Randomized controlled study of extracorporeal albumin dialysis for hepatic encephalopathy in advanced cirrhosis. Hepatology. 2007;46:1853-62. [ Links ]
64. Arvaniti V, DAmico G, Fede G, Manousou P, Tsochatzis E, Pleguezuelo M, et al. Infections in patients with cirrhosis increase mortality four-fold and should be used in determining prognosis. Gastroenterology. 2010;139:1246-56. [ Links ]
65. Freire P, Romãozinho JM, Ferreira M, Amaro P, Leitão MC. O doente cirrótico na Unidade de Cuidados Intensivos: avaliação do prognóstico. J Port Gastrenterol. 2011;18:73-80. [ Links ]
66. Cholongitas E, Senzolo M, Patch D, Shaw S, Hui C, Burroughs AK. Review article: scoring systems for assessing prognosis in critically ill adult cirrhotics. Aliment Pharmacol Ther. 2006;24:453-64. [ Links ]
67. Cholongitas E, Senzolo M, Patch D, Kwong K, Nikolopoulou V, Leandro G, et al. Risk factors, sequential organ failure assessment and model for end-stage liver disease scores for predicting short term mortality in cirrhotic patients admitted to intensive care unit. Aliment Pharmacol Ther. 2006;23:883-93. [ Links ]
68. Levesque E, Hoti E, Azoulay D, Ichai P, Habouchi H, Castaing D, et al. Prospective evaluation of the prognostic scores for cirrhotic patients admitted to an intensive care unit. J Hepatol. 2012;56:95-102. [ Links ]
69. Das V, Boelle PY, Galbois A, Guidet B, Maury E, Carbonell N, et al. Cirrhotic patients in the medical intensive care unit: early prognosis and long-term survival. Crit Care Med. 2010;38:2108-16. [ Links ]
70. Juneja D, Gopal PB, Kapoor D, Raya R, Sathyanarayanan M. Profiles and outcome of patients with liver cirrhosis requiring mechanical ventilation. J Intensive Care Med. 2012;27:373-8. [ Links ]
71. Aggarwal A, Ong JP, Younossi ZM, Nelson DR, Hoffman-Hogg L, Arroliga AC. Predictors of mortality and resource utilization in cirrhotic patients admitted to the medical ICU. Chest. 2001;119:1489-97. [ Links ]
72. Lim LG, Tam XX, Woo SJ, Dan YY, Lee YM, Lai V, et al. Risk factors for mortality in cirrhotic patients with sepsis. Hepatol Int. 2011;5:800-7. [ Links ]
73. Thomson SJ, Moran C, Cowan ML, Musa S, Beale R, Treacher D, et al. Outcomes of critically ill patients with cirrhosis admitted to intensive care: an important perspective from the non-transplant setting. Aliment Pharmacol Ther. 2010;32: 233-43. [ Links ]
74. Fede G, DAmico G, Arvaniti V, Tsochatzis E, Germani G, Georgiadis D, et al. Renal failure and cirrhosis: a systematic review of mortality and prognosis. J Hepatol. 2012;56:810-8. [ Links ]
Conflito de interesses
Os autores declaram não haver conflito de interesses.
*Autor para correspondência
Correio eletrónico: pcarrola@sapo.pt (P. Carrola).
Recebido a 12 de março de 2012; aceite a 19 de septembro de 2012













