Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Acessos
Acessos
Links relacionados
-
 Similares em
SciELO
Similares em
SciELO
Compartilhar
Jornal Português de Gastrenterologia
versão impressa ISSN 0872-8178
J Port Gastrenterol. vol.20 no.5 Lisboa set. 2013
https://doi.org/10.1016/j.jpg.2013.03.002
ARTIGO ORIGINAL
Hepatite autoimune em idade pediátrica: experiência de 20 anos
Autoimmune hepatitis in paediatrics: 20-year experience
Ana Bretta,∗, Patrícia Cardosoa, Carla Pintoa, António Pedro Camposa, Sandra Ferreiraa, Maria Augusta Ciprianob, António Martinhoc e Isabel Gonçalvesa
a Unidade de Hepatologia, Hospital Pediátrico de Coimbra, Centro Hospitalar e Universitário de Coimbra, Coimbra, Portugal
b Serviço de Patologia Clínica, Hospitais da Universidade de Coimbra, Centro Hospitalar e Universitário de Coimbra, Coimbra, Portugal
c Centro de Histocompatibilidade do Centro, Coimbra, Portugal
*Autor para correspondência
RESUMO
Introdução: A hepatite autoimune (HAI) é uma doença rara em idade pediátrica. Sendo uma hepatopatia tratável, o seu diagnóstico precoce, possibilitando o tratamento adequado, é essencial.
Objetivos: Caracterizar a forma de apresentação clínica e laboratorial, os antecedentes pessoais e familiares de patologia autoimune, a demora diagnóstica e a evolução das crianças seguidas numa unidade de hepatologia com o diagnóstico de HAI.
Métodos: Estudo descritivo, cujo método de colheita de dados foi retrospetivo, através dos processos clínicos das crianças diagnosticadas com HAI numa unidade de hepatologia de um hospital pediátrico, durante 20 anos (1992-2011).
Resultados: Foram incluídas no estudo 33 crianças, 69,7% do sexo feminino, com idade média de 9,0±3,1 anos. A forma de apresentação foi hepatite aguda em 63,6%. Tinham antecedentes pessoais e familiares de doença autoimune 18,2% e 21,1%, respetivamente. Analiticamente, 93,9% dos casos apresentavam hiperglobulinémia e 63,6% citólise importante. Tinham HAI tipo 1 66,7%, HAI tipo 2 27,3%, enquanto 6% não apresentavam autoanticorpos circulantes na data do diagnóstico. Todos os diagnósticos foram confirmados por biópsia hepática. A demora diagnóstica foi superior a um mês em 66,7% dos casos. Aos 2 meses de tratamento com imunossupressores, 89,7% dos casos apresentavam uma redução das enzimas de citólise superior a 80% em relação ao valor na data do diagnóstico. Três casos necessitaram de transplante hepático, um dos quais faleceu.
Conclusões: É fundamental considerar o diagnóstico de HAI perante uma criança, geralmente do sexo feminino e com idade superior a 8 anos, com um quadro de hepatite aguda, hiperglobulinémia e enzimas de citólise elevadas. O envio precoce para um centro de referência, para realização de biópsia hepática e início de tratamento adequado, é fortemente recomendado.
Palavras-Chave: Crianças; Hepatite autoimune; Diagnóstico
ABSTRACT
Introduction: Autoimmune hepatitis (AIH) is a rare disease in paediatrics. Since it is a treatable liver disease, an early diagnosis, allowing for an adequate treatment, is essential.
Aim: To describe the clinical presentation, laboratory features, personal and family history of autoimmune disease, diagnostic delay and outcome of the children followed in a Hepatology Unit with the diagnosis of AIH.
Methods: Descriptive retrospective study of the clinical records of children diagnosed with AIH in a Hepatology Unit of a Paediatric Hospital, during 20 years (1992-2011). Results: The study included 33 children, 69.7% female, with an average age of 9.0±3.1 years. At presentation 63.6% had acute hepatitis. Personal and family history of autoimmune disease was present in 18.2% and 21.1%, respectively. Laboratory analysis showed hyperglobulinaemia in 93.9% and major cytolysis in 63.6%. The diagnosis was of AIH type 1 in 66.7%, AIH type 2 in 27.3% and 6% had negative auto-antibodies. All had their diagnosis confirmed by liver biopsy. The duration of disease prior to diagnosis was longer than one month in 66.7% of cases. After 2 months of treatment with immunosuppressants, 89.7% had a decrease of more than 80% in the levels of baseline ALT and AST. Three cases required liver transplantation, one of whom died.
Conclusions: The diagnosis of AIH should be considered when a child, usually a girl and over 8 years-old, presents with acute hepatitis, hyperglobulinaemia and important cytolysis. An early referral for liver biopsy, so that adequate treatment can be started, is strongly recommended.
Keywords: Children; Autoimmune hepatitis; Diagnosis
Introdução
Na última década temos assistido a um decréscimo na incidência de hepatites virais e a um crescente número de diagnósticos de hepatite autoimune (HAI) em idade pediátrica. A HAI é uma hepatopatia inflamatória progressiva, caracterizada serologicamente por níveis elevados de aminotransferases, imunoglobulina G (IgG), presença de autoanticorpos e por alterações histológicas típicas, na ausência de uma etiologia conhecida de hepatite crónica1,2. Atinge principalmente o sexo feminino3,4, com uma idade de apresentação variável, embora mais frequente abaixo dos 18 anos de idade5. É uma doença que responde, habitualmente, ao tratamento com imunossupressores2,6.
Ainda não são totalmente conhecidos os mecanismos patogénicos da HAI. Vários fatores, nomeadamente predisposição genética, uma falha nos mecanismos de tolerância imunológica e desencadeantes ambientais, parecem colaborar em induzir e perpetuar uma agressão dos linfócitos T CD4 sobre os antigénios hepáticos, conduzindo a um processo necroinflamatório e fibrótico progressivo7-9.
A HAI classifica-se habitualmente em 2 tipos, de acordo com os autoanticorpos isolados. Na HAI tipo 1 estão presentes anticorpos antimúsculo liso (ASMA) e/ou anticorpos antinucleares (ANA); na HAI tipo 2 é característica a presença de anticorpos anti-microssoma hepático-renal tipo 1 (anti-LKM 1) e/ou anticorpos anticitosol hepático tipo 1 (anti-LC 1)10,11. No entanto, em ambos os tipos de HAI podem também ser encontrados outros autoanticorpos, nomeadamente anticorpos antígeno hepático solúvel (SLA) ou anticorpos antireceptores de asialoglicoproteínas12,13. Por outro lado, em cerca de 20% dos casos a HAI pode ter autoanticorpos negativos10,14, ou seja, os autoanticorpos circulantes estão ausentes, sendo o diagnóstico baseado no índice International Autoimmune Hepatitis Group (IAIHG)10. Nestes casos é importante procurar outros marcadores, como o anti-SLA2.
A HAI em idade pediátrica tem um largo espectro de apresentação clínica, desde ausência de sintomas a hepatite aguda ou cirrose com hipertensão portal15. Cerca de 40% dos casos manifestam-se com sintomas agudos, indistinguíveis dos doentes com hepatite vírica, e algumas crianças podem desenvolver insuficiência hepática aguda (IHA). Apenas um terço dos doentes apresentam um início insidioso, com sintomas com mais de 6 meses de evolução16. Em cerca de 10% existem sinais de hipertensão portal sem colestase3. Exceto os casos de IHA, as características clínicas de apresentação são indistinguíveis nos 2 subgrupos de HAI3, embora o tipo 2 atinja preferencialmente crianças mais jovens3.
O diagnóstico de HAI é, portanto, efetuado mediante a utilização de critérios clássicos (hepatite + autoanticorpos) ou pela aplicação do índice IAIHG10. Este permite classificar o diagnóstico de HAI como provável ou definitivo, podendo ser aplicado antes ou depois do tratamento. Tem como objetivo principal o diagnóstico diferencial em situações complexas, como por exemplo nas síndromes de sobreposição. Contempla as seguintes variáveis: sexo, relação fosfatase alcalina/enzimas de citólise, níveis de globulinas ou de IgG, presença de ANA, ASMA ou LKM-1, autoanticorpos antimitocondriais (AMA) e marcadores virais, consumo de álcool ou drogas, histologia hepática e antecedentes de patologia autoimune; os parâmetros opcionais são a positividade para outros autoanticorpos, a presença de HLA DR3 ou DR4 e a resposta ao tratamento. Recentemente foi publicado um sistema simplificado, baseado no doseamento de autoanticorpos, IgG, histologia e exclusão de hepatite viral, mais adequado para a prática clínica17.
A HAI, quando não tratada, pode conduzir a IHA ou a cirrose com hipertensão portal, com necessidade de transplante hepático2; a mortalidade aos 5 anos é de 75%18. Porém, quando o tratamento com imunossupressores é precoce, a evolução é geralmente favorável15.Este estudo pretende caracterizar as crianças com HAI seguidas numa unidade de hepatologia de um hospital pediátrico nos últimos 20 anos, nomeadamente no que diz respeito à apresentação clínica e laboratorial, antecedentes pessoais e familiares de patologia autoimune, demora diagnóstica e evolução.
Material e métodos
Foi efetuado um estudo observacional descritivo, cujo método de colheita de dados foi retrospetivo, em que foram incluídas todas as crianças com diagnóstico de HAI seguidas na unidade de hepatologia de um hospital pediátrico, durante um período de 20 anos (janeiro de 1992 a dezembro de 2011).
A HAI foi definida pela presença de autoanticorpos específicos, hipergamaglobulinémia, enzimas de citólise elevadas e histologicamente por alterações típicas na biópsia hepática. Nos casos de HAI seronegativa, esta foi definida pelos restantes parâmetros descritos e por uma boa resposta à terapêutica imunossupressora. Em todas as crianças foram excluídas hepatite por vírus, défice de alfa-1-antitripsina, doença de Wilson e ainda história de ingestão recente ou prolongada de fármacos ou de álcool.
Foi realizado o diagnóstico de IHA nas crianças com doenças hepática e coagulopatia com INR > 2, sem resposta a vitamina K endovenosa.
Os parâmetros estudados foram: idade de diagnóstico, sexo, antecedentes pessoais ou familiares de patologia autoimune, forma de apresentação, exames complementares de diagnóstico, biópsia hepática, tipo de HAI, tipagem HLA, score IAIHG, tempo de demora diagnóstica, tratamento e evolução.
Foram avaliados os seguintes exames laboratoriais de diagnóstico: diferencial (proteínas totais - albumina), IgG, alanina aminotransferase (ALT), aspartato aminotransferases (AST), bilirrubina total e direta, gama-glutamil transferase (GGT) e fosfatase alcalina (FA). O diferencial (proteínas totais - albumina) foi usado para medir indiretamente o valor das globulinas, tendo sido definida hiperglobulinémia como um diferencial > 30 g/L. A IgG foi considerada elevada em relação à idade das crianças de acordo com os seguintes valores: > 12,4 g/L (1-5 anos), > 15,7 g/L (6-10 anos) e > 13,5 g/L (> 10 anos)19. Foram analisados os valores de AST e ALT no diagnóstico e nos 1, 2 e 6 meses seguintes. Foi considerado um valor normal de ALT até 45 UI/L e definiu-se citólise importante quando ALT > 500 UI/L. Os valores considerados normais para as enzimas de colestase foram GGT 12-58 UI/L e FA 175-420 UI/L e para os valores de bilirrubina total < 17,1mmol/L e bilirrubina conjugada < 5mmol/L.
Ao longo do período estudado os autoanticorpos foram sempre detetados por imunofluorescência indireta (IFI). Nos últimos 7 anos, dependendo do autoanticorpo detetado, esta técnica foi complementada por Immunoblot e ELISA. Todas as crianças têm mais do que um doseamento de autoanticorpos ao longo do seguimento. Títulos superiores a 1:40 foram considerados positivos. A tipagem HLA foi efetuada por técnicas de biologia molecular - amplification refractory mutation system-polimerase chain reaction (ARMS PCR), efetuada no Centro de Histocompatilidade do Centro.
A avaliação imagiológica inicial foi ecográfica e em casos pontuais complementada por colangioressonância. Quando suspeitadas alterações da árvore biliar, a demonstração ou exclusão do diagnóstico de colangite ou colangiopatia autoimune foi baseada na avaliação histológica e/ou colangiopancreatografia retrograda endoscópica (CPRE).
Foi considerado diagnóstico definitivo de HAI um score IAIHG > 15 e diagnóstico provável se valor entre 10-15, de acordo com o estabelecido na literatura10. As crianças com HAI tipo 1 e tipo 2 foram comparadas quanto a: idade, sexo, forma de apresentação, doenças autoimunes associadas, história familiar de doença autoimune, presença de autoanticorpos, diferencial proteínas totais/albumina, níveis de ALT e tipagem HLA.
Todas as crianças com o diagnóstico de HAI iniciaram tratamento, independentemente da gravidade do quadro clínico. A terapêutica inicial é efetuada com prednisolona na dose 2 mg/kg por dia (máximo 60 mg/dia). Após um mês de tratamento é associada a azatioprina (2 mg/kg por dia), com o objectivo de permitir a redução mais rápida do corticóide. Aos 6 meses, quando não há normalização das enzimas, a azatioprina é substituída por micofenolato de mofetil. Pontualmente são utilizados outros imunossupressores (p. ex. ciclosporina).
Os dados foram tratados estatisticamente com recurso ao programa Statistical Package for the Social Sciences® (SPSS Inc., Chicago, IL) versão 19. A caracterização da população foi feita pelo cálculo de medidas de tendência central e de dispersão para variáveis quantitativas e pela determinação de frequências absolutas e relativas para variáveis qualitativas. Foi utilizado o teste U de Mann-Whitney para comparação de variáveis quantitativas sem distribuição normal e o teste t-Student para comparação de variáveis quantitativas com distribuição normal. Para a associação de 2 variáveis qualitativas usou-se o teste exato de Fisher, já que a menor frequência esperada situava-se abaixo de 5. Foi considerado um nível de significância estatística de p < 0,05.
Resultados
Durante o período de 20 anos foram diagnosticadas 33 crianças com HAI, representando 8% dos doentes seguidos na consulta de hepatologia. Dos doentes diagnosticados com HAI, 23 (69,7%) eram do sexo feminino, com um rácio feminino/masculino de aproximadamente 5:2. A média de idade na altura do diagnóstico foi de 9,0±3,1 anos, com 66,7% das crianças com idade superior ou igual a 8 anos.
Forma de apresentação
Dos 33 casos de HAI, em 63,6% (n = 21) a forma de apresentação foi hepatite colestática aguda. Destes, 2 crianças, de 13 meses e 7,5 anos, tinham critérios de IHA com necessidade de internamento em cuidados intensivos e outra criança apresentava uma infeção concomitante por parvovirus B19. Nenhum outro caso teve uma infeção vírica associada.
Em 11 casos (33,3%) as crianças apresentavam hepatite crónica, 6 com a seguinte clínica associada: colite inespecífica, colite ulcerosa, coagulopatia refratária a vitamina K, pancitopenia com tiroidite autoimune associada e 2 casos com esplenomegália, um dos quais com pancitopenia.
Cinco doentes eram assintomáticos, tendo sido detetadas alterações analíticas em exames de rotina.
Um caso teve como primeira manifestação clínica um síndrome histiofagocítico secundário.
Antecedentes pessoais e familiares
Seis crianças (18,2%) tinham antecedentes pessoais de doença autoimune: doença inflamatória intestinal (n = 3), vitiligo (n = 1), psoríase (n = 1) e tiroidite autoimune (n = 1).
Em 7 casos (21,1%) havia doença autoimune em familiares: patologia tiroideia (n = 4), sarcoidose (n = 2) e psoríase (n = 1). Apenas uma criança tinha concomitantemente história pessoal e familiar de doença autoimune (psoríase).
Duas crianças tinham história familiar e pessoal de esferocitose.
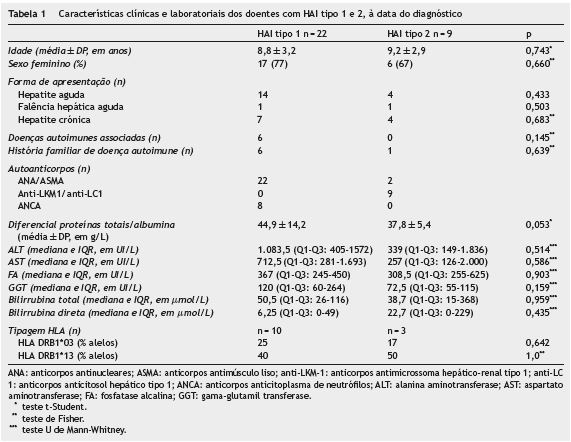
Na tabela 1 é comparada a presença de patologia autoimune em crianças de acordo com o tipo de HAI. Embora sem significado estatístico, todas as crianças com antecedentes pessoais e 6 crianças com antecedentes familiares de doença autoimune foram diagnosticadas com HAI tipo 1.
Exames complementares de diagnóstico
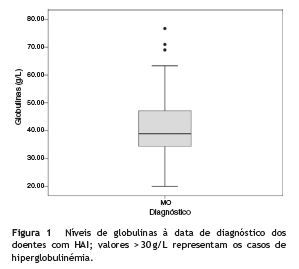
Na avaliação laboratorial inicial, a mediana das globulinas foi de 38,9 g/L (Q1-Q3: 34,2-47,6), apresentando 31 crianças (93,9%) hiperglobulinémia (fig. 1). A IgG foi quantificada em 21 crianças, com uma média de 23,4±12,9 g/L, encontrando-se elevada de acordo com os valores de referência em todas exceto 3 crianças.
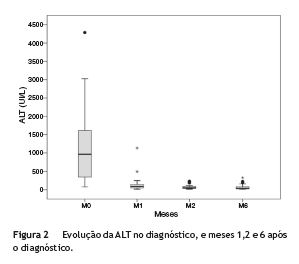
Relativamente ao valor das aminotransferases, a mediana de ALT e de AST no diagnóstico foi de 964 UI/L (Q1-Q3:342-1674) e 575 UI/L (Q1-Q3: 250-1622), respetivamente, apresentando 63,6% dos casos citólise elevada (fig. 2).
A mediana das enzimas de colestase foi GGT 106 U/L (Q1-Q3: 61,5-165,5) e FA 367 U/L (Q1-Q3: 258,5-613,5). O valor em mediana da bilirrubina total foi de 42,7mmol/L (Q1-Q3: 28,05-124,75) e da bilirrubina direta de 8,3mmol/L (Q1-Q3: 0,7-53,4). Quando comparadas as crianças com e sem hepatite colestática, o valor em mediana da bilirrubina total foi de 51,1mmol/L (Q1-Q3:28,9-221,4) e de 37,1mmol/L (Q1-Q3: 8,3-46,4), respetivamente (p = 0,06;teste U de Mann-Whitney).
Quanto aos autoanticorpos, 22 crianças tinham ANA ou ASMA positivos (HAI tipo 1) e 9 tinham anti-LKM 1 ou anti- LC 1 positivos (HAI tipo 2). Nas crianças diagnosticadas com HAI tipo 1, 8 apresentavam ANCA positivos. Em 2 casos (6%) os autoanticorpos foram indetetáveis. Na tabela 1 estão descritas as características clínicas e laboratoriais destes doentes na altura do diagnóstico. Quando comparado o diferencial (proteínas totais - albumina) entre as crianças com HAI tipo 1 e 2, a diferença não é estatisticamente significativa (44,9±14,2 g/L vs 37,8±5,4 g/L, p = 0,053; teste t-Student).
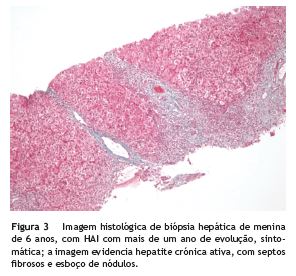
Todos os diagnósticos foram confirmados por biópsia hepática. As características histológicas típicas foram hepatite de interface, infiltrado linfoplasmocitário e presença de hepatócitos com disposição em roseta (fig. 3).
Foi diagnosticada colangiopatia autoimune por biópsia e/ou CPRE em 7 crianças, 57% do sexo feminino, todas com HAI tipo 1, 5 das quais com ANCA positivos e 4 com patologia autoimune associada (3 com doença inflamatória intestinal).
A tipagem HLA foi efetuada em 14 casos, um dos quais com HAI com autoanticorpos negativos. O alelo DRB1*13 foi isolado em 10 crianças, com uma frequência de 11 alelos (39,3%). O alelo DRB1*03 estava presente em 6 crianças, com 6 alelos isolados (21,4%), estando presente em 3 crianças em que foi também isolado o alelo DRB1*13. A diferença na percentagem de alelos isolados na tipagem HLA nos dois tipos de HAI não foi estatisticamente significativa (tabela 1).
O score IAIHG foi aplicado em todos os casos pré-tratamento, de acordo com a clínica e exames complementares de diagnóstico, apresentando uma mediana de 18 (Q1-Q3: 16,5-20). Oito crianças tinham um score entre 10-15.
Demora diagnóstica
A mediana em meses desde o início dos sintomas até à observação numa unidade de saúde foi de um mês (Q1-Q3:0,2-3). Foram referenciadas de outros hospitais 24 (72,7%) crianças, com uma mediana de 0,5 meses (Q1-Q3: 0,06-1,8) desde a sua primeira observação.
A demora diagnóstica, desde o início dos sintomas até ao diagnóstico final, foi superior a um mês, com uma mediana de 2 meses (Q1-Q3: 0,75-4,5), em 66,7% dos casos.
Tratamento
Todas as crianças iniciaram tratamento com prednisolona, tendo sido associada azatioprina em 8 crianças com HAI tipo 1. O tratamento subsequente foi realizado de acordo com o protocolo terapêutico já descrito. Em 3 casos foi realizado transplante hepático: nas 2 crianças com IHA e num jovem de 13 anos com cirrose e hipertensão portal diagnosticadas no decurso de investigação de esplenomegália e pancitopenia. Seis crianças referenciadas para transplante melhoraram com a terapêutica médica instituída.
Evolução clínica e analítica
Na avaliação realizada 2 meses após o início de imunossupressão, 89,7% dos casos apresentavam uma redução das enzimas de citólise superior a 80%. A figura 2 mostra a evolução da ALT nos primeiros 6 meses após o diagnóstico de HAI.
Faleceu uma criança com 13 meses, após a realização de transplante hepático por IHA.
Discussão
A HAI é uma doença rara em idade pediátrica. No entanto, é uma importante etiologia de doença hepática crónica. Sendo uma hepatopatia tratável, é um diagnóstico «emergente» face a outras etiologias de hepatite crónica da criança e adolescente. Como tal, é importante reconhecer a sua forma de apresentação, de forma a otimizar o seu diagnóstico e tratamento atempados.
São escassas as casuísticas sobre HAI em idade pediátrica na literatura, não se encontrando dados nacionais publicados relativos a esta faixa etária. Um estudo sobre a prevalência de doença hepática crónica em Portugal, em adultos, descreve 3% de prevalência de patologia hepática autoimune20, inferior à encontrada nesta unidade pediátrica (8%).
Apesar de apresentarem uma resposta semelhante ao tratamento, é pertinente diferenciar entre HAI tipo 1 e tipo 2, pois estas variam quanto a idade de início, forma de apresentação, distribuição geográfica, gravidade e recidivas18. Tipicamente dois terços dos casos de HAI são do tipo11,3,21 e a incidência de HAI seronegativa em crianças é de 5,5-7,7%22,23. Estes dados são coincidentes com os descritos neste estudo: 22 casos (66,7%) foram diagnosticados com HAI tipo 1 e 9 (27,3%) com HAI tipo 2, tendo 2 casos (6%) autoanticorpos negativos. Nas crianças com HAI tipo 1 podem estar presentes outros autoanticorpos, nomeadamente o ANCA16, tal como foi constatado nesta série, com 38,1% dos casos de HAI tipo 1 com ANCA positivo. Nesta série não foi avaliada sistematicamente a presença de anticorpo anti-SLA, geralmente associado a maior gravidade de doença e probabilidade de recidiva12. De salientar que em pediatria os títulos de autoanticorpos são frequentemente mais baixos que os níveis considerados positivos em adultos16.
A HAI é uma doença mais frequente no sexo feminino, independentemente do seu tipo. Nesta série 69,7% dos casos eram raparigas, com outras séries em idade pediátrica a mostrar valores entre 75-90%3,15,21,23.
Relativamente à idade, a mediana de idade de diagnóstico foi de 9,0±3,1 anos, com 66,7% das crianças com idade superior ou igual a 8 anos, semelhante a outros estudos21-23. Quando comparados os 2 tipos de HAI, a média de idade na HAI tipo 1 foi de 8,8±3,2 anos e na HAI tipo 2 de 9,2±2,9 anos (p = 0,743, teste t-Student). De acordo com outro estudo3, seria de esperar uma média de idade mais elevada no grupo com HAI tipo 1, em que a apresentação clínica é habitualmente na puberdade (média de idade de apresentação de 10,5 anos), em relação ao grupo com HAI tipo 2, mais típica na infância (média de idade de apresentação de 7,4 anos). Esta disparidade entre a literatura e o presente estudo está provavelmente associada a uma referenciação tardia, uma vez que 4 em 9 crianças (44,4%) diagnosticadas com HAI tipo 2 tinham como forma de apresentação hepatite crónica (tabela 1).
Nesta série, na maioria dos casos (63,6%) a forma de apresentação foi com hepatite aguda, dos quais 2 com IHA. Estes dados são semelhantes a outros estudos descritos de crianças com HAI3,23.
Classicamente, um pré-requisito para o diagnóstico de HAI na criança era uma duração de doença hepática de pelo menos 6 meses. Atualmente esta abordagem está ultrapassada, pois grande parte dos doentes com HAI apresenta um início agudo, difícil de distinguir de uma hepatite viral, embora com alterações histológicas de doença hepática crónica24. Aliás, mesmo em casos de hepatite crónica, excluída uma etiologia vírica (p. ex. VHB, VHC), quanto mais precoce o diagnóstico e início da terapêutica imunossupressora, melhor a resposta clínica25. A crescente sensibilização para o diagnóstico de HAI foi o fator mais importante para uma progressiva diminuição da demora diagnóstica, que neste estudo foi de 2 meses (mediana).
Um dos elementos importantes para o diagnóstico de HAI é uma historia pessoal e/ou familiar positiva de autoimunidade ou imunodeficiência. Cerca de 20% dos doentes com HAI apresentam uma ou mais doenças autoimunes associadas (p. ex. tiroidite, vitiligo, diabetes tipo 1, doença intestinal inflamatória, doença celíaca e síndrome nefrótica) e 40% têm história familiar de doença autoimune3. Nesta série, embora a frequência de antecedentes de doença autoimune seja semelhante ao esperado, apenas 21,1% tinha história familiar de doença autoimune. Quando comparadas as crianças de acordo com o tipo de HAI, verificou-se um predomínio de patologia autoimune pessoal e familiar nas crianças com HAI tipo 1, diferente do descrito em outros estudos, em que os valores são semelhantes nos dois tipos de HAI3,16. O pequeno número (n = 9) de doentes com HAI tipo 2 poderá justificar esta diferença.
Na HAI, a gravidade da doença é semelhante nos dois tipos, embora geralmente as crianças com HAI tipo 2 apresentem níveis mais elevados de bilirrubina e aminotransferases e evoluam mais frequentemente para IHA3. Neste estudo não observámos diferenças estatisticamente significativas relativamente a estes parâmetros laboratoriais entre os dois tipos de HAI (tabela 1).
O valor da mediana da FA e GGT (tabela 1) foi semelhante ao descrito noutra série pediátrica3. No entanto, em crianças, a FA é um marcador pouco específico, dado o valor representar as isoenzimas do fígado, intestino e osso (crescimento), sendo a GGT um marcador mais útil de colestase. Ao contrário da HAI do adulto, não é conhecido valor prognóstico à GGT em séries pediátricas3.
Níveis elevados de IgG são característicos nos doentes com HAI, embora 15% das crianças com HAI tipo 1 e 25% das com HAI tipo 2 possam apresentar níveis normais3. Nesta série, das 21 crianças em que foi doseada a IgG, apenas 3 (14,3%) não apresentavam níveis elevados de globulina.
A biópsia hepática, obrigatória no diagnóstico de HAI, foi fundamental na confirmação do diagnóstico dos casos de HAI com autoanticorpos ausentes, devido aos seus aspetos característicos (hepatite de interface, infiltrado linfoplasmocitário e presença de hepatócitos com disposição em roseta).
Nesta série, 7 crianças com HAI tipo 1 foram diagnosticadas com colangiopatia autoimune, uma entidade distinta da colangite esclerosante primária descrita nas síndromes de sobreposição em adultos26. A colangiopatia autoimune pode estar presente em até 50% dos casos de HAI, sendo mais comum nas HAI tipo 1 e frequentemente associada a outras alterações na autoimunidade27, tal como foi descrito neste estudo. A associação com colite foi também mais frequente.
A suscetibilidade individual para desenvolver HAI está associada a genes na região HLA, em particular às variantes DRB128. A prevalência do alelo DRB1*13 na população portuguesa é de 32,9% (dados do Centro de Histocompatibilidade do Centro). Neste estudo, a frequência do haplótipo HLA DRB1*1301 foi 39,3%, percentagem superior à população portuguesa de dadores. Este haplótipo é também predominante nas crianças com HAI na América Latina28-30, sendo os haplótipos HLA DRB1*03 e HLA DRB1*04 mais frequentes em crianças anglo-saxónicas, o último dos quais também frequente no Japão3,28,31.
Relativamente ao diagnóstico, o índice IAIHG10 valoriza ou exclui parâmetros que são tipicamente de adultos (p. ex. ingestão de fármacos, álcool, presença de anticorpos antimitocondriais). Além disso, apenas pontua a presença dos alelos DRB1*03 e DRB1*04, menos típicos na população descrita. É complexo e exige exclusão exaustiva de várias patologias hepáticas, continuando a ser difícil distinguir claramente as situações de colangite esclerosante, colangiopatia autoimune e outras síndromes de sobreposição. No entanto, o seu uso na prática clinica deve ser incentivado, em particular nos casos mais complexos em que não há inicialmente autoanticorpos séricos detetáveis, mas a histologia e a exclusão de outras patologias favorecem a hipótese de HAI, existindo estudos que mostram a sua legitimidade na população pediátrica3,32. Nesta série o índice foi determinado em todas as crianças, sendo 75,7% classificadas como HAI definitiva pré-tratamento; outras séries apresentam resultados semelhantes, com 67%3 e 86%32.
Os critérios simplificados de HAI17 não foram utilizados neste estudo. Dois estudos com o objetivo de determinar a aplicabilidade destes critérios em idade pediátrica apresentaram resultados díspares. Embora ambos tenham mostrado que os critérios simplificados têm elevada especificidade, um dos estudos concluiu que não é adequado à idade pediátrica33,34.
O tratamento com prednisolona, associada ou não a azatioprina, é eficaz, com remissão da doença em mais de 80% dos casos3. Na maioria das crianças, os níveis de aminotransferases iniciais diminuem 80% no período de 6 semanas, tal como verificado neste estudo em 89,7% dos casos35. A melhoria dos sintomas precede a resposta bioquímica. No entanto, o tempo para remissão completa desta pode ser longo, com uma mediana de 7 meses3. Nas crianças que apresentam IHA, a imunossupressão raramente é eficaz, sendo necessário recorrer a transplante hepático35, como se verificou neste estudo. Apesar de uma terapêutica adequada, as recaídas sob tratamento são comuns, afetando cerca de 40% das crianças e requerendo um aumento temporário da dose de corticóides ou a associação de azatioprina35. Estas recaídas devem ser detetadas e tratadas precocemente, razão pela qual a vigilância laboratorial destes doentes deve ser efetuada com uma periodicidade não superior a 2 meses, já que mesmo com aminotransferases muito elevadas as crianças podem estar assintomáticas. A descompensação hepática pode ocorrer, mesmo após anos de controlo bioquímico aparentemente adequado3.
Embora as HAI tipo 1 e 2 possam apresentar diferenças quanto a idade de início e forma de apresentação clínica e laboratorial, neste estudo essas diferenças não foram significativas (tabela 1). No entanto, mantém-se pertinente diferenciar os 2 tipos de HAI, pois tipicamente a HAI tipo 2 tem um pior prognóstico, com evolução mais frequente para IHA ou cirrose.
Em conclusão, sendo a HAI uma doença de fácil diagnóstico e tratável, é fundamental considerá-la, em particular perante uma criança, geralmente do sexo feminino e com idade superior a 8 anos, que apresente um quadro clínico de hepatite aguda e analiticamente com hiperglobulinémia e enzimas de citólise elevadas. A referenciação e tratamento precoces são fundamentais para controlar a progressão da doença.
Bibliografia
1. Vergani D, Mieli-Vergani G. Autoimmune hepatitis. Em: Textbook of hepatology: From basic science to clinical practice. 3 rd ed UK: Blackwell Publishing; 2007. p. 1089-101. [ Links ]
2. Manns MP, Czaja AJ, Gorham JD, Krawitt EL, Mieli-Vergani G, Vergani D, et al. Diagnosis and management of autoimmune hepatitis. Hepatology. 2010;51:2193-213. [ Links ]
3. Gregorio GV, Portmann B, Reid F, Donaldson PT, Doherty DG, McCartney M, et al. Autoimmune hepatitis in childhood: A 20- year experience. Hepatology. 1997;25:541-7. [ Links ]
4. McFarlane IG, Heneghan MA. Autoimmunity and the female liver. Hepatol Res. 2004;28:171-6. [ Links ]
5. Mieli-Vergani G, Heller S, Jara P, Vergani D, Chang MH, Fujisawa T, et al. Autoimmune hepatitis. J Pediatr Gastroenterol Nutr. 2009;49:158-64. [ Links ]
6. Mieli-Vergani G, Vergani D. Immunological liver diseases in children. Semin Liver Dis. 1998;18:271-9. [ Links ]
7. Vergani D, Choudhuri K, Bogdanos DP, Mieli-Vergani G. Pathogenesis of autoimmune hepatitis. Clin Liver Dis. 2002;6:727-37. [ Links ]
8. Czaja AJ. Autoimmune hepatitis. Part A: Pathogenesis. Expert Rev Gastroenterol Hepatol. 2007;1:113-28. [ Links ]
9. Liberal R, Longhi MS, Mieli-Vergani G, Vergani D. Pathogenesis of autoimmune hepatitis. Best Pract Res Clin Gastroenterol. 2011;25:653-64. [ Links ]
10. Alvarez F, Berg PA, Bianchi FB, Bianchi L, Burroughs AK, Cancado EL, et al. International Autoimmune Hepatitis Group Report: Review of criteria for diagnosis of autoimmune hepatitis. J Hepatol. 1999;31:929-38. [ Links ]
11. Martini E, Abuaf N, Cavalli F, Durand V, Johanet C, Homberg JC. Antibody to liver cytosol (anti-LC1) in patients with autoimmune chronic active hepatitis type 2. Hepatology. 1988;8:1662-6. [ Links ]
12. Ma Y, Okamoto M, Thomas MG, Bogdanos DP, Lopes AR, Portmann B, et al. Antibodies to conformational epitopes of soluble liver antigen define a severe form of autoimmune liver disease. Hepatology. 2002;35:658-64. [ Links ]
13. Hausdorf G, Roggenbuck D, Feist E, Buttner T, Jungblut PR, Conrad K, et al. Autoantibodies to asialoglycoprotein receptor (ASGPR) measured by a novel ELISA–revival of a diseaseactivity marker in autoimmune hepatitis. Clin Chim Acta. 2009;408:19-24. [ Links ]
14. Czaja AJ. Autoantibody-negative autoimmune hepatitis. Dig Dis Sci. 2012;57:610-24. [ Links ]
15. Kansu A, Kalayci AG, Altuntas B, Doganci T, Girgin N. Autoimmune hepatitis in children: A report of ten cases. Turk J Med Sci. 2000;30:55-61. [ Links ]
16. Mieli-Vergani G, Vergani D. Autoimmune hepatitis in children: What is different from adult AIH? Semin Liver Dis. 2009;29:297-306. [ Links ]
17. Hennes EM, Zeniya M, Czaja AJ, Pares A, Dalekos GN, Krawitt EL, et al. Simplified criteria for the diagnosis of autoimmune hepatitis. Hepatology. 2008;48:169-76. [ Links ]
18. Mieli-Vergani G, Vergani D. Autoimmune hepatitis. Nat Rev Gastroenterol Hepatol. 2011;8:320-9. [ Links ]
19. Jolliff CR, Cost KM, Stivrins PC, Grossman PP, Nolte CR, Franco SM, et al. Reference intervals for serum IgG, IgA, IgM, C3, and C4 as determined by rate nephelometry. Clin Chem. 1982;28:126-8. [ Links ]
20. Valente AI, Almeida A, Gouveia A, Serejo F, Ramalho F, Baptista A, et al. Prevalence of chronic hepatic disease in Portugal. Apropos of a review carried out in a hepatology unit. Acta Med Port. 1996;9:197-202. [ Links ]
21. Bellomo-Brandao MA, Costa-Pinto EA, de Tommaso AM, Hessel G. Clinical and biochemical features of autoimmune hepatitis in 36 pediatric patients. Arq Gastroenterol. 2006;43:45-9. [ Links ]
22. Dumortier J, Arita CT, Rivet C, LeGall C, Bouvier R, Fabien N, et al. Long-term treatment reduction and steroids withdrawal in children with autoimmune hepatitis: A single centre experience on 55 children. Eur J Gastroenterol Hepatol. 2009;21:1413-8. [ Links ]
23. Ferreira AR, Roquete ML, Penna FJ, Toppa NH. Autoimmune hepatitis in children and adolescents: Clinical study, diagnosis and therapeutic response. J Pediatr (Rio J). 2002;78:309-14. [ Links ]
24. Mieli-Vergani G, Vergani D. Autoimmune paediatric liver disease. World J Gastroenterol. 2008;14:3360-7. [ Links ]
25. Vegnente A, Larcher VF, Mowat AP, Portmann B, Williams R. Duration of chronic active hepatitis and the development of cirrhosis. Arch Dis Child. 1984;59:330-5. [ Links ]
26. Boberg KM, Chapman RW, Hirschfield GM, Lohse AW, Manns MP, Schrumpf E, et al. Overlap syndromes: The International Autoimmune Hepatitis Group (IAIHG) position statement on a controversial issue. J Hepatol. 2011;54:374-85. [ Links ]
27. Gregorio GV, Portmann B, Karani J, Harrison P, Donaldson PT, Vergani D, et al. Autoimmune hepatitis/sclerosing cholangitis overlap syndrome in childhood: A 16-year prospective study. Hepatology. 2001;33:544-53. [ Links ]
28. Oliveira LC, Porta G, Marin ML, Bittencourt PL, Kalil J, Goldberg AC. Autoimmune hepatitis. HLA and extended haplotypes Autoimmun Rev. 2011;10:189-93. [ Links ]
29. Bittencourt PL, Goldberg AC, Cancado EL, Porta G, Carrilho FJ, Farias AQ, et al. Genetic heterogeneity in susceptibility to autoimmune hepatitis types 1 and 2. Am J Gastroenterol. 1999;94:1906-13. [ Links ]
30. Fainboim L, Marcos Y, Pando M, Capucchio M, Reyes GB, Galoppo C, et al. Chronic active autoimmune hepatitis in children. Strong association with a particular HLA-DR6 (DRB1*1301) haplotype. Hum Immunol. 1994;41:146-50. [ Links ]
31. Cookson S, Constantini PK, Clare M, Underhill JA, Bernal W, Czaja AJ, et al. Frequency and nature of cytokine gene polymorphisms in type 1 autoimmune hepatitis. Hepatology. 1999;30:851-6. [ Links ]
32. Ebbeson RL, Schreiber RA. Diagnosing autoimmune hepatitis in children: Is the International Autoimmune Hepatitis Group scoring system useful? Clin Gastroenterol Hepatol. 2004;2:935-40. [ Links ]
33. Mileti E, Rosenthal P, Peters MG. Validation and modification of simplified diagnostic criteria for autoimmune hepatitis in children. Clin Gastroenterol Hepatol. 2012;10:417-21, e411-12. [ Links ]
34. Hiejima E, Komatsu H, Sogo T, Inui A, Fujisawa T. Utility of simplified criteria for the diagnosis of autoimmune hepatitis in children. J Pediatr Gastroenterol Nutr. 2011;52:470-3. [ Links ]
35. Mieli-Vergani G, Vergani D. Autoimmune hepatitis in children. Clin Liver Dis. 2002;6:623-34. [ Links ]
Responsabilidades éticas
Proteção de pessoas e animais.Os autores declaram que para esta investigação não se realizaram experiências em seres humanos e/ou animais.
Confidencialidade dos dados.Os autores declaram ter seguido os protocolos do seu centro de trabalho acerca da publicação dos dados de pacientes e que todos os pacientes incluídos no estudo receberam informações suficientes e deram o seu consentimento informado por escrito para participar nesse estudo.
Direito à privacidade e consentimento escrito.Os autores declaram ter recebido consentimento escrito dos pacientes e/ou sujeitos mencionados no artigo. O autor para correspondência deve estar na posse deste documento.
Conflito de interesses
Os autores declaram não haver conflito de interesses.
*Autor para correspondência
Correio eletrónico: anacbrett@gmail.com (A. Brett).
Recebido a 16 de setembro de 2012; aceite a 7 de março de 2013













