Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Acessos
Acessos
Links relacionados
-
 Similares em
SciELO
Similares em
SciELO
Compartilhar
Jornal Português de Gastrenterologia
versão impressa ISSN 0872-8178
J Port Gastrenterol. vol.21 no.4 Lisboa ago. 2014
https://doi.org/10.1016/j.jpg.2014.01.005
ARTIGO ORIGINAL
Hiperhomocisteínemia - Uma ameaça oculta da doença inflamatória intestinal?
Hyperhomocysteinemia, an occult threat in inflammatory bowel disease
Joana Magalhães∗, Bruno Rosa, Maria João Moreira, Mara Barbosa, Ana Rebelo, Sílvia Leite e José Cotter
Serviço de Gastrenterologia, Centro Hospitalar do Alto Ave, Guimarães, Portugal
*Autor para correspondência
RESUMO
Introdução e objetivos: Estudos recentes têm demonstrado um aumento dos níveis de homocisteína na doença inflamatória intestinal (DII). A hiperhomocisteínemia (hHcys) foi confirmada como um fator de risco independente para doença arterial coronária e trombose arterial e venosa, constituindo um importante fator patogénico a ter em conta na DII. O objetivo d esteestudo foi avaliar a prevalência de hHcys nos doentes com DII e investigar a associação entre os níveis de homocisteína e os seus principais determinantes.
Material e métodos: Estudo prospetivo, unicêntrico, incluindo 47 doentes (29 com doença de Crohn e 18 com colite ulcerosa) consecutivamente observados numa consulta de DII. Efetuado em todos os doentes estudo analítico, com determinação dos níveis de proteína C reativa, ácido fólico, vitamina B12 e homocisteína. Os registos clínicos desde a data do diagnóstico até à determinação dos níveis de homocisteína foram analisados. A associação entre variáveis categóricas e comparação de médias foi realizada recorrendo ao teste exato de Fisher e teste t de Student, respetivamente. Para identificar fatores preditivos de hHcys recorreu-se a uma análise de regressão linear. Considerou-se o nível de significância p < 0,05 e a análise estatística foi realizada recorrendo ao SPSS (versão 18.0).
Resultados: Verificou-se a presença de hHcys em 10,6% dos doentes com DII. Cinco doentes (10,6%) apresentavam história prévia de tromboembolismo. Comparando os doentes de acordo com os níveis de homocisteína, aqueles com hHcys eram mais jovens (p < 0,001), tinham baixos níveis de ácido fólico (p < 0,001) e uma menor duração da doenc¸a (p < 0,001), tendo-se verificado ainda uma associação significativa entre a presença de hHcys e os hábitos tabágicos (p < 0,001). A análise de regressão linear para identificar fatores preditivos de hHcys baseada na idade, duração da doença, níveis de vitamina B12 e ácido fólico, foi significativa (p = 0,001), justificando 37% da variação dos níveis de homocisteína desta amostra. Os níveis de ácido fólico foram um fator preditivo significativo (p = 0,01).
Conclusão: A hiperhomocisteínemia é um fenómeno frequente nos doentes com DII. Medidas preventivas devem focar-se nos fatores de risco reversíveis relacionados com hHcys, tais como a cessação de hábitos tabágicos e a correção de défices vitamínicos.
Palavras-Chave: Doença inflamatória intestinal; Doença de Cronh; Colite ulcerosa; Hiperhomocisteínemia
ABSTRACT
Introduction and objectives: Several recent studies have reported increased homocysteine levels in Inflammatory Bowel Disease (IBD). Hyperhomocysteinemia (hHcys) has been proved to be an independent risk factor for coronary artery disease, arterial and venous thrombosis, making it an interesting candidate as a pathogenic link in IBD. The aims of this study were to assess the prevalence of hHcys in patients with IBD and to investigate the relation between homocysteine levels and its main determinants.
Material and methods: Single-center prospective study including 47 patients (29 patients with Crohns disease and 18 patients with Ulcerative Colitis) consecutively observed in a consultation of Inflammatory Bowel Disease. Blood samples were obtained from all patients following fasting and these samples were used for determination of C reactive protein, folic acid, vitamin B12 and homocysteine levels. Clinical data recorded from disease onset to the time of the homocysteine assay were analysed. Association between categorical variables and comparisons of mean s were tested by Fisher exact test and Student t test, respectively. To identify predictive factors of hHcys in patients with IBD, a linear regression analysis was applied. The statistical level of significance was established at 5%. Statistical analysis was performed with SPSS (version 18.0).
Results: In our series, 10.6% of IBD patients were found to have hHcys. Five patients (10.6%) had a previous history of thromboembolism. Compared to patients with normal homocysteine levels, those with hHcys were younger (p < 0.001), had lower levels of folic acid (p < 0.001), and had a lower illness duration (p < 0.001). In patients with hHcys there also were a statistically significant difference according to smoking status (p < 0.001). Linear regression analysis to predict homocysteine levels based on age, illness duration, vitamin B12 and folic acid levels was significative (p = 0.001) and explain 37% of the variance found in homocysteine levels of this sample. The level of folic acid was a significant predictor (p = 0.01) of hHcys.
Conclusion: Hyperhomocysteinemia is a common phenomenon in patients with IBD. Preventive measures could focus on reversible risk factors correlated with hHcys, such as cessation of smoking and correction of vitamin deficiencies.
Keywords: Inflammatory bowel disease; Crohns disease; Ulcerative colitis; Hyperhomocysteinemia
Introdução
A doença inflamatória intestinal (DII) abrange, essencialmente, a doença de Crohn (DC) e a colite ulcerosa (CU). Estas caracterizam-se por serem doenças crónicas de etiologia multifatorial complexa e de evolução variável, com períodos de remissão e exacerbação. Clinicamente podem manifestar-se por um conjunto de sintomas intestinais diversificados, extraintestinais e sistémicos. É conhecido um maior risco de complicações tromboembólicas nos doentes com DII. A incidência de fenómenos tromboembólicos venosos e arteriais habitualmente descrita na DII é de 1-8%. No entanto, alguns estudos de autópsias relatam uma incidência tão elevada como 39%1,2. Estudos sobre este tema têm demonstrado que na DII existe frequentemente um estado de hipercoagulabilidade envolvendo todos os componentes do sistema de coagulação3-5.
A homocisteína é um aminoácido sulfurado intermediário do metabolismo da metionina. A hiperhomocisteínemia (hHcys) leve ocorre em cerca de 5-7% da população em geral, tem um conhecido efeito trombogénico e apresenta-se como um fator de risco independente para doença arterial coronária6 e trombose arterial e venosa7-14. A elevação dos níveis de homocisteína pode resultar de alterações genéticas nas enzimas envolvidas no metabolismo da metionina ou homocisteína15 ou de fatores nutricionais16. Vários estudos recentes têm documentado um aumento nos níveis de homocisteína na DII17-22, podendo o défice de nutrientes/cofatores essenciais para o metabolismo da homocisteína, nomeadamente vitamina B2, B6, B12 e ácido fólico, ser responsável pelo aumento dos níveis de homocisteína na DII23. O défice de vitamina B12 e ácido fólico são condições relativamente comuns na DII, especialmente na doença ativa, podendo ser o resultado de estados de desnutrição, má absorção ou tratamento com fármacos antifolato como o metotrexato e a sulfassalazina.
Este estudo foi realizado com o objetivo de avaliar a prevalência de hHcys nos doentes com DII e investigar a relação entre os níveis de homocisteína e os seus principais determinantes.
Material e métodos
Estudo prospetivo, unicêntrico, incluindo 47 doentes com DII seguidos em regime de ambulatório na consulta de DII. O diagnóstico de DII (DC e CU) foi baseado em critérios clínicos, endoscópicos, imagiológicos e histológicos24,25.
A população em estudo foi composta por 29 doentes com CD e 18 com CU, dos quais 32 (68,1%) do sexo feminino, com idade entre os 16-62 anos (média ± DP 36,3±13,2). Os 29 doentes com DC incluídos no estudo tinham uma idade média de 33,7±11,9 anos (entre os 16-59 anos) e 18 (62,1%) eram do sexo feminino Os 18 doentes com CU incluídos no estudo tinham uma idade média de 40,1±14,7 anos (entre os 18-62 anos) e 14 (77,8%) eram do sexo feminino.
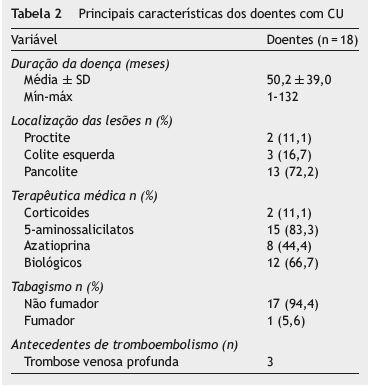
As principais caraterísticas clínicas dos doentes com DC e CU são apresentadas na tabelas 1 e 2, respetivamente.

Para a determinação dos níveis de homocisteína nos doentes com DII foi obtida uma amostra de sangue venoso, após um jejum de 12 h. Através destas amostras sanguíneas foi possível a determinação dos níveis séricos de ácido fólico, vitamina B12 e homocisteína, para cada doente. O valor de referência para os níveis de homocisteína sérica foi de <15[1]mol/L. Os valores de referência para a vitamina B12 e ácido fólico séricos foram de ≥254 pg/mL e ≥3,5 ng/mL, respetivamente.
Foram analisados os registos clínicos desde o início da doença até ao momento do estudo. Registaram-se para cada doente os seguintes dados: idade, sexo, tabagismo, duração da doença, topografia das lesões intestinais, história de ressecção intestinal, tratamento médico no momento de inclusão no estudo e história prévia de complicações tromboembólicas.
Doentes com outras doenças sistémicas, tais como diabetes mellitus, hipertiroidismo, doença hepática ou renal crónica ou neoplasia foram excluídos do estudo. Doentes com DII com história de ressecção intestinal ou a realizar suplementos vitamínicos foram também excluídos.
A análise estatística foi realizada com o programa SPSS 18.0. A associação entre variáveis categóricas e comparação de médias foi realizada recorrendo ao teste exato de Fisher e teste t de Student, respetivamente. Para identificar fatores preditivos de hHcys utilizou-se uma análise de regressão linear, tendo por base os seguintes preditores: idade, duração da doença, vitamina B12 e ácido fólico. Considerou-se o nível de significância p < 0,05.
Resultados
Níveis séricos de ácido fólico, vitamina B12 e homocisteína O valor médio de homocisteína sérica foi de 10,4 mmol/L (7,30-19,20 mmol/L) nos doentes com CU e 12,0 mmol/L (6,1-33,8 mmol/L) nos doentes com DC. A presença de hHcys foi observada em 5 doentes (10,6%), um doente com CU e 4 doentes com DC.
Os níveis médios de ácido fólico e vitamina B12 foram de 8,6 ng/mL (1,9-20,0 ng/mL) e 722,7 pg/mL (317- 1.075 pg/ml) na CU. Nos doentes com DC foram de 6,6 ng/mL (1,9-20,0 ng/mL) e 539,0 pg/mL (244-1.320 pg/mL), respetivamente.
Foi identificado défice de ácido fólico e vitamina B12 em 2 (6,9%) e 10 (34,5%) doentes com DC, respetivamente. No grupo de doentes com CU os níveis de ácido fólico estavam abaixo do valor de referência em 4 (22,2%) dos doentes e não foi observado qualquer doente com défice de vitamina B12.
Fatores associados com hiperhomocisteínemia
Não se observou uma diferença estatisticamente significativa entre os níveis de homocisteína e o tipo de doença (p = 0,64), motivo pelo qual estas 2 foram consideradas em simultâneo na avaliação estatística subsequente.
No grupo estudado, os doentes com hHcys eram mais jovens (24,8±4,1 anos vs 37,5±13,2, p < 0,001), tinham um menor tempo médio de duração da doenc¸a (13,2±10,5 vs 48,8±46,3, p < 0,001) e níveis médios de ácido fólico mais baixos (2,7±0, 7 vs 7,9±6,4, p < 0,001). Verificou-se ainda uma correlação estatisticamente significativa entre a presença de hHcys e os hábitos tabágicos (80% fumadores vs 20% não fumadores, p < 0,001).
Não se verificou associação entre a presença de hHcys e o sexo (p = 0,65), os níveis de proteína C reativa (p = 0,89), os níveis de vitamina B12 (p = 0,93), história tromboembólica prévia (p = 1,00) ou o tipo de tratamento (5-aminossalicilatos p = 0,65, corticosteroides p = 0,57, azatioprina p = 0,35; terapêutica com fármacos biológicos p = 1, 00).
Na análise de regressão linear a idade dos doentes foi um preditor marginalmente significativo dos níveis de homocisteína, com os doentes mais novos a apresentar uma tendência para níveis mais elevados de homocisteína (b= - 0,30, t = -1,71, p < 0,10). Em contraste, a duração da doença (b= -0,09, t = -0,66, n.s.) e o nível de vitamina B12 (b= 0,14, t = 1,03, n.s.) não foram preditores significativos. O nível de ácido fólico foi um preditor significativo, com valores mais elevados associados a níveis mais baixos de homocisteína (b= -0,39, t = -2,67, p < 0,05). O modelo de regressão encontrado foi significativo (F (4,41) = 6,11, p < 0,001) e explica 37% da variância encontrada nos níveis de homocisteína desta amostra.
Discussão
Estudos prévios referem uma associação entre a hHcys e a DII, variando a prevalência de hHcys em doentes com DII entre 11-56%17-23,26-28. No nosso estudo, 10,6% dos doentes com DII apresentavam hHcys.
Vários estudos têm demonstrado uma associação entre hHcys e um baixo nível de vitamina B12 e/ou défice de ácido fólico19-21. Em doentes com DII os défices vitamínicos são de etiologia multifatorial, incluindo fatores como a ingestão reduzida, diminuição da absorção intestinal, aumento das necessidades destas vitaminas e interação com fármacos29. O presente estudo demonstrou que os níveis séricos de ácido fólico são um preditor significativo de hHcys nos doentes com DII. Por outro lado, os níveis séricos de vitamina B12 não foram um preditor da presença de hHcys. É importante sublinhar que as reservas de vitamina B12 são geralmente suficientes para 3-4 anos, mesmo que todas a fontes desta vitamina sejam suprimidas o que poderá explicar, em parte, o reduzido número de doentes com défice de vitamina B12 no presente estudo.
Uma associação entre a presença de hHcys e os níveis elevados de proteína C reativa foi previamente reportada numa série de 106 doentes com DII30. No entanto, no nosso estudo não foi encontrada nenhuma associação entre a hHcys e este marcador bioquímico de inflamação, sendo este achado corroborado por outros estudos31.
Os aminossalicilatos têm sido implicados na má absorção de ácido fólico e hHcys em doentes com DII32. No presente estudo não se observou qualquer efeito do tratamento (aminossalicilatos, corticosteroides, azatioprina, biológico) nos níveis de homocisteína.
No nosso estudo, a idade jovem foi apenas um preditor marginalmente significativo da presença de hHcys. A relação entre a idade e os níveis de homocisteína foi previamente reportada em outros estudos20,33, no entanto, o verdadeiro mecanismo subjacente a esta alteração não se encontra definido na literatura. Vários fatores poderão estar subjacentes a estes achados, nomeadamente o consumo de álcool, o tabagismo e os diferentes padrões de ingestão alimentar.
O tabagismo tem uma conhecida associação com níveis elevados de homocisteína séria34,35 e com a ocorrência de eventos tromboembólicos. No presente estudo, o tabagismo foi um fator associado com a presença de hHcys (p < 0,001). Vários mecanismos poderiam explicar o aumento do risco tromboembólico em fumadores com hHcys. Fumar interfere com múltiplos mecanismos vaso-oclusivos, tais como a agregação plaquetária, a viscosidade do plasma e os níveis de fibrinogénio36. Também a hHcys tem sido associada com alterações da função endotelial e do fluxo sanguíneo37,38. O fato de ambos os fatores de risco poderem exercer efeitos semelhantes, sugere um forte potencial de interação entre eles no sentido de produzir dano vascular.
Estudos retrospetivos demonstraram 1,3-6,4% de complicações tromboembólicas em doentes com DII1,23. No nosso estudo encontramos uma alta prevalência (5/47; 10,6%) de eventos tromboembólicos neste grupo de doentes, no entanto, não foi observada uma correlação estatisticamente significativa entre a presença de complicações tromboembólicas e os níveis séricos de homocisteína. Apesar da elevada prevalência de eventos tromboembólicos na nossa população em estudo, o número de casos foi ainda pequeno para fornecer conclusões seguras, embora se encontre descrito que elevados níveis de homocisteína podem predispor os doentes com DII para complicações tromboembólicas em combinação com outros fatores de risco circunstanciais ou permanentemente existentes39.
Na nossa série não foi estudada a prevalência de variante 5,10-metilenotetrahidrofolato redutase (MTHFR C677T), a qual resulta numa menor síntese de 5-metiltetrahidrofolato. Um estudo prévio17 descreve um total de 17,5% de doentes com CU e 16,8% dos doentes com DC - homozigotos para a variante C677T, em comparação com 7,3% dos controles. No entanto, nesse estudo, os níveis de homocisteína também foram elevados em doentes com DII sem mutação da enzima MTHFR e os níveis de homocisteína diminuíram após a suplementação com ácido fólico, independentemente do facto de a mutação ser detetada ou não.
Em conclusão, a hHcys é um fenómeno comum nos doentes com DII. Medidas preventivas devem-se focar nos fatores de risco reversíveis relacionados com hHcys, tais como a cessação de hábitos tabágicos e a correção de défices vitamínicos. Os défices vitamínicos devem ser determinados em todos os doentes com DII e a suplementação de ácido fólico deve ser incluída no seu tratamento.
Novos estudos devem ser realizados para investigar a etiologia multifatorial do desenvolvimento de eventos tromboembólicos em doentes com DII e a eficácia da correção da hHcys com suplementos vitamínicos na redução destas complicações.
Referências
1. Talbot RW, Heppell J, Dozois RR, Beart RW. Vascular complications of inflammatory bowel disease. Mayo Clin Proc. 1986;61:140-5. [ Links ]
2. Vecchi M, Cattaneo M, de Franchis R, Mannucci PM. Risk of thromboembolic complications in patients with inflammatory bowel disease. Study of hemostasis measurements. Int J Clin Lab Res. 1991;21:165-70. [ Links ]
3. Hudson M, Hutton RA, Wakefield AJ, Sawyerr AM, Pouder RE. Evidence for activation of coagulation in Crohns disease. Blood Coagul Fibrinolysis. 1992;3:773-8. [ Links ]
4. Souto JC, Martinez E, Roca M, Mateo J, Pujol J, Gonzalez D, et al. Prothrombotic state and signs of endothelial lesion in plasma of patients with inflammatory bowel disease. Dig Dis Sci. 1995;40:1883-9. [ Links ]
5. Collins CE, Cahill MR, Newland AC, Rampton DS. Platelets circulate in an activated state in inflammatory bowel disease. Gastroenterology. 1994;106:840-5. [ Links ]
6. Gallagher PM, Meleady R, Shields DC, Tan KS, McMaster D, Rozen R, et al. Homocysteine and risk of premature coronary disease: Evidence for a common gene mutation. Circulation. 1996;94:2154-8. [ Links ]
7. Ridker PM, Hennekens CH, Selhub J, Miletich JP, Malinow MR, Stampfer MJ. Interrelation of hyperhomocysteinemia, factor V Leiden, and risk of future venous thromboembolism. Circulation. 1997;95:1777-82. [ Links ]
8. Cantu C, Alonso E, Jara A, Martinez L, Rios C, Fernandez Mde L, et al. Hyperhomocysteinemia, low folate and vitamin B12 concentrations, and methylenetetrahydrofolate reductase mutation in cerebral venous thrombosis. Stroke. 2004;35:1790-4. [ Links ]
9. den Heijer M, Koster T, Blom HJ, Bos GM, Briet E, Reitsma PH, et al. Hyperhomocysteinemia as a risk factor for deep-vein thrombosis. N Engl J Med. 1996;334:759-62. [ Links ]
10. Ray JG. Meta-analysis of hyperhomocysteinemia as a risk factor for venous thromboembolic disease. Arch Intern Med. 1998;158:2101-6. [ Links ]
11. Langman LJ, Ray JG, Evrovski J, Yeo E, Cole DE. Hyperhomocysteinemia and the increased risk of venous thromboembolism: More evidence from a case-control study. Arch Intern Med. 2000;160:961-4. [ Links ]
12. Hankey GJ, Eikelboom JW. Homocysteine and vascular disease. Lancet. 1999;21:407-13. [ Links ]
13. Seshadri N, Robinson K. Homocysteine, B vitamins, and coronary artery disease. Med Clin North Am. 2000;84:215-37. [ Links ]
14. Welch GN, Loscalzo J. Homocysteine and atherothrombosis. N Engl J Med. 1998;338:1042-50. [ Links ]
15. Wilmink AB, Welch AA, Quick CR. Dietary folate and vitamin B6 are independent predictors of peripheral arterial occlusive disease. J Vasc Surg. 2004;39(3):513-6. [ Links ]
16. Savage DG, Lindenbaum J, Stabler SP, Allen RH. Sensitivity of serum methylmalonic acid and total homocysteine determinations for diagnosing cobalamin and folate deficiencies. Am J Med. 1994;96:239-46. [ Links ]
17. Mahmud N, Molloy A, McPartlin J, Corbally R, Whitehead AS, Scott JM, et al. Increased prevalence of methylenetetrahydrofolate reductase C677T variant in patients with inflammatory bowel disease, and its clinical implications. Gut. 1999;45:389-94. [ Links ]
18. Oldenburg B, Fijnheer R, van der Griend R, vanBerge-Henegouwen GP, Koningsberger JC. Homocysteine in inflammatory bowel disease: A risk factor for thromboembolic complications? Am J Gastroenterol. 2000;95:2825-30. [ Links ]
19. Chowers Y, Sela BA, Holland R, Fidder H, Simoni FB, Bar-Meir S. Increased levels of homocysteine in patients with Crohns disease are related to folate levels. Am J Gastroenterol. 2000;95:3498-502. [ Links ]
20. Koutroubakis IE, Dilaveraki E, Vlachonikolis IG, Vardas E, Vrentzos G, Ganotakis E, et al. Hyperhomocysteinemia in Greek patients with inflammatory bowel disease. Dig Dis Sci. 2000;45:2347-51. [ Links ]
21. Romagnuolo J, Fedorak RN, Dias VC, Bamforth F, Teltscher M. Hyperhomocysteinemia and inflammatory bowel disease: Prevalence and predictors in a cross-sectional study. Am J Gastroenterol. 2001;96:2143-9. [ Links ]
22. Papa A, de Stefano V, Danese S, Chiusolo P, Persichilli S, Casorelli I, et al. Hyperhomocysteinemia and prevalence of polymorphisms of homocysteine metabolism-related enzymes in patients with inflammatory bowel disease. Am J Gastroenterol. 2001;96:2677-82. [ Links ]
23. Petros Z, Georgia P, Nikolaos N, Themistoclis V, Giouleme O, Evgenidis N. Hyperhomocysteinemia in ulcerative colitis is related to folate levels. World J Gastroenterol. 2005;11:6038-42. [ Links ]
24. van Assche G, Dignass A, Panes J, Beaugerie L, Karagiannis J, Allez M, et al. The second European evidence-based consensus on the diagnosis and management of Crohns disease: Definitions and diagnosis. J Crohns Colitis. 2010;4:7-27. [ Links ]
25. Stange EF, Travis SP, Vermeire S, Reinisch W, Geboes K, Barakauskiene A, et al. European evidence-based Consensus on the diagnosis and management of ulcerative colitis: Definitions and diagnosis. J Crohns Colitis. 2008;2:1-23. [ Links ]
26. Cattaneo M, Vecchi M, Zighetti ML, Saibeni S, Martinelli I, Omodei P, et al. High prevalence of hyperhomocysteinemia in patients with inflammatory bowel disease: A pathogenic link with thromboembolic complications? Thromb Haemost. 1998;80:542-5. [ Links ]
27. Roblin X, Germain E, Phelip JM, Ducros V, Pofelsky J, Heluwaert F, et al. Factors associated with hyperhomocysteinemia in inflammatory bowel disease: Prospective study in 81 patients. Rev Méd Interne. 2006;27:106-10. [ Links ]
28. Erzin Y, Uzun H, Celik AF, Aydin S, Dirican A, Uzunismail H. Hyperhomocysteinemia in inflammatory bowel disease patients without past intestinal resections: Correlation with cobalamine, pyridoxine, folate concentrations, acute phase reactants, disease activity, and prior thromboembolic complications. J Clin Gastroenterol. 2008;42:481-6. [ Links ]
29. Aghadassi E, Wendland BE, Stapleton M, Raman M, Allard JP. Adequacy of nutritional intake in a Canadian population of patients with Crohns disease. J Am Diet Assoc. 2007;107:1575-80. [ Links ]
30. Bjerregaard LT, Nederby NJ, Fredholm L, Brandslund I, Munkholm P, Hey H. Hyperhomocysteinemia, coagulation pathway activation and thrombophilia in patients with inflammatory bowel disease. Scand J Gastroenterol. 2002;37:62-7. [ Links ]
31. Chiarello PG, Penaforte FR, Japur CC, Souza CD, Vannucchi H, Troncon LE. Increased folate intake with no changes in serum homocysteine and decreased levels of C-reactive protein in patients with inflammatory bowel diseases. Dig Dis Sci. 2009;54:627-33. [ Links ]
32. Halsted CH, Ghandhi G, Tamura T. Sulfasalazine inhibits the absorption of folates in ulcerative colitis. N Eng J Med. 1981;305:1513-7. [ Links ]
33. Maire F, Beaugerie L, Cohen M, Deschamps A, Cosnes J, Capeau J, et al. Factors associated with hyperhomocysteinemia in Crohns disease. Gastroenterol Clin Biol. 2001;25:745-8. [ Links ]
34. Nygard O, Refsum H, Ueland PM, Vollset SE. Major lifestyle determinants of plasma total homocysteine distribution: The Hordaland Homocysteine Study. Am J Clin Nutr. 1998;67:263-70. [ Links ]
35. El-Khairy L, Ueland PM, Nygard O, Refsum H, Vollset SE. Lifestyle and cardiovascular disease determinants of total cysteine in plasma: The Hordaland Homocysteine Study. Am J Clin Nutr. 1999;70:1016-24. [ Links ]
36. Bartecci CE, Mackenzie TD, Schrier RW. The human costs of tobacco use. N Engl J Med. 1994;330(pt1):907-12 (pt2) 975-80. [ Links ]
37. Bellamy MF, McDowell IFW, Ramsey MW, Brownlee M, Bones C, Newcombe RG, et al. Hyperhomocysteinemia after an oral methionine load acutely impairs endothelial function in adults. Circulation. 1995;91:1314-9. [ Links ]
38. Nappo F, de Rossa N, Marfella R, de Lucia D, Ingrosso D, Perna AF, et al. Impairment of endothelial function by acute hyperhomocysteinaemia and reversal by antioxidant vitamins. JAMA. 1996;281:2113-8. [ Links ]
39. Koutroubakis IE. Unrevealing the mechanisms of thrombosis in inflammatory bowel disease. Am J Gastroenterol. 2001;96:1325-7. [ Links ]
*Autor para correspondência
Correio eletrónico: jmagalhaaes@chaa.min-saude.pt (J. Magalhães).
Responsabilidades éticas
Proteção de pessoas e animais. Os autores declaram que para esta investigação não se realizaram experiências em seres humanos e/ou animais.
Confidencialidade dos dados. Os autores declaram ter seguido os protocolos de seu centro de trabalho acerca da publicação dos dados de pacientes e que todos os pacientes incluídos no estudo receberam informações suficientes e deram o seu consentimento informado por escrito para participar nesse estudo.
Direito à privacidade e consentimento escrito. Os autores declaram ter recebido consentimento escrito dos pacientes e/ ou sujeitos mencionados no artigo. O autor para correspondência deve estar na posse deste documento.
Conflito de interesses
Os autores declaram não haver conflito de interesses.
Recebido a 28 de setembro de 2013; aceite a 16 de janeiro de 2014













