Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Acessos
Acessos
Links relacionados
-
 Similares em
SciELO
Similares em
SciELO
Compartilhar
Revista Portuguesa de Pneumologia
versão impressa ISSN 0873-2159
Rev Port Pneumol v.16 n.1 Lisboa jan. 2010
Fronteiras do pulmão – Relação com o sistema Gastrenterológico
C Teles Martins1, J Rosal Gonçalves2
1 Interna do Internato Complementar de Pneumologia/Pulmonology resident
2 Assistente graduado de Pneumologia/Specialist consultant in Pulmonology
Resumo
A interacção entre os sistemas respiratório e gastrintestinal é reconhecida há várias décadas, sendo motivada por mecanismos anatómicos, fisiológicos e patológicos diversos.
Se é certo que a relação de algumas entidades nosológicas acorre, intuitivamente, ao pneumologista, como é o caso da asma e o refluxo gastroesofágico, outras interacções patológicas tendem a ser subdiagnosticadas, não só pela sua complexidade fisiológica, mas também pela sua menor frequência (doenças da via aérea motivadas pela colite ulcerosa e doença de Crohn, por exemplo).
É objectivo do presente artigo rever os mecanismos anatomofisiológicos, patológicos, clínicos e terapêuticos responsáveis pela complexa interacção entre o pulmão e o sistema gastrintestinal.
Palavras-chave: Pulmão, aparelho digestivo.
Boundaries of the lung – Relationship to the gastrointestinal system
Abstract
The relation between the respiratory and gastrointestinal systems has been long recognized and depends on various anatomical, physiological and pathological mechanisms.
The certain recognition of some interactions, such as the relation between asthma and gastroesophageal reflux, is more or less intuitive to the pulmonogist, whereas other areas of confluence are more easily missed, such as the relation between airway disorders and inflammatory bowel disease.
The purpose of this article is to review the interaction between the lung and the gastrointestinal systems, as far as anatomy, physiology, pathology, clinical manifestations and therapeutical options go.
Key-words: Lung, gastrointestinal system.
Introdução
A relação do pulmão com o sistema gastrintestinal é reconhecida há mais de um século, tornando intuitiva a associação de determinadas entidades nosológicas respiratórias com a patologia do sistema digestivo.
Efectivamente, podemos falar de um eixo pulmão-tubo digestivo-órgãos anexos, motivado pela proximidade anatómica entre estes e a relação fisiológica estreita entre os sistemas circulatórios e os mecanismos neuroendócrinos afectos a cada um1.
A relação entre a asma e o refluxo gastroesofágico (RGE), por exemplo, é sugerida, pela primeira vez, em 1892, por William Osler2, surgindo ao longo das décadas seguintes dezenas de trabalhos postulando mecanismos etiológicos diversos, como a microaspiração de ácido gástrico e fenómenos autonómicos vagais3,4,5.
O entusiasmo desencadeado por estas investigações tem levado muitos autores a procurar a relação do RGE com outras doenças respiratórias, como sejam a pneumonia, as bronquiectasias, a fibrose pulmonar idiopática6, o insucesso no transplante pulmonar7 e mesmo a doença pulmonar obstrutiva crónica (DPOC)8.
Contudo, é reconhecido que as relações do eixo pulmão-tubo digestivo-órgãos anexos são substancialmente mais amplas e determinam interacções patológicas mútuas e variadas do pulmão com o cólon (doença inflamatória intestinal) e órgãos anexos (cirrose hepática, síndroma hepatopulmonar, pancreatite, entre outras)9.
O presente trabalho propõe-se rever as relações anatomofisiológicas entre o sistema respiratório e gastrintestinal, bem como as alterações patológicas e implicações clínicas, terapêuticas e prognósticas das mesmas.
Eixo pulmão-tubo digestivo - órgãos anexos
Não é complicado conceber que patologia do esófago possa condicionar patologia da traqueia e vias áereas (ou o inverso) apenas pela sua proximidade anatómica. No entanto, é mais complexo aceitar a relação entre órgãos anatomicamente mais distantes, como o pulmão, o cólon, o fígado e mesmo o pâncreas, recorrendo apenas a uma justificação anatómica.
O eixo pulmão-tubo digestivo - órgãos anexos relaciona-se, não só anatomicamente, mas também através da vasculatura e do sistema neuroendócrino1.
Por exemplo, a incapacidade de filtração por parte do fígado de toxinas absorvidas ao nível da circulação intestinal (na cirrose hepática) ou a absorção de outras noxas pelo sistema digestivo (de que é exemplo a fenfluramina – anorexígeno associado a hipertensão pulmonar10) permitirá que estas alcancem facilmente a circulação pulmonar e condicionem lesão local1.
Por outro lado, patologia do pulmão pode ser responsável por lesão orgânica gastrintestinal, não apenas condicionada por incapacidade do primeiro em garantir as trocas gasosas que assegurem a viabilidade celular, mas também porque o pulmão é responsável por diversas funções metabólicas e neuroendócrinas com repercussão sistémica (mediadores de fase aguda, produção e regulação de factores neuroumorais, entre outras)1,10.
Salienta-se, ainda, a importância da regulação dos aparelhos respiratório e gastrintestinal pelo sistema nervoso autónomo a partir de um conjunto de estruturas neurológicas comuns, frequentemente determinante da fisiopatologia e expressão clínica das interacções em revisão11.
Pulmão e doença de refluxo gastroesofágico
A doença de refluxo gastroesofágico (DRGE) é, possivelmente, a entidade mais investigada para compreensão da relação pulmão-tubo digestivo, mas também a que mais controvérsia gera no que diz respeito à sua etiologia.
Desde o século xix que, para além da apresentação característica da DRGE por pirose, regurgitação ácida oral e azia, se reconhecem expressões clínicas distintas, como tosse crónica, disfonia, pieira e mesmo infecções respiratórias recorrentes1,2,11.
A associação estreita entre a sintomatologia respiratória e dispéptica pode entender-se não só pela proximidade da posição anatómica do esófago, estômago e pulmão, mas também pela sua origem a partir de divisões da mesma estrutura embrionária (intestino primitivo anterior)11,12 e inervação autonómica similar pelo X par craniano, o nervo vago11.
O relaxamento transitório do esfíncter esofágico inferior, responsável pelo RGE, é um reflexo mediado neurologicamente pelo tronco cerebral e nervo vago11.
Postula-se que a presença de ácido no esófago distal induz hiperreactividade e constrição brônquicas por estimulação dos receptores parassimpáticos luminais ou por fenómenos de microaspiração crónicos, que são eles próprios responsáveis por inflamação neurogénica (vagal) da via aérea11,13.
Inicialmente, a teoria da microaspiração era detentora de mais adeptos, uma vez que vários trabalhos demonstraram, por cintigrafia de ventilação pulmonar, que ocorria aspiração de conteúdo gástrico na presença de RGE14, e que esta era mais significativa e correlacionável com a gravidade do RGE em doentes com sintomas respiratórios15.
Contudo, outros autores mostraram que em doentes asmáticos, após infusão intraesofágica de ácido clorídrico 0,1%, ocorria uma redução significativa do débito de ponta (PEF) e aumento da resistência das vias áreas, sem evidência de aspiração concomitante ou de refluxo ácido ao nível do esófago proximal14.
Afirmaram, ainda, que a broncoconstrição induzida pelo ácido intraesofágico era resultado da estimulação vagal da mucosa, determinante de uma inflamação neurogénica, autoperpetuadora da patologia obstrutiva4.
Embora com menor frequência, pode ocorrer microaspiração alimentar em doentes com alterações da motilidade do esófago ou anomalias da tonicidade dos esfíncteres esofágicos (superior e inferior)16. No entanto, constatou-se que muitos doentes com alterações manométricas e tosse crónica não tinham qualquer evidência de microaspiração4,11.
Associada ou não à asma, a tosse crónica causada pelo RGE, por aumentar as pressões transdiafragmáticas e promover o relaxamento transitório do esfíncter esofágico inferior, pode condicionar mais refluxo, criando um ciclo fisiopatológico vicioso11.
Esta teoria não é, todavia, apoiada por todos os autores. Alguns estudos, ainda que efectuados em populações diferentes (voluntários saudáveis), mostraram que o esforço expiratório forçado e a contracção vigorosa da musculatura abdominal não condicionavam a ocorrência de episódios de refluxo ácido17.
No entanto, será importante recordar trabalhos efectuados por Ferrari (1995)18, Benini (2000)19 e respectivos colaboradores, que mostraram que doentes com RGE têm um limiar tussígeno mais baixo, independentemente de terem ou não queixas respiratórias habituais, havendo normalização da amplitude do reflexo da tosse após terapêutica antir refluxo18,19.
Diversas entidades nosológicas e sintomas respiratórios, tanto das vias aéreas superiores como inferiores, têm sido associados ao RGE.
Além de tosse crónica, alguns doentes referem congestão e prurido nasal, rinorreia posterior, esternutos, disfonia e rouquidão11,20.
Do ponto de vista patofisiológico, embora a asma seja efectivamente a entidade mais estudada, trabalhos mais recentes apontam o RGE como factor etiológico possível em alguns casos de fibrose pulmonar idiopática 6, insucesso no transplante pulmonar7, DPOC8 e síndroma de apneia obstrutiva do sono (SAOS)27 (Fig. 1).

Fig. 1 – Interacções patofisiológicas entre o RGE e o pulmão
Asma e RGE
Do ponto de vista epidemiológico, a prevalência do RGE é mais elevada no doente asmático do que na população em geral, variando entre 30% e 80%11.
Além das já referidas relações anatómicas entre a via aérea e o esófago, origem embrionária partilhada e inervação vagal similar, o doente asmático apresenta, frequentemente, alterações no gradiente de pressão toracoabdominal e posição do diafragma11,21. Estas modificações predispõem ao aparecimento de hérnia do hiato esofágico e RGE21.
Tornando mais complexa esta relação, sabe-se que a terapêutica β2 agonista e as xantinas reduzem a pressão do esfíncter esofágico inferior e os corticosteróides aumentam a secreção ácida11.
Assim, e atendendo aos factores já detalhados, compreendemos que a asma e o RGE se perpetuam e complicam mutuamente (Fig. 2), sendo por isso essencial ter em mente que um dos mecanismos responsáveis pela asma de controlo difícil é, frequentemente, o RGE não tratado22.
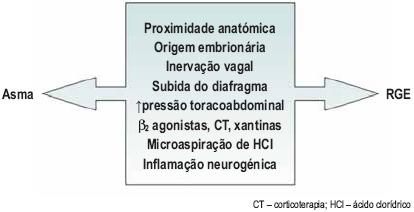
Fig. 2 – Mecanismos de interacção entre a asma e o RGE
Poderia assumir-se que a terapêutica do RGE – com inibidores da bomba de protões (IBP) ou cirurgia – resultasse no controlo eficaz da asma. No entanto, alguns autores avaliaram o resultado da terapêutica com IBP (omeprazol 40 mg/dia) na asma de controlo difícil e verificaram que ocorria melhoria do FEV1 e PEF em apenas 50% dos doentes com RGE23. Outros autores compararam a terapêutica médica e cirúrgica para o RGE e verificaram que se alcançou o controlo da asma em 74,9% dos doentes a quem foi efectuada fundoplicação de Nissen, contra apenas 9% dos doentes tratados apenas com IBP24
Estes resultados mostram-nos a heterogeneidade clínica e etiológica da asma e do RGE, bem como da multiplicidade de mecanismos envolvidos na relação entre ambos, cujo controlo não dependerá exclusivamente da inibição da produção ácida25.
Exemplificando esta perspectiva, temos os casos de refluxo não ácido26, cujo controlo dependerá, não de IBP, mas, possivelmente, de fármacos que aumentem o tónus do esfíncter esofágico inferior25 ou da cirurgia26.
Doenças do interstício pulmonar e RGE
As doenças do interstício pulmonar constituem um conjunto amplo e variado de patologias, cuja etiologia não está completamente definida. Além de factores imunológicos e humorais, alguns autores defendem que o refluxo ácido pode ser um factor etiológico de lesão intersticial28,29.
Os estudos efectuados demonstram que a prevalência de RGE nos doentes com fibrose pulmonar idiopática é muito elevada (87% em algumas séries)30 e que o tempo de exposição da mucosa esofágica ao ácido gástrico nos mesmos é significativamente superior ao dos controlos, ainda que apenas 25% dos casos se acompanhem de sintomas típicos de RGE28.
Os autores dos trabalhos mencionados postulam que, no caso da fibrose pulmonar idiopática, a lesão instersticial advém de microaspiração crónica de conteúdo ácido ou não ácido29,30.
Num estudo de quatro casos, efectuado por Raghu e colaboradores31 ao longo de quatro anos, verificou-se que doentes com fibrose pulmonar idiopática e RGE, que recusaram terapêutica imunossupressora e foram medicados apenas com IBP ou efectuaram fundoplicação de Nissen, apresentaram estabilização da doença respiratória31. Verificou-se ainda que, nos períodos de suspensão da terapêutica com IBP, ocorriam agudizações da doença respiratória nos mesmos doentes31.
A relação do RGE com a doença do interstício pulmonar está também patente nos casos de esclerose sistémica11. Alguns trabalhos demonstram que estes doentes apresentam esofagite e lesões laríngeas sugestivas de aspiração ácida11 e que os doentes com RGE mais grave apresentam maior redução da capacidade de difusão alveolocapilar do CO e mais alterações sugestivas de lesão intersticial na tomografia computorizada de alta resolução (TCAR) do tórax32. Embora permaneça uma área do conhecimento pouco explorada, será útil ter em consideração a possibilidade de RGE nos indivíduos com doença do interstício pulmonar, particularmente nos casos de fibrose pulmonar idiopática, uma vez que a terapêutica dirigida poderá trazer vantagens sintomáticas e prognósticas11.
DPOC e RGE
A investigação recente tem referido que a prevalência do RGE está aumentada nos doen tes com DPOC grave (57% dos casos)8 e que o primeiro poderá contribuir para a patogénese e episódios de agudização da doença obstrutiva33, uma vez que episódios agudos de refluxo ácido parecem associar-se a episódios de oxidessaturação33.
Uma vez mais, o RGE nestes casos é, habitualmente, silencioso – os sintomas típicos de pirose e regurgitação surgem em apenas um terço dos casos8.
De facto, a DPOC constitui um factor de risco para o RGE: o aumento da pressão intratorácica (sobretudo nos doentes com hiperinsuflação dinâmica), o aplanamento da posição diafragmática, os acessos de tosse frequentes e a terapêutica β 2 agonista são todos promotores de relaxamento do esfíncter esofágico inferior e refluxo8 (Fig. 3).
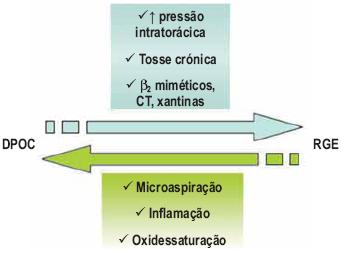
Fig. 3 – Relação do RGE com a DPOC
Contudo, a presença de RGE deverá ser investigada nos doentes obstrutivos que apresentem sintomas sugestivos e não com o propósito de rastreio na população com DPOC em geral8. Efectivamente, a eficácia do rastreio generalizado de RGE neste grupo de doentes, bem como os efeitos da sua terapêutica (médica e/ou cirúrgica) no curso natural e prognóstico da doença obstrutiva, não são, ainda, conhecidos8,33.
SAOS e RGE
Nas últimas duas décadas têm surgido vários estudos que tentam demonstrar a associação entre o RGE e o SAOS.
Durante o sono há uma redução fisiológica da peristalse primária, da produção de saliva e da clearence de ácido do esófago34. Associado a este risco fisiológico de refluxo, os doentes com SAOS apresentam ainda aumento do gradiente de pressão transdiafragmática proporcional ao aumento da pressão intratorácica durante os episódios de apneia, de que resulta insuficiência do cárdia e episódios repetitivos de RGE34.
Alguns autores verificaram que a terapêutica com CPAP nasal nos doentes com SAOS reduzia a gravidade e frequência dos episódios de RGE e que o controlo do refluxo (com antagonistas dos receptores H2 da histamina) reduzia o número de microdespertares, mas não influenciava o índice de apneia/hipopneia (IAH)35. Outros, utilizando o omeprazol, mostraram que a terapêutica do RGE com IBP reduzia, significativamente (em cerca de 73% à sexta semana de terapêutica), o número e a gravidade dos episódios de apneia36.
Contudo, e apesar dos resultados promissores, ainda subsistem dúvidas quanto ao papel exacto dos episódios de refluxo ácido e o desencadeadar de apneias e microdespertares36, sendo esta uma área de intensa investigação.
Transplante pulmonar e RGE
A relação entre o sucesso do transplante pulmonar e a presença e gravidade do RGE tem vindo a ser objectivada ao longo das últimas décadas37,38,39.
A prevalência de RGE é particularmente elevada após o transplante pulmonar37, postulando-se que este facto se deva aos procedimentos cirúrgicos em si, à terapêutica imunossupressora, ou à presença prévia de RGE nestes doentes37,38.
Existe uma associação, ainda não completamente fundamentada, entre a microaspiração de ácido gástrico e a disfunção do enxerto pulmonar, precocidade dos mecanismos de rejeição crónica, desenvolvimento de bronquiolite obliterativa e mortalidade aumentada37,38.
Efectivamente, alguns autores demonstraram que a correcção cirúrgica do RGE previne a disfunção precoce do enxerto e melhora a sobrevida geral dos doentes submetidos a transplante pulmonar39.
Pulmão e doença inflamatória intestinal
A doença inflamatória intestinal, reconhecida hoje como doença granulomatosa multissistémica, pode envolver qualquer órgão11.
O envolvimento pulmonar é pouco frequente, sendo geralmente assintomático e relacionado com alterações ao nível das provas funcionais respiratórias, lavado broncoalveolar (LBA) e radiografia de tórax11. Só raramente ocorrem sintomas que se relacionam com o envolvimento pulmonar específico pela doença de Crohn (DC) ou pela colite ulcerosa (CU)11 (Quadro I).
Quadro I – Manifestações respiratórias da doença inflamatória intestinal
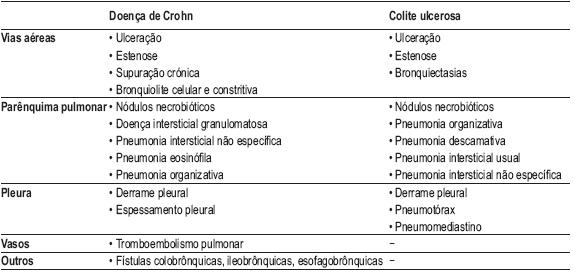
Será importante ter em mente que muitas manifestações respiratórias da doença inflamatória intestinal se relacionam com os fármacos imunossupressores utilizados ou constituem síndromas de sobreposição com outras doenças granulomatosas, por exemplo, a sarcoidose11.
Doença de Crohn e pulmão Vias áreas
O envolvimento sintomático das vias áreas (VA) pela DC é muito raro, não ultrapassando 0,2% em algumas séries40. Geralmente, estas manifestações da doença granulomatosa sucedem-se ao diagnóstico da doença intestinal, embora possam ser a primeira manifestação da mesma e não se correlacionem, necessariamente, com a gravidade e a evolução daquela.11
O envolvimento da via área superior pode manifestar-se através de inflamação e ulceração da nasofaringe, hipofaringe, cordas vocais e traqueia subglótica, condicionando estenose e obstrução11. A terapêutica com corticosteróides sistémicos permite a resolução das lesões e proporciona, geralmente, remissões prolongadas11.
O envolvimento traqueobrônquico resulta de processos inflamatórios crónicos, granulomatosos ou não, condicionantes de espessamento e infiltração da parede brônquica11. Estas lesões poderão não ter expressão radiológica, mas a broncofibroscopia permite evidenciar lesões granulosas esbranquiçadas numa mucosa difusamente eritematosa e edemaciada, que quando graves podem mesmo causar deformações brônquicas, estenose e fistulização11.
Estas alterações patológicas facilitam a infecção e a supuração crónicas, razão pela qual o LBA destes doentes tende a apresentar contagens elevadas de neutrófilos11.
Naturalmente, a expressão clínica destas alterações será de quadros supurativos crónicos, bem como alterações funcionais obstrutivas que tendem a melhorar significa tivamente com a terapêutica corticóide inalada e sistémica11.
Na verdade, os corticóides inalados e sistémicos promovem melhoria significativa das lesões visíveis na broncofibroscopia, embora o seu efeito seja menor quando existem estenoses e deformações brônquicas.11
O envolvimento bronquiolar, seja por processos de bronquiolite celular ou constritiva, é raro e não parece relacionar-se com o hábito tabágico11. Clinicamente expresso por dispneia, tosse e mesmo febre, revela-se funcionalmente por obstrução e hiperinsuflação e ao nível do LBA por linfocitose e discreto aumento da relação CD4+/CD8+11.
O diagnóstico final depende da confirmação anatomopatológica por biópsia pulmonar, mas perante um quadro clínico, endoscópico e radiológico compatível, poderá ser iniciada terapêutica corticóide sistémica que permitirá a regressão das lesões e a melhoria significativa da função respiratória11.
Parênquima pulmonar
A expressão da DC ao nível do parênquima pulmonar é variada do ponto de vista clínico e imagiológico. Quanto ao primeiro, pode ser assintomática ou incluir queixas de tosse e dispneia. Relativamente ao segundo, pode manifestar-se como focos de consolidação, infiltrados intersticiais, nódulos ou massas11.
Face a esta inespecificidade de sintomas e aspectos radiológicos, o diagnóstico de envolvimento pulmonar pela DC requer confirmação histológica11.
Ao nível do parênquima, a DC pode apresentar-se como nódulos necrobióticos, doença intersticial granulomatosa, pneumonite intersticial não específica (NSIP), infiltrados pulmonares associados a eosinofilia e pneumonia organizativa11,41.
Nódulos necrobióticos
Expressão rara da DC, estes nódulos cavitados são evidentes na TCAR do tórax, sobretudo ao nível das regiões periféricas do pulmão. Resultam de necrose perivascular e podem estender-se por extensas áreas do parênquima. A sintomatologia é inespecífica e inclui tosse e dispneia42.
O seu diagnóstico requer confirmação anatomopatológica, verificando-se frequentemente remissão clínica e imagiológica mesmo na ausência de terapêutica11.
Doença intersticial granulomatosa
É a forma mais frequente de lesão parenquimatosa pulmonar pela DC e resulta de inflamação granulomatosa do interstício, paredes bronquiolares, vasculares e septos alveolares11.
Manifesta-se por sintomas constitucionais, tanto em adultos como em crianças, e associa-se frequentemente a tosse produtiva, dispneia e dor torácica43.
As alterações imagiológicas mostram alterações reticulares focais ou difusas e, raramente, nódulos e massas43. O estudo funcional revela alteração ventilatória restritiva e redução da capacidade de difusão alveolocapilar do CO11,43. O LBA é, geralmente, hipercelular e de predomínio linfocítico11.
A resolução clínica e radiológica desta entidade depende de terapêutica com corticosteróides sistémicos, ainda que já tenham sido relatados casos de remissão espontânea11.
Pneumonia intersticial não específica (NSIP)
Expressão muito rara da DC, resulta da inflamação do interstício pulmonar sem formação de granulomas41.
As suas manifestações incluem tosse seca e dispneia, e do ponto de vista imagiológico predominam as alterações em vidro despolido e fibrose pulmonar11,41.
A terapêutica envolve doses elevadas de corticóides sistémicos e ciclofosfamida41.
Pneumonite eosinofílica
Constitui uma manifestação específica da DC ao nível do pulmão, embora seja necessário fazer o diagnóstico diferencial com a toxicidade pulmonar pela sulfasalazina e a mesalazina44.
Consiste numa doença intersticial associada a infiltrados eosinofílicos, com ou sem eosinofilia periférica, e a terapêutica baseia-se, uma vez mais, na corticoterapia sistémica44.
Pneumonia organizativa (OP)
Apesar de constituir, mais frequentemente, um efeito adverso da terapêutica da DC, a OP também pode surgir em doentes não tratados, sugerindo lesão inflamatória relacionada com a doença intestinal11.
Foram descritos casos de remissão espontânea, mas a terapêutica pode incluir os corticóides sistémicos e o infliximab11.
Pleura
O envolvimento das serosas é possível na DC, mas são escassos os casos descritos relativamente ao envolvimento pleural11. Este pode incluir o derrame pleural (geralmente, exsudado de predomínio neutrófilo) ou o espessamento pleural11,44.
Fístulas
Embora raras, as fístulas colobrônquicas, esofagobrônquicas e ileobrônquicas já foram descritas45,46,47.
O diagnóstico baseia-se na clínica (tosse produtiva de expectoração fecalóide e infecções respiratórias recorrentes) e no estudo radiológico do tubo digestivo11.
A terapêutica requer a correcção cirúrgica do trajecto fistuloso e os fármacos específicos para a DC11.
Vascularização pulmonar
É hoje aceite que a DC é um factor de risco independente para o tromboembolismo pulmonar (TEP), embora a causa para o estado de hipercoagulabilidade que origina não esteja ainda esclarecida48.
Deste modo, face a um doente com DC e sintomas sugestivos, a hipótese de TEP deverá ser sempre considerada48.
Colite ulcerosa e pulmão
Apesar de se reconhecerem algumas semelhanças na expressão clínica, patológica e imagiológica, entre a lesão pulmonar na DC e na CU, os estudos efectuados parecem apontar para maior frequência e gravidade na última49.
Assim, a ulceração traqueal e a estenose traqueal, a supuração brônquica, as bronquiectasias, a pneumonia organizativa e os nódulos necrobióticos são mais frequentes na CU do que na DC11,49.
O envolvimento respiratório na CU, que diz respeito, na maioria dos casos, às vias aéreas, pode preceder, ser concomitante ou suceder, por vezes em muitos anos, o diagnóstico da doença inflamatória intestinal49.
Pensa-se que a colectomia ou a proctocolectomia são factores de risco para o desenvolvimento de doença respiratória na CU, não sendo ainda clara a acção dos aminossalicilatos na patogénese da última49.
Vias aéreas
A inflamação das VA (glóticas, subglóticas, traqueia, brônquios principais e distais), associada ou não a ulceração e estenose, é o padrão mais comum de envolvimento respiratório na CU49.
Os locais mais frequentes de lesão são as vias aéreas de grande calibre (traqueia, carina e brônquios principais) e, face às lesões inflamatórias, estenóticas e ulcerativas, os sintomas habituais são a dispneia, a tosse (geralmente produtiva), a broncorreia (mucopurulenta ou francamente purulenta) e as hemoptises11,49.
O envolvimento das vias aéreas superiores pode acompanhar-se de rouquidão e estridor e o envolvimento distal, ao nível bronquiolar, pode resultar em queixas de pieira11,49.
A exacerbação da sintomatologia respiratória pode coincidir ou não com a exacerbação das queixas intestinais, não sendo raro o agravamento rápido dos sintomas respiratórios basais após proctocolectomia11.
Apesar da expressão por vezes exuberante dos sintomas respiratórios, os achados endoscópicos podem ser discretos, e incluem a hiperemia e o edema, por vezes condicionante de redução luminal da traqueia e dos brônquios principais11,49. A carina também pode estar alargada por edema11,49.
O LBA apresenta, geralmente, predomínio de neutrófilos e a histologia das lesões é em muito semelhante às encontradas no cólon11.
Funcionalmente, o padrão obstrutivo é o mais habitual nestes casos e a resposta ao broncodiltador é, frequentemente, negativa11.
Apesar de a radiografia simples do tórax ser, muitas vezes, incaracterística, na TCAR pode ser evidente a retenção aérea e o mosaico de perfusão, resultado da obstrução das vias aéreas de menor calibre49. As bronquiectasias e o espessamento da parede brônquica também podem ser visíveis nos casos de doença mais grave49. A impactação de secreções nas pequenas vias aéreas pode originar o padrão de árvore em botão na TCAR49.
A melhoria clínica, funcional e das lesões visíveis por broncofibroscopia, mesmo nos doentes com bronquiectasias, raramente se alcança apenas com a terapêutica específica para a CU e requer a corticoterapia inalada em doses elevadas11. Nos casos mais graves, poderá ser útil a corticoterapia sistémica11.
Insterstício pulmonar
A doença do interstício pulmonar constitui uma manifestação mais rara da patologia respiratória na CU, e pode incluir a OP, a NSIP, a pneumonia intersticial descamativa, os infiltrados granulomatosos e mesmo a pneumonia intersticial usual (UIP)11.
Geralmente, o LBA destes doentes é linfocítico, ou mais raramente eosinófilico, ao invés de neutrofílico, como acontece nos casos de atingimento preferencial da VA11.
A doença do interstício pulmonar na CU exige sempre o diagnóstico diferencial de toxicidade pulmonar pelos aminossalicilatos, uma vez que esta pode expressar-se pelos mesmos padrões de lesão intersticial11,49.
A terapêutica com corticóides sistémicos tende a melhorar, substancialmente, qualquer forma de doença intersticial associada à CU11.
Pleura
Ainda que pouco frequente, a serosite é possível como expressão extraintestinal da CU, podendo resultar em derrames pleurais e pericárdicos de repetição11.
Embora seja possível a existência de derrame pleural como resultado da toxicidade pela sulfasalazina (síndroma lúpus -like), muitas vezes a serosite é independente da terapêutica e tende a acompanhar as exacerbações da doença intestinal11,49.
A terapêutica baseia-se na corticoterapia sistémica e anti-inflamatória não esteróide, tendo geralmente bons resultados11.
O pneumotórax e pneumomediastino são entidades muito raras na CU e podem resultar de perfuração do cólon ou megacólon tóxico, em doentes sem patologia pulmonar ou com envolvimento bronquiolar subclínico11,50.
Pulmão e fígado
Pulmão e fígado relacionam-se não apenas pela proximidade anatómica, entre as duas superfícies do diafragma, mas também pela partilha de doenças afectas a ambos (deficiência de α1 antitripsina e fibrose quística, por exemplo), relações vasculares complexas entre a circulação portal, sistémica e pulmonar, e a participação própria e interligada em situações de manutenção da homeostasia corporal e equilíbrio acidobase11.
As entidades eventualmente mais representativas da complexidade desta relação, ainda que de etiologia, prevalência, fisiopatologia, prognóstico e terapêutica distintas, são a hipertensão portopulmonar (HTPP) e a síndroma hepatopulmonar (SHP)11.
Hipertensão portopulmonar
A hipertensão arterial pulmonar (PAP média >25 mmHg em repouso ou 30 mmHg no esforço, por cateterismo direito) ocorre em cerca de 2 a 5% dos doentes com hipertensão portal51.
O aumento marcado do débito vascular pulmonar nos doentes com hipertensão portal causa alterações da reologia local, promotoras de vasoconstrição e microtrombose, bem como alterações da anatomia vascular (hipertrofia da camada média e proliferação endotelial)51.
As endotoxinas e citocinas libertadas pela circulação esplâncnica, ao fazerem bypass à circulação hepática, poderão ser promotoras de alterações génicas na circulação pulmonar, induzindo as alterações descritas.
Apoiando esta hipótese, está o facto de os doentes com shunts portossistémicos poderem desenvolver as mesmas alterações vasculares pulmonares dos doentes com HTPP52.
Não parece haver correlação directa entre o desenvolvimento de HTPP e a existência ou gravidade de doença hepática ou hipertensão portal, do mesmo modo que nem todos os doentes com hipertensão portal desenvolvem HTPP, o que pressupõe a necessidade de determinadas características genéticas de susceptibilidade ainda não completamente identificadas52.
A HTPP é considerada pela OMS como uma categoria de hipertensão arterial pulmonar, juntamente com as outras formas de doença idiopática, devendo, portanto, considerar-se um diagnóstico de exclusão51.
A expressão clínica da HTPP não difere da hipertensão arterial pulmonar idiopática, incluindo dispneia de esforço, dor torácica, edemas periféricos, palpitações e síncope11.
Funcionalmente, há redução da capacidade de difusão alveolocapilar do CO, insuficiência respiratória parcial e alcalose respiratória11.
Na ausência de terapêutica, a sobrevida destes doentes é má, sendo em algumas séries inferior a 10% aos 6 meses11.
A terapêutica médica convencional é escassa e constituída essencialmente pelos diuréticos de ansa e a espironolactona, já que não se recomenda a hipocoagulação com dicumarínicos, pelo risco de hemorragia digestiva em doentes com alterações basais da coagulação, nem os antagonistas dos canais de cálcio, devido ao aumento do gradiente de pressão venosa hepática11. Nos últimos anos, a utilização de vasodilatadores pulmonares, como os análogos da prostaciclina, os antagonistas dos receptores da endotelina (em grupos com determinadas particularidades) e os inibidores da fosfodiesterase tem revelado resultados promissores em termos de melhoria clínica, hemodinâmica e prognóstica em alguns doentes11.
Ao contrário da síndroma hepatopulmonar, a transplantação hepática nos doentes com HTPP não assegura, necessariamente, a reversão das alterações patológicas e hemodinâmicas, associando-se ainda a importante risco de mortalidade perioperatória52.
Síndroma hepatopulmonar
A SHP é definida pela presença de doença hepática, vasodilatação intrapulmonar e redução da oxigenação arterial, na presença ou ausência de doença cardíaca ou pulmonar basal.11
Embora mais frequente nos adultos de meia-idade, pode ocorrer na população pediátrica, e resulta de alterações vasculares pulmonares profundas, com dilatação dos vasos a nível pré-capilar, capilar e pós-capilar, que permitem a passagem directa, sem possibilidade de trocas gasosas, do sangue venoso da circulação arterial pulmonar para as veias pulmonares.11
Estas alterações patológicas condicionam grave desequilíbrio entre a ventilação e a perfusão pulmonares, redução da vasoconstrição reflexa à hipoxia, redução da capacidade de difusão alveolocapilar e desenvolvimento de hipoxemia grave11.
Em teoria, qualquer doença hepática aguda ou crónica pode cursar com SHP, embora as causas mais frequentes sejam a cirrose hepática de qualquer etiologia e a hipertensão portal.11,52
Postula-se que na génese da vasodilatação intrapulmonar da SHP esteja a produção aumentada de óxido nítrico (NO), já que alguns estudos têm mostrado que o valor do NO no condensado do ar exalado se relaciona positivamente com a gravidade da doença hepática, trocas gasosas e alterações hemodinâmicas, e normaliza após o transplante hepático.53 Este aumento do NO poderá dever-se à expressão e actividade aumentadas da sintase do NO, tanto a nível do endotélio capilar, como nos macrófagos, segundo sugerem alguns estudos em modelos animais.54
Além das queixas típicas da doença hepática crónica, a SHP pode cursar com sintomas respiratórios característicos, embora não patognomónicos, como dispneia de esforço, platipneia (dispneia agravada na posição ortostática), ortodeoxia (diminuição da PaO2 ≥ 5% ou 4 mmHg na transição do decúbito supino para o ortostatismo), cianose e hipocratismo digital.11
O diagnóstico da SHP é feito pela ecocardiografia transtorácica com injecção de soro fisiológico agitado (método gold-standard), em que o atraso no aparecimento das microbolhas, provenientes da agitação do soro, ao nível da aurícula esquerda, sugere a existência de vasodilatação intrapulmonar, com retenção das microbolhas na vasculatura do pulmão11.
Outros exames complementares possíveis para o diagnóstico da SHP são a cintigrafia de ventilação-perfusão pulmonar, a TCAR do tórax e a angiografia pulmonar.11
A terapêutica desta entidade tem importância crucial, uma vez que a SHP é um factor prognóstico independente da gravidade da doença hepática basal, aumentando significativamente a mortalidade destes doentes.11
Apesar de alguns estudos observacionais referirem a embolização arterial pulmonar e o shunt transjugular intraepático como opções terapêuticas para a SHP, a transplantação hepática é, à data, a terapêutica mais eficaz, permitindo a resolução completa da doença em mais de 80% dos casos55.
Conclusões
O conhecimento das relações anatomofisiológicas entre o pulmão, o tubo digestivo e os órgãos anexos é de primordial importância para o pneumologista, uma vez que permitirá o diagnóstico e a terapêutica orientada de entidades nosológicas particulares que se associam, frequentemente, a grande morbilidade e dificuldade no controlo da sintomatologia respiratória propriamente dita.
Bibliografia
1. Fishman AP, Elias JA, Fishman JA, Grippi MA (Eds.). Fishmans Pulmonary Diseases and Disorders – 4th edition. 2008; 446-448.
2. Osler WB. Bronchial asthma. In: The principles and practice of medicine. NY: Appleton, 1892; 497-501 [ Links ]
3. Mays E. Intrinsic asthma in adults: association with gastroesophageal reflux. JAMA 1976; 236:2626-2628
4. Schan CA, et al. Gastroesophageal reflux–induced bronchoconstriction. An intraesophageal acid infusion study using state-of-the-art technology. Chest 1994; 106(3):731-737
5. Harding SM. Gastroesophageal reflux, asthma, and mechanisms of interaction. Am J Med 2001; 111(Suppl 8A):8S-12S.
6. Ing AJ. Interstitial lung disease and gastroesophageal reflux. Am J Med 2001; 111(Suppl 8A):41S-44S.
7. Young L, et al. Lung transplantation exacerbates gastroesophageal reflux disease. Chest 2003; 124:1689-1693.
8. Robert R, et al. High prevalence of proximal and distal gastroesophageal reflux disease in advanced COPD. Chest 2007; 131:1666-1671.
9. Pero -Golubičić T. In Clinical atlas of interstitial lung disease. Springer London. 2006; 193-197.
10. Mandel J, Taichman D (Ed.). Pulmonary vascular disease. 2006; 50-65.
11. Verleden GM. Pulmonary manifestations of systemic diseases. Eur Respir Monograph 2005; (10):34 184-185.
12. Mansfield LE. Embryonic origins of the relation of gastroesophageal reflux disease and airway disease. Am J Med 2001; 111:(Suppl 8A):3S -7S.
13. Harding SM. Gastroesophageal reflux, asthma, and mechanisms of interaction. Am J Med. 2001; 111: (Suppl 8A):8S-12S.
14. Chernow B, et al. Pulmonary aspiration as a consequence of gastroesophageal reflux, a diagnostic approach. Dig Dis Sci 1979; 24:839-844.
15. Crausaz FM, et al. Aspiration of solid food particles into lungs of patients with gastroesophageal reflux and chronic bronchial disease. Chest 1988; 93:376-378.
16. Patti MG, et al. Esophageal manometry and 24 –hour pH monitoring in the diagnosis of pulmonary aspiration secondary to gastroesophageal reflux. Am J Surg 1992; 163:401-406.
17. Kawahara H, et al. Role of gastroesophageal reflux in older children with persistent asthma. Am J Gastroenterol 2001; 96:2019-2025.
18. Ferrari M, et al. Tussive effect of capsaicin in patients with gastroesophageal reflux without cough. Am J Resp Crit Care Med 1995; 151:557 -561.
19. Benini L, et al. Cough threshold in reflux oesophagitis; influence of acid and of laryngeal and oesophageal damage. Gut 2000; 46:762-767.
20. Theodoropolous DS, et al. Prevalence of upper respiratory symptoms in patients with gastroesophageal reflux disease. Am J Resp Crit Care Med 2001; 164:72-76.
21. Martins M. Asthma and gastroesophageal reflux. J Bras Pneumol 2007; 33(2): editorial.
22. GINA Report WR 2005.
23. Leggett JL, et al. Prevalence of gastroesophageal reflux in difficult asthma – relationship to asthma outcome. Chest 2005; 127:1227-1231.
24. Sontag SJ, et al. Asthmatics with gastroesophageal reflux: long term results of a randomized trial of medical and surgical antireflux therapies. Am J Gastroenterol 2003; 98:987-999.
25. Subin J. Proton -pump inhibitor therapy for gastroesophageal reflux disease. Chest 2005;127;1097-1098.
26. Tutuian R, et al. Nonacid reflux in patients with chronic cough on acid -suppressive therapy. Chest 2006; 130:386-391.
27. Demeter P, et al. The relationship between gastroesophageal reflux disease and obstructive sleep apnea. J Gastroenterol 2004; 9:815-820.
28. Tobin RW, et al. Increased prevalence of gastroesophageal reflux in patients with idiopathic pulmonary fibrosis. Am J Resp Crit Care Med 1998; 158(6): 1804-1808.
29. Pashinsky Y, et al. Gastroesophageal reflux disease and idiopathic pulmonary fibrosis. The Mount Sinai J Med 2009; 76(1):24-29.
30. Raghu G, et al. High prevalence of abnormal acid gastro-oesophageal reflux in idiopathic pulmonary fibrosis. Eur Resp J 2006; 27:136-142.
31. Raghu G, et al. Sole treatment of acid gastroesophageal reflux in idiopathic pulmonary fibrosis: case series. Eur Resp J 2006; 129(3):794-800.
32. Marie I, et al. Esophageal involvement and pulmonary manifestations in systemic sclerosis. Arthritis Rheum 2001; 45:346-354.
33. Casanova C, et al. Increased gastro -oesophageal reflux disease in patients with severe COPD. Eur Resp J 2004; 23:841-845.
34. Demeter P, et al. The relationship between gastroesophageal reflux disease and obstructive sleep apnoea. J Gastroenterol 2004; 39(9):815-820.
35. Ing AJ, et al. Obstructive sleep apnea and gastroesophageal reflux. Am J Med 2000; 108(4a):120S-125S.
36. Bortolotti M, et al. Obstructive sleep apnoea is improved by a prolonged treatment of gastrooesophageal reflux with omeprazole. Dig Liver Dis 2005; [epub ahead of print].
37. Young LR, et al. Lung transplantation exacerbates gastroesophageal reflux disease. Chest 2003; 124(5):1689-1693.
38. Hadjiliadis D, et al. Gastroesophageal reflux disease in lung transplant recipients. Clin Transpl 2003; 17(4):363-368.
39. Hartwig MG, et al. Antireflux surgery in the setting of lung transplantation: strategies for treating gastroesophageal reflux in a high risk population. Thoracic Surg Clin 2005; 15(3):417-427.
40. Rogers BH, et al. The epidemiologic and demographic characteristics of infamatory bowel disease: an analysis of computerised file of 1400 patients. J Chronic Dis 1971; 24:743-773.
41. Hotermans G, et al. Nongranulomatous interstitial lung disease in Crohns disease. Eur Resp J 1996; 9:380-382.
42. Sanjeevi A, et al. Necrobiotic nodules: A rare pulmonary manifestation of Crohns disease. Am J Gastroenterol 2003; 98:941-943.
43. Alrashid Al, et al. Crohns disease involving the lung: resolution with infliximab. Dig Dis Sci 2001; 46:1736-1739.
44. Faller M, et al. Pulmonary migratory infiltrates and pachypleuritis in a patient with Crohns disease. Respiration 2000; 67:459-463.
45. Domej W, et al. Colobronchial fistula: a rare complication of Crohns colitis. Am Rev Resp Dis 1990; 142:1225-1227.
46. Ghahremani G, et al. Esophageal manifestations of Crohns disease. Gastroenterol Radiol 1982; 7:199-203.
47. Gumbo T, et al. Recurrent pneumonia from ileobronchial fistula complicating Crohns disease. J Clin Gastr 2001; 32:365-367.
48. Weinberger S, et al. Pulmonary complications of inflammatory bowel disease. Uptodate.com, 2007.
49. Mahadeva R, et al. Clinical and radiological characteristics of lung disease in inflammatory bowel disease. Eur Resp J 2000; 15:41-48.
50. Blanchet E, et al. Pneumomediastianum without colonic perforation during a severe attack of ulcerative colitis. Gastr Clin Biol 2001; 25:1121 -1123.
51. Simonneau G, et al. Clinical classification of pulmonary hypertension. J Am Col Cardiol 2004; 43(12 Suppl S):5S-12S.
52. Rodriguez -Roisin R, et al. Pulmonary-Hepatic Vascular Disorders Scientif Committee ERS Task Force. Eur Resp J 2004; 24:861-880.
53. Rolla G, et al. Exhaled nitric oxide and oxygenation abnormalities in hepatic cirrosis. Hepatology 1997; 26:842-847.
54. Fallon MB, et al. The role of endothelial nitric oxide synthase in the pathogenesis of a rat model of hepatopulmonary syndrome. Gastroenterol 1997; 113: 606-614.
55. Scharwzenberg S, et al. Resolution of severe intrapulmonary shunting after liver transplantation. Chest 1993; 103:1271-1273.
Serviço de Pneumologia I, CHLN,
Lisboa
e-mail: catarinateles@gmail.com
Recebido para publicação/received for publication: 09.06.15
Aceite para publicação/accepted for publication: 09.07.20













